Протокол парентерального питания в практике отделения интенсивной терапии новорожденных
СтатьиОпубликовано в журнале:
Вестник интенсивной терапии »» 2004 г, №3. Интенсивная терапия в педиатрии
Пруткин М. Е.
Областная детская клиническая больница №1, г. Екатеринбург
В неонатологической литературе последних лет большое внимание уделяется вопросам нутритивной поддержки. Проведение адекватное питание критически больного новорожденного защищает его от возможных будущих осложнений и способствует адекватному росту и развитию. Внедрение современных протоколов адекватного питания в отделении неонатальной интенсивной терапии способствует улучшенному потреблению питательных веществ, росту, сокращению пребывания больного в стационаре и, следовательно, снижению стоимости лечения больного.[1,3]
В настоящем обзоре мы бы хотели представить данные современных доказательных исследований и предложить стратегию нутритивной поддержки в практике отделения неонатальной интенсивной терапии.
Физиологические особенности новорожденного и адаптация к самостоятельному питанию. Внутриутробно плод получает все необходимые питательные вещества через плаценту. Плацентарный обмен нутриентов можно расценивать как сбалансированное парентеральное питание, содержащее белки, жиры, углеводы, витамины и микроэлементы. Хотелось бы напомнить, что в течение 3-го триместра беременности отмечается беспрецедентное увеличение массы тела плода. Если масса тела плода 26 недель гестации составляет около 1000 г., то в 40 недель гестации (то есть всего через 3 месяца) новорожденный ребенок весит уже около 3000 г. Таким образом, за последние 14 недель беременности плод утраивает свою массу. Именно в эти 14 недель и происходит основное накопление плодом питательных веществ, которые потребуются ему для последующей адаптации к внеутробной жизни.
Таблица 2.
Физиологические особенности новорожденного
|
Процесс всасывания жирных кислот с длинной цепью затруднен в связи с недостаточной активностью желчных кислот.
Запасы питательных веществ. Чем более недоношенным рождается новорожденный ребенок, тем меньшим запасом питательных веществ он обладает. Сразу после рождения и пересечения пуповины поток питательных веществ, поступавший к плоду через плацентарную систему, прекращается, а высокая потребность в нутриентах остается. Следует также помнить, что в силу структурной и функциональной незрелости органов пищеварения способность недоношенных новорожденных к самостоятельному энтеральному питанию ограничена (табл. 2). Поскольку идеальной моделью роста и развития недоношенного ребенка для нас будет являться внутриутробный рост и развитие плода, наша задача – обеспечить нашему пациенту столь же сбалансированное, полноценное и адекватное питание как то, которое он получал внутриутробно.
В таблице 3 приведена оценка энергетической потребности растущего недоношенного ребенка по данным Американской академии педиатрии и Европейского общества гастроэнтерологии и питания.
Таблица 3
|
Фактор |
Американская академия |
Европейское общество |
|
|
Средние |
Диапазон |
||
|
Энергетические затраты |
|||
| |
50 | 52.5 | 45 – 60 |
|
|
15 |
7.5 |
5 – 10 |
| |
10 | 7.5 | 5 – 10 |
| 8 | 17.5 | 10 – 25 | |
| Энергетические запасы |
25 | 25 | 20 – 30 |
| Энергия выделения |
12 | 20 | 10 – 30 |
|
ИТОГО |
120 |
130 |
95 - 165 |
Особенности метаболизма питательных веществ у новорожденных
Жидкость и электролиты. В течение первой недели жизни у новорожденного ребенка происходят значительные изменения водно-электролитного обмена, которые отражают процесс его адаптации к условиям внеутробной жизни. Уменьшается общее количество жидкости в организме и происходит перераспределение жидкости между межклеточным и внутриклеточным сектором (рис. 2).
Рис. 2
Влияние возраста на распределение жидкости между секторами [7]
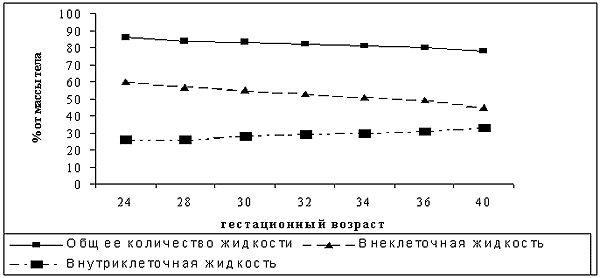
Именно эти перераспределения приводят к «физиологической» убыли в массе тела, которая развивается в первую неделю жизни. Большое влияние на водно-электролитный обмен, особенно у маленьких недоношенных новорожденных могут оказывать т.н. «неощутимые потери» жидкости. Коррекция дозы жидкости проводится на основании темпа диуреза (2-5 мл/кг/ч), относительной плотности мочи (1002 – 1010) и динамики массы тела.
Натрий – основной катион внеклеточной жидкости. Примерно 80% натрия в организме метаболически доступно. Потребность в натрии обычно составляет 3 мМоль/кг/сут. У маленьких недоношенных детей вследствие незрелости канальцевой системы могут отмечаться значительные потери натрия. Эти потери могут потребовать возмещения вплоть до 7-8 мМоль/кг/сут.
Калий – основной внутриклеточный катион (примерно 75% калия находится в мышечных клетках). Концентрация калия в плазме определяется многими факторами (нарушения кислотно-основного состояния, асфиксия, инсулинотерапия) и не является достоверным показателем запасов калия в организме. Обычно потребность в калии составляет 2 мМоль/кг/сут.
Хлориды – основные анионы внеклеточной жидкости. Передозировка, как и дефицит хлоридов, может приводить к нарушению кислотно-основного состояния. Потребность в хлоридах составляет 2 – 6 мЭкв/кг/сут.
Кальций – преимущественно локализуется в костях. Примерно 60% кальция плазмы находится в связи с белком (альбумином), поэтому даже измерение биохимически активного (ионизированного) кальция не позволяет достоверно судить о запасах кальция в организме. Потребность в кальции обычно составляет 1-2 мЭкв/кг/сут.
Магний – преимущественно (60%) находится в костях. Большая часть оставшегося магния находится внутриклеточно, поэтому измерение магния в плазме не позволяет точно оценить запасы магния в организме. Однако это не означает, что не следует контролировать концентрацию магния в плазме. Обычно потребность в магнии составляет 0.5 мЭкв/кг/сут. С осторожностью следует датировать магний новорожденным, чьи матери получали терапию сульфатом магния перед родами. Для лечения упорной гипокальциемии может потребоваться увеличение дозы магния.
Глюкоза
В течение всего периода гестации плод получает глюкозу от матери через плаценту. Уровень сахара крови плода составляет примерно 70% от сахара крови матери. В условиях нормогликемии матери плод практически не синтезирует глюкозу сам, несмотря на то, что ферменты глюконеогенеза определяются, начиная с 3-го месяца гестации. Таким образом, в случае голодания матери плод способен достаточно рано синтезировать глюкозу сам из таких продуктов, как кетоновые тела.
Гликоген начинает синтезироваться у плода с 9-й недели гестации. Интересно, что на ранних сроках гестации накопление гликогена происходит преимущественно в легких и в сердечной мышце, а затем, в течение третьего триместра беременности основные запасы гликогена образуются в печени и скелетных мышцах, а в легких исчезают. Отмечено, что выживаемость новорожденного после перенесенной асфиксии напрямую зависит от содержания гликогена в миокарде. Уменьшение содержания гликогена в легких начинается на 34-36 неделе, что может быть связано с расходом этого источника энергии на синтез сурфактанта.
На скорость накопления гликогена могут влиять такие факторы, как голодание матери, плацентарная недостаточность и многоплодная беременность. Острая асфиксия не влияет на содержание гликогена в тканях плода, в то время как хроническая гипоксия, например при преэклампсии матери, может приводить к дефициту накопления гликогена.
Инсулин является основным анаболическим гормоном плода в течение всего гестационного периода. Инсулин появляется в ткани поджелудочной железы к 8-10 неделе гестации и уровень его секреции у доношенного новорожденного соответствует таковому у взрослого человека. Поджелудочная железа плода менее чувствительна к гипергликемии. Отмечено, что повышенное содержание аминокислот делает стимуляцию выработки инсулина более эффективной. Исследования на животных показали, что в условиях гиперинсулинизма усиливается синтез белка и скорость утилизации глюкозы, в то время, как при дефиците инсулина уменьшается количество клеток и содержание в клетке ДНК [9]. Эти данные объясняют макросомию детей от матерей с сахарным диабетом, которые в течение всего гестационного периода находятся в условиях гипергликемии и, следовательно, гиперинсулинизма. Глюкагон обнаруживается у плода, начиная с 15 недели гестации, но его роль пока остается неизученной.
После родов и прекращения поступления глюкозы через плаценту под влиянием ряда гормональных факторов (глюкагон, катехоламины) происходит активация ферментов глюконеогенез, которая обычно длится 2 недели после рождения, независимо от гестационного возраста. Независимо от пути введения (энтерально или парентерально) 1/3 глюкозы утилизируется в кишечнике и печени, до 2/3 распределяется по организму. Большая часть усвоенной глюкозы расходуется на выработку энергии [10]
Исследования показали, что в среднем скорость продукции/утилизации глюкозы у доношенного новорожденного составляет 3.3 – 5.5 мг/кг/мин. [11].
Поддержание уровня глюкозы в крови зависит от уровня гликогенолиза и глюконеогенеза в печени и скорости ее утилизации на периферии.
Белки
Как уже упоминалось выше, в течение третьего триместра беременности происходит значительный рост и развитие ребенка. Поскольку идеальной моделью развития ребенка является внутриутробное развитие плода соответствующего гестационного возраста, потребность недоношенного в белке и темпы его накопления можно оценить, наблюдая за белковым обменом плода.
Если после рождения ребенка и прекращения плацентарного кровообращения не происходит адекватной дотации белка, это может привести к отрицательному азотистому балансу и потере белка. В то же время, несколько исследований продемонстрировали, что потребление белка в дозе 1 г/кг способно нивелировать отрицательный азотистый баланс, а увеличение дозы белка даже при скромной дотации энергии способно сделать азотистый баланс положительным (Табл. 6).
Таблица 6.
Исследования азотистого баланса у новорожденных в течение 1-й недели жизни .
|
Вес |
Энергия |
Белок |
Азотистый баланс |
|
|
Anderson et al., 1979 [14] |
1600 |
60 |
0 |
-132 |
|
60 |
2.5 |
178 |
||
|
Van Lingen et al., 1992 [15] |
1400 |
47 |
0 |
-96 |
|
1510 |
48 |
2.3 |
224 |
|
|
Kashyap and Heird, 1994 [16] |
996 |
30 |
0 |
-183 |
На накопление белка недоношенным новорожденным влияют различные факторы [17].
- Нутритивные факторы (количество аминокислот в программе питания, соотношение белок/энергия, исходный нутритивный статус)
- Физиологические факторы (соответствие гестационному возрасту, индивидуальные особенности и.т.д.)
- Эндокринные факторы (инсулиноподобный фактор роста и.т.д.)
- Патологические факторы (сепсис и другие болезненные состояния).
Усвоение белка здоровым недоношенным ребенком с гестационным возрастом 26-35 недель гестации составляет примерно 70%. Оставшиеся 30% подвергаются оксидации и экскретируются. Следует отметить, что чем меньше гестационный возраст ребенка, тем большее активный белковый обмен в пересчете на единицу массы тела наблюдается в его организме.
Поскольку синтез эндогенного белка – энергозависимый процесс, для оптимального накопления белка организмом недоношенного ребенка требуется определенное соотношение белка и энергии. В условиях энергетического дефицита эндогенные белки используются как источник энергии и
Поэтому азотистый баланс остается отрицательным. В условиях субоптимального снабжения энергией (50-90 ккал/кг/сут) увеличение дотации, как белка, так и энергии ведет к накоплению белка в организме. В условиях достаточного снабжения энергией (120 ккал/кг/сут) накопление белка стабилизируется и дальнейшее увеличение дотации белка не приводит к его дальнейшему накоплению [18]. Оптимальным для роста и развития считается соотношение 10ккал/1 г белка. В некоторых источниках приводится соотношение 1 белковая калория/10 калорий небелкового происхождения.
Дефицит аминокислот помимо отрицательных последствий для роста и накопления белка может приводить к таким неблагоприятным последствиям, как снижение в плазме инсулиноподобного фактора роста, нарушениям деятельности клеточных транспортеров глюкозы и, следовательно, гипергликемии, гиперкалийемии и энергетическому дефициту клетки. Обмен аминокислот у новорожденных имеет ряд особенностей (табл. 7).
Таблица 7.
Особенности обмена аминокислот у новорожденных
|
Вышеперечисленные особенности определяют необходимость использования для парентерального питания новорожденных специальные аминокислотные смеси, адаптированные к метаболическим особенностям новорожденного. Использование таких препаратов позволяет удовлетворить потребности новорожденного в аминокислотах и избежать довольно серьезных осложнений парентерального питания [19].
Потребность недоношенного новорожденного в белке составляет 2.5-3 г/кг.
Последние данные, полученные Thureen PJ et all. показывают, что даже раннее назначение 3 г/кг/сут аминокислот не приводило к токсическим осложнениям, зато улучшало показатели азотистого баланса.[21]
В эксперименте на недоношенных животных показано, что положительный азотистый баланс и накопление азота у новорожденных при раннем применении аминокислот связано с усилением синтеза альбумина и белка скелетных мышц. [22]
Принимая во внимание изложенные выше соображения, дотация белков начинается со 2-х суток жизни, если состояние ребенка к этому моменту времени стабилизировано или сразу после стабилизации показателей центральной гемодинамики и газообмена, если это происходит позже 2-х суток жизни. В качестве источника белков при проведении парентерального питания используются специально адаптированные для новорожденных растворы кристаллических аминокислот (Аминовен-Инфант, Трофамин). Неадаптированные аминокислотные препараты не должны использоваться у новорожденных.
Липиды.
Липиды являются необходимым субстратом для нормального функционирования организма новорожденного ребенка. Таблица демонстрирует, что жиры являются не только необходимым и выгодным источником энергии, но и необходимым субстратом для синтеза клеточных мембран и таких необходимых биологически-активных веществ, как простагландины, лекотриены и.т.д. Жирные кислоты способствуют созреванию сетчатки и головного мозга. Кроме того, следует помнить, что основной составляющей сурфактанта являются фосфолипиды
Организм доношенного новорожденного ребенка содержит от 16% до 18% белого жира. Кроме того, присутствует небольшое количество бурого жира, который необходим для продукции тепла. Основное накопление жира происходит в течение последних 12-14 недель гестации. Недоношенные дети рождаются с существенным дефицитом жиров. Кроме того, недоношенные дети не могут синтезировать некоторые необходимые жирные кислоты из доступных предшественников. Необходимые количества этих незаменимых жирных кислот содержится в грудном молоке и не содержится в смесях для искусственного вскармливания. Есть некоторые доказательства того, что добавление этих жирных кислот в смесь для кормления недоношенных новорожденных способствует ускорению созревания сетчатки, хотя не было выявлено никаких долговременных преимуществ применения таких веществ. [23].
Исследования последних лет свидетельствуют о том, что применение жиров (в исследовании использовался Интралипид) при парентеральном питании способствует формированию глюконеогенеза у недоношенных новорожденных.[24]
Опубликованы данные, показывающие целесообразность внедрения в клиническую практику и использование у недоношенных новорожденных жировых эмульсий на основе оливкового масла. Эти эмульсии содержат меньше полиненасыщенных жирных кислот и больше витамина Е. Причем витамин Е в таких составах более доступен, чем в составах на основе соевого масла. Такое сочетание может иметь преимущества у подверженных окидативному стрессу новорожденных, антиоксидантная защита которых слаба. [25]
Исследования Kao с соавторами, посвященные утилизации парентеральных жиров, показали, что усвоение жиров лимитируется не суточной дозой (например 1 г/кг/сут), а скоростью введения жировой эмульсии [26]. Не рекомендуется превышать скорость инфузии более 0.4-0.8 г/кг/сут. Некоторые факторы (стресс, шок, хирургическая операция) могут повлиять на способность к утилизации жиров. В этом случае скорость инфузии жиров рекомендуется снизить или вовсе прекратить. Кроме того, исследования показали, что применение 20% жировых эмульсий было связано с меньшим количеством метаболических осложнений, чем использование 10% жировых эмульсий [27].
Скорость утилизации жиров также будет зависеть как от общих энергозатрат новорожденного, так и от дозы глюкозы, которую получает ребенок. Есть данные, что применение глюкозы в дозе более 20 г/кг/сут тормозит утилизацию жиров.
Несколько исследований были посвящены изучению взаимосвязи между содержанием в плазме свободных жирных кислот и концентрации неконьюгированного билирубина [28]. Ни в одном из них не было обнаружено положительной корреляционной зависимости.
Противоречивыми остаются данные о влиянии жировых эмульсий на газообмен и легочное сосудистое сопротивление. Жировые эмульсии (Липовеноз, Интралипид) мы начинаем использовать с 3-х –4-х cуток жизни, если считаем, что к 7 – 10 суткам жизни ребенок не начнет усваивать 70 – 80 ккал/кг энтерально.
Витамины
Потребность недоношенных новорожденных в витаминах представлена в таблице 10 [29].
Таблица 10.
Потребности новорожденного в водо-и жирорастворимых витаминах
|
Витамин |
Энтерально |
Парентерально
|
|
С (мг) |
8 |
25 |
|
Тиамин (mг) |
40 |
350 |
|
Рибофлавин (mг) |
60 |
150 |
|
В 6 (mг) |
35 |
180 |
|
Ниацин (мг) |
0.25 |
6.8 |
|
Биотин (mг) |
1.5 |
6 |
|
Пантотеновая кислота (мг) |
0.3 |
2 |
|
В 12 (mг) |
0.15 |
0.3 |
|
Фолиевая кислота (mг) |
4 |
56 |
|
А (МЕ) |
250 |
1665 |
|
D (МЕ) |
40 |
400 |
|
Е (мг) |
0.5 |
2.8 |
|
К (mг) |
4 |
80 |
Отечественная фармацевтическая промышленность выпускает достаточно большой спектр витаминных препаратов для парентерального введения. Использование этих препаратов при проведении парентерального питания у новорожденных не представляется рациональным из-за несовместимости большинства этих препаратов друг с другом в растворе и сложностях при дозировании, если исходить из потребностей, приведенных в таблице. Оптимальным представляется использование поливитаминных препаратов. На отечественном рынке водорастворимые поливитамины для парентерального введения представлены препаратом Солувит, а жирорастворимые – препаратом Виталипид.
СОЛУВИТ Н (SOLUVIT N) добавляется в раствор для парентерального питания из расчета 1 мл/кг. Может добавляться и в жировую эмульсию. Обеспечивает ребенку суточную потребность во всех водорастворимых витаминах.
Виталипид Н детский (Vitalipid N infant) – Специальный препарат, содержащий жирорастворимые витамины, для удовлетворения суточной потребности в жирорастворимых витаминах: А, Д, Е и K1. Препарат растворяется только в жировой эмульсии. Выпускается в ампулах по 10 мл
Показания для парентерального питания.
Парентеральное питание должно обеспечивать доставку питательных веществ тогда, когда энтеральное питание невозможно (атрезия пищевода, язвенно-некротический энтероколит) или его объем недостаточен для покрытия метаболических потребностей новорожденного ребенка.
В заключении хотелось бы отметить, что описанная выше методика проведения парентерального питания успешно используется в отделении реанимации новорожденных Областной детской больницы г. Екатеринбурга уже около 10 лет. Для ускорения и оптимизации расчетов разработана компьютерная программа. Использование данного алгоритма позволило оптимизировать применение дорогостоящих препаратов для парентерального питания, свести к минимуму частоту возможных осложнений и оптимизировать применение препаратов крови.
Список литературы: на сайте в интернете vestvit.ru
