Герпес - угроза беременности
СтатьиОпубликовано в журнале:
Медицина для всех
№ 1 (12), 1999 - »» Формула здоровья женщины.
Гинекологические заболевания и вопросы репродукции .
Л.А.МАРЧЕНКО, доктор медицинских наук, ведущий научный сотрудник отделения гинекологической эндокринологии. Герпетическая инфекция нередко является причиной гибели зародыша. Ее последствия могут привести к возникновению у плода пороков развития.
Вагинальные инфекции относятся к разряду наиболее часто встречающихся заболеваний нижнего отдела полового тракта. Патологические выделения из влагалища являются симптомом более 20 заболеваний, поэтому первоначально правильно установленный этиологический диагноз во многом не только определяет успех лечения, но и является гарантом отсроченных осложнений.
В последние годы наряду с общеизвестными микроорганизмами, вызывающими специфические и неспецифические инфекционные заболевания половых путей, все чаще диагностируются поражения, обусловленные вирусной инвазией гениталий, среди которых, несомненно, важная роль принадлежит вирусу простого герпеса (ВПГ).
Различают два типа ВПГ. Большинство вирусов составляет 2-ю, антигенную группу - ВПГ-2, которые преимущественно вызывают генитальную патологию, ВПМ вызывают экстрагенитальные поражения.
Пути передачи. Эпидемиология
Генитальный герпес (ГГ) относится к заболеваниям, передающимся половым путем (ЗППП).
Заражение может происходить в случае, когда у партнера, являющегося источником инфекции, на половых органах имеются типичные герпетические высыпания (рецидив заболевания) или, что особенно важно, когда он выделяет вирус, не имея при этом клинических симптомов заболевания (атипичная форма, или бессимптомное вирусоносительство).
Инфицирование возможно также при орогенитальных контактах. Бытовой путь переноса инфекции встречается крайне редко и полностью исключается, если секрет, содержащий вирус, высыхает.
Генитальный герпес может вызываться вирусом и 1-го и 2-го типа.
Известно, что степень распространенности ВПГ-2 инфекции зависит от пола обследуемых, числа их сексуальных партнеров, возраста, низкого образовательного уровня и этнической принадлежности. Исследования в 10 развитых странах показали, что серопозитивными на ВПГ-2 являются 107 млн. человек, при этом частота инфицирования в США составляет от 22 до 33%, в Европе - от 7 до 24%, в странах Индокитая - до 6%. Ситуация с инфицированием ГГ в России остается во многом крайне неясной, так как, хотя ГГ и отнесен в группу ЗППП, учет заболеваемости ведется плохо. Согласно проведенным в 1994 г. эпидемиологическим исследованиям на примере закрытой популяции в Москве, частота инфицирования генитальным герпесом составляет 19,7%. Выявлено два ее возрастных пика - 16-24 года и 35-40 лет. Женщины в 1,7 раза чаще инфицируются ВПГ-2, чем мужчины, подобных половых различий в инфицировании экстрагенитальным герпесом не выявлено.
Многие исследователи считают, что истинная ситуация в мире в отношении роста заболеваемости ГГ в достаточной мере не контролируется в связи со значительным процентом его асимптомных форм. Частота последних составляет 40-74%.
Нередко психосоциальные последствия ГГ бывают более выраженными и значимыми, чем физические страдания, связанные с частыми обострениями заболевания. ГГ, безусловно, влияет на качество жизни пациентов, т.к. уже с момента обращения к врачу перед ними возникает ряд психологических и медицинских проблем, среди которых ведущая роль принадлежит следующим: страх обнаружения вируса, депрессия; влияние на сексуальную и интимную жизнь; снижение социальной активности и изменение образа жизни; отношение к ГГ, как к болезни, передающейся половым путем; страх заразиться или быть зараженным; страх быть отвергнутым обществом; боязнь быть неизлеченным и т.д.
Клиника. Диагностические критерии
По особенностям клинических проявлений инфекции ГГ разделяют на типичный и атипичный.
Инкубационный период в среднем составляет 3-9 дней, в течение которых экспрессия вируса минимальна.
Острый период заболевания при типичной форме инфекции характеризуется обширными эрозивно-язвенными высыпаниями на слизистой больших и малых половых губ, промежности, влагалища, шейки матки. Ему всегда предшествует продромальный период, сопровождающийся субъективными ощущениями в виде боли, зуда, жжения, парестезий в области гениталий, а также общей симптоматикой - недомогание, озноб, лихорадка и т.д. При этом в 13-35% случаев наблюдается асептический менингит с тошнотой, рвотой, онемением затылка, головной болью. Все эти симптомы самостоятельно проходят с появлением высыпаний, в 10-15% отмечается фарингостоматит.
Длительность острого периода заболевания не превышает 8-10 дней, однако в редких случаях отмечается затяжной характер высыпаний. Время эпителизации эрозий, образующихся из лопнувших везикул, по мнению большинства исследователей, зависит от особенностей иммунологической реактивности организма и его репаративных возможностей. В 50-60% случаев острый период сопровождается региональным лимфаденитом.
Довольно часто при первичном эпизоде заболевания отмечается поражение мочевой системы, проявляющееся от незначительной дизурии до стойкой задержки мочеиспускания, обусловленной отеком и резкой болезненностью в области уретры в результате обширных герпетических язв или вовлечения в воспалительный процесс слизистой оболочки мочевого пузыря и уретры.
Для ГГ характерна фиксированность очагов высыпания. В зависимости от локализации последних выделяют следующие стадии поражения:
I - наружные гениталии;
II - влагалище и шейка матки;
III - матка и область придатков.
Однако подобная стадийность весьма условна. После первичного эпизода заболевания под влиянием провоцирующих факторов периодически возникают рецидивы инфекции.
Анализ провоцирующих факторов показал, что наиболее часто обострение возникает на фоне стресса (78%); переутомления (56%); менструации (50%), перенесенной простуды (24%), в то время как ультрафиолетовое облучение, физические нагрузки и употребление алкоголя встречаются, соответственно, в 12, 10 и 6% случаев.
При ГГ рецидивы возникают в 50-75% случаев, что значительно выше показателей обострения при экстрагенитальной инфекции. Это объясняется особенностями антигенной структуры вируса 2-го типа.
Частота рецидивов у многих пациентов с годами снижается. Однако довольно часто после длительной ремиссии возникает период учащения рецидивов.
В зависимости от частоты обострений выделяют три степени тяжести ГГ:
тяжелое течение - ремиссии от нескольких дней до 6 недель;
средней тяжести - ремиссии от 2 до 3 месяцев;
легкое - ремиссии не менее 4 месяцев.
Клиническая картина рецидивов хронической генитальной герпетической инфекции разнообразна. В 50-85% случаев ей сопутствует продромальный период в виде чувства жжения, зуда, болезненности в очаге поражения. В 25% случаев выявляется болевой синдром - боль иррадиирует в ногу, пах, ягодицу. В 10% случаев появляются лимфаденит, общее недомогание, озноб.
В 70% случаев во время рецидива визуализируются микроскопические везикулезно-язвенные очаги, при рецидиве не обнаруживаются какие-либо патологические изменения, и обострение бывает трудно диагностировать без дополнительных лабораторных методов исследования. Рецидив протекает, как правило, легко, продолжительность высыпаний не превышает 3-5 дней, после чего слизистые или кожные покровы полностью эпителизируются.
Диссеминация ГГ наблюдается крайне редко, только в случаях тяжелой сопутствующей инфекции либо у больных с выраженным наследственным или приобретенным иммунодефицитом.
Диагностическим критерием наличия ГГ во многом являются местные проявления заболевания. Однако при атипичных формах отсутствует манифестный признак инфекции - сгруппированные везикулы, наполненные серозной жидкостью, трансформирующиеся в эрозии и язвы, что в значительной степени затрудняет постановку диагноза. Отдует особо подчеркнуть, часто подобный тип течения ГГ характерен в значительном проценте случаев с самого начала заболевания, поэтому первичный эпизод инфекции ретроспективно выявить бывает крайне трудно.
В настоящее время в 40-75% случаев ГГ протекает атипично - без появления характерных герпетических высыпаний, включая первичный эпизод заболевания.
На основании многолетних наблюдений и соотношения жалоб с данными вирусологических исследований нами были разработаны клинические критерии, позволяющие в большинстве случаев подтвердить герпетическую природу заболевания при атипичных формах инфекции. Ведущими среди них являются стойкий зуд и жжение вульвы и влагалища; кольпиты, не поддающиеся традиционной антибактериальной терапии; рецидивирующие эрозии и лейкоплакии шейки матки; привычное невынашивание беременности; стойкий вегетативный тазовый ганглионеврит (см. рис.).
СЕМИОТИКА АТИПИЧНОЙ ФОРМЫ ГЕНИТАЛЬНОГО ГЕРПЕСА 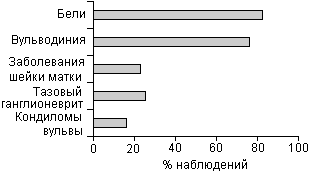
Значение этих критериев чрезвычайно важно для выявления групп инфицированных. Необходимо информирование больных о часто встречающихся атипичных симптомах заболевания в связи с возможностью бессимптомной передачи инфекции. Согласно данным отдельных исследователей, только 20% инфицированных ВПГ имеют диагностированный симптоматический герпес, 60% - нераспознанный симптоматический ГГ (атипичную форму) и 20% - бессимптомный герпес.
К четвертому, относительно редко встречающемуся варианту течения инфекции относят бессимптомный герпес, или вирусоносительство, при котором нет никаких клинических проявлений инфекции, однако в образцах слизи из цервикального канала или в мазках-отпечатках с половых органов выявляется вирус герпеса.
Знание этих вариантов течения инфекции важно для разработки тактики ведения беременных, страдающих ГГ.
Существует три основных механизма инфицирования плода ВПГ-2:
- вирусы из влагалища и шейки матки могут проникать к плодному яйцу восходящим путем или эмбрион может быть инфицирован во время имплантации инфицированной спермой;
- трансплацентарный переход вирусов к плоду при наличии их в крови беременных;
- заражение плода при прохождении через инфицированные родовые пути.
Последствиями герпетической инфекции являются гибель зародыша, пороки развития (микроцефалия, хориоретинит, дисплазия сетчатки, микрофтальмия, помутнение хрусталика, пороки сердца, гепатоспленомегалия, поражение отдельных органов и систем).
При ведении пациенток с генитальным герпесом врачу необходимо ставить перед собой следующие цели:
- купирование симптомов;
- проведение профилактики последствии инфекции и ее передачи половому партнеру и новорожденному.
Риск внутриутробного заражения плода ВПГ определяется совокупностью факторов - вариантом клинического течения ГГ (первичный эпизод заболевания или рецидив), особенностями клинической картины (типичное, атипичное или бессимптомное течение инфекции), продолжительностью контакта плода с инфицированными родовыми путями матери и стадией герпетических высыпаний.
При совпадении первичного эпизода заболевания ГГ с I или III триместром беременности в 40-50% случаев наблюдается либо мертворождение, либо рождение ребенка с врожденным поражением мозга (микроцефалия и другие аномалии). Поэтому, согласно рекомендациям ВОЗ, при первичном эпизоде заболевания, особенно в случае первичной инфекции в I триместре, целесообразно беременность прервать.
При рецидивирующем герпесе риск инфицирования плода составляет всего О-8%, что объясняется пассивной передачей материнских антител, более низкими титрами вируса и более коротким периодом его воздействия. В этих случаях беременность следует сохранить.
Наибольшую значимость в плане возможного инфицирования плода имеют атипично протекающие формы хронической ге-нитальной герпетической инфекции. В 70% случаев дети с неонатальным герпесом рождаются именно от матерей с атипичными или бессимптомными формами ГГ, при том, что частота бессимптомного носительства ВПГ-2 составляет в различных популяциях 0,5-8%. Смертность новорожденных от неонатального герпеса в этой группе составляет 50-70%; из выживших новорожденных здоровыми остаются только 15%.
Таким образом, становятся понятны социальная значимость для нашей страны проблемы генитальной герпетической инфекции и ее неблагоприятный вклад в заболеваемость и перинатальные потери.
Для установления нормального контакта между врачом и пациентом необходимо:
- неосуждение со стороны врача;
- вовлечение пациента в управление своей болезнью;
- возможность больного получить лучшее из доступного на текущий момент лечение.
Принципы современной терапии
К базисному виду терапии относится прежде всего комплекс противовирусного лечения - длительная блокада репродукции вируса современными химиопрепаратами, на фоне которых следует проводить стимуляцию неспецифической и специфической резистентности организма. Необходимо подчеркнуть, что лечение всегда целесообразно подбирать индивидуально и в каждом конкретном случае выбор медикаментозного комплекса определяется клинической формой инфекции, фазой заболевания (рецидив или ремиссия), иммунологическим состоянием пациента, предшествующим лечением и его эффективностью, наличием сопутствующих заболеваний (особое внимание необходимо уделять аллергоанамнезу).
Идеальный противовирусный препарат должен обладать селективным и специфическим механизмом действия, не быть токсичным (мутагенным, тератогенным, канцерогенным), не иметь побочных эффектов, не вызывать резистентность. Препарат должен характеризоваться хорошей биодоступностью, не взаимодействовать с другими лекарствами и иметь удобный режим дозирования.
Наиболее безопасным вариантом химиотерапии оказалось создание синтетических аналогов какого-либо структурного компонента (нуклеозид) герпес-вирусной ДНК, который избирательно фосфорилируется не клеткой, а вирусспецифическим ферментом - тимидинкиназой.
К наиболее широко используемым в мировой клинической практике аномальным нуклеозидам относятся ацикловир (зовиракс, виролекс), валацикловир (валтрекс), фамцикловир (пенцикловир), ганцикловир и т.д. К аналогам пирофосфата относится триаптен. К препаратам с другим механизмом действия (специфические ингибиторы) - бонафтон, алпизарин, флакозид, хелипин, флореналь.
Чаще всего для лечения генитального герпеса используют ацикловир (АЦ), обладающий высокой степенью сродства и селективности в отношении герпес-вирусов.
Ацикловир проникает преимущественно в зараженные ВПГ клетки, однако в неизмененном виде инертен и малотоксичен, прежде чем стать активным, он должен фосфорилироваться.
Существует две методики лечения рецидивирующей герпетической инфекции АЦ: эпизодическое лечение каждого обострения и продолжительная супрессивная терапия с целью предотвращения рецидивов. Выбор режима терапии определяется клиническим вариантом инфекции (первичный эпизод или рецидив) и степенью ее тяжести, а также проблемой передачи инфекции в случае, если один из партнеров серонегативен, и при планировании беременности.
В последние годы в России в качестве химиопрепарата широко использовался алпизарин. Проведенное сравнительное исследование лечебного и профилактического эффекта алпизарина и зовиракса при тяжелом течении ГГ показало, что прием зовиракса в режиме супрессивной терапии по 800 мг в сутки способствовал стойкой ремиссии у 73% больных, в то время как прием алпизарина вызывал подобный эффект только в 19% случаев. Профилактический эффект зовиракса более чем в 5 раз превосходит эффект алпизарина по восстановлению качества жизни больных.
Однако биодоступность перорально вводимого ацикловира составляет всего 15-21 %, поэтому в течение последних 10 лет с целью повышения его эффективности разрабатывались различные аминокислотные эфиры ацикловира.
Всего было синтезировано более 18 аминокислотных эфиров. Валацикловир (L-валиловый эфир) показал биодоступность, равную 63%. В отличие от ацикловира валацикловир (валтреке) под влиянием фермента валацикловиргидролазы хорошо всасывается в кишечнике и быстро метаболизируется в печени, полностью превращаясь в ацикловир. Фармакокинетика и токсические свойства валацикловира идентичны таковым для ацикловира.
В клинической практике (особенно при лечении привычного невынашивания беременности) нередко возникает необходимость одновременно проводить профилактику как генитального герпеса, так и ЦМВ-инфекции. Использование в этих случаях валтрекса в значительной степени облегчает задачу врача, так как наиболее специфичный для ЦМВ-инфекции химиопрепарат ганцикловир оказывает выраженный гепатотоксический эффект и вызывает гипоплазию костного мозга.
Более высокие концентрации ацикловира в плазме как конечного продукта введения валацикловира позволяют также использовать его в случаях инфицирования больных резистентными штаммами герпес-вируса. Поддержание высоких уровней ацикловира в плазме при лечении валацикловиром позволяет уменьшить кратность приема препарата и способствует лучшему его усвоению.
В режиме эпизодической терапии валтрекс следует назначать по 500 мг 2 раза в день в течение 5 дней. Для профилактики рецидивов инфекции - по 100 мг один раз в сутки в течение 4-6 месяцев. За безопасностью применения ацикловира и его аналогов наблюдают с 1982 года. Подобная программа принята и для валацикловира. Наиболее частыми побочными эффектами являются головная боль, тошнота, диарея. Однако они не выражены.
Высокой биодоступностью (77%) обладает и фамцикловир (диацетил-6 - дезоксипроизводное пенцикловира). Пенцикловир имеет сходный, но не аналогичный ацикловиру спектр действия, включающий вирус ветряной оспы, ВПГ-1, ВПГ-2, а также вирус гепатита В. Фамцикловир превращается в пенцикловир при всасывании и пассаже через печень, последний активируется вирусной тимидинкиназой. Фамцикловир хорошо переносится, однако в дозе в 50 мг раз выше, чем терапевтическая повышает риск развития аденокарциномы груди у мышей.
Однако ни ацикловир, ни другие противовирусные агенты - фамцикловир, валацикловир - не предотвращают ни перехода вируса в латентное состояние, ни возникновения рецидивов после их отмены, ни передачи инфекции, а также, к сожалению, не влияют на естественное течение этой инфекции в плане полного излечения. Поэтому на протяжении последних 20 лет ученые изыскивают методы непосредственного воздействия на иммунную систему больных ГГ с целью стимуляции специфических и неспецифических ее факторов, тем самым способствуя блокаде репродукции вируса. Одним из перспективных подходов профилактики и лечения герпес-вирусных заболеваний являются применение препаратов иммуноглобулинов человека и вакцинотерапия.
