Роль воспаления в патогенезе респираторных заболеваний
Статьи Опубликовано в журнале, Consilium Medicum, №10, т. 5, 2003 В.С.Козлов, В.В.Шиленкова, О.Д.ЧистяковаКафедра оториноларингологии Ярославской государственной медицинской академии
Острые респираторные заболевания (ОРЗ) относятся к группе самых распространенных болезней. Ежегодно миллионы жителей нашей планеты заболевают респираторной инфекцией. Не секрет, что многие из нас в течение года не раз и не два страдают этим недугом. В большинстве случаев ОРЗ протекает легко, порой мы даже не обращаем особого внимания на клинические проявления болезни. Однако нередко ОРЗ вызывают серьезные осложнения, которые могут угрожать жизни больного. Поэтому недооценку значения ОРЗ в общей структуре заболеваемости следует считать непростительной ошибкой как со стороны врача, так и со стороны заболевшего.
Этиология ОРЗ полиморфна. Заболевание может быть обусловлено большим числом (более 200) различных агентов. К ним прежде всего относятся: вирусы гриппа различных антигенных типов и вариантов, парагриппа 4 типов, респираторно-синцитиальный вирус, коронавирусы 4 типов, риновирусы (свыше 100 типов), энтеровирусы 60 типов, реовирусы 3 типов, аденовирусы 32 серотипов и аденоассоциированные вирусы, вирусы простого герпеса. Кроме того, причиной ОРЗ могут быть бактерии: стрептококки, стафилококки, менингококки, легионеллы, хламидии - C.psittacis, C. pneumoniae, микоплазмы - M. pneumoniae, M. hominis (S.Sperber, 1994). Естественным хозяином и источником подавляющего большинства ОРЗ является больной как с клинически выраженными, так и со стертыми формами ОРЗ. Передача инфекции происходит воздушно-капельным путем. Заболевание встречается в виде спорадических случаев и эпидемических вспышек.
Несмотря на многообразие возбудителей ОРЗ, в их патогенезе можно выделить следующие основные этапы (U.Gluck, J.Gerrber, 2000):
Исходя из сказанного, ОРЗ всегда сопровождается воспалительной реакцией, которая затрагивает слизистую оболочку тех или иных отделов респираторного тракта. Что же такое воспаление?
Воспаление - это реакция слизистой оболочки и всего организма в целом, которая возникает в результате воздействия какого-либо раздражителя на слизистую оболочку и направлена на ограничение патологического процесса и элиминацию возбудителя. Наряду с местными проявлениями воспаление часто сопровождается системными изменениями, выраженность и исход которых во многом определяется интенсивностью и распространенностью патологического процесса (В.В.Новицкий, Е.Д.Гольдберг, 2001).
Выделяют три стадии воспаления: альтерацию, экссудацию и пролиферацию. Альтерация - это повреждение ткани, проявляющееся нарушением трофики, структуры и функции. Различают первичную и вторичную альтерацию. Первичная альтерация представляет собой воздействие воспалительного агента (вируса, бактерии) на слизистую оболочку, выраженность которой зависит от свойств агента. Таким образом, первичная альтерация не является элементом воспаления, так как воспаление представляет собой реакцию на повреждение, вызванное инфекционным агентом, т.е. на первичную альтерацию. Вторичная же альтерация имеет прямое отношение к воспалению, так как является реакцией на уже вызванное вредным началом повреждение. Вторичное повреждение необходимо для отграничения возбудителя и поврежденной под его воздействием ткани от всего организма.
В зависимости от силы повреждающего агента, интенсивности и локализации воспаления морфологические проявления альтерации широко варьируют. Наблюдается набухание цитоплазмы клеток, явления их дистрофии. Резко повышается проницаемость мембран клеток и их органелл, что приводит к выходу разнообразных ферментов, играющих роль в разрушении субклеточных структур. В тканях накапливаются недоокисленные продукты углеводного обмена. Вследствие нарушения обмена белков, жиров и нуклеиновых кислот в очаге нарастает содержание жирных кислот, кетоновых тел, полипептидов, аминокислот, в результате чего наступает ацидоз. Ацидоз имеет большое значение в повышении проницаемости сосудов. В результате физико-химических изменений в воспаленных тканях происходит увеличение дисперсности коллоидов, их способности притягивать и задерживать воду. Изменения осмотического и онкотического давления являются важным фактором экссудации и, соответственно, воспалительного отека.
Все описанные выше проявления воспаления обусловлены высвобождением целой группы биологически активных веществ, так называемых медиаторов воспаления. Это биологически активные вещества, которые либо усиливают, либо ослабляют выраженность воспалительных явлений (рис. 1).
Рис. 1. Реакция слизистой оболочки верхних дыхательных путей на внедрение чужеродного агента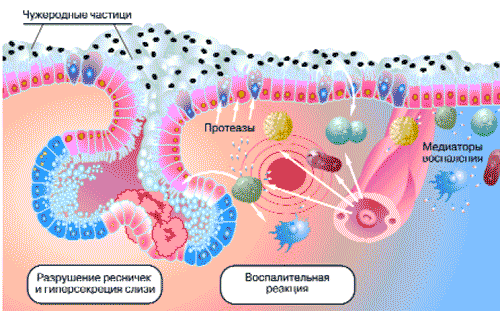
Все известные медиаторы воспаления по происхождению можно разделить на гуморальные (образующиеся в жидких средах - плазме крови и тканевой жидкости) и клеточные. К первым относятся производные комплемента, кинины и факторы свертывающей системы крови, ко второй - вазоактивные амины, производные арахидоновой кислоты (эйкозаноиды), лизосомальные факторы, цитокины (монокины), лимфокины, активные метаболиты кислорода, нейропептиды (T.Brunee и соавт., 1991).
Уже в первые минуты воспалительной реакции благодаря первичной альтерации в тканях происходит увеличение концентрации свободного гистамина. Через 1-2 ч содержание гистамина достигает максимума, а затем уменьшается в связи с увеличением гистаминазной активности в тканях. Гистамин существует в тканях организма в трех формах: связанной, лабильной и свободной. Он содержится в макрофагах и базофилах в основном в связанном состоянии - в комплексе с мукополисахаридами (гликозаминогликанами). Кроме того, гистамин присутствует в тучных клетках и тромбоцитах. Лабильный гистамин выделяется с помощью факторов, способствующих дегрануляции тучных клеток. К таким факторам относятся токсические вещества, продукты разрушения тканей, реакция антиген-антитело, лизосомальные ферменты. Гистамин выполняет различные функции, включая местное расширение мелких сосудов и капилляров, артериол, местное повышение сосудистой проницаемости за счет сокращения эндотелиальных клеток, а также отвечает за хемотаксис эозинофилов и торможение функций Т-лимфоцитов (рис. 2).
Рис. 2. Механизмы действия гистамина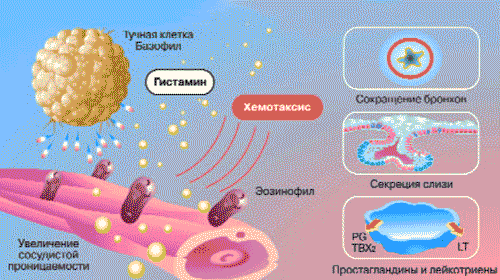
Главным источником цитокинов (монокинов) при воспалении являются стимулированные моноциты и макрофаги. Кроме того, эти пептиды продуцируются нейтрофилами, лимфоцитами, эндотелиальными и другими клетками (рис. 3).
Рис. 3. Роль цитокинов в воспалении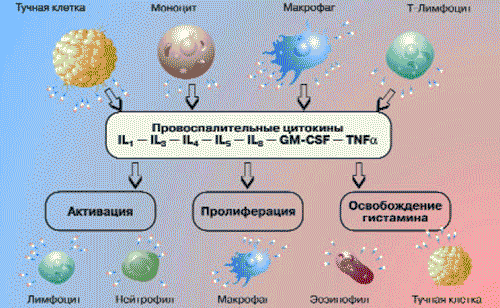
Наиболее изученными из цитокинов являются интерлейкин-1 (IL-1) и фактор некроза опухоли (TNF). Цитокины повышают сосудистую проницаемость, адгезию и миграцию лейкоцитов. Они стимулируют нейтрофилы и моноциты к умерщвлению, поглощению и перевариванию внедрившихся микроорганизмов, а также усиливают фагоцитоз. Основная роль цитокинов - контроль направления, интенсивности и продолжительности иммунного ответа, а также изменений, происходящих в тканях. Так, центральная роль в воспалении принадлежит IL-1 и TNF. Регуляцию воспалительной реакции осуществляют IL-11, TNF и хемокины. IL-4 и IL-11 отвечают за обратное развитие воспалительной реакции, так как они способны снижать уровень провоспалительных цитокинов. Продукция большинства лимфокинов и монокинов, таких как IL-1, IL-6 и TNF, ингибируется трансформирующим фактором роста (TGF). TGF стимулирует образование сосудов, пролиферацию и активность клеток соединительной ткани, однако имеет антипролиферативный эффект по отношению к большинству других клеточных элементов, включая эпителиальные, эндотелиальные и гладкомышечные клетки, а также миелоциты, эритроциты и лимфоциты. Кроме того, TGF является мощным иммуносупрессивным цитокином, который снижает активность клеточного и гуморального иммунитета, включая противоопухолевый иммунитет (H.Nguyen и соавт., 1998).
К наиболее изученным лимфокинам, модулирующим воспалительный ответ, относятся фактор, угнетающий макрофаги, макрофагактивирующий фактор, IL-2. Лимфокины координируют взаимодействие нейтрофилов, макрофагов и лимфоцитов, регулируя, таким образом, воспалительную реакцию в целом (M.Yamamoto, H.Kiyono, 1998).
Из клеточных медиаторов первостепенный интерес вызывают эйкозаноиды. Основная роль в продукции эйкозаноидов в очаге воспаления принадлежит лейкоцитам, в особенности моноцитам и макрофагам, хотя они образуются почти всеми типами ядерных клеток при стимуляции последних. Преобладающими эйкозаноидами в очаге воспаления почти всегда оказываются простагландин ПГF2, лейкотриен, тромбоксан, ПГF2 и другие. Простагландины сами не повышают сосудистую проницаемость, но, являясь сильными вазодилататорами, усиливают гиперемию и, следовательно, экссудацию. Они играют ключевую роль в модуляции воспалительного процесса, осуществляя двунаправленную регуляцию экссудации, миграции и дегрануляции лейкоцитов, а также фагоцитоза. Так, например, простагландин Е2 способен потенцировать развитие отека, вызванного гистамином или брадикинином, а ПГF2, напротив, ослаблять (M.O'Hollaren, 1998).
Таким образом, медиаторы воспаления - гистамин, простагландины, лейкотриены, цитокины и фактор активации тромбоцитов - активируют клетки, играющие большую роль в иммунном ответе: тучные клетки, базофилы, макрофаги, нейтрофилы, Т-лимфоциты, эозинофилы (рис. 4).
Рис. 4. Активация клеточных элементов медиаторами воспаления
Поэтому в дальнейшем остановимся на этой группе клеток. Известно, что значительная роль в защите организма от повреждающего агента принадлежит лимфоцитам, которые делятся на В-, Т-лимфоциты и нулевые клетки. Т-лимфоциты составляют 70-80% от общего числа лимфоцитов крови, В-лимфоциты - 10-15%, остальные лимфоциты называются нулевыми клетками. Главное предназначение лимфоцитов -распознавание антигенов. В-лимфоциты способны вырабатывать антитела к различным антигенам и являются основными эффекторами гуморального иммунитета. От других клеток их можно отличить по наличию иммуноглобулинов на клеточной мембране. Т-лимфоциты участвуют в реакциях клеточного иммунитета: аллергических реакциях замедленного типа, реакции отторжения трансплантата, обеспечивают противоопухолевый иммунитет. Популяция Т-лимфоцитов делится на две субпопуляции: лимфоциты CD4 - Т-хелперы и лимфоциты CD8 - цитотоксические Т-лимфоциты и Т-супрессоры.
Другое название нулевых клеток - большие гранулярные лимфоциты. Одна из разновидностей нулевых клеток - NK-лимфоциты. На их поверхности есть рецепторы к Fc-фраг-менту IgG, благодаря чему они могут присоединяться к покрытым антителами клеткам-мишеням и разрушать их. Это явление получило название антителозависимой клеточной цитотоксичности. NK-лимфоциты могут разрушать клетки-мишени, например, опухолевые или инфицированные вирусами, без участия антител (H.Kiyono, H.Iijima, 1998).
Вторую группу клеток, обеспечивающих иммунный ответ, составляют фагоциты. К ним следует отнести макрофаги, моноциты и гранулоциты. Они мигрируют в очаг воспаления, проникая в ткани сквозь стенки капилляров, поглощают и переваривают антигены. Так, макрофаги обеспечивают фагоцитоз, переработку и представление антигена Т-лимфоцитам, вырабатывают ферменты, некоторые белки сыворотки крови, кислородные радикалы, простагландины, лейкотриены и цитокины. Их предшественниками являются моноциты. Моноциты, выйдя из костного мозга, в течение нескольких суток циркулируют в крови, а затем мигрируют в ткани. В отличие от В- и Т-лимфоцитов, макрофаги и моноциты не способны к специфическому распознаванию антигена. Но чрезмерно стимулированные макрофаги могут вызывать серьезные повреждения тканей, способствуют развитию и поддержанию воспалительной реакции. Кроме того, макрофаги способны усилить воспаление за счет взаимодействия с Т-лимфоцитами на уровне специфических мембранных лигандов, называемых молекулами межклеточной адгезии.
Следует отметить, что фагоцитоз обеспечивается не только макрофагами и их предшественниками моноцитами. Эта функция свойственна и другим клеткам: нейтрофилам и эозинофилам. Действие нейтрофилов, как и макрофагов, неспецифично. Эозинофилы по свойствам сходны с нейтрофилами, но обладают меньшей фагоцитарной активностью. Считается, что в норме эозинофилы угнетают воспаление. Однако при бронхиальной астме эти клетки начинают вырабатывать медиаторы воспаления - главный основной белок, нейротоксин эозинофилов, катионный белок эозинофилов, лизофосфолипазу, которые вызывают повреждение эпителия дыхательных путей.
Немаловажная роль в секреции медиаторов воспаления принадлежит базофилам и тучным клеткам. Они секретируют гистамин, лейкотриены, простагландины, фактор активации тромбоцитов, которые, как указывалось ранее, повышают проницаемость сосудов и участвуют в воспалении. Базофилы циркулируют в крови, время их жизни составляет всего несколько суток. Тучные клетки, которых значительно больше, чем базофилов, в отличие от них находятся в тканях. Кроме того, и базофилы, и тучные клетки несут на своей поверхности рецепторы IgE, поэтому играют важнейшую роль в аллергических реакциях немедленного типа (G.Berger и соавт., 2000; R.Norman и соавт., 2000).
Одним из важнейших компонентов воспаления является сосудистая реакция, которая проявляется в основном в терминальных сосудах: артериолах, прекапиллярах, капиллярах и венулах. Изменения микроциркуляции происходит по фазам. В первую фазу может произойти как преходящее сужение артериол, так и их расширение. Вторая фаза носит название артериальной воспалительной гиперемии, которая имеет миопаралитическую природу. Сосуды микроциркуляторого русла, прежде всего прекапилляры, достигнув максимального расширения, перестают реагировать на сосудистое раздражение. Длится эта фаза от 30 мин до суток, при этом наблюдается покраснение и повышение местной температуры тканей, ускорение кровотока, увеличение артериального давления в сосудах. В этот период происходит значительное увеличение объема кровотока по сети капилляров, причем изменения в самой капиллярной стенке еще незначительные, поэтому экстраваскулярная потеря плазмы невелика. Затем наступает третья фаза сосудистой реакции - венозная, которая сопровождается замедлением тока крови, расширением сосудов, что внешне проявляется в виде синюшности, отека и снижения температуры тканей. Венозная гиперемия завершается престазом и стазом крови. В эту фазу преобладают вазодилататорные реакции, что доказывается резким угнетением реакции сосудов на катехоламины.
Сосудистая реакция при воспалении сопровождается экссудацией, т.е. выходом жидкой части крови в ткань через стенку сосудов (рис.5).
Рис. 5. Экссудация - выход жидкой части крови в ткань через стенку сосудов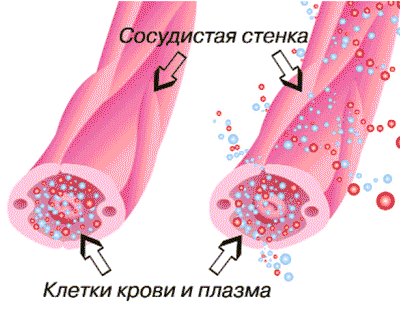
Экссудат отличается от транссудата высоким содержанием белков (от 3 до 8%). Экссудат содержит ферменты, соли, продукты промежуточного обмена, а также клеточные элементы разной стадии их повреждения. Выделяют три причины экссудации: повышение проницаемости сосудистой стенки; увеличение фильтрационного давления в микрососудах и повышение коллоидно-осмотического давления в тканях. Повышение проницаемости сосудов обусловлено округлением эндотелиальных клеток с образованием щелей между ними, а также усилением транспорта жидкости через сами клетки. Ведущее значение в механизме повышения проницаемости принадлежит биологически активным веществам, о которых уже говорилось выше.
Экссудация играет огромную роль в разрешении воспаления, так как экссудат уменьшает концентрацию токсинов и тем самым ослабляет их действие на ткань. Кроме того, в экссудате содержатся ферменты, которые разрушают токсические вещества и лизируют некротизированные ткани. С экссудатом в ткани выделяются иммуноглобулины и факторы неспецифической защиты (лизоцим, комплемент, интерферон, бета-лизины и др.), которые оказывают антитоксическое и антимикробное действие. Экссудат содержит также большое количество фибриногена, который переходит в фибрин и таким образом оказывает защитное действие, препятствуя распространению болезнетворного фактора по межклеточным пространствам.
Процесс экссудации протекает одновременно с эмиграцией форменных элементов крови - лейкоцитов. В этот период в центре мелких сосудов происходит беспрерывное движение эритроцитов, в то время как пристеночный (плазматический) слой наполняется лейкоцитами, которые вначале движутся по стенке сосудов (краевое расположение), а затем как бы прилипают к стенке, после чего через 2-4 ч, иногда позже, начинается их миграция.
Третьим компонентом воспалительной реакции является пролиферация. Она начинается уже с самого начала воспаления. Источником пролиферации являются ткани мезенхимы, клетки капилляров, адвентициальные клетки, фибробласты и др. Мигрировавшие в ткань макрофаги и лимфоидные клетки также являются источником пролиферации. Стимуляторами пролиферации являются продукты тканевой альтерации - тканевые стимуляторы роста. Все три компонента воспалительной реакции (альтерация, экссудация, пролиферация) взаимосвязаны и происходят одновременно, но выражены в разной степени в зависимости от характера действия патогенного фактора, реактивности организма и фазы воспаления (В.В.Новицкий, Е.Д.Гольдберг, 2001; U.Gluck и соавт., 2000).
В зоне острого воспаления происходят резкие изменения тканевого обмена, что обусловлено, во-первых, повреждением ткани, во-вторых, нарушением регионарного кровотока. Повреждение тканей приводит к быстрому накоплению большого количества разрушенных клеток. В дальнейшем вследствие нарушения венозного застоя с экссудацией, миграцией и отеком развивается местная гипоксия, которая является причиной изменений в аэробном обмене более обширного участка ткани, чем зона повреждения. Тем не менее воспаление играет важную роль в ограничении возбудителя, элиминации продуктов распада и выработке как местного, так и общего иммунитета. Однако воспаление не всегда заканчивается выздоровлением. Возможны и другие исходы: развитие осложнений и хронизация процесса. Поэтому терапия ОРЗ должна быть направлена не только на элиминацию повреждающего агента, но и на снижение проявлений воспалительной реакции путем ограничения зоны повреждения и блокады выработки биологически активных веществ - медиаторов воспаления.
Возможности терапии воспаления при ОРЗ и клиническая эффективность фенспирида
Фенспирида гидрохлорид особую уникальную нишу среди препаратов, оказывающих противовоспалительный эффект при острых и хронических инфекциях верхних дыхательных путей. Уникальность этого препарата заключается в том, что он не относится к известным группам нестероидных и стероидных препаратов. При этом фенспирид оказывает сходное со стероидами действие, ингибируя активность фосфолипазы Однако он действует на активность фосфолипазы А2 не усилением синтеза белка-ингибитора фермента фосфолипазы Он тормозит ее активность посредством блокады транспорта ионов Ca++ в клетку. Недостаток ионов кальция снижает активность фосфолипазы А2, вызывая замедление каскада трансформации арахидоновой кислоты, что приводит к снижению образования простагландинов, лейкотриенов и тромбоксанов. Помимо этого фенспирид снижает синтез гистамина и уровень экспрессии ɑ-адрено-рецепторов. Согласно данным E.Pinelli и соавт. (1993) противовоспалительная и спазмолитическая активность фенспирида обусловлена его способностью ингибировать действие гистамина, уменьшать лейкоцитарную инфильтрацию, проницаемость сосудов и экссудацию. При этом наивысшая фармакологическая эффективность препарата проявляется на уровне верхних и нижних дыхательных путей.
Клиническая эффективность фенспирида в настоящее время подтверждена многими исследованиями (М.В.Дроздова, А.В.Полевщиков, 1999; Е.В.Середа и соавт., 2001; A.Broillet и соавт., 1988; G.Akoun и соавт., 1991; J.Kips и соавт., 1993 и др.). В многоцентровом исследовании изучена эффективность и переносимость фенспирида у детей и подростков с острыми воспалительными заболеваниями респираторного тракта (Г.А.Самсыгина и соавт., 2002). В данной работе убедительно доказана безопасность фенспирида и его способность существенно облегчать течение ОРЗ в детском возрасте. Авторы подчеркивают высокую эффективность препарата в монотерапии ОРЗ, особенно при его назначении в первые дни заболевания.
Целью настоящего исследования явилось изучение эффективности противовоспалительной терапии фенспиридом ОРЗ у взрослых. Для этого проведено многоцентровое, рандомизированное, сравнительное исследование в 10 регионах России в зимний период 2003 г. Фактически при этом были охвачены все климатические зоны страны. Каждому врачу, участвующему в исследовании, необходимо было в соответствии с критериями включения и исключения провести лечение 5 пациентов. Критериями включения были возраст от 18 до 60 лет и наличие ОРЗ верхних дыхательных путей с проявлениями ринита, фарингита, синусита, тонзиллита, ларингита, ларинготрахеита и бронхита. Рандомизацию пациентов осуществляли следующим образом. Первый, третий и пятый пациенты составили основную группу. Им применяли монотерапию фенспиридом в дозе 80 мг (1 таблетка) 3 раза в день в течение 10 дней. В этой группе помимо фенспирида допускался только прием парацетамола. Второй и четвертый пациенты составили контрольную группу, им назначали терапию, включающую парацетамол, муколитики, антигистаминные препараты и антисептики. Назначение антибиотиков, а также аспирина и других нестероидных противовоспалительных препаратов, кортикостероидов в обеих группах запрещалось. Применять сосудосуживающие капли в нос также запрещалось в обеих группах, за исключением тех случаев, когда у пациента с риносинуситом отсутствовало носовое дыхание, что препятствовало сну.
Во время первого визита к врачу больному определяли диагноз и степень тяжести заболевания. Легкую степень оценивали баллом 1, среднюю степень тяжести - баллом 2. Оценку жалоб пациента проводили следующим образом: отсутствие жалоб - 0 баллов, наличие жалоб - 1 балл. При этом учитывали наличие выделений из носа, заложенность носа, кашель, наличие мокроты, чихание, зуд в носу, затруднение носового дыхания, боль в горле, осиплость, головную боль, слабость, одышку, повышение температуры тела. Клинические симптомы болезни оценивали в баллах от 0 до 4. Состояние глотки определяли по размеру небных миндалин, наличию или отсутствию гиперемии и отека небных дужек и задней стенки глотки, наличию фолликулярных изменений. Регионарные лимфатические узлы расценивали по степени их увеличения и болезненности. Аускультативно изучали характер дыхания в легких, наличие хрипов и их характер.
Во время первого визита пациенту выдавали дневник, в котором он отмечал динамику симптомов с 1 по 10-й день лечения, а также применение сосудосуживающих капель в нос. Во время второго визита на 4-й день терапии оценивали выполнение пациентом назначенного лечения на основании заполнения дневника, прослеживали динамику клинических симптомов болезни и переносимость фенспирида. Третий визит был назначен на 7-й день лечения, четвертый - на 10-й день. При этом также производили оценку динамики клинических симптомов и переносимость препарата. На 10-й день определяли исход заболевания. Результаты лечения оценивали как отличные, хорошие, удовлетворительные и без эффекта.
Всего анализу было подвергнуто 1309 карт клинического наблюдения. Из анализа было исключено 126 карт как не соответствующих критериям включения. Всего статистической обработке подверглись 1183 карты, из них основная группа составила 733 карты и контрольная - 450 карт. По диагнозам больные основной и контрольной групп распределены следующим образом: острый ринит - 100 и 89 больных, острый фарингит - 133 и 117 больных, острый и обострение хронического синусита - 54 и 18 больных, острый тонзиллит - 22 и 10 больных, острый ларингит - 31 и 32 больных, ларинготрахеит - 243 и 131 больной, острый бронхит - 150 и 53 больных (рис. 6).
Рис. 6. Распределение больных по диагнозам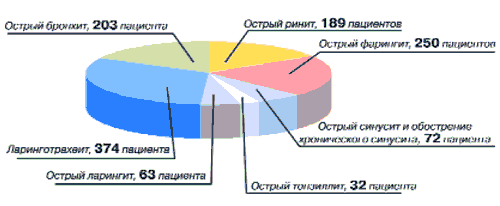
При анализе результатов лечения больных острым ринитом было отмечено, что процентное соотношение мужчин и женщин, а также средний возраст, рост, масса тела, тяжесть и длительность заболевания до момента обращения к врачу были практически одинаковыми, что позволило провести корректное сравнение результатов. Сравнение жалоб пациентов показало, что симптом выделений из носа до начала лечения у больных основной группы составлял 0,97±0,02 балла, снижаясь к окончанию лечения до 0,01±0,01 (р<0,001). У больных контрольной группы этот показатель до лечения был равен 0,97±0,01, а после лечения 0,15±0,04 (р<0,05). Показатель заложенности носа в основной группе до лечения был равен 0,92±0,03, снижаясь к последнему дню терапии до 0,01±0,01 (р<0,001). Этот же показатель у больных контрольной группы до лечения составлял 0,93±0,03, а после лечения 0,12±0,04 (р<0,05). Показатель затруднения носового дыхания в основной группе до лечения был равен 0,91±0,03, уменьшаясь к моменту окончания лечения до 0,01±0,01 (р<0,001). Как отражено на рис. 7, этот же показатель у больных контрольной группы до лечения составлял 0,93±0,04, а после лечения 0,13±0,04 (р<0,05).
Рис. 7. Динамика клинических симптомов у пациентов с ринитом
Изучение конечных результатов лечения показало, что в основной группе выздоровление наступило у 94% больных, а в контрольной - у 86,5%. Результаты лечения в основной группе расценены как отличные у 61% больных, как хорошие - у 29% больных, как удовлетворительные - у 5%. Эффекта не было у 5% пациентов. Таким образом, у 90% больных острым ринитом в основной группе получены отличные и хорошие результаты лечения. Какие-либо нежелательные явления отсутствовали у 92% больных.
Как и у больных острым ринитом, у пациентов с острым фарингитом в основной и контрольной группах не отмечено разницы в половом, возрастном составе, а также при анализе роста, массы тела, степени тяжести заболевания. У больных фарингитом эффективность лечения оценивали по следующим показателям: кашель, боль в горле, изменения слизистой оболочки задней стенки глотки. В основной группе показатель интенсивности кашля до лечения был равен 0,83±0,04. К моменту окончания лечения он составил 0,04±0,02 (р<0,001). У больных контрольной группы этот показатель до лечения составлял 0,88±0,04, а после лечения - 0,17±0,04 (р<0,05). Интенсивность боли в горле у больных основной группы до лечения была 0,87±0,03, а после лечения 0,01±0,01 (р<0,001). У пациентов контрольной группы, как показано на рис. 8, показатель боли в горле до лечения был равен 0,91±0,03, а после лечения 0,13±0,09 (р<0,05).
Рис. 8. Динамика боли в горле у пациентов С остррыи фарингитом
Изменения слизистой оболочки задней стенки глотки в основной группе во время первого визита составляли 1,7±0,06, снижаясь к последнему дню терапии до 0,08±0,03 (р<0,001). Н рис. 9 продемонстрировано, что в контрольной группе этот показатель был равен 1,68±0,07 до лечения и 0,24±0,05 после лечения (р<7).
Рис. 9. Динамика состояния задней стенки глотки у пациентов с острым фарингитом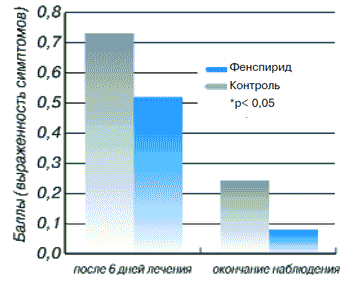
Выздоровление наступило у 98,5% больных основной группы и у 85,5% больных контрольной группы. Умеренные и незначительные нежелательные явления от применения фенспирида отмечены только в 5% наблюдений.
Среди больных синуситом пациентов, вошедших в основную группу, было в 3 раза больше по сравнению с контрольной - 54 и 18 соответственно. При этом в основной группе женщин также было больше, чем в контрольной - 45 и 12. Однако другие показатели (тяжесть заболевания, время обращения к врачу) были практически сходными, что позволило провести сравнительный анализ между группами. Ведущими симптомами, по которым оценивали эффективность лечения, были выделения из носа, заложенность носа и затруднение носового дыхания. Показатель выделений из носа у больных основной группы до лечения составил 0,88±0,05, снижаясь к 10-му дню терапии до 0,10±0,04 (р<0,001). В контрольной группе этот показатель до лечения был равен 0,89±0,08, а после лечения - 0,22±0,1 (р<0,05). Заложенность носа в основной группе выражалась показателем 0,94±0,03 до лечения и 0,14±0,05 после лечения (р<0,001). В контрольной группе этот показатель был равен 0,9±0,07 до лечения и 0,33±0,11 после лечения (р<0,05). Показатель затруднения носового дыхания у больных основной группы до лечения был равен 0,96±0,03, снижаясь к окончанию лечения до 0,08±0,04 (р<0,001). В контрольной группе этот показатель был равен до лечения 0,94±0,06, а после лечения 0,22±0,1 (р<0,05). Балльная оценка головной боли у больных основной группы до лечения была равна 0,82±0,06, а после лечения - 0,04±0,03 (р<0,01). Этот же показатель у пациентов контрольной группы до лечения составил 0,89±0,08 и после лечения - 0,05±0,06 (р<0,05). В основной группе выздоровели 94,4% больных, в группе контроля - 77,8%.
Под наблюдением находились 22 больных основной группы и 10 пациентов контрольной группы, у которых диагностирован острый тонзиллит. При изучении показателей, на которых базировалась диагностика, были получены следующие результаты. В основной группе боль в горле, повышение температуры тела, гиперемия и отек небных миндалин к 10-му дню терапии полностью исчезли у 100% больных. В контрольной группе этот показатель составил 70%.
Основная и контрольная группы больных острым ларингитом составили соответственно 31 и 32 человека. По клиническим характеристикам эти группы были практически идентичны. Течение острого ларингита оценивали по изменениям в жалобах на осиплость, боли в горле и кашель. У пациентов как основной, так и контрольной групп в течение периода наблюдения отмечена стойкая тенденция к уменьшению симптомов. К окончанию периода наблюдения выздоровление наступило у 96,8% больных основной и 87,5% контрольной групп. Следует, однако, отметить, что достоверной разницы в результатах лечения исследуемых групп отмечено не было.
Пациенты с острым ларинготрахеитом составили наибольшую группу настоящего наблюдения. В основную группу были включены 243 пациента, а в контрольную - 131. Оценку эффективности лечения проводили исходя из анализа двух важнейших симптомов, таких как кашель и наличие мокроты. Показатель интенсивности кашля у больных основной группы до лечения составил 0,99±0,08, снизившись по окончании терапии до 0,15±0,03 (р<0,01). У пациентов контрольной группы этот же показатель до лечения равнялся 0,97±0,02, уменьшаясь по окончании лечения лишь до 0,54±0,05 (рис. 10).
Рис. 10. Динамика кашля у пациентов с острым ларинготрахеитом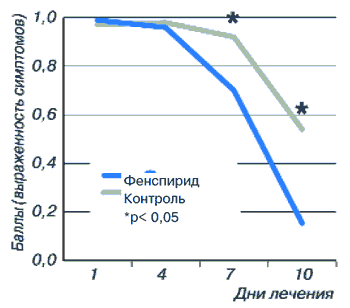
Показатель наличия мокроты в основной группе до лечения был равен 0,34±0,03, а после лечения составил 0,04±0,02 (р<0,001). В контрольной группе этот показатель до лечения составлял 0,22±0,04, увеличившись к моменту окончания лечения до 0,27±0,44 (рис. 11).
Рис. 11. Динамика мокроты у пациентов с острым ларинготрахеитом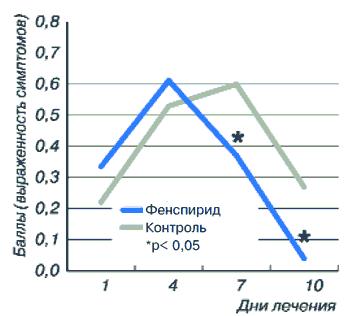
Число выздоровевших больных в основной группе составило 95%, в то время как в контрольной - лишь 68%.
В настоящем исследовании анализу были подвергнуты карты наблюдений 203 больных острым бронхитом, из которых в основную группу вошли 153 пациента, а в контрольную - 53. Несмотря на различие в количественном составе этих групп, их основные клинические характеристики были практически идентичны. Оценку эффективности терапии у данных пациентов проводили на основании анализа физикальных методов исследования, а также анализа жалоб больных. Так, показатель интенсивности кашля у больных основной группы до лечения был равен 0,98±0,01, снижаясь к 10-му дню терапии до 0,16±0,03 (р<0,01). В контрольной группе этот показатель до лечения составлял 0,96±0,03, а после лечения -0,48±0,07 (рис. 12).
Рис. 12. Динамика кашля у пациентов с острым бронхитом
Показатель наличия мокроты в основной группе до лечения был равен 0,51±0,04, снижаясь к окончанию лечения до 0,09±0,03 (р<0,01). Этот же показатель у больных контрольной группы (рис. 13) составлял до лечения 0,48±0,07, а после лечения 0,24±0,06 (р<0,05).
Рис. 13.Динамик мокроты у пациентов с острым бронхитом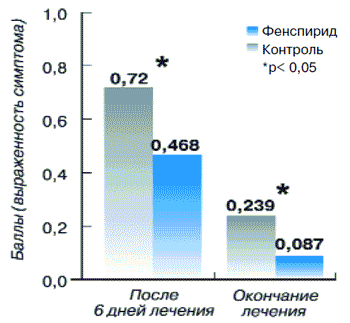
Выздоровление составило 94% в основной группе и 54,7% в группе контроля.
Таким образом, проведенный анализ показал достоверно лучшие результаты от применения фенспирида в терапии ОРЗ по сравнению с традиционными методами лечения. Следует полагать, что фенспирид - уникальное лекарственное средство, так как оказывает мощный противовоспалительный эффект, не являясь при этом гормональным препаратором и, соответственно, не обладая системными побочными эффектами. Как все новое, этот препарат с трудом находит дорогу к практическим врачам, так как они, находясь в кругу стереотипов мышления, предпочитают стандартное лечение. Именно поэтому проведенное исследование имеет важное значение, так как впервые на большом клиническом материале показана эффективность фенспирида при различных ОРЗ. Следует также подчеркнуть, что фенспирид может использоваться как монотерапия, а не как адекватная терапия, дополняющая антибиотики. Наряду с высокой эффективностью фенспирид показал себя как достаточно безопасный препарат. Серьезных нежелательных явлений было отмечено всего 2, что составило 0,17%. В заключение следует отметить, что ОРЗ всегда протекает с реакцией воспаления, которая развивается в ответ на вирусную или бактериальную инфекцию. Воспаление возникает как защитная реакция организма, направленная на элиминацию патогенного агента. Однако в случае неконтролируемой продукции цитокинов механизмы воспаления из защитныхспособны легко превращаться в повреждающие. Раннее назначение противовоспалительного препарата фенспирид, тропного к эпителию дыхательных путей, обеспечивает рациональный контроль над симптомами воспаления, способствует быстрому улучшению клинических проявлений респираторной инфекции, уменьшает вероятность развития осложнений. Литература
1. Дроздова МВ., Полевщиков АВ, Рязанцев СВ. Высокая клиническая эффективность эреспала при лечении заболеваний верхних дыхательных путей у детей Новости оториноларингол. и логопатол, 1999; 2.
2. Патофизиология: Учебник для мед. вузов под ред. ВВНовицкого и ЕДГольдберга, Томск, 2001; 199-230.
3. Самсыгина ГА, Фитилев СБ., Левин АМ. Результаты многоцентрового исследования эффективности фенспирида гидрохлорида (Эреспала) при лечении острой респираторной инфекции у детей. Педиатрия 2002; 2: 1-5.
4. Середа Е.В., Розинова НН. Геппе НА и др. Фенспирид (Эреспал) в терапии бронхитов у детей. М., 2001.
5. Akoun G, Arnaud F, Blanchon F et al Effects of fenspiride on airway function and blood gases in stable COPD patients. Eur Resp Rew 1991; 1 (rev. 2): 111-25.
6. Berger G, Kattan A, Bernheim J et al. Acute Sinusitis: A Histopathological and Immunohistochemical Study. Laryngoscope 2000; 110:2089-94.
7. Broillet A, White R, Ventrone R, Giessinger N. Efficacy of fenspiride on alleviating SO2 induced chronic bronchitis in rats and allergic rhinitis in guinea-pigs. Rhinology 1988; 4: 77-86.
8. Brunnue T, Nigam S, Kunkel G, Baumgarten CR. Clin Exp Allergy 1991; 21 (4): 425-31.
9- Friedman NR, Pachigolla R, Deskin RW, Hawkins HK. Optimal Technique to Diagnose Primary Ciliary Dyskinesia. Laryngoscope 2000; 110:1548-51.
10. Gluck U, GebbersJO. The Nose As Bacterial Reservoir: Important Differences Between the Vestibule and Cavity. Laryngoscope 2000; 110: 426-8.
11. Gluck U, GebbersJO, Sutherland BM, Woodhead AD. The Comet Assay of Nasal Epithelia: Measurement of DNA Damage for the Assessment of Genotoxic Air Pollution. Laryngoscope 2000; 110: 123-5.
12. Harbus T. Cost-effective treatment of rhinitis: a managed care perspective. Am J Managed Care 1997; 3:31.
13. Kips JC, Joos GF, Pauwells RA The effect of fenspiride on allergen induced airway-response in sensitized rats. Eur Resp J1993; 6 (17): 254.
14. Kiyono H, lijima H, Tokuhisa T The mucosal immune system. Molecular Allergology,Japan, 1998; Р. 523-30.
15. Nguyen HH, Boyaka PN, Moldoveanu Z et al. Influenza virus-infected epithelial cells present viral antigens to antigen-specific CD8+ cytotoxic T lymphocytes. Virol 1998; 72:4534-6.
16. OHollaren M. Update in allergy and immunology. Ann Internal Med 1998; 129:1036-43.
17. Pinelli E, Cambon C, Crambes O, Pipy B. Inhibition of LPS-induced TNF-alfa production in mouse inflammatory macrophages by fenspiride. Eur Resp J1993; 6 (17): 3055.
18. Sperber SJ. The common cold. Infect Med 1994; 1:235-42.
19. Yamamoto M, Kiyono H Tumor necrosis factor (TNF) and lymphotoxin (LT) in the mucosal immune system.Antibiot Chemother 1998; 14:102-6.
