Дисцикуляторная энцефалопатия – вопросы патогенеза, диагностики, дифференциальной диагностики и лечения на современном этапе
СтатьиОпубликовано в журнале:
В.И. Шмырев, А.С. Васильев, М.С. Рудас
ФГУ «Учебно-научный медицинский центр» Управления делами Президента РФ
Авторы считают, что своевременная полноценная диагностика ДЭ позволяет обеспечить выбор адекватной тактики ведения больного, подбор комплексной терапии, охватывающей весь спектр патогенетических и клинических вариантов этого заболевания и обеспечивающей профилактику осложнений. Своевременное начало лечения позволяет не только улучшить качество жизни пациента, но и существенно продлить период его социальной активности.
Ключевые слова: дисциркуляторная энцефалопатия, нарушения мозгового кровообращения.
The authors consider that modern complete diagnostics of discirculatory encephalopathy (DE) allows to implement an adequate tactics of treatment, to choose a complex therapy effective for all spectrum of pathogenetic and clinical variants of the disease as well as to provide prophylactics of DE complications. Timely treatment improves not only the patient’s quality of life but considerably prolongs the period of his active social activity.
Кey words: discirculatory encepalopathy, brain circulation disorders.
Хронические нарушения мозгового кровообращения являются одной из самых частых патологий в практике врача. К их числу относятся начальные проявления недостаточности кровоснабжения мозга (НПНКМ) и дисциркуляторная энцефалопатия (ДЭ). ДЭ представляет собой хроническую прогрессирующую недостаточность кровоснабжения головного мозга, сопровождающуюся диффузными и мелкоочаговыми изменениями, возникающую вследствие различных расстройств циркуляции. При этом, с одной стороны, хроническая цереброваскулярная недостаточность является фактором риска развития ОНМК, а с другой — причиной постепенного нарастания различных неврологических и психических расстройств. Весьма велика и социальная значимость этой патологии, т.к. неврологические и психические расстройства при ДЭ могут быть причиной серьезного снижения качества жизни и тяжелой инвалидизации пациентов. Так, только в Москве на учете в городских поликлиниках в 2003 году состояло более 450000 больных с цереброваскулярными заболеваниями, которые явились причиной более 330000 дней временной нетрудоспособности, а почти у 13000 человек – основной причиной выхода на инвалидность [3,4,5].
К сожалению, в МКБ Х, пересмотра термин ДЭ отсутствует (так же, как отсутствовал и МКБ IХ пересмотра), что неизбежно способствует «размыванию» представлений о комплексном патогенезе этого заболевания. Близкими к нему по смыслу, согласно МКБ X являются состояния, обозначенные как закупорка и стеноз церебральных или прецеребральных артерий, не приводящие к инфаркту мозга (I65.*, I66.*); другие цереброваскулярные болезни (I67), в частности, церебральный атеросклероз – атерома артерий мозга (I67.2), прогрессирующая сосудистая лейкоэнцефалопатия – болезнь Бинсвангера (I67.3), гипертензивная энцефалопатия (I67.4), другие уточненные поражения сосудов мозга (I67.8), в частности, ишемия мозга (хроническая), цереброваскулярная болезнь неуточненная I67.9; транзиторные церебральные ишемические приступы (атаки) и родственные синдромы (G45.*). При этом, в соответствии с МКБ Х имеется возможность формулировать диагноз в зависимости от ведущего клинического синдрома (сосудистые деменции, некоторые другие неврологические синдромы). При описании поздних, далеко зашедших стадий сосудистой патологии головного мозга в зарубежной литературе обычно используется термин «сосудистая деменция».
Основными патогенетическими факторами, приводящими к развитию ДЭ, являются артериальная гипертензия, стенозирующее поражение магистральных артерий головы, расстройства системы гемостаза, однако у подавляющего числа больных патогенез ДЭ носит многофакторный характер. Стойкое повышение артериального давления сопровождается поражением мелких мозговых артерий – микроангиопатией, морфологически проявляющейся аpтеpиосклеpозом или липогиалинозом. Обнаруживаются изменения артерий мозга в виде очагов плазмо-, геморрагий, зон и некроза стенки сосуда с ее истончением, одновременно регистрируются элементы репаративных и адаптивных процессов в виде гипертрофии мышечной оболочки с перекалибровкой артерий, формированием “гипертонических стенозов”, вплоть до полной облитерации просвета сосудов [1].
Так как артериальная гипертензия (АГ) является ведущим фактором риска прогредиентных форм цереброваскулярной патологии (и ДЭ в том числе), одним из важнейших вопросов является определение наличия и характера гипертензии у пациента, причем наиболее важными являются такие параметры, как уровень АД, степень поражения органов-мишеней (сердце, почки, головной мозг) и этиология. В таблице 1 приведена классификация АГ по уровню АД в соответствии с рекомендациями Российского общества по артериальной гипертонии и Всероссийского научного общества кардиологов (3-й пересмотр, 2008 год) [7].
Таблица 1. Классификация АГ по уровню АД (мм рт.ст.)
| Категории АД | САД | ДАД | |
| Оптимальное | < 120 | и | < 80 |
| Нормальное | 120 - 129 | и/или | 80 - 84 |
| Высокое нормальное | 130 - 139 | и/или | 85 - 89 |
| • АГ 1 степени | 140 - 159 | и/или | 90 - 99 |
| • АГ 2 степени | 160 - 179 | и/или | 100 - 109 |
| • АГ 3 степени | ≥ 180 | и/или | ≥ 110 |
| Изолированная систолическая АГ * | ≥ 140 | и | < 90 |
Примечание: * ИСАГ должна классифицироваться на 1, 2, 3 степени согласно уровню САД.
Данная классификация имеет большое значение, т.к. позволяет наглядно оценить тяжесть гипертензии и, как следствие риск развития ОНМК либо прогредиентного ухудшения церебральной гемодинамики. Также крайне важно учитывать стадию АГ и наличие факторов риска. При I стадии АГ объективные проявления поражения органов-мишеней отсутствуют. При II стадии имеется как минимум один из инструментально или лабораторно выявляемых признаков поражения органов-мишеней, таких, как гипертрофия левого желудочка, сужение сосудов сетчатки, микроальбуминурия, атеросклеротическое поражение сонных, подвздошных и бедренных артерий или аорты. При III стадии, кроме перечисленных признаков, имеются ассоциированные клинические состояния (АКС), к числу которых, согласно упомянутым Рекомендациям, относятся ишемический и геморрагический мозговой инсульт, а также ТИА. С клинической точки зрения необходимо учитывать и такие состояния, как церебральные гипертонические кризы, гипертоническая дисциркуляторная энцефалопатия, сосудистая деменция. К сожалению, встречается сочетание в диагнозе одного пациента ДЭ, ТИА или гипертонических кризов и АГ I–II стадии, что говорит о недооценке состояния больного и степени риска осложнений.
При оценке сердечно-сосудистого риска также большую роль играет наличие другой патологии. В частности, к факторам риска относят большую величину пульсового АД (у пожилых), возраст (мужчины > 55 лет; женщины > 65 лет), курение, дислипидемии, сахарный диабет и нарушенная толерантность к глюкозе, семейный анамнез ранних ССЗ, абдоминальное ожирение и ряд других состояний (см. Рекомендации). Стратификация риска осуществляется согласно параметрам, представленным в таблице 2.
Таблица 2. Стратификация риска у больных АГ *
| ФР, ПОМ и СЗ | АД (мм рт. cт.) | |||
| Высокое нормальное 130-139/85-89 |
АГ 1 степени 140-159/90-99 | АГ 2 степени 160-179/100-109 | АГ 3 степени > 180/110 | |
| Нет ФР | Незначимый | Низкий доп. риск | Средний доп. риск | Высокий доп. риск |
| 1-2 ФР | Низкий доп.** риск | Средний доп. риск | Средний доп. риск | Очень высокий доп. риск |
| ≥ 3 ФР, ПОМ, МСилиСД | Высокий доп. риск | Высокий доп. риск | Высокий доп. риск | Очень высокий доп. риск |
| АКС | Очень высокий доп. риск | Очень высокий доп. риск | Очень высокий доп. риск | Очень высокий доп. риск |
Примечание: *точность определения общего сердечно-сосудистого риска напрямую зависит оттого, насколько полно проведено клинико-инструментальное и биохимическое обследование больного. Без данных УЗИ сердца и сосудов для диагностики ГЛЖ и утолщения стенки (или наличия бляшки) сонных артерий до 50% больных АГ могут быть ошибочно отнесены к категории низкого или среднего риска вместо высокого или очень высокого; ** доп. — дополнительный риск.
Клинические проявления и течение энцефалопатии зависят от ряда факторов, в частности от индивидуальных особенностей патогенеза. В тех случаях, когда ведущим компонентом патогенеза ДЭ является АГ, наиболее характерным является преобладание ступенеобразного развития симптоматики на фоне периодически развивающихся гипертонических церебральных кризов. При этом преимущественно поражаются интрацеребральные артерии диаметром 70–500 мкм и микроциркуляторное русло мозга, типичен сегментарный характер сосудистых поражений. Развивающиеся сосудистые поражения подразделяются на первичные – острые, повторные деструктивные изменения, обусловленные сосудистыми кризами (плазморрагии, фибриноидный некроз с набуханием стенки и развитием острого гипертонического стеноза, изолированный некроз миоцитов средней оболочки артерий, милиарные аневризмы, разрыв стенки, тромбоз) и вторичные – хронические репаративные процессы (артериосклероз, гиалиноз с утолщением стенок и сужением просвета артерий вплоть до облитерации), компенсаторно-приспособительные изменения (миоэластофиброз, гиперэластоз, мышечно-эластические «подушки» в местах отхождения ветвей, гипертрофия средней оболочки, пролиферация сосудов микроциркуляторного русла). Таким образом, множественные диффузные и мелкоочаговые изменения ткани мозга, имеющие различный патогенез, локализацию, характер и распространенность, приводят к формированию гипертонической ангиоэнцефалопатии.
Для больных с тяжелым течением АГ и повторными сосудистыми кризами характерны малые глубинные (лакунарные) инфаркты головного мозга, которые рассматриваются в качестве особой формы ишемического поражения мозга. При этом сначала обычно развиваются такие лакунарные синдромы, как «чистый двигательный» инсульт, «чистый чувствительный» инсульт или «чистый мозжечковый» инсульт. При повторении подобных эпизодов развивается лакунарное состояние. Это тяжелая многоочаговая патология мозга ишемического характера, формирующаяся при развитии множественных гипертонических малых глубинных (лакунарных) инфарктов (например, у больных с тяжелым течением АГ, множественными ТИА), приводящих к уменьшению массы и объема головного мозга, расширению объема желудочков и субарахноидальных пространств. Для таких пациентов обычно характерно когнитивное снижение.
При сочетании АГ с эшелонированным атеросклерозом характерно формирование атеросклеротических малых глубинных (лакунарных) инфарктов, «фенотипически» сходных с гипертоническими, однако имеющих иной патогенез. При этом поражаются не сами перфорирующие артерии (как при АГ), а передние, средние и задние церебральные, а также экстракраниальные отделы сонных и позвоночных артерий в различных сочетаниях. Снижение кровотока в перфорирующих артериях является вторичным.
В соответствии с особенностями патогенеза и клинического течения ДЭ подразделяют на следующие формы:
I – Субкортикальная атеросклеротическая энцефалопатия (САЭ);
II – Мультиинфарктное состояние (МИС);
III – Атеросклеротическая дисциркуляторная энцефалопатия (АДЭ);
IV – Смешанные формы: наиболее типичны САЭ+МИС, АДЭ+МИС;
V – Венозная энцефалопатия (ВЭ).
Субкортикальная атеросклеротическая энцефалопатия (болезнь Бинсвангера)
Морфологическим субстратом является поражение мелких перфорирующих артерий белого вещества мозга диаметром менее 150 мкм в виде гипертрофии сосудистой стенки, гиалиноза, склероза, сопровождающихся сужением или полным закрытием просвета сосуда, ведущее к диффузному поражению вещества мозга (спонгиоз, очаги неполного некроза, распад миелина, очаги энцефалолизиса).
Характерными клиническими проявлениями являются:
- Прогрессирующее нарастание когнитивных нарушений (снижение памяти, внимания, интеллекта), достигающее на последних этапах степени деменции.
- Постепенное нарастание эмоционального оскудения, потеря интереса к жизни, сужение круга интересов.
- Постепенное нарастание постуральных и локомоторных нарушений (в первую очередь ходьбы).
- Псевдобульбарный синдром различной выраженности.
- Возможно развитие подкоркового паркинсоноподобного синдрома.
- Возможны легкие и умеренные парезы конечностей.
- Постепенно нарастают нарушения контроля функций тазовых органов
На КТ, МРТ отмечается снижение плотности белого вещества, особенно выраженное вокруг передних рогов боковых желудочков; феномен «лейкоареоза» и множественные постинфарктные кисты (после лакунарных инфарктов, иногда клинически «немых») в белом веществе и подкорковых узлах.
Мультиинфарктное состояние
Морфологический субстратом является поражение средних и крупных перфорирующих артерий белого вещества мозга диаметром 200-500 мкм в виде перекалибровки, гипертрофии сосудистой стенки, гиалиноза, склероза, сопровождающихся сужением или полным закрытием просвета сосуда, ведущее к диффузному и мелкоочаговому поражению вещества мозга. Характерно сочетание множественных инфарктов различного генеза. Развивается преимущественно у пациентов с артериальной гипертензией, кардиоэмболиями (при мерцательной аритмии), сужением просвета интрацеребральных сосудов в результате их перекалибровки, а также с различными ангиопатиями и коагулопатиями.
Характерными клиническими проявлениями являются:
- Когнитивные нарушения, редко достигающие степени деменции;
- Псевдобульбарный синдром;
- Подкорковый синдром;
- Мозжечковый синдром.
- Характерно ступенеобразное развитие симптоматики (при микроинсультах).
Атеросклеротическая дисциркуляторная энцефалопатия
Морфологическим субстратом является атеросклеротическое поражение преимущественно магистральных артерий головы (вплоть до стеноза и окклюзии), приводящее к формированию очагов неполного некроза и малым инфарктам. Клиническая картина поражения артерий каротидного и вертебробазилярной системы различна.
Характерными проявлениями поражения сонных артерий являются:
- Преобладание различных умеренно выраженных очаговых изменений корковых функций (афазия, алексия, аграфия, пространственная агнозия);
- Когнитивные нарушения, редко достигающие степени деменции.
Характерными клиническими проявлениями поражения артерий вертебробазилярой системы являются:
- Зрительные и глазодвигательные расстройства;
- Нарушения статики и координации движений;
- Вестибулярные нарушения;
- Транзиторная глобальная амнезия;
- Зрительная агнозия;
- Внезапные падения (drop attacks);
- Синкопальный вертебральнобазилярный синдром;
- Нарушения сна и бодрствования;
- Вегетативно-висцеральные расстройства.
При этом дисциркуляции в ВБС составляют 70% всех ПНМК. Согласно МКБ X вертебробазилярная недостаточность выделена в самостоятельный симптомокомплекс «синдром вертебробазилярной артериальной системы» в рамках «Преходящих транзиторных ишемических приступов и родственных синдромов» (G 45.0).
По степени выраженности жалоб и неврологического дефицита выделяют три стадии АДЭ.
Стадии атеросклеротической дисциркуляторной энцефалопатии
|
I стадия Жалобы на быструю утомляемость, рассеянность, ухудшение памяти, особенно на текущие события, снижение умственной работоспособности, плохое общее самочувствие, головные боли, шум в голове, несистемное головокружение, эмоциональную неустойчивость, тревожный сон. Объективно: рассеянная микросимптоматика органического поражения нервной системы - вялость зрачковых реакций, асимметрия черепной иннервации, симптомы орального автоматизма, дрожание пальцев вытянутых рук и т.д. Социальная адаптация: Способен обслуживать себя в обычных условиях, сложность возникает лишь при повышенной нагрузке. II стадия. Жалобы: аналогично I стадии, но более выражены, часть жалоб может исчезнуть из-за снижения критики. Объективно: на первый план выступают грубые расстройства памяти, включая долгосрочную, снижена критика к своему состоянию, характерны переоценка собственных возможностей, возбудимость, многословность, слабодушие. Начинает снижаться интеллект, часто отмечаются эпизоды дизартрии, нарушения координации, возникают патологические рефлексы. Социальная адаптация: требует некоторой помощи в обычных условиях. III стадия. Жалобы: Вариабельны, зависят от ведущих клинических проявлений и сохранности критики. Объективно: наряду с рассеянной симптоматикой выявляется преимущественное поражение определенных областей мозга (подкорковых узлов, ствола мозга, мозжечковых систем и т.д.). Характерны амиостатический, псевдобульбарный, вестибуло-мозжечковый синдромы, синдром «сосудистой» деменции, drop attacks, «поздняя» эпилепсия, синдром глобальной амнезии. Социальная адаптация: из-за неврологического и когнитивного дефицита самообслуживание невозможно, требуется постоянная помощь. Венозная энцефалопатия. Морфологический субстратом обычно является длительный венозный застой в мозге вследствие: сердечной или сердечно-легочной недостаточности, сдавления внечерепных вен в области шеи, дистонии и гипотонии мозговых вен. Характерными клиническими проявлениями венозной энцефалопатии являются:
|
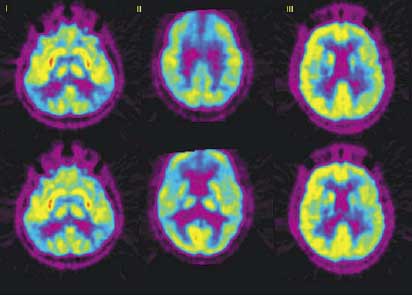
Одним из сложных вопросов ведения пациентов с ДЭ является диагностика и дифференциальная диагностика. В первую очередь для выбора адекватной тактики ведения больного необходимо достоверно определить ведущие патогенетические механизмы и факторы риска у конкретного пациента. Также весьма важна дифференциальная диагностика с клинически сходными заболеваниями, в частности, с болезнью Альцгеймера (БА) и болезнью Пика (БП). При этом для дифференциации ДЭ и БА можно использовать как традиционную шкалу Хачинского (таб. 3), так и современные методы нейровизуализации, в частности позитронно-эмиссионную томографию (ПЭТ). Для БА на ПЭТ характерно симметричное, реже односторонне, снижение метаболизма сначала в заднетеменных отделах, а при прогрессировании переход зоны гипометаболизма на височную и лобную области, остаются интактными мозжечок и подкорковые образования. При БП, в отличие от БА, фронтотемпоральная деменция характеризуется снижением метаболизма в лобных долях, которое с прогрессированием заболевания распространяется на височные доли. Такие характерные паттерны метаболических изменений позволяют достаточно легко дифференцировать БА и БП, что недоступно при МРТ и КТ. В отличие от них сосудистая деменция не имеет характерных ПЭТ-признаков, при ДЭ чаще отмечаются очаговые снижения метаболизма без характерных локализаций. Изменения метаболизма при этих заболеваниях представлены на рис. 1.
Таблица 3. Шкала Хачинского
| Признаки | Баллы |
| • Внезапное развитие деменции | 2 |
| • Ступенеобразное развитие | 1 |
| • Флюктуирующее развитие | 2 |
| • Дезориентация в ночное время | 1 |
| • Относительная сохранность личности | 1 |
| • Депрессия | 1 |
| • Эмоциональная неустойчивость | 1 |
| • Артериальная гипертония в анамнезе | 1 |
| • Инсульт в анамнезе | 2 |
| • Наличие атеросклероза (ЭКГ +УЗДГ) | 1 |
| • Очаговая неврологическая симптоматика | 2 |
| • Патологические знаки | 2 |
| При сумме 4 балла и менее – БА, 7 и более – ДЭ | |
Рис. 1. Дифференциальная диагностика БА (I), БП (II) и ДЭ (III) по данным ПЭТ (пояснения в тексте).
При ведении пациентов с ДЭ основными направлениями являются профилактика прогрессирования заболевания и лечение основных синдромов. Возможности фармакологической терапии ДЭ обширны (таб. 4), но для подбора адекватной терапии требуется не только обеспечить ее патогенетическую обоснованность, но и подобрать препараты, сочетающие достаточно высокую эффективность и хорошую переносимость при длительном или курсовом применении.
Таблица 4. Компоненты комплексной терапии ДЭ
|
Антигипертензионная терапия Используются все классы антигипертензивных препаратов и их рациональные комбинации, однако не следует применять АГП, вызывающие ортостатическую гипотонию. Препараты, улучшающие метаболизм мозга ноотропил, пирацетам, пиридитол, церебролизин, актовегин, метионин, альвезин, глицин, инстенон, акатинол, мемантин, пикамилон, энцефабол, когитум, эссенциале, лецитин, бетасерк, витамины А, С, Е, группы В, фолиевая к-та, глиатилин и др. Препараты, восстанавливающие микроциркуляцию танакан, эуфиллин, винпоцетин, пентоксифиллин, пентиллин, инстенон, трентал, циннаризин, нимодипин, флюрицин, ницерголин Ангиопротекторы кавинтон, сермион, ниннаризин, теоникол, ксантинола никотинат, пармидин, галидор, винпоцетин, агапурин Антикоагулянты аспирин, клопидогрель (плавикс), пентоксифиллин (трентал), тромбоАСС, курантил, кимотон, варфарин, микомед, карди АСК Антиоксиданты мексидол, эмоксипин, витамины А, С, Е, группы В, селен, микроэлементы |
У больных с преобладающим значением АГ в патогенезе ДЭ важнейшую роль играет контроль АД. У больных, перенесших ТИА или мозговой инсульт, необходимо стремиться к целевому АД 130/80 мм рт.ст. и менее. Для его достижения АД следует снижать с использованием этапной схемы, учитывая индивидуальную переносимость и избегая эпизодов гипотонии. При этом необходимо принимать во внимание возрастные особенности, в частности, оптимальная величина систолического АД для пожилых обычно составляет 135-150 мм рт.ст. («рабочее» давление), дальнейшее его снижение ведет к усугублению клинической картины ДЭ и повышению риска развития ОНМК. Особенно осторожно следует снижать АД у больных с гемодинамически значимым атеросклерозом сонных артерий. Также необходимо контролировать АД в ночные часы (суточный мониторинг), так как у пациентов с суточным ритмом типа «over-dipper» и высоким значением индекса «день-ночь» имеется повышенный риск развития нарушений мозгового кровотока. Адекватная фармакологическая терапия позволяет существенно снизить риск осложнений, в частности, согласно данным исследования Progress, профилактический прием престариума 4 мг 1 р.д. позволяет снизить риск развития всех когнитивных нарушений на 45% и деменции на 30%.
В случае, если у больного имеет место мерцательная аритмия, то для профилактики эмболизации необходимо применение варфарина под контролем МНО или ацетилсалициловой кислоты (АСК). Многочисленные клинические исследования, в частности Antithrombotic Trialists’ Collaboration [9], показали, что, в отличие от роста побочных эффектов, не существует достоверной положительной зависимости эффективности приема АСК от увеличения ее дозы, однако нарастает риск развития побочных эффектов. Поэтому, согласно результатам большинства проведенных в последние годы исследований, рекомендуется прием АСК в дозе 75-150 мг в сутки, как оптимальный.
При этом весьма важным является вопрос профилактики осложнений АСК, к числу которых относятся, в первую очередь, гастриты, язвы желудка и 12-перстной кишки, а также иная гастро-интестинальная патология. Мета-анализ контролируемых испытаний АСК показал, что ее прием ведет к увеличению риска желудочно-кишечных кровотечений или язвообразования в 3,5 раза, причем большая часть осложнений развивается при приеме высоких доз препарата. В этом плане является важным соблюдение режима приема препарата, а также одновременное назначение антацидов в виде самостоятельной лекарственной формы или комплексного препарата, например, кардиомагнила (сочетание АСК с невсасывающимся антацидом, действующим на всем протяжении ЖКТ - гидроокисью магния). Также могут иметь место различные аллергические реакции, идиосинкразии и кровоизлияния. Что же касается сверхмалых доз этого препарата (менее 75мг в сутки), они менее изучены. Следует также иметь в виду, что от 25 до 30% пациентов могут быть вообще резистентны к антиагрегационным эффектам ацетилсалициловой кислоты [6].
В случае непереносимости или неэффективности АСК в терапевтических дозах возможными заменами могут быть сочетание АСК (25 мг) и дипиридамола (200 мг) дважды в сутки, клопидогрел (75 мг/сутки) или монотерапия дипиридамолом (200мг дважды в сутки). Необходимо отметить, что применение комбинации АСК с дипиридамолом может сопровождаться головной болью, что отрицательно влияет на комплаенс. Также с большой осторожностью необходимо относиться к его использованию у пациентов со стенокардией напряжения и документированным тяжелым стенозом коронарных артерий из-за риска осложнений. Во всех случаях применение альтернативных схем лечения требует более частого (в том числе лабораторного) мониторинга состояния пациента.
У пациентов с АДЭ на первое место выходит стабилизация атеросклеротического процесса. Если у пациента с клинической картиной ДЭ имеет место дислипидемия, а по данным ЦДС или МСКТ имеется хотя бы одна атеросклеротическая бляшка в магистральных артериях головы и шеи, то может быть поставлен вопрос о необходимости назначения статинов, например, аторвастатина в малой терапевтической дозе 10мг в сутки. При решении этого вопроса необходимо учитывать ряд факторов, в том числе уровень холестерина, гемодинамическую значимость бляшки (процент стеноза), ее тип (I-III типы по Gray-Weale с высоким риском тромбоэмболии), сопутствующую патологию (противопоказаниями к назначению являются активное заболевание печени, тяжелая недостаточность функции печени с повышенной активностью трансаминаз и д.р.). Снижение в результате лечения статинами ЛПНП холестерина на 1,0 ммоль/л приводило к снижению риска всех инсультов на 10%, а на 1,8 ммоль/л - на 17%. В целом, по данным ряда исследований (SSSS, 1995; HPS, 2001), применение статинов в течение 3-5 лет позволяет снизить риск развития инсульта на 24-36% [10].
Следующим важным направлением лечения пациентов с ДЭ является применение нейрометаболических и вазоактивных препаратов. К их числу можно отнести препараты комплексного действия (актовегин, инстенон, винпоцетин, цераксон), преимущественно нейротропные препараты (пирацетам, глицин, энцефабол), препараты, преимущественно влияющие на мозговой кровоток (циннаризин, ницерголин, ксантинола никотинат, танакан), препараты, улучшающие микроциркуляцию (пентоксифиллин), препараты, обладающие преимущественно нейротрофическим действием (церебролизин). В клинической практике в большинстве случаев оптимальным является применение препаратов комплексного действия, т.к. это позволяет снизить фармакологическую нагрузку на больного в сочетании с повышением комплаенса. Одним из таких препаратов является актовегин, обладающий широким спектром фармакологических эффектов:
- Улучшает потребление и утилизацию глюкозы и кислорода клетками в условиях ишемии (антигипоксант)
- Активизирует антиоксидантную систему организма (антиоксидант)
- Ускоряет синтез белков, углеводов и липидов (метаболик)
- Способствует процессам репарации и регенерации
- Оказывает нейротрофическое действие
- Способствует реваскуляризации зоны ишемии
Несомненным достоинством Актовегина является хорошая переносимость, возможность длительного применения даже в относительно высоких дозировках [2,4]. Побочные эффекты в виде аллергических реакций (крапивница, отеки, лихорадка), тошноты, ощущения жара и усталости наблюдаются редко [8]. Противопоказанием является только наличие аллергии к препарату. Как и в отношении других инфузионных средств, имеются ограничения к инфузионному введению актовегина: декомпенсированная сердечная недостаточность, отек легких, олигурия, анурия, задержка жидкости в организме.
Клиническая эффективность актовегина была доказана еще в 1992 г. при проведении исследования «Лечение хронической цереброваскулярной недостаточности с использованием драже актовегин форте» (двойное слепое плацебо-контролируемое исследование, с участием 120 пожилых пациентов). По тесту Паули, мозаичному тесту (один из тестов HAWIE) и по всем клиническим симптомам (депрессия, чувство страха, головокружение, нарушения сна и т.д.) было обнаружено превосходство актовегина над плацебо с высокой степенью статистической значимости [8]. Актовегин не только улучшает транспорт глюкозы и поглощение кислорода, но и стимулирует их утилизацию, что улучшает кислородный метаболизм даже в условиях гипоксии , что обусловлено инсулиноподобным действием актовенина.
Оптимальная схема применения актовегина при ДЭ на амбулаторном этапе - 200 мг по 1-2 таблетке 3 раза в день в течение 4-6 недель или 200 мг в/м 10-15 инъекций курсами 2-4 раза в год. В условиях стационара возможно применение препарата в дозе 1000мг в/в капельно №10 через день с последующим переходом на таблетированную форму.
Следующим препаратом комплексного действия является инстенон, представляющий собой комбинацию гексобендина (метаболик), этамивана (нейротропный препарат, улучшающий интегративную деятельность головного мозга за счет стимуляции ретикулярной формации) и этофиллина (улучшает гемодинамику вследствие повышения перфузионного давления в зоне ишемии и улучшения микроциркуляции). При хорошей переносимости препарат весьма эффективен, однако у ряда пациентов может отмечаться идиосинкразия преимущественно к этофиллину, поэтому у больных с кардиологической патологией препарат должен назначаться с осторожностью.
При лечении ДЭ в амбулаторной практике оптимальным является назначение инстенона в дозе 1 табл. или 1 табл-форте 3 раза в день в течение 30 дней курсами 2-4 раза в год. Это позволяет добиться уменьшения головокружения, улучшения памяти и координации движений. В случае выраженного головокружения можно рекомендовать сочетание инстенона 1 т. х 3 р.д. и бетастигмина (бетасерка) 24 мг в сутки. Это позволяет существенно уменьшить вызываемые головокружением нарушения походки, снизить риск травматизации и облегчить социальную адаптацию пациента.
В случае венозной энцефалопатии, а также в качестве элемента комплексной терапии других форм ДЭ можно рекомендовать назначение препаратов, обладающих венотоническим действием, например, танакана, представляющего собой стандартизированный экстракт Гингко Билоба (EGb 761). Суточная доза Танакана при лечении хронических сосудистых расстройств составляет 120 мг (по 1 т. или 1 мл х 3р.д. во время еды), при терапии астенических состояний она увеличивается до 240 мг/сут. Одновременно пациенту рекомендуется ношение мягкой воротниковой шины Шанца для разгрузки мышц плечевого пояса и шеи, что способствует снижению экстравазальной компрессии вен. При наличии возможности пациент должен быть проконсультирован мануальным терапевтом (остеопатом) для выявления и коррекции синдрома функционального блока верхней апертуры грудной клетки.
Таким образом, своевременная полноценная диагностика ДЭ позволяет обеспечить выбор адекватной тактики ведения больного, подбор комплексной терапии, охватывающий весь спектр патогенетических и клинических вариантов этого заболевания и обеспечивающей профилактику осложнений. Своевременное начало лечения позволяет не только улучшить качество жизни пациента, но и существенно продлить период его социальной активности.
ЛИТЕРАТУРА
1. Верещагин Н.В., Моргунов В.А., Гулевская Т.С. Патология головного мозга при атеросклерозе и артериальной гипертонии. М., Медицина, 1997, с. 288
2. Гудкова В.В., Стаховская Л.В., Кирильченко Т.Д. и др. Применение Актовегина на разных этапах лечения больных с ишемическим инсультом. Ж. CONSILIUM MEDICUM/ т. 9 / № 8 с 22-25.
3. Гусев Е.И., Белоусов Ю.Б., Бойко АН. и др. Общие принципы проведения фармакоэкономических исследований в неврологии: Метод. рекомендации. М.; Издатель Е. Разумова, 2003.-56 с.
4. Камчатнов ПР., Чугунов А.В., Воловец С.А., Умарова Х.Я. Комбинированная терапия дис циркуляторной энцефалопатии. Сonsilium medicum. 2005; 7 (8): 686-92
5 Камчатнов П.Р Хронические расстройства мозгового кровообращения возможности метаболической терапии. - РМЖ, том 16, № 5, 2008 - с. 274-276.
6. Пирадов М.А. Антиагрегантная терапия в профилактике повторных ишемических инсультов. - РМЖ, 2003 г, том 11, № 12 с. 696-698
7. Рекомендации Российского медицинского общества по артериальной гипертонии и Всероссийского научного общества кардиологов. - Приложение 2 к журналу “Кардиоваскулярная терапия и профилактика” 2008; 7(6).
8 Янсен В., Брукнер Г.В. Лечение хронической цереброваскулярной недостаточности с использованием драже Актовегин форте. Рос. мед. журн. 2002; 10 (12): 1-4.
9. Collaborative meta-analysis of randomised trials of anti- platelet therapy for prevention of death, myocardial infarction, and stroke in high risk patients. BMJ 2002 Jan 19;324(7330):141.
10. Law M.R., Wald N.J., Rudnicka A.R. Quantifying effect of statins on low density lipoprotein cholesterol, ischaemic heart dis- ease, and stroke: systematic review and meta-analysis. BMJ. 2003 Jun 28;326(7404):1423.
