Коморбидность неалкогольной жировой болезни печени и сердечно-сосудистых заболеваний: фокус на адеметионин и урсодезоксихолевую кислоту
СтатьиО. А. Полякова1, О. Д. Остроумова1, Г. П. Ковалева2, Е. Е. Павлеева3
1ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России, Москва
2ФГБУ «Санаторий „Загорские дали“» Управления делами Президента Российской Федерации, Московская обл., Сергиево-Посадский р-н, пос. Загорские дали
3ФГБОУ ВО «Московский государственный медико-стоматологический университет имени А. И. Евдокимова» Минздрава России, Москва
Резюме
Изменение характера взаимодействия факторов риска и глобальное старение населения привели к стремительному росту пациентов с сочетанной патологией, возводимой в ранг новой неинфекционной эпидемии. Существовавшая ранее парадигма «одно заболевание - один пациент» теряет актуальность и больше не соответствует медицинским потребностям, поэтому пациенты с сочетанными заболеваниями нуждаются в более широком подходе и индивидуализированных схемах лечения, которые в настоящее время полностью не определены. Согласно современным представлениям сосуществование патогенетически и патофизиологически взаимосвязанных двух и более заболеваний у одного индивидуума определяется термином «коморбидность». Наиболее распространенным фенотипом коморбидности является кардиометаболический. Особый интерес представляет взаимосвязь сердечно-сосудистых заболеваний (ССЗ) и неалкогольной жировой болезни печени (НАЖБП), так как обе нозологии имеют высокую распространенность в популяции и общие факторы метаболического риска (ожирение, сахарный диабет, гипертония и дислипидемия). Кроме того, имеются сведения, что НАЖБП является независимым фактором риска развития ССЗ, что позволяет предположить не только наличие единых патогенетических механизмов, отличных от метаболических путей, но и вероятность того, что лечение заболевания печени может снизить бремя ССЗ. В связи с этим в настоящем обзоре всесторонне анализируется взаимосвязь НАЖБП и ССЗ и обсуждается возможная терапевтическая стратегия, включающая применение комбинации адеметионина с урсодезоксихолевой кислотой.
Ключевые слова: неалкогольная жировая болезнь печени, сердечно-сосудистые заболевания, коморбидность, полиморбидность, мультиморбидность, адеметионин, урсодезоксихолевая кислота, гепатопротекторы.
Источник: Коморбидность неалкогольной жировой болезни печени и сердечно-сосудистых заболеваний: фокус на адеметионин и урсодезоксихолевую кислоту / О. А. Полякова, О. Д. Остроумова, Г. П. Ковалева, Е. Е. Павлеева // Медицинский алфавит. – 2021. – № 29. – С. 13-20. – DOI 10.33667/2078-5631-2021-29-13-20. – EDN PNAKFI.
Comorbidity of non-alcoholic fatty liver disease and cardiovascular disease: focus on ademetionine and ursodeoxycholic acid
O. A. Polyakova1, O. D. Ostroumova1, G. P. Kovaleva2, Е. Е. Pavleeva3
1 Russian Medical Academy for Continuing Professional Education, Moscow, Russia
2Zagorskiye Dali’ Sanatorium, Moscow Region, Sergiev Posad District, Zagorskiye Dali, Russia
3Moscow State University of Medicine and Dentistry n.a. A.I. Evdokimov, Moscow, Russia
Summary
Changes in the nature of the interaction of risk factors and global aging of the population have led to a rapid increase in patients with combined pathology, elevated to the rank of a new non-infectious epidemic. The previously existing ‘one disease, one patient' paradigm is losing its relevance and no longer meets medical needs, therefore patients with comorbidities need a broader approach and individualized treatment regimens, which are currently not fully defined. According to modern concepts, the coexistence of pathogenetically and pathophysiologically interrelated two or more diseases in one individual is defined by the term ‘comorbidity'. The most common comorbidity phenotype is cardiometabolic. Of particular interest is the relationship between cardiovascular disease (CVD) and non-alcoholic fatty liver disease (NAFLD), since both diseases are highly prevalent in the population and have common metabolic risk factors (obesity, diabetes mellitus, hypertension, and dyslipidemia). In addition, there is evidence that NAFLD is an independent risk factor for CVD, which suggests not only the presence of common pathogenetic mechanisms other than metabolic pathways, but also the likelihood that treatment of liver disease can reduce the burden of CVD. In this regard, this review comprehensively analyzes the relationship between NAFLD and CVD and discusses a possible therapeutic strategy, including the use of a combination of ademetionine with ursodeoxycholic acid.
Key words: non-alcoholic fatty liver disease, cardiovascular diseases, comorbidity, polymorbidity, multimorbidity, ademetionine, ursodeoxycholic acid, hepatoprotectors
Введение
Увеличение продолжительности жизни населения, изменение поведенческих факторов и характера воздействия факторов риска неинфекционных заболеваний (НИЗ), наблюдаемые во всем мире, привели к росту численности людей, имеющих не только одно, но и несколько хронических НИЗ [1-3]. Согласно накопленным данным, наличие сочетанных хронических заболеваний ассоциировано со значимым снижением качества жизни, повышенным риском ранней инвалидности и смертности [4-6]. Кроме того, в условиях быстро растущей распространенности данного явления парадигма «один пациент - одно заболевание» теряет актуальность и больше не соответствует медицинским потребностям, поэтому пациенты с сочетанными заболеваниями нуждаются в более широком подходе и индивидуализированных схемах лечения, а решение проблемы, связанной с особенностью ведения таких пациентов, является одной из основных задач, стоящих в настоящее время перед всемирным здравоохранением [7, 8].
В соответствии с современными представлениями сосуществование патогенетически и патофизиологически взаимосвязанных двух и более заболеваний у одного индивидуума определяется термином «коморбидность» [9]. Наиболее часто встречающимися НИЗ являются сердечно-сосудистые заболевания (ССЗ), сахарный диабет (СД), онкология и хронические респираторные заболевания [10, 11]. Первые три ассоциированы с метаболическими изменениями (избыточный вес, ожирение, гипертония, гиперурикемия, гиперлипидемия, гипергликемия), которые способны увеличивать риск их возникновения, составляя основу коморбидности [11]. По данным систематического обзора, направленного на изучение частоты, подтипов и сочетаний «множественных» заболеваний, включающего в общей сложности 70057 611 пациентов из 12 стран, наиболее частыми паттернами коморбидности являлись сердечно-сосудистые и метаболические состояния, объединяемые под общим названием «кардиометаболический фенотип» [12]. В последующих исследованиях были получены аналогичные результаты [13-15].
С точки зрения кардиометаболического фенотипа коморбидности, особый интерес представляет взаимосвязь ССЗ и неалкогольной жировой болезни печени (НАЖБП), так как обе нозологии имеют высокую распространенность в популяции и общие факторы метаболического риска (ожирение, СД, гипертония и дислипидемия) [16, 17]. Кроме того, имеются сведения, что НАЖБП является независимым фактором риска развития ССЗ [18, 19, 20], что позволяет предположить не только наличие единых патогенетических механизмов, отличных от метаболических путей, но и вероятность того, что лечение заболевания печени может снизить риск ССЗ [21]. В связи с этим в настоящем обзоре всесторонне анализируется взаимосвязь НАЖБП и ССЗ и обсуждаются возможные терапевтические стратегии.
Патофизиологические механизмы, объединяющие НАЖБП и ССЗ
Ожирение (индекс массы тела более 30 кг/м2) является наиболее распространенным фактором риска НАЖБП [22]. Встречаемость НАЖБП у пациентов с ожирением примерно в четыре раза выше, чем при его отсутствии [22]. При этом, несмотря на то что ожирение является некой отличительной чертой НАЖБП, до 20 % лиц с нормальной массой тела имеют признаки стеатоза печени, по результатам ультразвукового исследования [23]. В связи с этим важно понимать, что при НАЖБП распределение жировой ткани является более важным фактором, нежели индекс массы тела.
Метаболически активная висцеральная жировая ткань, а также эктопические очаги дисфункционального жира в печени, поджелудочной железе, почках, перикарде и скелетных мышцах тесно связаны с высоким кардиометаболическим риском и неблагоприятными исходами [24]. Повышенное накопление висцерального и эктопического жира, окисление липидов с образованием токсичных метаболитов, активация воспалительного каскада вызывают системные изменения, которые могут приводит к развитию как НАЖБП, так и ССЗ, в том числе с помощью механизмов, не ассоциированных напрямую с ожирением или избыточной массой тела [25, 26].
Увеличение объема жировой ткани в печени является следствием усиления в ней липогенеза de novo, недостаточным поглощением из крови циркулирующих липидов и включением компенсаторных механизмов утилизации жиров (окисление жирных кислот), а также изменением процесса образования липопротеиновых частиц [27]. Последнее характеризуется избыточным накоплением в печени триглицеридов с последующей их трансформацией в крупные частицы липопротеинов очень низкой плотности (ЛПОНП), служащих для транспортировки жира к периферическим тканям [28]. При НАЖБП избыток ЛПОНП инициирует развитие атерогенной дислипидемии и дислипопротеинемии, которые включают гипертриглицеридемию, преобладание липопротеинов низкой и промежуточной плотности на фоне снижения уровня липопротеинов высокой плотности (ЛПВП) [28, 29]. В атерогенезе в основном участвуют липопротеины, содержащие аполипопротеин-В, так как они после проникновения в субэндотелиальный слой сосудистой стенки, процессов окисления служат молекулярными маркерами повреждения, активирующими компоненты врожденной иммунной системы (Toll-подобные рецепторы) с последующей инициацией иммунного ответа [28, 30]. Существует также еще один класс аполипопротеинов - С III (АпоС III), который способен через взаимодействие с Toll-подобными рецепторами второго и четвертого типа активировать NLRР3-инфламмасому [28, 31]. NLRР3-инфламмасома -это цитозольный белковый комплекс, содержащий, в частности, такой фермент, как каспаза-1 или, по-другому,- интерлейкин (ИЛ)-1р-конвертирующий фермент, способный приводить к индукции воспалительного ответа по пути от ИЛ-1Р - ИЛ-6 до образования С-реактивного белка (СРБ), участвующего в сосудистом воспалении, атерогенезе и, как следствие, в развитии ССЗ [32]. Таким образом, через активацию Toll-подобных рецепторов описывается связь между часто наблюдаемой атерогенной дислипидемией у пациентов с НАЖБП и воспалением в сосудистой стенке, лежащим в основе сердечно-сосудистой патологии [28].
Увеличение липогенеза de novo в печени ассоциировано с избытком поступления насыщенных жирных кислот (НЖК) [28, 34]. НЖК так же, как и АпоС III, могут активировать Toll-подобные рецепторы и запустить каскад воспалительных и иммунных реакций, что представляет собой еще один патофизиологический механизм, объединяющий НАЖБП и ССЗ [33]. Кроме того, по данным H. Lai et al. [34], высокий уровень НЖК (пальмитиновая, пальмитолеиновая и олеиновая кислоты) в сыворотке крови связан с более высокой смертностью от всех причин и ССЗ в отдельности.
Помимо накопления жира в печени, при НАЖБП происходит увеличение и эктопической жировой ткани в сердце (миокардиальный и эпикардиальный жир), что является одним из центральных аспектов взаимосвязи НАЖБП и ССЗ [35]. Эпикардиальная жировая ткань обладает уникальными свойствами, которые отличают ее от других депо висцерального жира. У здоровых людей адипоциты эпикардиального жира имеют черты бурой жировой ткани, которая за счет сжигания жирных кислот предотвращает их провоспалительные эффекты и питает прилегающие ткани [36]. Также они секретируют адипонектин, который защищает кардиомиоциты от гипертрофических стимулов, снижает вероятность фиброза и воспаления в коронарных артериях и миокарде, тем самым снижая вероятность развития неблагоприятных клинических событий [37, 38]. Однако при ожирении, НАЖБП эпикардиальный жир меняет свои биологические характеристики и приобретает черты белой жировой ткани, при липолизе которой высвобождаются жирные кислоты, активирующие воспалительный ответ [37-39]. Кроме того, меняется и профиль синтеза адипонектина: наряду со снижением его высвобождения происходит усиление синтеза провоспалительных адипокинов (лептин, резистин, фактор некроза опухоли-а, ИЛ-1p и ИЛ-6), которые активируют миграцию макрофагов, профибротические пути и способствуют разрушению микрососудистого русла миокарда [37-39]. При таких условиях мезенхимальные стволовые клетки могут мигрировать в миокард, трансформироваться в фибробласты и способствовать образованию очагов фиброза [40]. Описанные механизмы в конечном итоге приводят к развитию и прогрессированию ишемической болезни сердца, аритмиям и сердечной недостаточности. Также следует отметить, что секреция эпикардиальными адипоцитами прововоспалительных цитокинов в кровоток значимо усиливает уже существующее системное воспаление, что, в свою очередь, увеличивает степень кардиометаболических нарушений и способствует дальнейшему отложению эпикардиального жира, замыкающего порочный круг [38]. Поскольку НАЖБП ассоциируется с накоплением эпикардиального жира и воспалительным каскадом, вероятно, что это еще один из патофизиологических механизмов, объединяющих НАЖБП и ССЗ.
Решающее значение в патогенезе как НАЖБП, так и ССЗ, также играют нарушение метаболизма глюкозы и инсулинорезистентность, связанные с висцеральным ожирением, системным воспалением и увеличением объема эктопической жировой ткани, в особенности в области поджелудочной железы (провоцирует дисфункцию бета-клеток и усугубляет инсулинорезистентность) [28, 41]. Инсулинорезистентность сопровождается компенсаторной гиперинсулинемией, которая занимает центральное место в провоцировании и сохранении неблагоприятного метаболического фона, например гипергликемии и повышенных уровней свободных жирных кислот. Гиперинсулинемия связана с повышенным синтезом глюкозы печенью (глюконеогенез), который приводит к увеличению уровня глюкозы плазмы крови и последующего еще большего повышения уровня инсулина, формируя порочный круг Кроме того, при НАЖБП снижается клиренс печеночного инсулина, который значимо усугубляет этот патологический процесс. Также высокий уровень инсулина способен активировать некоторые факторы транскрипции (SRЕВР-1с и ChREBP), влияющие на активность липогенных ферментов, запускающих дальнейшее накопление жира в печени [42]. Таким образом, за счет этих эффектов гиперинсулинемия еще больше ухудшает течение инсули-норезистентности и способствует в дальнейшем развитию кардиометаболических расстройств [28].
Инсулинорезистентность, гиперинсулинемия и гипергликемия ассоциированы с прогрессированием атеросклеротического процесса. За счет накопления эктопической жировой ткани, конечных продуктов гликирования, нарушения регуляции метаболизма липопротеинов и сопутствующего окислительного стресса происходит активация воспалительных сигнальных путей и инфламмасом, приводящих к развитию сосудистого воспаления, которое, в свою очередь, провоцирует как сам атерогенез, так и его осложнения (разрыв атеросклеротической бляшки) [28, 43]. Кроме того, инсулинорезистентность связана с развитием кардиальной нейропатии, провоцирующей систолическую и диастолическую дисфункцию миокарда и аритмии [44], нейрогуморальной активацией ренин-ангиотензин-альдостероновой системы (РААС) [28, 46], нарушением фибринолиза (повышение уровня ингибитора-1 активатора плазминогена) [45] и эндотелиальной дисфункцией [28, 46].
Эндотелиальная дисфункция - ранняя стадия атеросклеротического процесса, имеющая одно из самых важных значений в развитии ССЗ [41]. Эндотелиальная дисфункция возникает вследствие сниженной биодоступности молекулы оксида азота (ранее известный как эндотелиальный фактор релаксации) и связана с селективной резистентностью сосудов к инсулину, окислительным стрессом и сосудистым воспалением, опосредованным, например, СРБ или АпоС III или НЖК [28, 31, 33, 41]. Снижение уровня оксида азота при НАЖБП можно объяснить нарушением распада ассиметричного диметиларгинина (АДМА) - эндогенного антагониста синтазы оксида азота, повышенный уровень которого приводит к вазомоторной дисрегуляции, изменению проницаемости сосудистой стенки и дисфункции тромбоцитов [41]. Выраженность окислительного стресса при НАЖБП ассоциирована с гипергомоцистеинемией, способствующей снижению синтеза глутатиона [47, 48].
Нарушение прокоагулянтного баланса при НАЖБП характеризуется, с одной стороны, повышением факторов свертывания (VIII, IX, XI, XII), фактора Виллебранда, фибриногена и ингибитора-1 активатора плазминогена, с другой - снижением протеина C и антитромбина III [41, 48, 49]. Эти изменения могут повышать риск развития атеросклеротических ССЗ.
Имеются данные, свидетельствующие о том, что в патофизиологии НАЖБП участвуют также и ангиогенные цитокины, в частности сосудистый эндотелиальный фактор роста (VEGF). Известно, что повышение уровня VEGF ассоциировано с образованием и дестабилизацией атеросклеротической бляшки. По данным S. Coulon et al. [50], у пациентов с НАЖБП уровень VEGF был значимо выше, чем у здоровых добровольцев. Вместе с тем функциональная роль VEGF в атерогенезе у пациентов с НАЖБП до конца не определена и требует дальнейших исследований.
Генетические изменения, вовлеченные в патогенез НАЖБП, включают полиморфизмы гена белка 3, содержащего пататин-подобный фосфолипазный домен (PNPLA3), и гена трансмембранного белка 6 суперсемейства 2 (TM6SF2). Полиморфизмы этих генов повышают риск развития ожирения печени, неалкогольного стеатогепатита, фиброза печени и гепатоцеллюлярной карциномы [17]. По данным В. K. Lauridsen et al. [51], при увеличении содержания жира в печени постепенно возрастал и риск ишемической болезни сердца, однако при использовании менделевской рандомизации между полиморфизмом PNPLA3 и данной сердечно-сосудистой патологией ассоциации выявлено не было.
Помимо генетических изменений и изменений в составе тела, был определен еще один фактор, способствующий развитию таких кардиометаболических заболеваний, как НАЖБП, атеросклероз, СД и гипертония, - изменения в составе микробиома кишечника (дисбактериоз) [52]. Существует некоторое совпадение таксонов кишечной микрофлоры среди этих заболеваний, однако специфической сигнатуры для НАЖБП в настоящее время выявлено не было [53]. Общей особенностью, связанной с дисбактериозом кишечника, является повышение проницаемости барьера слизистой оболочки с последующей миграцией микробных продуктов (пептидогликаны, липополисахарид) и биологически активных веществ, высвобождаемых из поврежденных энтероцитов в кровоток, где уже происходит опосредованная ими активация воспалительных сигнальных путей [52, 53]. Данное воспаление может быть центральным звеном между нарушением микробиома кишечника и кардиометаболическими заболеваниями [28, 52, 53]. Кроме того, такие микробные метаболиты, как N-оксид триметиламина, желчные кислоты и короткоцепочечные жирные кислоты, вносят значительный вклад в развитие ССЗ [52]. Поэтому модификация диетических привычек может привнести существенную пользу для здоровья пациентов с НАЖБП и ССЗ.
Таким образом, основные механизмы, объединяющие НАЖБП с ССЗ, очень сложны, многогранны и могут иметь двунаправленное влияние, свидетельствующее в пользу наличия коморбидности между этими патологиями (рис. 1). Данная сильная взаимосвязь подчеркивает необходимость раннего выявления и адекватного лечения кардиометаболических факторов риска в этой популяции [54, 55].
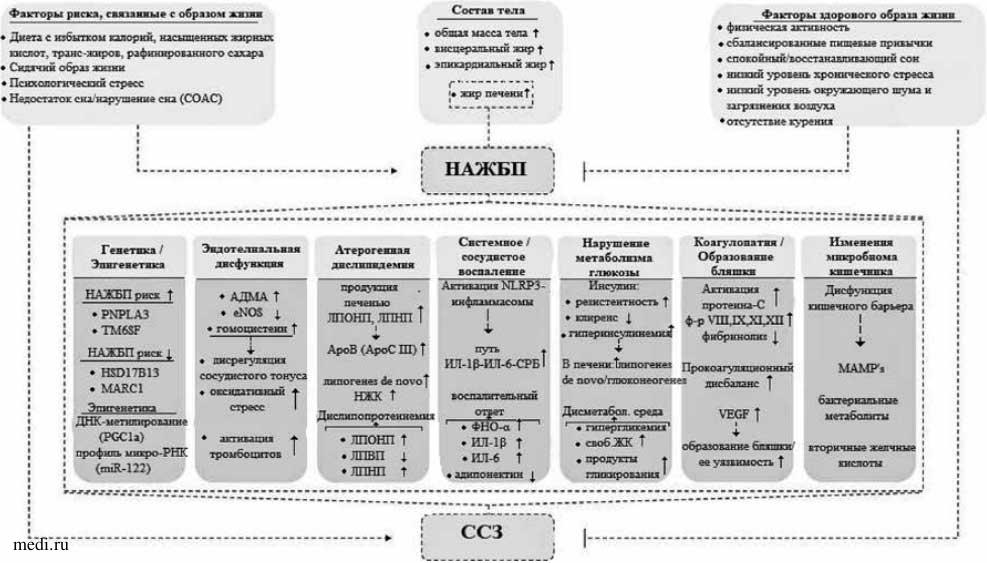 Рисунок 1. Патофизиологические механизмы, связывающие НАЖБП и ССЗ (адаптировано из [56]).
Рисунок 1. Патофизиологические механизмы, связывающие НАЖБП и ССЗ (адаптировано из [56]).Примечание: СОАС - синдром обструктивного апноэ сна, НАЖБП - неалкогольная жировая болезнь печени, PNPLA3 - протеин 3, содержащий пататин-подобный фосфолипазный домен, TM6SF - трансмембранный ген 6 (суперсемейство 2), HSD 17B 13 - гидроксистероиддегидрогеназа 17beta13, MARC 1 - митохондриальный восстанавливающий амидоксим компонент 1, PGC 1а - активируемый пролифератором пероксисом рецептора гамма - коактиватор 1-альфа, АДМА - асимметричный диметиларгинин, eNOS - эндотелиальная синтаза окиси азота, ЛПОНП -липопротеины очень низкой плотности, ЛПНП - липопротеины низкой плотности, АроВ - аполипопротеин В, АроС III - аполипопротеин С3, НЖК -насыщенные жирные кислоты, ЛПВП - липопротеин высокой плотности, ИЛ-1р - интерлейкин-1р, ИЛ-6 - интерлейкин-6, СРБ - С-реактивный белок, своб. ЖК- свободные жирные кислоты, VEGF - фактор роста эндотелия, MAMPs - микроб-ассоциированный молекулярный узор, ССЗ -сердечно-сосудистое заболевание. Стрелки вниз (↓) указывают на пониженные уровни, а стрелки вверх (↑) указывают на повышенные уровни.
Терапевтические стратегии лечения пациентов с НАЖБП и ССЗ
Основой лечения НАЖБП является модификация образа жизни, включающая расширение режима физической активности, изменение диеты и другие меры по снижению веса. При этом предпочтительным считается комплексный подход, сочетающий как диетические рекомендации, так и прогрессивное увеличение аэробных тренировок, которые следует адаптировать индивидуально под каждого пациента, учитывая сопутствующие ССЗ [55]. Однако, к сожалению, многим пациентам трудно добиться и поддерживать постоянные физические нагрузки и снижение веса, поэтому необходимы дополнительные методы лечения.
Согласно клиническим рекомендациям для терапевтов по диагностике и лечению НАЖБ у взрослых (третья версия), утвержденным Российским научным медицинским обществом терапевтов и Научным обществом гастроэнтерологов России (2020) [57], с целью снижения выраженности повреждения печени, возникающего вследствие окислительного стресса, воспаления и фиброобразования, рекомендуется использование такого класса препаратов, как гепатопротекторы. В этом контексте необходимо отметить, что в рамках первичной и вторичной кардиопрофилактики ключевой терапией для снижения риска неблагоприятных сердечно-сосудистых событий и смертности является применение препаратов статинового ряда [58-60], прием которых, как известно, может приводить к повышению печеночных ферментов и развитию выраженного лекарственно-индуцированного повреждения печени [61, 62]. Поэтому использование гепатопротекторов у коморбидных пациентов с НАЖБП и ССЗ является перспективной терапевтической стратегией. В рамках настоящего обзора фокус направлен на применение адеметионина (Самеликс®, ЗАО «Канонфарма продакшн», Россия) и урсодезоксихолевой кислоты (Эксхол®, ЗАО «Канонфарма продакшн», Россия) в схемах лечения коморбидных пациентов с НАЖБП и ССЗ.
Адеметионин
Адеметионин является основным биологическим донатором метильных групп и играет важную роль в ряде биохимических реакций, включающих ферментативное трансметилирование, транссульфарацию и синтез полиаминов [63]. До 85 % всех реакций трансметилирования происходит в печени. Метильная группа передается от адеметионина к нейротрансмиттерам, нуклеиновым кислотам, белкам, гормонам и фосфолипидам. При этом важно отметить, что метилирование фосфолипидов играет одну из ключевых ролей, так как отвечает за текучесть мембран и установление правильного соотношения фосфатидилэтаноламина (ФЭ) к фосфотидилхолину (ФХ) [64]. Известно, что изменения соотношения ФЭ/ФХ ассоциировано с развитием НАЖБП и ее прогрессированием от стеатоза до сте-атогепатита [65]. При НАЖБП, вероятно, в результате снижения активности метионинаденолтрансферазы (МАТ) и фосфатидилэтаноламин N-метилтрансферазы (ФЭТ) также происходит нарушение метаболизма метионина, снижается образование ФХ, который важен для сборки и экспорта ЛПОНП [64, 66]. Последнее происходит из-за того, что ФЭТ катализирует метилирование ФЭ в ФХ посредством метаболического пути, где в качестве донатора метильной группы используется адеметионин. Путь транссульфарации превращает гомоцистеин в цистеин и в конечном итоге в сульфаты и восстановленный глутатион - важный внутриклеточный антиоксидант. В пути аминопропилирования адеметионин метаболизируется до декарбоксилированного адеметионина, затем образуются полиамины спермидин и спермин - главные элементы роста клеток [64].
У пациентов с НАЖБП снижен уровень экспрессии МАТ и адеметионина, что способствует нарушению соотношения ФЭ/ФХ и уменьшению концентрации глутатиона [65]. В экспериментальных работах было показано, что при изменении соотношения ФЭ/ФХ происходят компенсаторные реакции, в ходе которых клетки печени приспосабливаются к его восстановлению, ингибируя секрецию ФХ, что, в свою очередь, нарушает экспорт ЛПОНП и приводит к увеличению концентрации триглицеридов в ткани печени [67]. В результате этого нарушенного экспорта триглицеридов через ЛПОНП повышаются бета-окисление и захват жирных кислот клетками печени [67]. Пониженное соотношение ФЭ/ФХ увеличивает проницаемость мембраны, что приводит к утечке клеточных компонентов, активации клеток Купфера, высвобождению провоспалительных цитокинов и последующему повреждению гепатоцитов [68]. Кроме того, пониженный уровень адеметионина повышает чувствительность печени к повреждению и также способствует экспрессии сигнальным молекул воспаления [69].
По данным A. K. Walker et al. [67], наличие у пациентов снижения соотношения ФЭ/ФХ в гепатоцитах зависело от уровня адеметионина и приводило к липогенезу и ожирению печени. В другом исследовании было обнаружено, что ген МАТ недоэкспрессируется у пациентов с запущенной НАЖБП, но не с легкой, что явно подчеркивает ключевую роль цикла адеметионина в патогенезе НАЖБП [70].
Высокая эффективность адеметионина при лечении НАЖБП продемонстрирована в ряде исследований. Так, по данным G. Vendemiale et al. [71], терапия адеметионином приводила к значительному повышению уровня глутатиона в печени у пациентов с НАЖБ по сравнению с пациентами, получавшими плацебо. В проспективном обсервационном исследовании 250 пациентов с НАЖБП было показано, что применение адеметионина ассоциировано со значительным снижением уровней печеночных ферментов (АЛТ - на 53 ед/л, р < 0,01; АСТ - на 37 ед/л, р < 0,01) [72]. В другом исследовании, включавшем 84 пациентов с НАЖБ, установлено, что по мере увеличения длительности терапии (в среднем 4 месяца) адеметионином наблюдалось отчетливое уменьшение степени стеатоза (на 6,9 % при II степени и на 13,7 % - при III) и снижение уровня печеночных ферментов, показателей липидного обмена и глюкозы крови [73]. В систематическом обзоре и метаанализе 11 рандомизированных клинических исследований, в которых участвовало 750 пациентов, продемонстрировано, что терапия адеметионином при хронических заболеваниях печени является эффективной (снижает уровень общего билирубина, печеночных ферментов) и безопасной (анализировались в том числе исследования, включающие беременных женщин) [74].
Применение адеметионина эффективно также и при лекарственном поражении печени препаратами статинового ряда у пациентов с ССЗ. По данным Т.Н. Калачнюк [75], пациенты пожилого возраста (67,7 ± 1,5 лет) с ишемической болезнью сердца и стенокардией напряжения I-II функционального класса с гиперхолестеринемией на фоне терапии статинами в течение 3-6 месяцев имели повышение уровня печеночных ферментов более чем в 3-5 раза по сравнению с исходным уровнем (р < 0,05), гистологические признаки лекарственного поражения печени, по данным биопсии, а после отмены статинов и назначения адеметионина установлено значимое улучшение клинико-лабораторных показателей: статистически значимое снижение в 3,9 раза активности аланинаминотрансферазы (АЛТ), в 3,5 раза - щелочной фосфатазы (ЩФ) и в 2,9 раза - гамма-глутамилтранспептидазы (ГГТ). Автор сделал вывод, что при статин-индуцированном поражении печени у пациентов пожилого возраста с ССЗ необходимо проводить целенаправленную гепатопротекторную терапию.
Таким образом, использование адеметионина в лечении коморбидных пациентов с НАЖБП и ССЗ является не только патогенетически обусловленным, но и клинически эффективным. Вместе с тем в рекомендациях по диагностике и лечению НАЖБП (2020) [57] подчеркивается, что при лечении пациентов с НАЖБ предпочтительным является назначение комбинации гепатопротекторов, в частности адеметионина и урсодезоксихолевой кислоты (УДХК).
Урсодезоксихолевая кислота
УДХК - вторичная желчная кислота природного происхождения, обладающая цитопротекторным, иммуномодулирующим и антиапоптическим действием [72].
В экспериментальных исследованиях было обнаружено, что УДХК улучшает состояние печени при стеатозе и воспалении частично за счет подавления пути miR-34a / SIRT1 / p53 [77]. Также УДХК может защищать гепатоциты, ингибируя абсорбцию токсичных гидрофобных солей желчных кислот из тонкого кишечника, конкурируя с токсичными желчными кислотами за связывание с мембранами клеток, тем самым поддерживая их стабильность [78]. Кроме того, УДХК способна улучшить чувствительность ткани печени к инсулину и снизить окислительное повреждение, повышая уровень глутатиона в печени и инактивируя индуцированные гидрофобными солями желчных кислот клетки Купфера [72, 79].
В систематическом обзоре 12 рандомизированных клинических исследований было показано, что монотерапия УДХК улучшает биохимический профиль (снижает уровень ферментов печени), гистологическую картину стеатоза и фиброза, по данным биопсии в нескольких испытаниях, но в сочетании с другими препаратами позитивные эффекты были более выраженными как со стороны стеатоза, так и воспаления [80].
Эффективность применения УДХК оценивалась также и в комбинации с препаратом статинового ряда при лечении атерогенной дислипидемии у пациентов с НАЖБП и МС. Так, по данным О. Н. Корнеевой и соавт. [81], при обследовании 60 пациентов с МС и НАЖБП, получавших лечение УДХК и симвастатином в течении 6 месяцев, отмечалось улучшение биохимических показателей (у 96 % больных аспартатаминотрансфераза снизилась до 35,1 ± 15,3 МЕ/л, аланинаминотрансфераза - до 33,9 ± 16,3 МЕ/л; p < 0,0003), улучшение липидного спектра у всех пациентов из исследования (р < 0,0100). При этом стоит отметить, что через 3 недели терапии статином в комбинации с УДХК не было зафиксировано ни одного случая повышения активности печеночных ферментов. В другом наблюдательном когортном исследовании, включающем 262 пациентов с ССЗ и хроническими заболеваниями печени (на долю НАЖБП приходилось 61,8 %), принимающих статины, установлено, что добавление УДХК к гиполипидемической терапии приводило к статистически значимому снижению уровня общего холестерина и ЛПНП через 6 месяцев наблюдения (р < 0,0010) до 4,3 и 2,3 ммоль/л соответственно, а также снижению активности печеночных ферментов (р < 0,001) [82]. Важно, что комбинация УДХК и статина приводила к большему снижению показателей липидного спектра, чем монотерапия статинами (р = 0,0100) [82].
Таким образом, патогенетические и клинические эффекты УДХК способствуют улучшению состояния печени у пациентов не только с НАЖБП, но и с сочетанием НАЖБП и ССЗ, что позволяет рекомендовать совместное применение адеметионина с УДХК у таких коморбидных больных.
Среди отечественных лекарственных препаратов аде-метионина и УДХК, существующих на рынке, выделяют препараты Самеликс® (ЗАО «Канонфарма продакшн», Россия) и Эксхол® (ЗАО «Канонфарма продакшн», Россия), эффективность и безопасность которых подтверждена в ряде клинических испытаний, а лекарственные формы, позволяющие гибко дозировать препараты, способствуют повышению комплаенса пациентов к терапии.
Заключение
Таким образом, применение комбинации адеметионина (Самеликс®, ЗАО «Канонфарма продакшн», Россия) и УДХК (Эксхол®, ЗАО «Канонфарма продакшн», Россия) в лечении коморбидных пациентов с НАЖБП и ССЗ является патогенетически обоснованным. Поскольку НАЖБ и ССЗ имеют некоторые единые двунаправленные патофизиологические механизмы, использование данных гепатопротекторов, вероятно, позволит улучшить не только состояние печени и желчевыводящих путей, но и сердечно-сосудистой системы, а также позволит снизить риски развития кардиометаболических нарушений.
Сведения об авторах
Полякова Ольга Александровна, врач-терапевт, ассистент кафедры терапии и полиморбидной патологии1.
Остроумова Ольга Дмитриевна, д.м.н., проф., зав. кафедрой терапии и полиморбидной патологии1.
Ковалева Галина Петровна, к.м.н., врач-терапевт2.
Павлеева Елена Евгеньевна, к.м.н., ассистент кафедры пропедевтики внутренних болезней и гастроэнтерологии3
1ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России, Москва
2ФГБУ «Санаторий „Загорские дали"» Управления делами Президента Российской Федерации, Московская обл., Сергиево-Посадский р-н, пос. Загорские дали
3ФГБОУ ВО «Московский государственный медико-стоматологический университет имени А. И. Евдокимова» Минздрава России, Москва
About authors
Polyakova Olga A., therapist, assistant at Dept of Therapy and Polymorbid Pathology1.
Ostroumova Olga D., DM Sci, professor, head of Dept of Therapy and Polymorbid Pathology1.
Kovaleva Galina P., PhD Med, general practitioner2.
Pavleeva Elena E., PhD Med, assistant at Dept of Propedeutics of Internal Diseases and Gastroenterology3
1Russian Medical Academy for Continuing Professional Education, Moscow, Russia
2Zagorskiye Dali’ Sanatorium, Moscow Region, Sergiev Posad District, Zagorskiye Dali, Russia
3Moscow State University of Medicine and Dentistry n. a. A. I. Evdokimov, Moscow, Russia
Список литературы / References
1. Roth GA, Mensah GA, Johnson CO, Addolorato G, Ammirati E, Baddour LM, Barengo NC, Beaton AZ, Benjamin EJ, Benziger CP, Bonny A, Brauer M, Brodmann M, Cahill TJ, Carapetis J, Catapano AL, Chugh SS, Cooper LT, Coresh J, Criqui M, DeCleene N, Eagle KA, Emmons-Bell S, Feigin VL, Fernandez-Sola J, Fowkes G, Gakidou E, Grundy SM, He FJ, Howard G, Hu F, Inker L, Karthikeyan G, Kassebaum N, Koroshetz W, Lavie C, Lloyd-Jones D, Lu HS, Mirijello A, Temesgen AM, Mokdad A, Moran AE, Muntner P, Narula J, Neal B, Ntsekhe M, Moraes de Oliveira G, Otto C, Owolabi M, Pratt M, Rajagopalan S, Reitsma M, Ribeiro ALP, Rigotti N, Rodgers A, Sable C, Shakil S, Sliwa-Hahnle K, Stark B, Sundstrom J, Timpel P, Tleyjeh IM, Valgimigli M, Vos T, Whelton PK, Yacoub M, Zuhlke L, Murray C, Fuster V; GBD-NHLBI-JACC Global Burden of Cardiovascular Diseases Writing Group. Global Burden of Cardiovascular Diseases and Risk Factors, 1990-2019: Update from the GBD2019 Study. Journal of the American College of Cardiology. 2020; 76 (25): 2982-3021.
2. Palladino R, Tayu Lee J, Ashworth M, Triassi M, Millett C. Associations between multimorbidity, healthcare utilisation and health status: evidence from 16 European countries. Age Ageing. 2016; 45 (3): 431-435.
3. Ording AG, Sorensen HT. Concepts of comorbidities, multiple morbidities, complications, and their clinical epidemiologic analogs. Clin Epidemiol. 2013; 5: 199-203.
4. Ryan A, Wallace E, O’Hara P, Smith SM. Multimorbidity and functional decline in community-dwelling adults: a systematic review. Health Qual Life Outcomes. 2015; 13: 168.
5. Kivimaki M, Kuosma E, Feme JE, et al. Overweight, obesity, and risk of cardiometabolic multimorbidity: pooled analysis of individual-level data for 120 813 adults from 16 cohort studies from the USA and Europe. Lancet Public Health. 2017; 2 (6): e277-e285.
6. Nunes BP, Flores TR, Mielke GI, Thume E, Facchini LA. Multimorbidity and mortality in older adults: A systematic review and meta-analysis. Arch Gerontol Geriatr. 2016; 67: 130-138.
7. Barnett K, Mercer SW, Norbury M, Watt G, Wyke S, Guthrie B. Epidemiology of multimorbidity and implications for health care, research, and medical education: a cross-sectional study. Lancet. 2012; 380 (9836): 37-43.
8. Rzewuska M, de Azevedo-Marques JM, Coxon D, et al. Epidemiology of multimorbidity within the Brazilian adult general population: Evidence from the 2013 National Health Survey (PNS2013). PLoS One. 2017; 12 (2): 1-13.
9. Оганов Р. Г., Симаненков В. И., Бакулин И. Г., Бакулина Н. В., Барбараш О.Л., Бойцов С. А., Болдуева С. А., Гарганеева Н. П., Дощицин В.Л., Каратеев А. Е., Котовская Ю. В., Лила А. М., Лукьянов М. М., Морозова Т. Е., Переверзев А. П., Петрова М. М., Поздняков Ю. М., Сыров А. В., Тарасов А. В., Ткачева О. Н., Шальнова С. А. Коморбидная патология в клинической практике. Алгоритмы диагностики и лечения. Кардиоваскулярная терапия и профилактика. 2019; 18 (1): 5-66.
Oganov R. G., Simanenkov V. I., Bakulin I. G., Bakulina N. V., Barbarash O. L., Boytsov S. A., Boldueva S. A., Garganeyeva N. P., Doshchitsin V. L., Karateev A. E., Kotovskaya Yu.V., Lila A. M., Lukyanov M.M., Morozova T. E., Pereverzev A. P., Petrova M. M., Pozdnyakov Yu.M., Syrov A. V., Tarasov A. V., Tkacheva O. N., Shalnova S. A. Comorbid pathology in clinical practice. Diagnostic and treatment algorithms. Cardiovascular therapy and prevention. 2019; 18 (1): 5-66. https://doi. org/10.15829/1728-8800-2019-1-5-66
10. Всемирная организация здравоохранения. 10 фактов о старении и здоровье. Информационный биллютень.
World Health Organization. 10 facts about aging and health. Information bill.
11. Guerra JVS, Dias MMG, Brilhante AJVC, Terra MF, Garcia-Arevalo M, Figueira ACM. Multifactorial Basis and Therapeutic Strategies in Metabolism-Related Diseases. Nutrients. 2021; 13 (8): 1-50.
12. Violan C, Foguet-Boreu Q, Flores-Mateo G, et al. Prevalence, determinants and patterns of multimorbidity in primary care: a systematic review of observational studies. PLoS One. 2014; 9 (7): 1-9.
13. Jeong D, Kim J, Lee H, Kim DY, Lim H. Association of Cardiometabolic Multimorbidity Pattern with Dietary Factors among Adults in South Korea. Nutrients. 2020; 12 (9): 1-15.
14. Dekker LH, de Borst MH, Meems LMG, de Boer RA, Bakker SJL, Navis GJ. The association of multimorbidity within cardio-metabolic disease domains with dietary patterns: A cross-sectional study in 129 369 men and women from the Lifelines cohort. PLoS One. 2019; 14 (8): 1-13.
15. Coste J, Valderas JM, Carcaillon-Bentata L. Estimating and characterizing the burden of multimorbidity in the community: A comprehensive multistep analysis of two large nationwide representative surveys in France. PLoS Med. 2021; 18 (4): 1-22.
16. Younossi ZM, Stepanova M, Afendy M, et al. Changes in the prevalence of the most common causes of chronic liver diseases in the United States from 1988 to 2008. Clin Gastroenterol Hepatol. 2011; 9 (6): 524-530.
17. Adams LA, Anstee QM, Tilg H, Targher G. Non-alcoholic fatty liver disease and its relationship with cardiovascular disease and other extrahepatic diseases. Gut. 2017; 66 (6): 1138-1153.
18. Armstrong MJ, Adams LA, Canbay A, Syn WK. Extrahepatic complications of nonalcoholic fatty liver disease. Hepatology. 2014; 59 (3): 1174-1197.
19. Soderberg C, Stal P, Askling J, et al. Decreased survival of subjects with elevated liver function tests during a 28-year follow-up. Hepatology. 2010; 51 (2): 595-602.
20. Ekstedt M, Hagstrom H, Nasr P, et al. Fibrosis stage is the strongest predictor for disease-specific mortality in NAFLD after up to 33 years of follow-up. Hepatology. 2015; 61 (5): 1547-1554.
21. Brouwers MCGJ, Simons N, Stehouwer CDA, Isaacs A. Non-alcoholic fatty liver disease and cardiovascular disease: assessing the evidence for causality. Diabetologia. 2020; 63 (2): 253-260.
22. Younossi ZM, Henry L. Epidemiology of non-alcoholic fatty liver disease and hepatocellular carcinoma. JHEP Rep. 2021; 3 (4): 1-10.
23. Kim D, Kim WR. Nonobese Fatty Liver Disease. Clin Gastroenterol Hepatol. 2017; 15 (4): 474-485.
24. Cusi K. Role of obesity and lipotoxicity in the development of nonalcoholic steatohepatitis: pathophysiology and clinical implications. Gastroenterology. 2012; 142 (4): 711-725.
25. Lechner K, Lorenz E, Drezner JA. The ‘heart’ of preventive cardiology: Lifestyle medicine for the treatment of cardiometabolic diseases. Eur J Prev Cardiol. 2020; 27 (19): 2069-2070.
26. Gepner Y, Shelef I, Schwarzfuchs D, et al. Effect of Distinct Lifestyle Interventions on Mobilization of Fat Storage Pools: CENTRAL Magnetic Resonance Imaging Randomized Controlled Trial. Circulation. 2018; 137 (11): 1143-1157.
27. Ipsen DH, Lykkesfeldt J, Tveden-Nyborg P. Molecular mechanisms of hepatic lipid accumulation in non-alcoholic fatty liver disease. Cell Mol Life Sci. 2018; 75 (18): 3313-3327.
28. Lechner K, McKenzie AL, Krankel N, et al. High-Risk Atherosclerosis and Metabolic Phenotype: The Roles of Ectopic Adiposity, Atherogenic Dyslipidemia, and Inflammation. Metab Syndr Relat Disord. 2020; 18 (4): 176-185.
29. Boren J, Chapman MJ, Krauss RM, et al. Low-density lipoproteins cause atherosclerotic cardiovascular disease: pathophysiological, genetic, and therapeutic insights: a consensus statement from the European Atherosclerosis Society Consensus Panel. Eur Heart J. 2020; 41 (24): 2313-2330.
30. Goulopoulou S, McCarthy CG, Webb RC. Toll-like Receptors in the Vascular System: Sensing the Dangers Within. Pharmacol Rev. 2016; 68 (1): 142-167.
31. Zewinger S, Reiser J, Jankowski V, et al. Apolipoprotein C 3 induces inflammation and organ damage by alternative inflammasome activation. Nat Immunol. 2020; 21 (1): 30-41.
32. Libby P, Everett BM. Novel Antiatherosclerotic Therapies. Arterioscler Thromb Vasc Biol. 2019; 39 (4): 538-545.
33. Hwang DH, Kim JA, Lee JY. Mechanisms for the activation of Toll-like receptor 2/4 by saturated fatty acids and inhibition by docosahexaenoic acid. Eur J Pharmacol. 2016; 785: 24-35.
34. Lai HTM, de Oliveira Otto MC, Lee Y, et al. Serial Plasma Phospholipid Fatty Acids in the De Novo Lipogenesis Pathway and Total Mortality, Cause-Specific Mortality, and Cardiovascular Diseases in the Cardiovascular Health Study. J Am Heart Assoc. 2019; 8 (22): 1-45.
35. Despres JP. Body fat distribution and risk of cardiovascular disease: an update. Circulation. 2012; 126 (10): 1301-1313.
36. Fitzgibbons TP, Kogan S, Aouadi M, Hendricks GM, Straubhaar J, Czech MP. Similarity of mouse perivascular and brown adipose tissues and their resistance to diet-induced inflammation. Am J Physiol Heart Circ Physiol. 2011; 301 (4): H1425-H1437.
37. Antonopoulos AS, Margaritis M, Verheule S, et al. Mutual Regulation of Epicardial Adipose Tissue and Myocardial Redox State by PPAR-y/Adiponectin Signalling. Circ Res. 2016; 118 (5): 842-855.
38. Packer M. Epicardial Adipose Tissue May Mediate Deleterious Effects of Obesity and Inflammation on the Myocardium. J Am Coll Cardiol. 2018; 71 (20): 2360-2372.
39. Gruzdeva OV, Akbasheva OE, Dyleva YA, et al. Adipokine and Cytokine Profiles of Epicardial and Subcutaneous Adipose Tissue in Patients with Coronary Heart Disease. Bull Exp Biol Med. 2017; 163 (5): 608-611.
40. Naftali-Shani N, Levin-Kotler LP, Palevski D, et al. Left Ventricular Dysfunction Switches Mesenchymal Stromal Cells Toward an Inflammatory Phenotype and Impairs Their Reparative Properties Via Toll-Like Receptor-4. Circulation. 2017; 135 (23): 2271-2287.
41. Stahl EP, Dhindsa DS, Lee SK, Sandesara PB, Chalasani NP, Sperling LS. Nonalcoholic Fatty Liver Disease and the Heart: JACC State-of-the-Art Review. J Am Coll Cardiol. 2019; 73 (8): 948-963.
42. Worm N. Beyond Body Weight-Loss: Dietary Strategies Targeting Intrahepatic Fat in NAFLD. Nutrients. 2020; 12 (5): 1-12.
43. Petersen MC, Shulman GI. Mechanisms of Insulin Action and Insulin Resistance. Physiol Rev. 2018; 98 (4): 2133-2223.
44. Agarwal SK, Norby FL, Whitsel EA, et al. Cardiac Autonomic Dysfunction and Incidence of Atrial Fibrillation: Results From 20 Years Follow-Up. J Am Coll Cardiol. 2017; 69 (3): 291-299.
45. Anand SS, Yi Q, Gerstein H, et al. Relationship of metabolic syndrome and fibrinolytic dysfunction to cardiovascular disease. Circulation. 2003; 108 (4): 420-425.
46. Laakso M, Kuusisto J. Insulin resistance and hyperglycaemia in cardiovascular disease development. Nat Rev Endocrinol. 2014; 10 (5): 293-302.
47. De Carvalho SC, Muniz MT, Siqueira MD, et al. Plasmatic higher levels of homocysteine in non-alcoholic fatty liver disease (NAFLD). Nutr J. 2013; 12: 37.
48. Francque SM, van der Graaff D, Kwanten WJ. Non-alcoholic fatty liver disease and cardiovascular risk: Pathophysiological mechanisms and implications. J Hepatol. 2016; 65 (2): 425-443.
49. Tripodi A, Fracanzani AL, Primignani M, et al. Procoagulant imbalance in patients with non-alcoholic fatty liver disease. J Hepatol. 2014; 61 (1): 148-154.
50. Coulon S, Francque S, Colle I, et al. Evaluation of inflammatory and angiogenic factors in patients with non-alcoholic fatty liver disease. Cytokine. 2012; 59 (2): 442-449.
51. Lauridsen BK, Stender S, Kristensen TS, et al. Liver fat content, non-alcoholic fatty liver disease, and ischaemic heart disease: Mendelian randomization and meta-analysis of 279 013 individuals. Eur Heart J. 2018; 39 (5): 385-393.
52. Tang WHW, Backhed F, Landmesser U, Hazen SL. Intestinal Microbiota in Cardiovascular Health and Disease: JACC State-of-the-Art Review. J Am Coll Cardiol. 2019; 73 (16): 2089-2105.
53. Aron-Wisnewsky J, Vigliotti C, Witjes J, et al. Gut microbiota and human NAFLD: disentangling microbial signatures from metabolic disorders. Nat Rev Gastroenterol Hepatol. 2020; 17 (5): 279-297.
54. Chalasani N, Younossi Z, Lavine JE, et al. The diagnosis and management of nonalcoholic fatty liver disease: Practice guidance from the American Association for the Study of Liver Diseases. Hepatology. 2018; 67 (1): 328-357.
55. European Association for the Study of the Liver (EASL); European Association for the Study of Diabetes (EASD); European Association for the Study of Obesity (EASO). EASL-EASD-EASO Clinical Practice Guidelines for the management of non-alcoholic fatty liver disease. J Hepatol. 2016; 64 (6): 1388-1402.
56. Kasper P, Martin A, Lang S, et al. NAFLD and cardiovascular diseases: a clinical review. Clin Res Cardiol. 2021; 110 (7): 921-937.
57. Лазебник Л.Б., Голованова Е. В., Туркина С. В., Райхельсон К.Л., Оковитый С. В., Драп-кина О. М., Маев И. В., Мартынов А. И., Ройтберг Г.Е., Хлынова О. В., Абдулганиева Д. И., Алексеенко С. А., Ардатская М. Д., Бакулин И. Г., Бакулина Н. В., Буеверов А. О., Виницкая Е. В., Волынец Г. В., Еремина Е. Ю., Гриневич В. Б., Долгушина А. И., Казю-лин А. Н., Кашкина Е. И., Козлова И. В., Конев Ю. В., Корочанская Н. В., Кравчук Ю. А., Ли Е.Д., Лоранская И.Д., Махов В.М., Мехтиев С.Н., Новикова В. П., Остроумова О.Д., Павлов Ч.С., Радченко В. Г., Самсонов А. А., Сарсенбаева А. С., Сайфутдинов Р. Г., Селиверстов П.В., Ситкин С. И., Стефанюк О.В., Тарасова Л.В., Ткаченко Е.И., Успенский Ю. П., Фоминых Ю. А., Хавкин А. И., Цыганова Ю. В., Шархун О. О. Неалкогольная жировая болезнь печени у взрослых: клиника, диагностика, лечение. Рекомендации для терапевтов, третья версия. Экспериментальная и клиническая гастроэнтерология. 2021; 185 (1): 4-52.
Lazebnik L. B., Golovanova E. V., Turkina S. V., Raikhelson K. L., Okovity S. V., Drapkina O. M., Maev I. V., Martynov A. I., Roitberg G. E., Khynova O. V., Abdulganieva D. I., Alekseenko S. A., Ardatskaya M. D., Bakulin I. G., Bakulina N. V., Bueverov A. O., Vinitskaya E V.V., Volynets G. V., Eremina E. Yu., Grinevich V. B., Dolgushina A. I., Kazyulin A. N., Kashkina E. I., Kozlova I. V., Konev Yu.V., Korochanskaya N. V., Kravchuk Yu.A., Li E. D., Loranskaya I.D., Makhov V.M., Mekhtiev S.N., Novikova V. P., Ostroumova O. D., Pavlov Ch.S., Radchenko V. G., Samsonov A. A., Sarsenbaeva A. S., Sayfutdinov R. G., Seliverstov P. V., Sitkin S. I., Stefanyuk O. V., Tarasova L. V., Tkachenko E. I., Uspensky Yu.P., Fominykh Yu.A., Khavkin A. I., Tsyganova Yu.V., Sharkhun O. O. Non-alcoholic fatty liver disease in adults: clinical picture, diagnosis, treatment. Guidelines for therapists, third version. Experimental and Clinical Gastroenterology. 2021; 185 (1): 4-52.
58. Taylor F, Ward K, Moore TH, et al. Statins for the primary prevention of cardiovascular disease. Cochrane Database Syst Rev. 201 1; (1): 1-76.
59. Keene D, Price C, Shun-Shin MJ, Francis DP. Effect on cardiovascular risk of high-density lipoprotein targeted drug treatments niacin, fibrates, and CETP inhibitors: meta-analysis of randomised controlled trials including 117,411 patients. BMJ. 2014; 349: 1-26.
60. Mach F, Baigent C, Catapano AL, et al. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk Eur Heart J. 2020; 41 (1): 111-188.
61. Bjornsson ES. Hepatotoxicity of statins and other lipid-lowering agents. Liver Int. 2017; 37 (2): 173-178.
62. Saha A, Garg A. Severe Liver Injury Associated with High-Dose Atorvastatin Therapy. J Investig Med High Impact Case Rep. 2021; 9: 1-4.
63. Mato JM, Martinez-Chantar ML, Lu SC. S-adenosylmethionine metabolism and liver disease. Ann Hepatol. 2013; 12 (2): 183-189.
64. Bottiglieri T. S-Adenosyl-L-methionine (SAMe): from the bench to the bedside -molecular basis of a pleiotrophic molecule. Am J Clin Nutr. 2002; 76 (5): 1151S-7S.
65. Li Z, Agellon LB, Allen TM, et al. The ratio of phosphatidylcholine to phosphatidylethanolamine influences membrane integrity and steatohepatitis. Cell Metab. 2006; 3 (5): 321-331.
66. Vance DE. Physiological roles of phosphatidylethanolamine N-methyltransferase. Biochim Biophys Acta.2013; 1831 (3): 626-632.
67. Walker AK, Jacobs RL, Watts JL, et al. A conserved SREBP-1/phosphatidylcholine feedback circuit regulates lipogenesis in metazoans. Cell. 2011; 147 (4): 840-852.
68. Caballero F, Fernandez A, Matias N, et al. Specific contribution of methionine and choline in nutritional nonalcoholic steatohepatitis: impact on mitochondrial S-adenosyl-L-methionine and glutathione. J Biol Chem. 2010; 285 (24): 18528-18536.
69. Fu S, Yang L, Li P, et al. Aberrant lipid metabolism disrupts calcium homeostasis causing liver endoplasmic reticulum stress in obesity. Nature. 2011; 473 (7348): 528-531.
70. Moylan CA, Pang H, Dellinger A, et al. Hepatic gene expression profiles differentiate presymptomatic patients with mild versus severe nonalcoholic fatty liver disease. Hepatology. 2014; 59 (2): 471-482.
71. Vendemiale G, Altomare E, Trizio T, et al. Effects of oral S-adenosyl-L-methionine on hepatic glutathione in patients with liver disease. Scand J Gastroenterol. 1989; 24 (4): 407-415.
72. Shankar R., Virukalpattigopalratnam M. P., Singh T. Heptral® (Ademetionine) in intrahepatic cholestasis due to chronic non-alcoholic liver disease: subgroup analysis of results of a multicentre observational study in India. Journal of Clinical and Experimental Hepatology. 2014; 4: S 33.
73. Барановский А. Ю., Райхельсон К.Л., Марченко Н. В. Применение S-аденозил-метионина (Гептрала®) в терапии больных неалкогольным стеатогепатитом. Клинические перспективы гастроэнтерологии, гепатологии. 2010; 1: 3-10.
Baranovsky A. Yu., Raikhelson K. L., Marchenko N. V. The use of S-adenosylmethionine (Heptral®) in the treatment of patients with non-alcoholic steatohepatitis. Clinical perspectives of gastroenterology, hepatology. 2010; 1: 3-10.
74. Guo T, Chang L, Xiao Y, Liu Q. S-adenosyl-L-methionine for the treatment of chronic liver disease: a systematic review and meta-analysis. PLoS One. 2015; 10 (3): 1-17.
75. Калачнюк Т. Н. Эффективность гепатопротекторной терапии лекарственного гепатита, возникшего при приеме статинов, у больных пожилого возраста. Клиническая геронтология. 2010; 16 (9-10): 34.
Kalachnyuk T. N. The effectiveness of hepatoprotective therapy for drug hepatitis caused by taking statins in elderly patients. Clinical gerontology. 2010; 16 (9-10): 34.
76. Lazaridis KN, Gores GJ, Lindor KD. Ursodeoxycholic acid ‘mechanisms of action and clinical use in hepatobiliary disorders’. J Hepatol. 2001; 35 (1): 134-146.
77. Castro RE, Ferreira DM, Afonso MB, et al. miR-34a/SIRT1/p53 is suppressed by ursodeoxycholic acid in the rat liver and activated by disease severity in human non-alcoholic fatty liver disease. J Hepatol. 2013;58(1): 119-125.
78. Beuers U. Drug insight: Mechanisms and sites of action of ursodeoxycholic acid in cholestasis. Nat Clin Pract Gastroenterol Hepatol. 2006; 3 (6): 318-328.
79. Sokolovic D, Nikolic J, Kocic G, et al. The effect of ursodeoxycholic acid on oxidative stress level and DNase activity in rat liver after bile duct ligation. Drug Chem Toxicol. 2013; 36 (2): 141-148.
80. Xiang Z, Chen YP, Ma KF, et al. The role of ursodeoxycholic acid in non-alcoholic steatohepatitis: a systematic review. BMC Gastroenterol. 2013; 13: 140.
81. Корнеева О. Н., Драпкина О.М. Возможности применения урсодезоксихолевой кислоты и статинов для уменьшения сердечно-сосудистого риска у больных с метаболическим синдромом и неалкогольной жировой болезнью печени. Российские медицинские вести. 2011;16(3): 57-64.
Korneeva O. N., Drapkina O. M. Possibilities of using ursodeoxycholic acid and statins to reduce cardiovascular risk in patients with metabolic syndrome and non-alcoholic fatty liver disease. Russian medical news. 2011; 16 (3): 57-64.
82. Марцевич С.Ю., Кутишенко Н. П., Дроздова Л.Ю.,Лерман О.В., Невзорова В. А., Резник И. И., Шавкута Г. В., Яхонтов Д.А. Изучение влияния урсодезоксихолевой кислоты на эффективность и безопасность терапии статинами у больных с заболеваниями печени, желчного пузыря и/или желчевыводящих путей (исследование ракурс). Рациональная фармакотерапия в кардиологии. 2014; 10 (2): 147-152.
