Клиническая эффективность и безопасность Эргоферона при гриппе и других острых респираторных вирусных инфекциях: критическая оценка с позиций доказательной медицины
СтатьиОпубликовано в журнале:
Инфекционные болезни: новости, мнения, обучение. 2019. т. 8, № 4.
Никифоров В.В.1, Руженцова Т.А.2
1 ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России, Москва, Россия
2 ФБУН «Центральный научно-исследовательский институт эпидемиологии» Роспотребнадзора, Москва, Россия
В обзоре представлены результаты критической оценки эффективности и безопасности Эргоферона при гриппе и других острых респираторных вирусных инфекциях (ОРВИ) с позиций доказательной медицины. В открытых источниках найдены данные о 6 зарегистрированных (grLs.ru) рандомизированных клинических исследованиях (РКИ). Проведен их статистический анализ: объединенные оценки средних значений, стандартные отклонения, t-критерий Стьюдента в модификации Уэлча, точный критерий Фишера, оценка общего риска смещения (Risk of bias).
Все РКИ – проспективные, проведенные в параллельных группах, с технически правильно выполненной рандомизацией: 4 с двойным слепым плацебо-контролем, 2 открытых сравнительных (осельтамивир). Эргоферон принимали – 715 человек, плацебо и осельтамивир – 554 и 172 пациента соответственно. Проанализированы следующие критерии: средняя длительность лихорадки (достижение температуры тела ≤37,2 °C); тяжесть симптомов ОРВИ по «площади под кривой» (AUC); доля пациентов с ухудшением течения заболевания (развитие осложнений, требующих назначения антибиотиков или госпитализации); доля пациентов с хотя бы одним нежелательным явлением. По дизайну, методологии, качеству изложения результаты РКИ соответствуют современным этическим требованиям и стандартам, а клиническая эффективность и безопасность применения Эргоферона при ОРВИ, включая грипп, у взрослых и детей с 6 мес доказана в ходе РКИ, из них 4 с наиболее высоким уровнем доказательности – РКИ с двойным слепым плацебо-контролем.
Ключевые слова: грипп, доказательная медицина, лечение, острые респираторные вирусные инфекции, рандомизированные клинические исследования, Эргоферон
Для цитирования: Никифоров В.В., Руженцова Т.А. Клиническая эффективность и безопасность Эргоферона при гриппе и других острых респираторных вирусных инфекциях: критическая оценка с позиций доказательной медицины // Инфекционные болезни: новости, мнения, обучение. 2019. Т. 8, № 4. С. 84-97. doi: 10.24411/2305-3496-2019-14011
Clinical efficacy and safety of Ergoferon in flu and other acute respiratory viral infections: a critical evaluation from the standpoint of evidence-based medicine
Nikiforov V.V.1, Ruzhentsova T.A.2
1 Pirogov Russian National Research Medical University (RNRMU), Moscow, Russia
2 Central Research Institute of Epidemiology of Rospotrebnadzor, Moscow, Russia
The review presents the results of a critical evaluation of the efficacy and safety of Ergoferon in flu and other acute respiratory viral infections (ARVI) from the standpoint of evidence-based medicine. Data of 6 registered randomized clinical trials (RCTs) can be found in an open source database (grls.ru). The statistical analysis of these RCTs was carried out, which included a pooled estimate of mean values, standard deviations, Student t-test in Welch modification, Fisher's exact test and the risk of bias. All RCTs are prospective, parallel-group, with technically correct randomization: 4 RCTs are with double-blind placebo control, 2 RCTs are open-label (compared with oseltamivir). 715 people took Ergoferon, 172 patients took oseltamivir and 554 patients took placebo. The analyzed criteria included: average duration of fever (reaching body temperature ≤37.2 °C); severity of ARVI symptoms according to the "area under the curve" (AUC); proportion of patients with worsening of the disease (development of complications requiring antibiotics or hospitalization); proportion of patients with at least one adverse event. The design, methodology, quality of presentation of the results of RCTs meets modern ethical requirements and standards. The clinical efficacy and safety of Ergoferon for treatment ARVI and flu in adults and children from 6 months were proved in RCTs, among which 4 RCTs have the highest level of evidence – RCTs with double-blind placebo control.
Keywords: flu, evidence-based medicine, treatment, acute respiratory viral infections, randomized clinical trials, Ergoferon
For citation: Nikiforov V.V., Ruzhentsova T.A. Clinical efficacy and safety of Ergoferon in flu and other acute respiratory viral infections: a critical evaluation from the standpoint of evidence-based medicine. Infektsionnye bolezni: novosti, mneniya, obuchenie [Infectious Diseases: News, Opinions, Training]. 2019; 8 (4): 84-97. doi: 10.24411/2305-3496-2019-14011 (in Russian)
Острые респираторные вирусные инфекции (ОРВИ) – одна из наиболее частых причин посещений врача первичного звена [1]. Значимость ОРВИ в клинической практике обусловлена не столько тяжестью течения (за исключением гриппозной инфекции), сколько их высокой распространенностью, а с эпидемиологической точки зрения – заболеваемостью. По данным государственного доклада «О состоянии санитарно-эпидемиологического благополучия населения в Российской Федерации в 2018 г.» острые инфекции верхних дыхательных путей на протяжении последнего десятилетия стабильно занимают 1-е место в рейтинге заболеваний по величине экономического ущерба. В 2018 г. они нанесли значительный ущерб в денежном эквиваленте – более 0,5 млрд руб. [2, 3]. Именно данный факт обусловливает их социально-экономическую важность, что определяется в мировой практике термином «бремя заболевания».
Бремя ОРВИ, включая грипп, весомо как в нашей стране, так и за рубежом [4, 5]. По оценке Всемирной организации здравоохранения (ВОЗ), ежегодно 5-10% населения мира болеют гриппом, у 3-5 млн человек наблюдается его тяжелое течение [6]. Известно, что большинство людей выздоравливают от неосложненного гриппа. Но в то же время грипп может вызывать осложнения, приводящие к тяжелым заболеваниям и смерти. В группе риска – маленькие дети, пожилые, беременные и женщины в течение 2 нед после родов, пациенты с патологией нервной системы и хроническими заболеваниями органов дыхания, сердечно-сосудистой системы, болезнями обмена веществ, а также люди с ослабленным иммунитетом [7]. Недавнее модельное исследование показало, что во всем мире ежегодно происходит до 646 тыс. случаев респираторной смерти, связанной с сезонным гриппом [8]. Накоплен достаточно большой пул данных о высоком риске осложнений при тяжелом течении гриппа и ассоциированных с ОРВИ состояний/ заболеваний [9-11].
Несмотря на общую склонность ОРВИ к самоограничению, вариабельность симптоматики и тяжесть их течения зависят от конкретного возбудителя [12]. Поскольку идентификация вируса, как правило, не является обычной процедурой в амбулаторной практике, зачастую возможна только интерпретация клинических симптомов с учетом эпидемической ситуации.
Клинические проявления ОРВИ неспецифичны. Вне зависимости от возбудителя наиболее характерные синдромы при ОРВИ – лихорадочный, респираторный/катаральный, интоксикационный. Причем лихорадка при гриппе и других ОРВИ рассматривается в качестве своеобразного биологического и клинического маркера, индикатора не только выраженности виремии, но и прогноза тяжести течения заболевания, его осложнений.
Вопросы лечения ОРВИ не перестают активно дискутироваться: обилие и разнообразие штаммов респираторных вирусов не позволяет перевести ассоциированные с ними заболевания в разряд контролируемых инфекций в связи с отсутствием вакцинных препаратов и других средств специфической профилактики в отношении каждого возбудителя, а публикуемые результаты и выводы многочисленных клинических исследований зачастую противоречивы.
В терапии гриппа и других ОРВИ в нашей стране и во всем мире, используются различные подходы [13]. Но все они включают несколько ключевых моментов: вакцинация при гриппе в качестве превентивной меры, применение химиопрепаратов для противовирусной терапии, симптоматическое лечение.
Несмотря на успехи специфической профилактики и химиотерапии в отношении гриппа, в связи с антигенной изменчивостью возбудителя существует ряд проблем, например, недостаточная эффективность вакцинации, устойчивость к химиотерапевтическим препаратам. В настоящее время 0,5-1,0% изолятов вируса гриппа A (H1N1) pdm09 устойчивы к осельтамивиру [14, 15]. И хотя вакцины остаются лучшим способом для снижения общего бремени гриппа, существует проблема недостаточного иммунного ответа при противогриппозной вакцинации даже у здоровых людей, в частности у маленьких детей и пожилых людей [6, 16, 17]. Общепризнанно, что ингибиторы нейраминидазы – препараты выбора для лечения гриппа. Однако, по мнению ряда авторов, их чрезмерного использования, в первую очередь из-за нежелательных явлений, следует избегать. Требуется точный отбор пациентов, которым действительно необходимо лечение [6]. Также, например, показано, что симптоматическая терапия не снижает риск осложненного течения ОРВИ – доказательства ее эффективности ограничены и имеют низкое качество [2].
Очевидно, что данный набор вмешательств абсолютно недостаточен для решения проблем пациента с ОРВИ, а поиск безопасных и эффективных альтернатив для их профилактики и лечения имеет решающее значение [6]. Именно поэтому в ряде стран, включая Россию, рекомендованы к применению не только этиотропные и симптоматические препараты, но и лекарственные средства этиопатогенетического и патогенетического действия, включая иммунотропное, противовоспалительное, антигистаминное.
Подобный подход согласуется с актуальной тенденцией в современной фармакологии – поиском лекарственных препаратов, способных эффективно предотвращать и лечить ОРВИ, включая грипп. В качестве вмешательств рассматриваются как вакцины к различным возбудителям ОРВИ, так и противовирусные, и иммунотропные препараты [18, 19]. Например, в настоящее время идет активное изучение вклада интерферонов в противовирусный ответ [20, 21]. Установлено, что интерфероны (ИФН) 1-го и 2-го типа обеспечивают противовирусный и противовоспалительный ответ в организме при вирусных инфекциях благодаря прямому противовирусному действию и активации иммунологической реактивности на вирус с вовлечением CD4+, CD8+, интерлейкинов и других факторов иммунной защиты. В фокусе исследований – не только особенности интерферонового ответа, но и возможности создания лекарственных препаратов, способных обеспечить широкий спектр противовирусной активности.
В связи с изменением парадигмы современной медицины роль врача первичного звена (участкового терапевта, врача общей практики) сегодня не сводится только к рутинному выполнению лечебно-диагностических и профилактических вмешательств, хотя именно их адекватное проведение во многом обеспечивает скорейшее выздоровление и предупреждение осложнений ОРВИ, включая грипп. На первый план выходит забота о благополучии пациента в контексте сбережения его здоровья, что актуализирует необходимость обоснованного выбора высокоэффективного противовирусного препарата широкого спектра действия с минимумом нежелательных явлений (НЯ).
Ключевой подход к выбору любого медицинского вмешательства – оценка соотношения потенциального риска и пользы для пациента. Его практическая реализация в современной медицине значительно упростилась с появлением такого инструмента поиска достоверной медицинской информации и ответов на клинические вопросы, как доказательная медицина (ДМ).
ДМ – необходимый компонент рутинной практики каждого врача как для обоснованного выбора наилучшего вмешательства у конкретного пациента, так и для клинической стратегии при решении сходной проблемы. Оптимально использовать ДМ не как некий догмат или фактор зачастую неясной доказательности данных, а как необходимый инструмент получения достоверной информации для решения конкретной проблемы пациента.
Важно понимать, что руководящие принципы, различного рода рекомендации, подготовленные на основе самых современных достижений ДМ, не всегда учитывают индивидуальные вариации среди пациентов. Они не предназначены для замены суждения врача в отношении конкретных пациентов или особых клинических ситуаций. И сегодня даже так называемый механистический подход, в большей степени присущий зарубежным школам, призывает врачей мыслить в контексте проблем пациента, а не слепо выполнять рекомендации. Так, например, Американское общество инфекционистов в своих последних клинических рекомендациях от 2018 г. по ведению пациентов с сезонным гриппом прямо указывает, что «...соблюдение этих руководящих принципов является добровольным, и окончательное решение об их применении должно быть сделано врачом с учетом индивидуальных обстоятельств пациента» [7].
В подобной ситуации способны помочь критический подход к результатам клинических исследований и умение обоснованно и независимо оценивать их в публикациях. Поскольку даже для считающихся «золотым стандартом» ДМ с наивысшим уровнем доказательности и силой рекомендаций рандомизированных контролируемых клинических исследований (РКИ) с двойным слепым плацебо-контролем существуют определенные ограничения – связанная именно с дизайном исследования сложность эктраполяции результатов на всю популяцию. Ведь в качественно выполненных РКИ выборка пациентов так жестко регламентирована критериями включения в исследование, что может значимо отличаться от особенностей рутинных пациентов с исследованной нозологией, а это в свою очередь не позволяет применить результаты исследования к конкретному пациенту на приеме. Но несмотря на такую особенность РКИ с двойным слепым плацебо-контролем альтернативы им на сегодняшний день нет, так как именно данный дизайн исследований позволяет минимизировать систематические ошибки, которые могут искажать полученные результаты.
Таким образом, несмотря на то, что зачастую РКИ подвергаются критике в связи с дизайном, общей методологией проведения, а систематические обзоры на их основе вызывают вопросы по поводу качества доказательств, на сегодняшний день систематический обзор и метаанализ на основе РКИ остаются на верхней ступеньке пьедестала убедительности данных в ДМ.
В контексте вышеизложенного среди множества существующих лекарственных препаратов в арсенале врача при ОРВИ обращает на себя внимание Эргоферон (ООО «НПФ «Материа Медика Холдинг», Россия) – препарат регуляторного типа, способный таргетно влиять на патогенез ОРВИ [22, 23].
Эргоферон – комбинированный лекарственный препарат, созданный на основе подвергнутых технологической обработке аффинно очищенных антител к ИФН-γ, гистамину, СD4-корецептору Т-лимфоцитов [22]. Эргоферон производится в таблетированной и в жидкой лекарственных формах. Стоит отметить интерес к препарату и его признание не только в нашей стране, но и за рубежом. Помимо Российской Федерации, препарат зарегистрирован в 14 странах, а также проходит процедуру регистрации еще в ряде стран. При этом отдельного внимания заслуживает тот факт, что на примере досье первого из активных компонентов Эргоферона – технологически обработанных аффинно очищенных антител к ИФН-γ, с препаратом были ознакомлены также и эксперты FDA (Food and Drug Administration – Агентство Министерства здравоохранения и социальных служб США), MHRA (Medicines and Healthcare products Regulatory Agency – Агентство по регулированию лекарственных средств и продуктов для здравоохранения Великобритании) в ходе научных консультаций отнесшие в своем заключении препарат к биологическим и рекомендовавшие использование стандартного нормативного подхода при его регистрации [24].
Согласно официальной инструкции по медицинскому применению препарата, Эргоферон показан для лечения ОРВИ, включая грипп, а также ряда других инфекционновоспалительных заболеваний органов дыхания и профилактики бактериальных осложнений вирусных инфекций [22]. Компоненты, входящие в препарат, обладают единым механизмом действия в виде повышения функциональной активности CD4-рецептора, рецепторов к ИФН-γ и гистамину. Стоит заметить, что реакции, в реализацию которых вовлечены «мишени» препарата, не имеют возрастных отличий, поэтому нет необходимости подбора схемы для пациентов разного возраста; Эргоферон рекомендован к применению у взрослых и детей с 6 мес.
Совместное применение компонентов препарата активирует универсальные механизмы противовирусной защиты, играющие ключевую роль в развитии иммунного ответа независимо от типа вируса. Под действием компонентов Эргоферона повышается продукция ИФН-γ и ИФН-α, улучшается рецепция ИФН-γ, повышается чувствительность клеток к ИФН и нормализуется цитокиновый статус, регулируется активность CD4-рецептора, который представлен на макрофагах и на Т-хелперных лимфоцитах 1-го и 2-го типа. Сочетанное влияние Эргоферона на систему ИФН вместе с активацией процессов распознавания вирусов CD4-лимфоцитами обеспечивает выраженный противовирусный эффект. Также Эргоферон обладает противовоспалительным и антигистаминным действием, реализуемым благодаря регулирующему влиянию на гистамин-зависимые реакции и продукцию про- и противовоспалительных цитокинов. В результате наблюдается уменьшение сосудистой проницаемости, сокращение длительности и выраженности катаральных симптомов и аллергических реакций, сопутствующих инфекционному процессу [22, 23].
Уникальность механизма действия Эргоферона, ассоциированная с его комбинированным противовирусным, противовоспалительным и антигистаминным действием, максимально значимыми в этиопатогенезе и клинических проявлениях ОРВИ, послужила поводом для оценки с позиций ДМ его эффективности и безопасности для лечения ОРВИ, включая грипп.
Цель обзора – оценка качества доказательств эффективности и безопасности Эргоферона в лечении ОРВИ по данным РКИ, включенным в реестр разрешений на проведение клинических исследований (КИ) сайта Государственного реестра лекарственных средств (grls.ru).
Методология: стратегия поиска и отбора данных для обзора
Основной клинический вопрос, на который будет дан ответ в ходе анализа результата РКИ Эргоферона: эффективно и безопасно ли применение препарата при ОРВИ, включая грипп.
Для ответа на поставленный вопрос проведен поиск в открытых источниках в интернете. В качестве ключевого слова выбрано «Эргоферон». Поиск информации не ограничивал результаты языком, датой или статусом публикации.
Стратегия поиска информации для данного обзора включала обращение к официальным сайтам – реестрам КИ в нашей стране и за рубежом для сбора информации зарегистрированных РКИ по препарату. Проведен поиск в следующих реестрах: Государственный реестр лекарственных средств (grls.ru); ClinicalTrials.gov (clintrials.gov); Международная платформа для регистрации клинических испытаний (ICTRP – International Clinical Trials Registry Platform) ВОЗ (www.who.int/ictrp/search/en).
Также проведена оценка найденных в открытом доступе, включая PubMed, EMBASE, MEDLINE, Кокрейновскую библиотеку, публикаций по результатам зарегистрированных РКИ Эргоферона.
В случае отсутствия данных о результатах РКИ в открытых источниках при наличии информации в российском и международном реестрах КИ, а также для повышения репрезентативности данных по оценке безопасности (получение информации в рамках фармаконадзора) у компании-производителя как спонсора исследования были запрошены отчеты о результатах КИ. Предоставленные данные использованы для получения и оценки статистической информации и включены в обзор.
В обзор включены только РКИ, сравнивающие Эргоферон с плацебо или осельтамивиром у людей любого возраста и пола с ОРВИ, включая грипп.
Найдена информация о 6 РКИ, зарегистрированных в реестре разрешений на проведение КИ сайта Государственного реестра лекарственных средств (grLs.ru). Из них результаты по 2 исследованиям доступны на сайте ClinicalTrials.gov.
В открытом доступе по ключевому слову «Эргоферон» найдено 85 полнотекстовых публикаций на русском и английском языках с информацией о более чем 20 исследованиях, включая двойные слепые плацебо-контролируемые РКИ. Согласно цели обзора из найденного массива данных отобрано 4 публикации по результатам 4 РКИ [25-28]. По 2 исследованиям данные не опубликованы (готовятся к публикации), использованы отчеты о КИ.
В настоящий обзор включены результаты всех найденных исследований, проведен статистический анализ с использованием объединенных оценок средних значений и стандартных отклонений. Среднюю длительность лихорадки и тяжесть симптомов анализировали по площади под кривой с помощью t-критерия Стьюдента в модификации Уэлча. Долю пациентов, у которых отмечено ухудшение течения заболевания (развитие осложнений, требующих назначения антибиотиков или госпитализации), и количество пациентов с хотя бы одним НЯ анализировали с помощью точного критерия Фишера.
Результаты исследований, которые нельзя было объединить, обобщены и изложены повествовательно. Стоит отметить, что в связи с разнородностью дизайна исследований ряд из них имели ограничения, которые описаны ниже.
Для оценки методологического качества включенных в обзор РКИ с использованием общего риска смещения (Risk of bias, RoB) применяли рекомендованную специалистами Кокрейновского сотрудничества программу RoB 2 с градацией риска смещения на «низкий», «высокий» или «неопределенный» [29, 30]. Оценка качества РКИ проведена по всем предлагаемым RoB 2 доменам и входящим в них вопросам об особенностях проведения исследований.
К сильным сторонам представленного обзора относятся всесторонний поиск без ограничения по дате и языку, попытка выявления неопубликованных данных и детальная оценка факторов, влияющих на достоверность результатов по всем вопросам и исследованиям. Из ограничений обзора можно выделить включение в него только РКИ из реестра разрешенных Минздравом России КИ, поскольку обращает на себя внимание довольно большое количество публикаций по исследованиям вне официального реестра, включая наблюдательные программы. Также к лимитам обзора можно отнести включение данных без ограничений по возрасту и применяемой лекарственной форме препарата. С другой стороны, указанный момент может считаться сильной стороной, поскольку присущие механизму действия Эргоферона особенности не зависят от возраста и, следовательно, позволяют экстраполировать полученные результаты на всю популяцию.
Таким образом, по данным размещенных в открытом доступе источников и отчетам о КИ с позиций ДМ проведена оценка эффективности и безопасности применения в клинической практике отечественного лекарственного препарата Эргоферон для лечения ОРВИ, включая грипп.
Рандомизированные клинические исследования Эргоферона: критический анализ
Дизайн исследований и характеристики пациентов.
В обзоре суммированы данные 6 РКИ о лечении гриппа и других ОРВИ Эргофероном (табл. 1) [25-28].
Таблица 1. Рандомизированные клинические исследования, включенные в обзор
| Сокращенное наименование |
Название исследования |
| ER-001 | № MMH-ER-001 «Многоцентровое открытое сравнительное рандомизированное клиническое исследование в параллельных группах эффективности и безопасности применения Эргоферона в лечении гриппа» |
| ER-002 | № MMH-ER-002 «Многоцентровое двойное слепое плацебо-контролируемое рандомизированное клиническое исследование в параллельных группах эффективности и безопасности применения Эргоферона в лечении острых респираторных вирусных инфекций» |
| ER-003 | № MMH-ER-003 «Сравнительное с осельтамивиром рандомизированное клиническое исследование в параллельных группах эффективности и безопасности применения Эргоферона в лечении гриппа» |
| ER-006 | № MMH-ER-006 «Многоцентровое двойное слепое плацебо-контролируемое рандомизированное клиническое исследование в параллельных группах безопасности и клинической эффективности жидкой лекарственной формы Эргоферона в лечении острых респираторных инфекций верхних дыхательных путей у взрослых пациентов» |
| ER-007 | № MMH-ER-007 «Многоцентровое двойное слепое плацебо-контролируемое рандомизированное клиническое исследование в параллельных группах безопасности и клинической эффективности жидкой лекарственной формы Эргоферона в лечении острых респираторных инфекций верхних дыхательных путей у детей» |
| ER-009 | № MMH-ER-009 «Международное многоцентровое двойное слепое плацебо-контролируемое рандомизированное клиническое исследование в параллельных группах эффективности и безопасности Эргоферона в лечении острых респираторных вирусных инфекций у детей» |
По дизайну все вошедшие в обзор исследования – проспективные РКИ с технически правильно проведенной рандомизацией, использованием модели параллельных групп (табл. 2).
Таблица 2. Дизайн включенных в обзор исследований: ключевые характеристики
| Иссле- дование |
Проспек- тивность |
Рандо-мизация | Ослеп- ление |
Парал-лельно- группо-вое КИ |
Препарат сравнения |
Лекарст- венная форма исследу- емого препарата |
Сопоста-вимость групп по сопутст-вующей терапии | Фаза исследо-вания | Количе-ство исследо-ватель-ских центров | Страна прове-дения |
| ER-001 | + | + | – | + | Осельтамивир | Таблетки | + | IV | 15 | Россия |
| ER-002 | + | + | + | + | Плацебо | Таблетки | + | IV | 10 | Россия |
| ER-003 | + | + | – | + | Осельтамивир | Таблетки | + | IV | 13 | Россия |
| ER-006 | + | + | + | + | Плацебо | Раствор для приема внутрь | + | III | 22 | Россия |
| ER-007 | + | + | + | + | Плацебо | Раствор для приема внутрь | + | III | 17 | Россия |
| ER-009 | + | + | + | + | Плацебо | Таблетки | + | IV | 13 | Россия, Казахстан |
В 4 исследованиях использован двойной слепой плацебо-контроль с соблюдением идентичных условий проведения и всех нюансов лечения (ER-002, -006, -007, -009). Другие 2 РКИ (ER-001, -003) с открытым сравнительным дизайном, препарат сравнения – осельтамивир («Ф. Хоффманн-Ля Рош Лтд», Швейцария). Исследования ER-001, -002, -003, -009 – постмаркетинговые РКИ с применением таблетированной формы Эргоферона. Остальные РКИ представлены исследованиями III фазы с применением Эргоферона в жидкой лекарственной форме, в виде раствора для приема внутрь.
Всего для проведения 6 РКИ одобрено 90 медицинских организаций. Каждое РКИ выполнялось на базах ≥10 клинических исследовательских центров. Кроме того, исследование ER-009 выполнялось в 2 странах – в России и Казахстане.
Все исследования проведены с 2011 по 2019 г. с участием 1441 пациента, из них 593 ребенка и 848 взрослых (табл. 3).
Таблица 3. Отдельные характеристики пациентов рандомизированных клинических исследований, включенных в обзор
| Исследование | Сроки заболевания | Возраст | Мужчины/женщины, абс. (%) | Количество пациентов | ||
| всего (Full Analysis set) | принимали Эргоферон | принимали плацебо (П) или осельтамивир (О) | ||||
| ER-001 | ≤24 ч | 18-65 лет | 57 (35)/104 (65) | 161 | 81 | 80 (О) |
| ER-002 | ≤48 ч | 18-60 лет | 69 (43)/92 (57) | 161 | 76 | 85 (П) |
| ER-003 | ≤48 ч | 18-70 лет | 85 (46)/99 (54) | 184 | 92 | 92 (О) |
| ER-006 | ≤24 ч | 18-60 лет | 129 (38)/213 (62) | 342 | 169 | 173 (П) |
| ER-007 | ≤24 ч | 3-18 лет | 159 (52)/145 (48) | 306 | 154 | 152 (П) |
| ER-009 | ≤24 ч | 6 мес – 6 лет | 136 (48)/146 (52) | 287 | 143 | 144 (П) |
Общее количество пациентов, принимавших Эргоферон, – 715, в группах сравнения – 726 человек (из них принимали плацебо 554 пациента, осельтамивир – 172). Данные 1421 пациента, подписавшего информированное согласие, прошедшего процедуру рандомизации и начавшего лечение, использовали для Intention to treat (ITT) анализа эффективности и оценки безопасности исследуемой терапии. Данные 1339 пациентов составили Per Protocol (PP) выборку (все пациенты, получившие предусмотренную протоколом терапию в полном объеме, прошедшие все предусмотренные визиты, не имевшие значительных отклонений от протокола) и использовались для анализа по критериям эффективности. Минимальный возраст включенных в РКИ пациентов составил 6 мес, максимальный – 70 лет.
В РКИ включались амбулаторные пациенты, которые начинали лечение в первые 24 ч (ER-001, -007, -006, -009) или 48 ч (ER-002, -003) от начала заболевания. Диагностика заболевания проводилась во всех РКИ на основе клинической картины, в ER-001, -002 для верификации возбудителя использован экспресс-метод детекции вируса гриппа QuickVue Influenza A+B, в ER-003, -009 – ПЦР-диагностика назофарингеальных мазков для определения респираторных вирусов, включая RT-PCR (Real-time PCR – полимеразная цепная реакция в реальном времени).
В РКИ не включали пациентов с подозрением на бактериальную инфекцию или наличием тяжелого заболевания, требующего назначения антибактериальных препаратов (АБП) (включая сульфаниламиды); подозрением на начальные проявления заболеваний, имеющих сходную симптоматику; отягощенным аллергологическим анамнезом, обострением, декомпенсацией хронических заболеваний, злоупотребляющие алкоголем, принимающие наркотики, а также беременные и кормящие грудью.
Эргоферон назначали по стандартной лечебной схеме, рекомендованной инструкцией по медицинскому применению препарата [22]. На один прием рекомендована 1 таблетка (или 1 мерная ложка для исследований ER-006, -007). В первые 2 ч препарат принимали каждые 30 мин, затем в течение 1-х суток – еще 3 приема через равные промежутки времени. Со 2-х по 5-е сутки – по 1 таблетке/1 мерной ложке 3 раза в день. Во всех РКИ использована одинаковая схема лечения, несмотря на различия в лекарственной форме.
В качестве первичных и вторичных конечных точек исследований в РКИ использовали различные критерии.
В качестве критериев эффективности в проведенных РКИ наиболее часто выбирали среднюю длительность лихорадки, тяжесть симптомов заболевания, долю пациентов с ухудшением течения заболевания (развитие осложнений, требующих назначения антибиотиков или госпитализации), динамику приема жаропонижающих препаратов, количество пациентов с хотя бы одним НЯ. В отдельных исследованиях также использованы следующие критерии: сроки купирования заболевания/разрешения симптомов заболевания и динамика качества жизни (ER-001, -002), продолжительность основных симптомов заболевания (ER-003, -007, -009), доля пациентов с нормальной температурой тела (ER-003, -007), доля пациентов с полным купированием всех симптомов заболевания по данным дневника пациента (ER-001, -002, -009), доля пациентов с отрицательным результатом вирусологического исследования и динамика показателей иммунного статуса (ER-003).
Несмотря на то, что во всех исследованиях определяли среднюю длительность лихорадки, под критерием «нормализация температуры тела» подразумевали различные значения: <37,0 °С (ER-001, -002, -003, -006); ≤37,2°С (ER-007), ≤37,5 °С (ER-009). Кроме того, неоднородность оцениваемых показателей обусловлена различными вариантами термометрии – применяли аксиллярную термометрию с использованием классического термометра без ртути (ER-003), тимпанальную термометрию с помощью электронного инфракрасного термометра (ER-006, -007), оральную термометрию цифровым термометром (ER-009), без уточнения – (ER-001, -002).
Клинические проявления заболевания оценивали как объективно, в ходе осмотра врачом-исследователем и с использованием лабораторной диагностики, так и с применением методов субъективной оценки с заполнением шкал, опросников – шкалы CCQ (Common Cold Questionnaire), опросника WURSS-21 (The Wisconsin Upper Respiratory Symptom Survey – 21), опросника качества жизни EQ5D (EuroQuality of life) и др. Для объединения данных в интегральную оценку использовали балльную оценку и расчет суммарного индекса заболевания.
Безопасность терапии оценивали с учетом количества и характера НЯ, их связи с приемом препарата, отклонений лабораторных и жизненно важных показателей в процессе лечения.
Проведенный анализ позволяет сделать вывод о том, что по своему дизайну и методологии, качеству изложения результатов проведенные исследования соответствуют современным этическим требованиям и стандартам GCP (Good Clinical practice – надлежащая, добросовестная клиническая практика), на основе которых разработаны Национальный стандарт РФ ГОСТ Р 52379-2005. GCP. Good Clinical Practice, приказ Минздрава России № 200н от 01.04.2016 «Об утверждении правил надлежащей клинической практики».
Результаты оценки риска смещения во включенных в обзор рандомизированных клинических исследованиях.
Актуальные подходы к определению качества РКИ предполагают оценку его дизайна с точки зрения возможности возникновения риска методологических ошибок, которые способствуют смещению результатов и снижению их достоверности [30].
С помощью инструмента RoB 2 проведен анализ каждого РКИ, включенного в обзор, в соответствии с первичными критериями эффективности. Сводные результаты представлены на рисунке.
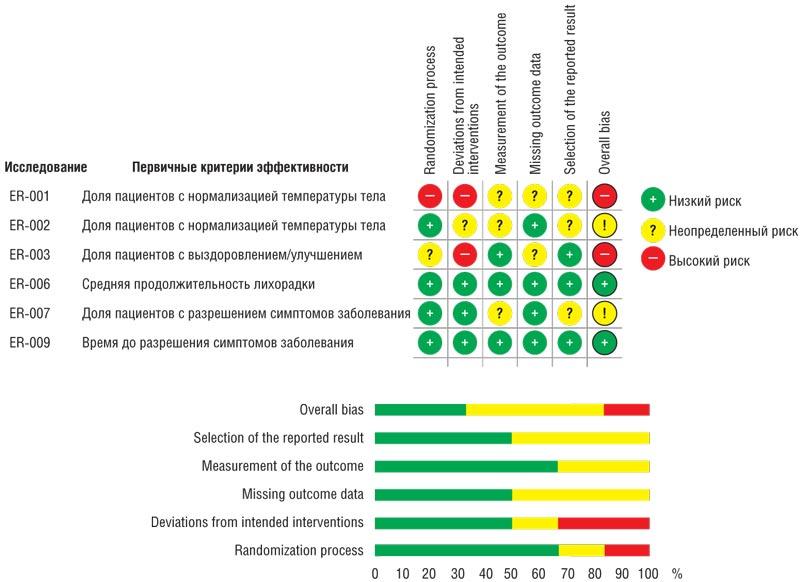 Результаты оценки риска смещения в рандомизированных клинических исследованиях по препарату Эргоферон
Результаты оценки риска смещения в рандомизированных клинических исследованиях по препарату ЭргоферонOverall bias – общая оценка риска; selection of the reported result – полнота предоставления результатов; measurement of the outcome – оценка «конечных точек»; missing outcome data – пропущенные данные; deviations from intended interventions – «ослепление» и отклонение от терапии; randomization process – рандомизация.
В целом, включенные в обзор РКИ характеризовались низким риском смещения более чем в половине от общего количества оценок по доменам RoB 2. В исследованиях ER-006, -009 низкий риск систематической ошибки отмечен по всем анализируемым доменам. Минимальный риск смещения в данных РКИ обусловлен применением валидированных шкал и методов для оценки эффективности терапии, подробным описанием процедуры ослепления, представлением результатов в соответствии с заявленными критериями. Высокий риск смещения выявлен в исследованиях ER-001, -003 в связи с недостатками процедуры рандомизации и отсутствием ослепления. Результаты по оценке RoB как «неопределенного» связаны в основном с отчетностью по дизайну исследования в публикациях по ER-001, -002, -003, -007: отсутствием подробной информации о первоначальном статистическом плане, работе с пропущенными данными.
Применение правила оценки общего риска систематической ошибки в РКИ, практикуемого Кокрейновским сотрудничеством, позволило отнести 2 РКИ, включенных в обзор (ER-006, -009), к исследованиям с низким общим риском систематических ошибок (А). Исследования ER-002, -007 отнесены к РКИ со средним общим риском систематических ошибок (В), а ER-001, -003 – с высоким уровнем общего риска смещения (С) [30].
Краткое описание результатов рандомизированных клинических исследований.
В исследовании ER-001 продемонстрирована сопоставимость терапевтической эффективности Эргоферона и осельтамивира [25]. При оценке по первичным и вторичным конечным точкам установлено, что на фоне лечения выраженность и продолжительность лихорадки достоверно не отличались (тест Вальда, t-критерий Стьюдента, модифицированный на сопоставимость). Отсутствие значимых межгрупповых различий показано и при оценке доли пациентов с купированием основных симптомов гриппа к 7-му дню наблюдения (p=0,028), длительности и выраженности основных симптомов гриппа, динамики снижения температуры тела к 3-му дню лечения (p=0,007), частоте применения жаропонижающих средств (p=0,0044), а также при анализе динамики суммарных баллов опросника EQ5D и Шкалы состояния здоровья. По частоте развития НЯ различия между группами отсутствовали, серьезных НЯ не зарегистрировано. К ограничениям данного исследования можно отнести отсутствие информации о вакцинации против гриппа, которая могла дополнительно повлиять на результаты терапии, открытый дизайн.
В исследовании ER-002 показано, что применение Эргоферона приводило к нормализации температуры тела у большей доли пациентов по сравнению с группой больных, принимавших плацебо (р<0,05) [26]. Ранний старт терапии Эргофероном имел более выраженную клиническую эффективность (критерий Кохрана-Мантеля-Хензеля, p=0,011; точный критерий Фишера, p=0,036). В ходе исследования было подтверждено снижение частоты приема жаропонижающих средств на фоне терапии Эргофероном (р=0,024). Безопасность исследуемого препарата подтверждалась отсутствием отрицательного влияния на витальные показатели и отсутствием различий по частоте НЯ в группах. Отмечена тенденция к уменьшению сроков заболевания. К ограничениям РКИ можно отнести тот факт, что влияние исследуемого препарата на лихорадку оценивали на фоне применения жаропонижающих препаратов. Стоит заметить, что подобная проблема в любых РКИ носит этический характер.
По данным отчета по исследованию ER-003 продемонстрирована сопоставимая противовирусная активность препаратов Эргоферон и осельтамивир. Выраженность лихорадки в процессе лечения значимо снижалась начиная со 2-го дня. Динамика лихорадки на фоне лечения сравниваемыми препаратами не отличалась (р=0,027 для утренних показателей; р=0,001 для вечерних). При приеме Эргоферона отмечено быстрое уменьшение частоты применения жаропонижающих препаратов. Оценка доли отрицательных результатов ПЦР (отсутствие вируса гриппа в назофарингеальных образцах) показала сопоставимые результаты в обеих группах: на 3-й день (р=0,014), на 5-й день (р=0,037), на 7-й день (р<0,001).
Лечение Эргофероном оказывало умеренное активирующее влияние на иммунную систему; выявлено увеличение в сыворотке крови концентрации цитокинов – регуляторов Т- и В-клеточного иммунного ответа: интерлейкина-2 и -4 на 3-й день лечения, ИФН-γ на 3-й и 7-й дни. В результате анализа количества лейкоцитов, абсолютного и относительного числа нейтрофилов, лимфоцитов, моноцитов, эозинофилов, базофилов, CD3, CD4, CD8, CD16, CD119 лимфоцитов на 1-й, 3-й и 7-й дни наблюдения установлено, что применение Эргоферона не оказывало стимулирующего влияния на рост и дифференцировку клеток иммунной системы. Эргоферон не влиял на жизненно важные показатели пациентов, не приводил к развитию серьезных нежелательных реакций. По частоте НЯ группы не различались. Лечение Эргофероном хорошо переносилось пациентами и характеризовалось высокой комплаентностью. Лимиты исследования – открытый дизайн, отсутствие информации о вакцинации против гриппа.
В РКИ ER-006 показано, что Эргоферон способствует сокращению продолжительности лихорадки (р=0,0174) [27]. Анализ «площади под кривой» (AUCtc – area under the curve, тс – тяжесть симптомов) для оценки тяжести заболевания у пациентов (опросник WURSS-21) показал статистически значимое превосходство терапии Эргофероном над плацебо (р=0,015). Количество применений препаратов симптоматической терапии у пациентов двух групп, включая антипиретики, не имело различий. Частота НЯ в группах не различалась. Лимитирующим фактором данного исследования может считаться использование Эргоферона вместе с симптоматической терапией, включавшей жаропонижающие препараты, топические деконгестанты, противокашлевые препараты и др.
В исследовании ER-007 установлено, что терапевтический эффект Эргоферона проявлялся уже с первых суток терапии, что выражалось в значимом превосходстве доли пациентов с разрешением всех симптомов заболевания по сравнению с группой плацебо (р=0,029) [28]. При сопоставимой частоте использования жаропонижающих препаратов более выраженная достоверная отрицательная динамика лихорадки отмечена в группе Эргоферона – изменение температуры тела на протяжении всего периода терапии (р<0,0001), доля пациентов с нормализацией температуры тела к 3-му дню (р=0,0147). Также в группе Эргоферона выявлена меньшая тяжесть течения заболевания по результатам «площади под кривой» (р=0,0493 для суммарного показателя). Случаев ухудшения течения заболевания и/или развития осложнений, потребовавших назначения АБП или госпитализации, не отмечено. При анализе безопасности терапии не выявлено значимых различий по частоте развития НЯ между группами (р=1,000). К ограничениям данного исследования можно отнести отсутствие запрета на применение жаропонижающих препаратов. Вместе с тем полученные результаты свидетельствуют о сопоставимости частоты их приема в обеих группах.
По данным отчета ER-009 применение Эргоферона в дополнение к симптоматической терапии приводило к значимому сокращению продолжительности заболевания (р=0,026), периода интоксикации/общих симптомов и длительности респираторных симптомов, ассоциированных с рино-, адено-, метапневмовирусами, вирусами гриппа А и В и их сочетанием. Также в целом применение Эргоферона приводило к более легкому течению заболевания и способствовало выздоровлению достоверно большего числа пациентов в течение 5 дней, предупреждало развитие вторичных бактериальных осложнений, требующих назначения антибиотиков (р=0,0001). Более легкое течение заболевания при приеме Эргоферона, включая значимо меньшую выраженность лихорадки, отмечено при достоверно меньшем использовании антипиретиков (р=0,0037). Частота НЯ, относящихся к классам системы органов (КСО) по кодам MedDRA (Медицинский словарь для регуляторной деятельности), не имела различий между двумя группами. В ходе исследования не зарегистрировано случаев взаимодействия Эргоферона с лекарственными средствами различных классов, включая нестероидные противовоспалительные средства, анальгетики, деконгестанты, антибиотики, бронхо-, муко- и секретолитики.
К лимитирующим факторам в данном исследовании можно отнести отсутствие ограничения по применению жаропонижающих препаратов.
Стоит отметить, что, несмотря на достаточно высокий методологический уровень включенных в обзор исследований в целом, с точки зрения статистики, различия в подходах к выбору конечных точек в каждом исследовании привели к значительной гетерогенности результатов с дальнейшим затруднением их обобщения и интерпретации и невозможности проведения развернутого метаанализа.
Обобщенные результаты по эффективности и безопасности Эргоферона
Для наиболее полного представления информации о доступных доказательствах эффективности и безопасности Эргоферона в обзоре представлены объединенные результаты отдельных исследований (табл. 4). Анализ обобщенных данных по эффективности и безопасности препарата Эргоферон проводили по следующим критериям:
- Средняя длительность лихорадки, определяемая по достижении температуры тела ≤37,2 °C.
- Тяжесть симптомов ОРВИ по «площади под кривой» (AUCTC).
- Доля пациентов, у которых отмечено ухудшение течения заболевания (развитие осложнений, требующих назначения антибиотиков или госпитализации).
- Количество пациентов хотя бы с одним НЯ.
Таблица 4. Результаты анализа обобщенных данных по эффективности и безопасности препарата Эргоферон
| Критерий (исследования) | Группа | Значение показателя | Количество пациентов, n | Статистика |
| Средняя длительность лихорадки, сут (ER-001, -002, -003, -006, -007, -009) | Эргоферон | 2,61±1,54 (M±SD) | 690 | р=0,0034* |
| Плацебо | 2,89±1,78 (M±SD) | 528 | ||
| Осельтамивир | 2,97±1,68 (M±SD) | 170 | – | |
| Тяжесть симптомов по «площади под кривой» (AUCtc), у.е. (ER-007, -009) | Эргоферон | 32,83±18,12 (M±SD) | 285 | р=0,0083* |
| Плацебо | 36,94±19,08 (M±SD) | 290 | ||
| Доля пациентов с ухудшением течения заболевания, % (ER-001, -002, -003, -006, -007, -009) |
Эргоферон | 0,7 | 698 | р=0,0001** |
| Плацебо | 4,1 | 542 | ||
| Осельтамивир | 1,8 | 170 | – | |
| Количество пациентов хотя бы с одним НЯ, человек (%) (ER-001, -002, -003, -006, -007, -009) |
Эргоферон | 49 (6,9) | 713 | р=0,0619** |
| Плацебо | 54 (9,9) | 548 | ||
| Осельтамивир | 25 (14,5) | 172 | – |
Примечание. * – t-критерий Стьюдента; ** – точный критерий Фишера.
Поскольку дизайн исследований и конечные точки могли отличаться в разных исследованиях, в обобщенный анализ каждого критерия попало разное количество РКИ и пациентов. Учитывали также данные из сравнительных (noninferiority) РКИ, но анализ проводили только между группами Эргоферон и плацебо.
Средняя длительность лихорадки
В объединенный анализ эффективности Эргоферона по длительности лихорадки вошли данные 6 РКИ. Общее количество пациентов, попавших в анализ, составило 1388 человек. Из них 690 человек принимали Эргоферон, 528 пациентов – плацебо и 170 пациентов – осельтамивир.
Минимальную длительность лихорадки – 1,11±0,95 сут (здесь и далее M±SD) при приеме Эргоферона наблюдали в исследовании ER-007, максимальную – 3,77±1,25 сут – в исследовании ER-003. Минимальная длительность лихорадки при приеме плацебо составила 1,32±1,00 сут в исследовании ER-007, максимальная – 3,47±1,33 сут в исследовании ER-002. Продолжительность лихорадки при приеме осельтамивира изменялась от 2,3±1,6 сут (ER-001) до 3,54±1,53 сут (ER-003). Разбросы в длительности лихорадочного периода обусловлены различиями в доле и типе вируса гриппа у пациентов, включенных в исследования в разные эпидемические сезоны.
Средняя продолжительность лихорадки у пациентов, принимавших препарат Эргоферон в 6 РКИ, составила 2,61±1,54 сут. У пациентов, принимавших плацебо – 2,89±1,78 сут. При анализе средних значений с использованием t-критерия Стьюдента получено статистически значимое различие между группами (p=0,0034), подтверждающее большую эффективность Эргоферона по сравнению с плацебо при лечении ОРВИ и гриппа.
Тяжесть симптомов по «площади под кривой» (AUCTC)
В анализ включены 2 исследования, в которых оценивали тяжесть симптомов ОРВИ и гриппа – ER-007 и ER-009. Размер выборки для анализа составил 575 человек: 285 пациентов в группе Эргоферона и 290 – в группе плацебо. Суммарная выраженность симптомов ОРВИ, рассчитанная по двум исследованиям, у пациентов, принимавших Эргоферон, составила 32,83±18,12 условных единиц (у.е.). В группе плацебо отмечена большая тяжесть симптомов ОРВИ – 36,94±19,08 у.е. Различие между группами, оцененное с помощью t-критерия Стьюдента, было статистически значимыми (p=0,0083), что подтверждает влияние препарата Эргоферон на выраженность симптомов ОРВИ и гриппа.
Доля пациентов, у которых отмечено ухудшение течения заболевания (развитие осложнений, требующих назначения антибиотиков или госпитализации)
В анализ долей пациентов с развитием осложнений ОРВИ и гриппа было включено 6 РКИ. Среди 698 пациентов, принимавших препарат Эргоферон по поводу ОРВИ и гриппа, развитие осложнений, требующих назначения антибиотиков или госпитализации отмечалось в 5 (0,7%) случаях. Осложнения у пациентов, принимавших плацебо (n=542), выявлялись в 22 (4,1%) случаях. Анализ с помощью точного критерия Фишера показал статистически значимое различие в количестве осложнений в группах (p=0,0001). Полученные данные свидетельствуют о возможности предотвращения развития осложнений, требующих назначения антибиотиков или госпитализации, у пациентов с ОРВИ и гриппом при приеме препарата Эргоферон.
Количество пациентов с хотя бы одним нежелательным явлением
Обобщенный анализ безопасности препарата Эргоферон проводился по данным 6 исследований. Включено 713 пациентов, принимавших Эргоферон, и 548 пациентов, принимавших плацебо. В группе Эргоферона выявлено 49 (6,9%) пациентов хотя бы с одним НЯ. В группе плацебо – 54 (9,9%) пациентов. Статистически значимых различий между группами не получено (точный критерий Фишера, p=0,0619).
Отдельно следует остановиться на ограничениях представленного обобщенного анализа эффективности Эргоферона. Для анализа показателя «средняя длительность лихорадки» данные были получены из 6 исследований, а для показателей «тяжесть симптомов ОРВИ» и «доля пациентов, у которых отмечено ухудшение течения заболевания», были доступны лишь 2 исследования. Кроме того, часть данных взята не только из плацебо-контролируемых исследований, а включала результаты сравнительных (noninferiority) исследований. Вместе с тем для проведения расчетов в соответствии с современными подходами и требованиями к метаанализу необходимо получить данные из не менее 10 схожих исследований. Таким образом, несмотря на то что в обзоре продемонстрированы доказательства, подтверждающие эффективность и безопасность Эргоферона в лечении гриппа и других ОРВИ, очевидна необходимость проведения методологически более однородных дополнительных исследований, что позволит провести полноценный метаанализ и получить данные более высокой доказательной силы.
Дополнительная оценка безопасности
По информации службы фармаконадзора компании ООО «НПФ «Материа Медика Холдинг», в 2010-2019 гг. всего было получено 72 сообщения о НЯ при проведении РКИ препарата Эргоферон. Также зарегистрировано 93 случая НЯ/нежелательных реакций (НР) по данным регуляторных органов и полученных спонтанных сообщений на «горячую линию» фармаконадзора; 7 НЯ/НР зафиксировано при проведении неинтервенционных исследований (табл. 5).
Таблица 5. Обобщенные данные по нежелательным явлениям/нежелательным реакциям на препарат Эргоферон с 2010 г. по август 2019 г.
| Источник информации | Количество НЯ/НР | Комментарии |
| Спонтанные сообщения о возникновении НЯ/НР. База данных фармаконадзора |
46 | НЯ/НР являются в большинстве своем ожидаемыми и представляют собой реакции повышенной индивидуальной чувствительности к компонентам препарата, неожидаемые НР относятся к разным КСО, имеют низкий уровень причинно-следственной связи с приемом препарата и не формируют сигнала безопасности |
| Клинические исследования, спонсированные ООО «НПФ "Материа Медика Холдинг"» | 72 | В КИ Эргоферона зарегистрировано 2 серьезных НЯ, не имеющих связи с приемом препарата, 66 НЯ, маловероятно/не связанных/имеющих сомнительную связь с исследуемой терапией, и 6 НЯ возможно/вероятно связанных с применением Эргоферона |
| Неинтервенционные исследования, спонсированные ООО «НПФ "Материа Медика Холдинг"» | 7 | НЯ/НР являются единичными, относятся к разным КСО, имеют низкий уровень причинно-следственной связи с приемом препарата и не формируют сигнала безопасности. |
| Литература (печатные источники информации), база данных фармаконадзора | 0 | Сообщений о НЯ/НР при проведении мониторинга источников литературы не выявлено |
| Независимые/инициативные клинические исследования | 0 | В инициативных клинических исследованиях НЯ/НР не выявлено |
| Регуляторные органы | 47 | Большинство НЯ/НР являются ожидаемыми и представляют собой реакции повышенной индивидуальной чувствительности к компонентам препарата, неожидаемые НР относятся к разным КСО, имеют низкий уровень причинно-следственной связи с приемом препарата и не формируют сигнала безопасности |
| Итого НЯ | 172 | |
Расшифровка аббревиатур дана в тексте.
По данным фармаконадзора компании, в 2010-2019 гг. сигналов безопасности не выявлено. В целом, по данным изучения безопасности, можно сделать вывод о том, что препарат Эргоферон обладает положительным соотношением польза/риск.
Проведенный критический анализ результатов РКИ Эргоферона с позиций ДМ позволяет сделать следующие выводы:
- Клиническая эффективность и безопасность применения Эргоферона при ОРВИ, включая грипп, доказана в ходе РКИ, 4 из них обладают наиболее высоким уровнем доказательности (РКИ с двойным слепым плацебо-контролем), с участием ведущих медицинских и научно-исследовательских центров.
- Эргоферон обеспечивает эффективную противовирусную терапию вне зависимости от этиологического агента и клинической картины.
- Препарат эффективен как для противовирусной, так и для патогенетической терапии ОРВИ, включая грипп, на любом этапе заболевания, а также способствует профилактике бактериальных осложнений.
- Эргоферон сочетается с любыми препаратами, необходимыми для лечения ОРВИ.
- Применение Эргоферона при гриппе и других ОРВИ безопасно.
Таким образом, с позиций доказательного подхода Эргоферон – это обоснованный выбор для медикаментозной терапии ОРВИ, включая грипп, обеспечивающий ее высокую эффективность и безопасность у взрослых и детей с 6 мес.
Конфликт интересов. Эргоферон – коммерческий препарат, производимый и реализуемый ООО «НПФ «Материа Медика Холдинг». Никифоров В.В. получал гонорары от ООО «НПФ «Материа Медика Холдинг» за представление научной медицинской информации по препарату на конгрессах и конференциях по респираторной и инфекционной патологии.
Авторы данной статьи подтвердили отсутствие иного возможного конфликта интересов, о котором необходимо сообщить.
Сведения об авторах
Никифоров Владимир Владимирович (Nikiforov Vladimir V.) – доктор медицинских наук, профессор, заведующий кафедрой инфекционных болезней и эпидемиологии ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России, Москва, Россия orcid.org/0000-0002-2205-9674
Руженцова Татьяна Александровна (Ruzhentsova Tatiana A.) – доктор медицинских наук, ведущий научный сотрудник клинического отдела инфекционной патологии ФБУН «Центральный научно-исследовательский институт эпидемиологии» Роспотребнадзора, Москва, Россия orcid.org/0000-0002-6945-2019
Литература
- Fashner J., Ericson K., Werner S. Treatment of the common cold in children and adults // Am. Fam. Physician. 2012. Vol. 86, N 2. P. 153159.
- van Driel M.L., Scheire S., Deckx L., Gevaert P., De Sutter A. What treatments are effective for common cold in adults and children? // BMJ. 2018. Vol. 363. k3786.
- Государственный доклад «О состоянии санитарно-эпидемиологического благополучия населения в Российской Федерации в 2018 году». rospotrebnadzor.ru/upload/iblock/798/gosudarstvenn… [дата обращения: 10.10.2019]
- Rolfes M.A., Foppa I.M., Garg S., Flannery B. et al. Annual estimates of the burden of seasonal influenza in the United States: a tool for strengthening influenza surveillance and preparedness // Influenza Other Respir. Viruses. 2018. Vol. 12, N 1. P. 132-137.
- Scholz S., Damm O., Schneider U., Ultsch B. et al. Epidemiology and cost of seasonal influenza in Germany – a claims data analysis // BMC Public Health. 2019. Vol. 19, N 1. P. 1090.
- Principi N., Camilloni B., Alunno A., Polinori I. et al. Drugs for influenza treatment: is there significant news? // Front Med. (Lausanne). 2019. Vol. 6. P 109.
- Uyeki T.M., Bernstein H.H., Bradley J.S. Clinical practice guidelines by the Infectious Diseases Society of America: 2018 Update on Diagnosis, Treatment, Chemoprophylaxis, and Institutional Outbreak Management of Seasonal Influenza // Clin. Infect. Dis. 2019. Vol. 68, N 6. P e1-e47.
- Iuliano A.D., Roguski K.M., Chang H.H. Global seasonal influenza-associated mortality collaborator network. Estimates of global seasonal influenza-associated respiratory mortality: a modelling study // Lancet. Vol. 391. P 1285-1300.
- Калюжин О.В. Острые респираторные вирусные инфекции: современные вызовы, противовирусный ответ, иммунопрофилактика и иммунотерапия. М. : Медицинское информационное агентство, 2014.
- Thomsen S.F. Exploring the origins of asthma: Lessons from twin studies // Eur. Clin. Respir. J. 2014. Vol. 1, Suppl. 1. doi: 10.3402/ecrj. V1.25535
- Reddehase M.J. Adverse immunological imprinting by cytomegalovirus sensitizing for allergic airway disease // Med. Microbiol. Immunol. 2019. Vol. 208. P. 469.
- Allan G.M., Arroll B. Prevention and treatment of the common cold: making sense of the evidence // CMAJ.2014. Vol. 186, N 3. P 190-199.
- McKimm-Breschkin J.L. Influenza neuraminidase inhibitors: Antiviral action and mechanisms of resistance // Influenza Other Respir. Viruses. 2012. Vol. 7, Suppl. 1. P. 25-36.
- Jefferson T., Rivetti A., Di Pietrantonj C., Demicheli V. Vaccines for preventing influenza in healthy children // Cochrane Database Syst. Rev. 2018. Vol. 2. CD004879.
- Demicheli V., Jefferson T., Ferroni E., Rivetti A., Di Pietrantonj C. Vaccines for preventing influenza in healthy adults // Cochrane Database Syst. Rev. 2018. Vol. 2:CD001269.
- Demicheli V., Jefferson T., Di Pietrantonj C., Ferroni E. et al. Vaccines for preventing influenza in the elderly // Cochrane Database Syst. Rev. 2018. Vol. 2. CD004876.
- Jefferson T., Rivetti A., Di Pietrantonj C., Demicheli V. Vaccines for preventing influenza in healthy children // Cochrane Database Syst. Rev. 2018. Vol. 2. CD004879.
- Abbas A.T., El-Kafrawy S.A., Sohrab S.S., Azhar E.I.A. IgY antibodies for the immunoprophylaxis and therapy of respiratory infections // Hum. Vaccin. Immunother. 2019. Vol. 15, N 1. P 264-275.
- Berry C.M. Antibody immunoprophylaxis and immunotherapy for influenza virus infection: Utilization of monoclonal or polyclonal antibodies? // Hum. Vaccin. Immunother. 2018. Vol. 14, N 3. P 796-799.
- Teijaro J.R. Type I interferons in viral control and immune regulation // Curr. Opin. Virol. 2016. Vol. 16. P 31-40.
- Singhania A., Graham C.M., Gabrysova L. Transcriptional profiling unveils type I and II interferon networks in blood and tissues across diseases // Nat. Commun. 2019. Vol. 10, N 1. P 2887.
- Официальная инструкция по медицинскому применению препарата Эргоферон. grls.rosminzdrav.ru (дата обращения: 11.10.2019).
- Журавлева М.В., Каменева Т.Р, Черных Т.М., Чурсина Т.А. Сравнительная характеристика ряда препаратов для лечения острой респираторной вирусной инфекции и гриппа // Педиатрия Доктор.Ру). 2015. № 13(114). С. 11-18.
- Andrianova E., Putilovskiy M. Efficacy and safety of Ergoferon versus oseltamivir: reply to the Letter to the Editor // Int. J. Infect. Dis. 2019. pii: S1201-9712(19)30391-1. doi: doi.org/10.1016Aijid.2019.09.028 [Epub ahead of print]
- Rafalsky V., Averyanov A., Bart B., Minina E. et al. Efficacy and safety of Ergoferon versus oseltamivir in adult outpatients with seasonal influenza virus infection: a multicenter, open-label, randomized trial // Int. J. Infect Dis. 2016. Vol. 51. P 47-55.
- Селькова Е.П., Костинов М.П., Барт Б.Я., Аверьянов А.В., Петров Д.В. Лечение острых респираторных вирусных инфекций у взрослых: результаты рандомизированного двойного слепого плацебо-контролируемого клинического исследования // Пульмонология. 2019. Т. 29, № 3. С. 302-310.
- Костинов М.П., Хамитов РФ., Бабкин А.П., Минина Е.С. и др. Лечение острой респираторной инфекции у взрослых: результаты многоцентрового рандомизированного двойного слепого плацебо-контролируемого клинического исследования // Леч. врач. 2019. № 10. С. 72-78.
- Геппе Н.А., Кондюрина Е.Г., Мельникова И.М., Сабитов А.У. и др. Релиз-активный противовирусный препарат Эргоферон в лечении острых респираторных инфекций у детей. Эффективность жидкой лекарственной формы Эргоферона: результаты рандомизированного двойного слепого плацебо-контролируемого клинического исследования // Педиатрия. Журнал им. Г.Н. Сперанского. 2019. Т. 98, № 1. С. 87-94.
- Higgins J.P, Altman D.G., Gotzsche PC., JQni P et al. The Cochrane Collaboration’s tool for assessing risk of bias in randomised trials // BMJ. 2011. Vol. 343. d5928.
- Реброва О.Ю., Федяева В.К., Хачатрян Г.Р Адаптация и валидизация вопросника для оценки риска систематических ошибок в рандомизированных контролируемых испытаниях // Медицинские технологии. Оценка и выбор. 2015. № 1 (19). С. 9-17.
References
- Fashner J., Ericson K., Werner S. Treatment of the common cold in children and adults. Am Fam Physician. 2012; 86 (2): 153-9.
- van Driel M.L., Scheire S., Deckx L., Gevaert P., De Sutter A. What treatments are effective for common cold in adults and children? BMJ. 2018; 363: k3786.
- State report "About the state of sanitary and epidemiological welfare of the population in the Russian Federation in 2018". https:// rospotrebnadzor.ru/upload/iblock/798/gosudarstvennyy-doklad-o-sostoyanii-sanitarno_epidemiologicheskogo-blagopoluchiya-naseleniya-v-rossiyskoy-federatsii-v-2018-godu.pdf (access 10 October 2019) (in Russian)
- Rolfes M.A., Foppa I.M., Garg S., Flannery B., et al. Annual estimates of the burden of seasonal influenza in the United States: A tool for strengthening influenza surveillance and preparedness. Influenza Other Respir Viruses. 2018; 12 (1): 132-7.
- Scholz S., Damm O., Schneider U., Ultsch B., et al. Epidemiology and cost of seasonal influenza in Germany – a claims data analysis. BMC Public Health. 2019; 19 (1): 1090.
- Principi N., Camilloni B., Alunno A., Polinori I., et al. Drugs for influenza treatment: is there significant news? Front Med (Lausanne). 2019; 6: 109.
- Uyeki T.M., Bernstein H.H., Bradley J.S. Clinical practice guidelines by the Infectious Diseases Society of America: 2018 Update on Diagnosis, Treatment, Chemoprophylaxis, and Institutional Outbreak Management of Seasonal Influenza. Clin Infect Dis. 2019; 68 (6): e1-47.
- Iuliano A.D., Roguski K.M., Chang H.H. Global seasonal influenza-associated mortality collaborator network. Estimates of global seasonal influenza-associated respiratory mortality: a modelling study. Lancet. 2018; 391: 1285-300.
- Kalyuzhin O.V. Acute respiratory viral infections: modern challenges, antiviral response, immunoprophylaxis and immunotherapy. Moscow: Medical Information Agency, 2014. (in Russian)
- Thomsen S.F. Exploring the origins of asthma: Lessons from twin studies. Eur Clin Respir J. 2014; 1 (Suppl 1): 10.3402/ecrj.v1.25535
- Reddehase M.J. Adverse immunological imprinting by cytomegalovirus sensitizing for allergic airway disease. Med Microbiol Immunol. 2019; 208: 469.
- Allan G.M., Arroll B. Prevention and treatment of the common cold: making sense of the evidence. CMAJ. 2014; 186 (3): 190-9.
- McKimm-Breschkin J.L. Influenza neuraminidase inhibitors: Antiviral action and mechanisms of resistance. Influenza Other Respir Viruses. 2012; 7 (Suppl. 1): 25-36.
- Jefferson T., Rivetti A., Di Pietrantonj C., Demicheli V. Vaccines for preventing influenza in healthy children. Cochrane Database Syst Rev. 2018; 2: CD004879.
- Demicheli V., Jefferson T., Ferroni E., Rivetti A., Di Pietrantonj C. Vaccines for preventing influenza in healthy adults. Cochrane Database Syst Rev. 2018; 2: CD001269.
- Demicheli V., Jefferson T., Di Pietrantonj C., Ferroni E., et al. Vaccines for preventing influenza in the elderly. Cochrane Database Syst Rev. 2018; 2: CD004876.
- Jefferson T., Rivetti A., Di Pietrantonj C., Demicheli V. Vaccines for preventing influenza in healthy children. Cochrane Database Syst Rev. 2018; 2: CD004879.
- Abbas A.T., El-Kafrawy S.A., Sohrab S.S., Azhar E.I.A. IgY antibodies for the immunoprophylaxis and therapy of respiratory infections. Hum Vaccin Immunother. 2019; 15 (1): 264-75.
- Berry C.M. Antibody immunoprophylaxis and immunotherapy for influenza virus infection: Utilization of monoclonal or polyclonal antibodies? Hum Vaccin Immunother. 2018; 14 (3): 796-9.
- Teijaro J.R. Type I interferons in viral control and immune regulation. Curr Opin Virol. 2016; 16: 31-40.
- Singhania A., Graham C.M., Gabrysova L. Transcriptional profiling unveils type I and II interferon networks in blood and tissues across diseases. Nat Commun. 2019; 10 (1): 2887.
- The official instruction for medical use of the drug Ergoferon. grls.rosminzdrav.ru (access 11 October 2019) (in Russian)
- Zhuravleva M.V., Kameneva T.R., Chernykh T.M., Chursina T.A. Comparative characteristics of drugs for the treatment of acute respiratory viral infection and influenza. Pediatrics (Doctor.Ru). 2015; (13): 11-8. (in Russian)
- Andrianova E., Putilovskiy M. Efficacy and safety of Ergoferon versus oseltamivir: reply to the Letter to the Editor. Int J Infect Dis. 2019. pii: S1201-9712(19)30391-1. doi: doi.org/10.1016/j.ijid.2019.09.028 [Epub ahead of print]
- Rafalsky V, Averyanov A, Bart B, Minina E, Putilovskiy M, Andrianova E, et al. Efficacy and safety of Ergoferon versus oseltamivir in adult outpatients with seasonal influenza virus infection: a multicenter, open-label, randomized trial. Int J Infect Dis.2016; 51: 47-55.
- Selkova E.P., Kostinov M.P., Bart B.Ya., Averyanov A.V., Petrov D.V. Treatment of acute respiratory viral infections in adults: results of a randomized, double-blind, placebo-controlled clinical trial. Pulmonologiya [Pulmonology]. 2019; 29 (3): 302-10. (in Russian)
- Kostinov M.P., Khamitov R.F., Babkin A.P., Minina E.S., et al. Treatment of acute respiratory infection in adults: results of a multicenter, randomized, double-blind, placebo-controlled clinical trial. Lechashchiy vrach [Attending Physician]. 2019 (10): 72-8. (in Russian)
- Geppe N.A., Kondyurina E.G., Melnikova I.M., Sabitov A.U., et al. Release-active antiviral drug Ergoferon in the treatment of acute respiratory infections in children. The efficiency of liquid dosage form of Ergoferon: results of a randomized double-blind placebo-controlled clinical studies. Pediatriya. Zhurnal im. G.N. Speranskogo [Pediatrics. Journal named after G.N. Speranskiy]. 2019; 98 (1): 87-94. (in Russian)
- Higgins J.P., Altman D.G., Gctzsche P.C., JQni P., et al. The Cochrane Collaboration’s tool for assessing risk of bias in randomised trials. BMJ. 2011; 343: d5928.
- Rebrova O.Yu., Fedyaeva V.C., Khachatryan G.R. Adaptation and validation of a questionnaire to assess the risk of systematic errors in randomized controlled trials. Meditsinskie tekhnologii. Otsenka i vybor [Medical Technology. Evaluation and Selection]. 2015; 1 (19): 9-17. (in Russian)
