К вопросу о генетической предрасположенности к гепатоцеллюлярной карциноме
СтатьиОпубликовано в журнале:
Южно-Российский медицинский журнал »» №1 / 2004
Попов Е.А., Левитан Б.Н.
Кафедра факультетской терапии Астраханской государственной медицинской академии
Целью исследования явился поиск иммуногенетических маркёров гепато-целлюлярной карциномы (ГЦК) из числа специфичностей HLA. С помощью реакции комплемент-зависимой цитотоксичности по методу Терасаки проанализирован характер распределения антигенов HLA класса I и II локусов А, В, С и DR у 32 больных ГЦК в популяции русских, проживающих на территории Астраханской области. Результаты исследования показали наличие ассоциативной связи между ГЦК и определённым фенотипом HLA. Высокий риск развития ГЦК ассоциирован с аллелями HLA-A9 (RR=2,57) и В35 (RR=3,07), а также с неполным фенотипом по локусу A (RR=2,62). Резистентность к развитию ГЦК маркируется аллелями HLA-A11 (RR=0,288) и В7 (RR=0,297). Присутствие в фенотипе больных хронической HBV-инфекцией специфичностей HLA-A9, В35 и, особенно, гаплотипа HLA-A2/B35, значительно увеличивает у них риск развития ГЦК. У лиц старше 60 лет маркёром повышенного риска развития ГЦК является специфичность HLA-B16. Наличие возрастной рестрикции генетических маркёров может быть связано с различными механизмами формирования ГЦК в определённые сроки жизни.
Первичная гепатоцеллюлярная карцинома (ГЦК) -тяжелая онкологическая патология с быстропрогрессирующим течением и крайне неблагоприятным прогнозом. Единственный метод, позволяющий вылечить больного ГЦК - хирургическое вмешательство. В большинстве наблюдений 5-летняя выживаемость пациентов после резекции составляет около 20%. Лишь у 10-15% больных к моменту постановки диагноза этих опухолей возможна радикальная операция. Общий уровень выживаемости равен примерно 10%.
Хотя в России гепатома встречается достаточно редко, в мире это одна из самых частых злокачественных опухолей, которая является причиной более миллиона смертей ежегодно [2]. В структуре онкологических заболеваний в Российской Федерации первичный рак печени составляет 1,0-1,5% всех злокачественных опухолей. В подавляющем числе случаев развивается гепатоцеллюлярный рак (90%), гораздо реже - холангиоцеллюлярный рак (10%).
И хотя ведущие эпидемиологические факторы риска ГЦК уже идентифицированы, онкогенетические механизмы, формирующие опухолевую прогрессию на молекулярном уровне, изучены ещё недостаточно [8]. Доминирующая роль гепатотропной вирусной инфекции (HBV и HCV) в формировании ГЦК не вызывает сомнений [6]. Эпидемиологические исследования показали, что у HBsAg-положительных больных вероятность заболеть раком печени в 30 раз выше. Сочетание же HBsAg и HBeAg у больных хроническим вирусным гепатитом В (ХВГВ) увеличивает риск развития первичной гепатоцеллюлярной карциномы в 60 раз [4].
В работе H.Hamada et al. показано, что ГЦК развивается у 11% больных с хронической HCV-инфекцией, в среднем, через 31 год после внутривенного заражения вирусом С. Возраст 92% больных ГЦК был больше 60 лет [7]. По данным J.L.Perret et al., у африканских негров Габона, страдающих ГЦК, HBsAg встречается в 40,5% случаев, частота анти-HCV-ab достигает 28,6% [9]. В индийской популяции коинфекция HBV и НCV встречается у 26,6% пациентов с гепатомой [10] M.P.Dore et al. выдвинули гипотезу о триггерной роли Helicobacter pylori в развитии ГЦК [5].
Цирроз печени (ЦП), независимо от этиологии, -основной фактор риска развития гепатомы. По статистическим данным, у больных ЦП гепатома возникает в 3-5% случаев, причем значительно чаще у мужчин, Нередки случаи гепатомы при алкогольном ЦП, гемохроматозе, аутоиммунном гепатите, наследственной недостаточности альфа-1-антитрипсина, хронической HCV-инфекции, а также при некоторых редких наследственных заболеваниях (наследственная тирозинемия и нарушение обмена гликогена).
Приведенная выше неутешительная статистика делает весьма актуальной разработку новых прогностических алгоритмов повышенного риска развития ГЦК с использованием показателей иммуногенетического статуса человека (в первую очередь, HLA-генов), особенно у больных с хронической HBV- и HCV-инфекцией. Появляется реальный шанс значительно улучшить раннюю диагностику ГЦК и, тем самым, продлить жизнь больным.
Вопрос о генетически детерминированной предрасположенности к первичной ГЦК находится в стадии изучения. В мировой литературе встречаются единичные работы, направленные на поиск иммуногенетических маркёров ГЦК. Опубликованные данные крайне противоречивы, что подтверждает наличие выраженной популяционной рестрикции HLA-генов как маркёров ГЦК.
Таблица 1
Частота регистрации некоторых специфичностей HLA локусов А и В у больных ГЦК
|
Антиген HLA |
Больные ГЦК (п = 32) |
Контрольная группа (п = 200) |
Относительный |
Степень |
||
|
абсолютн. |
частота АГ |
абсолютн. |
частота АГ |
|||
|
А9 |
12 |
37,5% |
38 |
19,0% |
2,574 |
4,544 |
|
АИ |
1 |
3,1% |
31 |
14,0% |
0,288 |
4,060 |
|
Ах |
17 |
53,1% |
60 |
30,0% |
2,622 |
5,651 |
|
В7 |
2 |
6,3% |
43 |
21,5% |
0,297 |
5,137 |
|
В16 |
5 |
15,6% |
15 |
7,5% |
2,394 |
1,395 |
|
В17 |
1 |
3,1% |
22 |
11,0% |
0,378 |
2,899 |
|
В21 |
3 |
9,4% |
5 |
2,5% |
4,218 |
2,124 |
|
В35 |
10 |
32,0% |
26 |
13,0% |
3,073 |
5,686 |
Материалы и методы
Проведено клиническое и иммуногенетическое обследование 32 лиц с ГЦК, госпитализированных в гастроэнтерологическое отделение Александро-Мариинской областной клинической больницы № 1 г. Астрахани за период с 1990 по 2002 гг.. Клинический диагноз ГЦК устанавливался на основании жалоб больных, анамнеза, типичной клинической картины, изменения биохимических и иммунологических показателей, инструментальных методов обследования: ультразвуковой томографии, спленопортографии, рентгеноскопии пищевода и желудка, ФГДС, сканирования, лапароскопии с прицельной биопсией и морфологическим исследованием ткани печени. Для уточнения этиологии ГЦК проводилось исследование маркёров гепатотропных вирусов В, С и D: HBsAg, анти-HCV, анти-HDV методом радиоиммунного и иммуноферментного анализа, у части больных - методом полимеразной цепной реакции (ПЦР).
У всех 32 пациентов проведено типирование антигенов HLA класса I и II локусов А, В, С и DR на лимфоцитах периферической крови с помощью реакции комплемент-зависимой цитотоксичности по методу Терасаки. Иммуногенетическое обследование проводилось с помощью наборов иммунных сывороток Российского НИИ гематологии и переливания крови (г.Санкт-Петербург) для специфичностей HLA класса I и II. В качестве контроля использованы показатели антигенного профиля 200 здоровых лиц в русской популяции Астраханской области. При типировании антигенов II класса в качестве контроля использовались показатели антигенного профиля 412 жителей г. Санкт-Петербурга и 2911 европеоидов (VIII Уоркшоп) [1]. Анализ результатов HLA-типирования проводился по общепринятой методике и включал изучение частоты регистрации отдельных антигенов и их сочетаний (гаплотипов), определение показателя относительного риска - RR. Достоверность полученных результатов оценивалась с помощью критерия χ2 с поправкой Yates на непрерывность выборки и с использованием корригированного значения (рс) степени достоверности для малых выборок.
Результаты исследования
В группу больных ГЦК вошли 27 мужчин (84%) и 5 женщин (16%). Возраст больных на момент постановки диагноза колебался от 32 лет до 71 года, составляя, в среднем, 56 лет. HBsAg был выявлен у 18 пациентов, т.е. в 56,3% случаев. Статистически значимых различий в частоте регистрации антигенов HLA локусов С и DR между группой больных ГЦК и контролем найдено не было. Вместе с тем, существенные различия частотных характеристик некоторых специфичностей установлены для локусов А и В (табл. 1).
В группе больных ГЦК зарегистрировано достоверное повышение частоты антигенов HLA-A9 (37,5%>19,0%; RR=2,574; χ 2=4,544; рс<0,05) и В35 (32,0%>13,0%; RR=3,073; χ 2=5,686; рс<0,04). Отмечалась, также, повышенная частота специфичностей HLA-B16 и В21, но разница была статистически недостоверной (р>0,05). Обращает на себя внимание высокая частота неполного фенотипа по локусу А у пациентов с ГЦК (53,1%>30,0%; RR=2,62; χ 2=5,651; р<0,04). В группе больных ГЦК установлено статистически достоверное снижение частоты регистрации специфичностей HLA-A11 (3,1%>14,0%; RR=0,288; χ 2=4,060; р<0,05) и В7 (6,3%<21,5%; RR=0,297; χ 2=5,137; р<0,04). Разница в частоте HLA-B17 между двумя анализируемыми группами была недостоверной.
Интересные данные получены при сравнительном анализе частотных характеристик гаплотипов в двух группах. По сравнению с контролем, в группе больных ГЦК установлено повышение частоты регистрации гаплотипов HLA-A2/B35 (12,9%>1,11%), А3/В35 (4,0%>1,63%) и А19/В35 (3,45%>0,44%). Но лишь для HLA-A2/B35 установленная разница была статистически достоверной с высоким показателем относительного риска (RR=7,86; χ 2=15,817; рс<0,02).
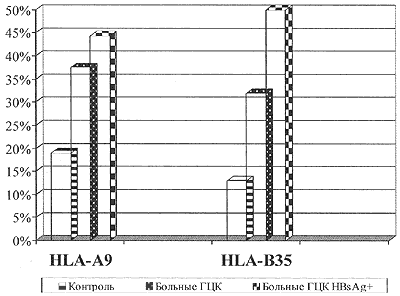
У больных ГЦК на фоне доказанной хронической HBV-инфекции (18 чел.) частота антигенов HLA-A9 и В35 возрастала ещё выше, увеличивая показатели относительного риска (для HLA-A9 до 44,4%; RR=3,42; χ 2=4,984 и для HLA-B35 до 50,0%; RR=6,58; χ 2=14,142), (рис. 1). В целом, присутствие антигенов HLA-A9, В35 или гаплотипа HLA-A9/B35 в фенотипе установлено у 14 из 18 больных ГЦК, позитивных по HbsAg (T.e., в 77,8%).
Нами проведён анализ особенностей фенотипа у больных ГЦК в зависимости от возраста. В первую группу вошли 19 пациентов, у которых диагноз первичного рака печени был верифицирован в возрасте до 60 лет. Вторую группу составили 13 больных ГЦК старше 60 лет на момент постановки диагноза. В возрастной группе до 60 лет частота специфичностей HLA-A9 и В35 была значительно выше, чем в контроле и даже достоверно выше, чем в общей группе больных ГЦК (47,4% и 36,8%, соответственно). Показатели относительного риска составили 3,82 (χ 2=6.687; р<0,04) и 3,95 (χ 2=5,957; р<0,04) для каждого антигена. В группе больных старше 60 лет частота антигенов HLA-A9 и В35 практически не отличалась от таковой в контроле.
Вместе с тем, в старшей возрастной группе выявлено статистически значимое увеличение частоты HLA-B16 (30,8%>7,6%; RR=5,67; χ 2=5,523; p<0,05).
Рисунок 1
Частота регистрации HLA-A9 и В35 у больных ГЦК
Заключение
Таким образом, у русских, проживающих на территории Астраханской области, повышенный риск развития ГЦК ассоциируется с наличием в антигенном профиле аллелей I класса HLA-A9 и В35 и неполным фенотипом по локусу А. Резистентность к развитию ГЦК маркируется аллелями HLA-A11 и В7. Присутствие в фенотипе больных хронической HBV-инфекци-ей специфичностей HLA-A9, В35 и, особенно, гаплотипа HLA-A2/B35, значительно увеличивает у них риск развития ГЦК. У лиц старше 60 лет маркёром ГЦК является антиген HLA-B16. Наличие возрастной рестрикции иммуногенетических маркёров можетбыть связано с различными механизмами формирования ГЦК в определённые сроки жизни.
С точки зрения теории молекулярной мимикрии, возникновение гепатомы может быть обусловлено сходством биохимических структур отдельных фрагментов антигенных детерминант гепатотропных вирусов с молекулами HLA класса 1, в частности — HLA-A9 и В35. Избыточная экспрессия молекул HLA на гепа тоцитах, инфицированных вирусами, обеспечивает их цитолиз, т.к. именно молекулы 1 класса презентуют чужеродные антигены Т-киллерам. Последние распознают повреждённые гедатоциты только после взаимодействия денатурированных белков вируса с HLA-антигеном I класса. Структурное сходство собственного и чужеродного антигенов блокирует этот процесс Кроме того, с присутствием в фенотипе индивида специфичности HLA-B35 коррелирует значительное снижение величины иммунорегуляторного индекса CD4/CD8 и уменьшение содержания киллеров-супрессоров [4]. Всё вышеперечисленное способствует возникновению ГЦК на фоне хронической HBV- или HCV- инфекции.
Литература
1. Беляева Е.В., Калинина Н.М. Распределение HLA-DR-антигенов среди жителей Ленинграда // Вестник АМН СССР. -1988. -N7. -С.15-17.
2. Вуд М., Банн П. Секреты гематологии и онкологии // Пер с англ. -изд. 2-е, исправ. -М.: Издательство Бином, Спб.: Невский диалект, 2001. -560 с.
3. Клиническая иммунология / Под. ред. А.В.Караулова. -М.: Медиц. информац. агентство, 1999. -604 с.
4. Chen C.J. Hepatitis В risk factors for liver cancer // Lancet Infect. Disease. -2002. -V.2. -P.879.
5. Dore M.P., Realdi G., Mura D. et al. Helicobacter infection in patients with HCV-related chronic hepatitis, cirrhosis, and hepatocellular carcinoma//Dig. Dis. Sic. -2002. -V.47. -N7. -P.1638-1643.
6. Feitelson M. Chronic hepatitis С virus infection and the
pathogenesis of hepatocellular carcinoma// Arch. Immunol. Ther. Exp. (Warsz). -2001. -V.49. -Suppl.2. -S.65-74.
7. Hamada H., Yatsuhashi H., Yano K. et al. Impact of aging on the development of hepatocellular carcinoma in patients with posttransfusion chronic hepatitis С // Cancer. -2002. -V.95. -N2. -P.331-339.
8. McGlynn K.A., Edmonson M.N., Michielli R.A. et al. A phy-logenetic analysis identifies heterogeneity among hepatocellular carcinomas//Hepatology. -2002. -V.36. -P.1341-1348.
9. Perret J.L., Moussavou-Kombila J.B., Delaporte E. et al. HBs Ag and antibodies to hepatitis С virus in complicated chronic liver disease in Gabon. A case control study // Gastroenterol. Clin. Biol. -2002. -V.26. -N2. -P. 131-135.
10. Xess A, Kumar M., Minz S. et al. Prevalence of hepatitis В and hepatitis С virus coinfection in chronic liver disease //; Indian. J. Pathol. Microbiol. -2001. -V.44. -N3. -P.253-255.
Комментарии
ПРАКТИКА ПЕДИАТРА
