Воздействие LGG на здоровье желудочно-кишечного тракта
СтатьиПредыдущая глава | Оглавление | Следующая глава
3. Здоровье желудочно-кишечного тракта - воздействие LGG®
3.1. Побочные эффекты антибиотиков
Наиболее известным является свойство пробиотиков предотвращать побочные эффекты антибактериальной терапии, такие как диарея и боли в животе, а так же нарушения работы желудочно-кишечного тракта. Прием антимикробных агентов нарушает экологический баланс между носителем и микрофлорой (Sullivan et al., 2001). Антибиотики также вмешиваются в метаболизм микрофлоры, например, через задерживание образования короткоцепочечных жирных кислот в толстой кишке. Пробиотики, таким образом, прекрасно подходят для поддержания или восстановления баланса желудочно-кишечной микрофлоры. Кроме того, хорошо сбалансированная микрофлора препятствует закреплению резистентных микробных культур. Был доказан факт снижения побочных эффектов антибиотиков среди детей при приеме L. rhamnosus GG в форме капсул. В смешанном исследовании, проведенном двойным слепым методом с использованием плацебо, распространенные острые инфекционные заболевания у 188 детей лечились семейными врачами при помощи часто используемых в практике антибиотиков (Vanderhoof et al., 1999). Половина участников ежедневно получали 1-2 капсулы L. rhamnosus GG (1х109 КОЕ), а другая половина получала идентичные капсулы плацебо (одна капсула для детей с весом <12 кг, две капсулы - для остальных). Возникновение любых жалоб на функционирование желудочно-кишечного тракта отслеживалось посредством телефонных опросов. Среди группы L. rhamnosus GG наблюдалась существенно более низкая частота диареи и ежедневных дефекаций в сравнении с контрольной группой. Кроме того, стул был более твердый, а также наблюдалось меньше случаев боли в животе, чем в группе плацебо (рисунок 7). Прием L. rhamnosus GG не оказал никаких побочных эффектов как в этом, так и в других исследованиях.
Рисунок 7. Воздействие L. rhamnosus GG на симптомы, вызванные лечением антибиотиками среди детей (Vanderhoof et al 1999). 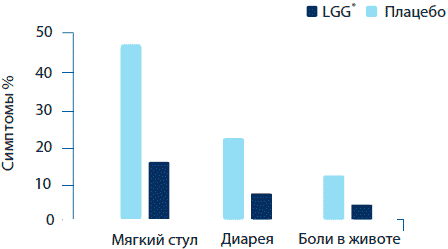
Другое исследование данной тематики было проведено в Финляндии среди детей, которым был прописан прием пероральных антибиотиков для лечения острых респираторных заболеваний (Arvola et al., 1999). Случайным образом отобранные участники получали либо одну капсулу плацебо (п=58), либо капсулу, содержащую L. rhamnosus GG (n=61), два раза в день (2x1010 КОЕ), при этом родители вели дневник симптомов, а также записывали частоту и консистенцию стула. В случаях заболевания диареей образцы стула были проанализированы на наличие аденовируса, ротавируса, каликвируса и астровируса, а также Salmonella, Shigella, Yersinia, Campylobacter, Clostridia difficile, Staphylococcus aureus и дрожжевых грибов. В течение двух недель антимикробного лечения эпизодичность диареи составляла 5% среди группы L. rhamnosus GG и 16% среди контрольной группы (р=0.05).
В небольшом исследовании среди взрослых добровольцев L. rhamnosus GG показал значительное снижение эпизодов диареи, вызванной эритромицином, а также в достаточной степени облегчил боли в животе (Siitonen et al., 1990). В данном исследовании добровольцы употребляли в пищу молочные продукты с добавлением L. rhamnosus GG или йогурт-плацебо (постпастеризованный йогурт, не содержащий живых бактерий) утром и вечером, полчаса спустя после приема антибиотиков.
Armuzzi et al. изучали влияние L. rhamnosus GG на нарушение функции кишечника, вызванное противомикробным лечением H.pylori (2001). В пилотном исследовании (Armuzzi et al., 2001) 120 доброволь-цев-носителей Н. pylori (бессимптомных) были случайным образом разделены на группы, после чего была проведена интенсивная терапия с использованием пантопразола, кларитомицина и тинидазола в течение одной недели, или тот же самый режим, однако с добавлением L. rhamnosus GG (6х109 КОЕ/упаковка) и в течение двух недель. Прием L. rhamnosus GG осуществлялся спустя 2 часа после завтрака и ужина, в смеси с водой. Среди побочных эффектов вздутие, диарея и нарушение вкусовых ощущений были самыми распространенными в течение недели проведения интенсивной терапии и были существенно ниже в группе, принимавшей L. rhamnosus GG. Аналогичная схема наблюдалась и в последующий период. Общий подсчет переносимости лечения показал существенную положительную тенденцию в пользу L. rhamnosus GG (р=0.03).
В другом двойном-слепом, плацебо-контролируемом исследовании 60 здоровых добровольцев с бессимптомным носительством H.pylori были разделены на 2 группы случайным образом, одна из которых проходила одну неделю интенсивной терапии с добавлением в диету L. rhamnosus GG (6х109 КОЕ/упаковка) в течение двух недель или аналогичный режим, но с приемом плацебо (Armuzzi et al., 2001). Аналогично предыдущим результатам проявления диареи, тошноты и расстройства вкусовых ощущений оказались существенно ниже в группе L. rhamnosus GG в сравнении с группой плацебо (соотношение риска = 0.1,0.3 и 0.5 соответственно). Общий подсчет переносимости лечения показал существенную положительную тенденцию в пользу L. rhamnosus GG (р=0.04). По показателям эффективности терапии H.pylori среди групп разницы выявлено не было (в обоих испытаниях данный показатель составлял 80%), однако добавление L. rhamnosus GG способствовало улучшению переносимости антибиотиков. Исследование, проведенное по аналогичной схеме (Ceemoni et al., 2002), также выявило способность пробиотика к предотвращению диареи, вызванной приемом противомикробных препаратов (рисунок 8).
Рисунок 8. Эффективность L. rhamnosus GG в предотвращении диареи, связанной с лечением антибиотиками среди взрослых.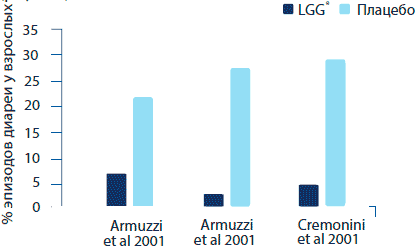
В другом исследовании, проведенном двойным слепым методом с использованием плацебо, 83 ребенка-носителя H.pylori были случайным образом распределены на группы с последующим проведением недельного курса интенсивной терапии с добавлением в диету L. rhamnosus GG или плацебо (Sjajewska et al., 2009). Как и в аналогичных исследованиях, показатели успешности интенсивной терапии в обеих группах были сходными, однако риск связанной с лечением антибиотиками диареи в группе L. rhamnosus GG был ниже, чем в контрольной группе (6% против 20%).
В двойном-слепом плацебо-контролируемом исследовании среди 267 помещенных в стационар взрослых, проходящих курс лечения пе-роральными или внутривенными антибиотиками от предполагаемых или обнаруженных инфекций (пневмония, инфекция мочеиспускательных путей и пиелонефрит) (Thomas et al., 2001), основными группами применявшихся антибиотиков были b-лактамы (цефалоспорины 60%, пенициллин 27%) и фторхинолоны (39%). Дважды в день участникам предлагалось принять капсулы L. rhamnosus GG (1x1010 КОЕ) или плацебо. Антибиотики широкого спектра, в особенности среди пациентов с нарушением работы иммунной системы, способны вызвать серьезный молочный ацидоз из-за кишечных лактобацилл, производящих молочную кислоту типа D. Lactobacillus rhamnosus GG выделяет молочную кислоту типа L, что было использовано при лечении одного из таких случаев (Gavazzi et al., 2001). Несмотря на то, что L. rhamnosus GG чувствителен к основным распространенным антибиотикам, он показал достаточную выживаемость в кишечнике при приеме антибиотиков среди большинства испытуемых. Выживаемость L. rhamnosus GG объясняется тем, что антибиотики и бактериальный препарат принимаются в разное время, а также за счет более низкой концентрации антибиотика в кишечнике, чем в кровотоке.
Суммируя приведенную выше информацию
Прием L. rhamnosus GG снижает такие побочные эффекты антимикробного лечения, как боли в животе, а так же клинически-доказанно предотвращает антибиотик-ассоциированную диарею. Антибиотик и пробиотик следует принимать в разное время.
3.2. Токсины в диете
Показано, что кишечная микрофлора способствует метаболизму вредных соединений, содержащихся в рационе человека, а также способна разрушать токсины. Афлатоксины являются группой структурно-схожих токсинов, выделяемых распространенным видом плесени Aspergillus flavus и A.nomius в теплой и влажной среде. Данные токсины являются факторами риска для развития гепатоцеллюлярного рака среди людей; риск особенно велик среди лиц, зараженных вирусом гепатита В. Афлаток-син перерабатывается в печени, а его метаболиты (например AFQ1, AFM1 и АРВ1-N(7)-гуанин) могут образовывать связи с гуанином в ДНК, что приводит к образованию мутаций и увеличенному риску образования опухолей (El-Nezami et al., 2006). AFB1 выделяются через молоко, мочу и экскременты. Среди молодых лиц мужского пола китайского происхождения самым распространенным метаболитом был AFQ1 (Mukkanen et al., 2005).
Опубликовано достаточно небольшое количество исследований, проводившихся среди людей, где бы измерялось связывание афлаток-сина. El-Nizami et al. (2006) изучали эффект 5-недельного воздействия L. rhamnosus GG на выделение AFB1-метаболитов среди лиц мужского пола китайского происхождения, подвергшихся воздействию AFB1. Группа ученых предположила, что связывание токсина AFB1 приведет к уменьшению содержания AFB1 -М(7)-гуанина в моче.
Эти результаты показывают, что токсичный эффект проявления афлатоксина в человеческом организме можно уменьшить введением пробиотических штаммов, которые эффективно связывают токсин.
Результаты показали, что лечение пробиотическими культурами увеличило соотношение образцов, отрицательных на пробу AFB1-N(7)— гуанина. Прием пробиотика также привел к статистически значимому снижению уровня АРВ1-N(7)-гуанина в моче (El-Nizami et al., 2006) (рисунок 9). Спустя пять недель после прекращения лечения разница между группами более не являлась значимой. Эти данные показывают, что токсичное влияние афлатоксина может быть снижено приемом пробиотиков, которые эффективно связывают яд, а также оказывают воздействие на метаболизм токсина в тканях человека.
Рисунок 9. Воздействие L. rhamnosus GG на выделение афлатоксина В1-М7-гуанин с мочой среди здоровых пациентов китайского происхождения (El-Nezami et al., 2006).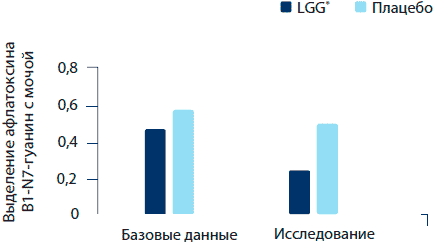
Кроме того, пробиотики также оказывают воздействие на энзимную активность в толстой кишке. Прием LGG® в экспериментальных исследованиях вызвал снижение активности канцерогенных и про-канцерогенных соединений, таких как бета-глюкозидаза, бета-глюку-ронидаза, нитроредуктаза, азо-редуктаза, уреаза и/или трипсин, в образцах фекалий (Goldin et al., 1992; Ling et at, 1992, 1994; Ouwehand et al., 2002; Suomalainen et al., 2008, Hattaka et al., 2008). Кроме того, LGG®, применяемые вместе с пребиотическим волокном (фруктоолигосахариды), показали снижение метаболизма канцерогенов в экспериментальных исследованиях через снижение генотоксичности фекальной жидкости и через регулирование иммунной реакции кишечника (Klinder et al., 2004; Rafter et al., 2007 Roller et al., 2007).
Суммируя приведенную выше информацию
Культура LGG® в исследованиях показала способность связывать токсичные соединения, такие как афлатоксин В1, который является одним из сильнейших белковых ядов, а также потенциальным канцерогеном. Кроме того LGG® в комплексе с фруктоолигосахаридами продемонстрировали эффект в отношении снижения активности других канцерогенных и про-канцерогенных соединений в кишечнике.
3.3. Запор
Считается, что молочнокислые бактерии способны облегчить состояние запора. В исследованиях, проведенных в Японии, ежедневное употребление молочных продуктов с добавлением L. rhamnosus GG увеличило частоту дефекаций и способствовало устранению дискомфорта, связанного с процессом дефекации при запоре. Была выявлена тенденция увеличения вязкости фекальных масс, а также снижение их кислотности и содержания аммиака (Hosoda et al., 1994,1998).
Тем не менее молочные продукты с добавлением L. rhamnosus GG, слегка увеличивая вязкость стула, никак не повлияли на частоту дефекаций в случае здоровых добровольцев (Benno et al., 1996; Ling et al., 1992), a также не повлияли на время прохождения пищи через пищеварительный тракт среди участников, страдающих запором (Niemi et al., 2001). L. rhamnosus GG увеличил слабительный эффект пищевых волокон (фруктоолигосахариды), а также продемонстрировал тенденцию к снижению кишечного дискомфорта, связанного с их приемом (Niemi et al., 2001). Слабительный эффект фруктоолигосахаридов обеспечивается стимуляцией роста бактериальной массы, увеличивающих массу стула и умеренной задержкой жидкости в содержимом кишечника. За счет увеличения объема каловых масс происходит физиологическое воздействие на рецепторы и стимулирование моторно-эвакуаторной функции толстой кишки. Кроме того, увеличение активности кишечника также наблюдалось в исследовании влияния L. rhamnosus GG с применением лактулозы и без нее (Salminen et al., 1997).
3.4. Воспалительные заболевания кишечника
Существует несколько хронических заболеваний кишечника с неизвестной этиологией, таких как болезнь Крона, неспецифический язвенный колит и дивертикулит. Вместе они образуют группу заболеваний, называемую воспалительными заболеваниями кишечника (ВЗК), проявления которых различаются, однако они имеют общие признаки в механизме патологического воздействия и клинического течения (Strober et al.,2007). В дополнение к генетическому происхождению и аутоиммунной природе заболеваний также обсуждается и роль кишечной микрофлоры в возбуждении и развитии данных заболеваний (Sartor et al., 2008). Считается, что ВЗК вызываются агрессивной аутоиммунной реакцией на бактерии, присутствующие в просвете, которая характеризуется цито-кинным паттерном типа Thl. Влияние L. rhamnosus GG изучалось в четырех различных исследованиях среди пациентов с болезнью Крона (Gubta et al., 2003; Prantera et al., 2002; Schultzet al., 2004; Bousvaros et al., 2005). В целом L. rhamnosus GG оказался недостаточно эффективен как в поддержании или продлении ремиссии, так и в предотвращении рецидива после хирургически вызванной ремиссии. Единственные положительные результаты были достигнуты в исследовании с участием детей, страдающих легкими или средней тяжести формами болезни Крона. Результаты данного пилотного открытого исследования показали значительное улучшение клинической активности, а также увеличение проходимости кишечника (Gubta et al., 2003).
L. rhamnosus GG показал предварительные положительные результаты в поддержании ремиссии среди больных дивертикулитом (Gosselink et al., 2004). Кроме того, результаты открытого пилотного исследования по терапии трудноизлечимых форм дивертикулита капсулами с L. rhamnosus GG с добавлением фруктоолигосахардов показывают положительное воздействие на успешность лечения при совместном применении с антибиотиками (Friedman et al.,2002). В другом исследовании, проводившемся среди 187 субъектов с неактивной формой неспецифического язвенного колита, участники были случайным образом разделены на группы, одна из которых принимала L. rhamnosus GG в течение одного года. В поддержании ремиссии среди страдающих данным заболеванием прием пробиотика показал эффективность, схожую с месала-зином (Zocco et al.,2006).
В заключение
L. rhamnosus GG (LGG®) показал интересные предварительные результаты в поддержании ремиссии у пациентов, страдающих неспецифическим язвенным колитом, однако для их подтверждения требуется проведение дополнительных клинических исследований.
Предыдущая глава | Оглавление | Следующая глава
Комментарии
ПРАКТИКА ПЕДИАТРА
