Мальтофер. Препарат следующего поколения: Токсикологические и фармакологические свойства препарата Мальтофер
СтатьиПредыдущий раздел | Оглавление | Следующий раздел
Токсикологические и фармакологические свойства препарата Мальтофер ®
3.1. Токсикология
Фармакологические свойства и потенциальная токсичность ГПК отличаются от таковых широко используемого железосодержащего соединения сульфата железа (II). Препараты сульфата железа, как известно, довольно часто вызывают дозозависимые побочные реакции, такие как желудочно-кишечные расстройства и изменение окраски эмали зубов.
Практическое отсутствие токсичности у ГПК объясняется тем, что вместо пассивной диффузии, происходит активный транспорт ионов железа и конкурентный обмен лигандами, уровень которых определяет скорость процесса абсорбции железа, при отсутствии в любой момент свободных ионов железа (см. Рис. 3-10).
В противоположность этому, у лиц с нормальным содержанием железа или даже при его избытке в организме происходит всасывание железа из его простых солей. Пассивная диффузия свободных ионов железа может вызывать побочные реакции или интоксикацию, особенно в тех случаях, когда препарат принимается несколько раз в день. Это происходит оттого, что транспортная система активного насыщения может оказаться переполненной и свободные ионы железа получают возможность проникать в кровоток. (Geisser и Mueller, 1987).
Приведенные ниже исследования демонстрируют хорошую переносимость ГПК и отсутствие токсических реакций. Дополнительные данные о терапевтической безопасности ГПК представлены в следующей главе.
3.1.1. Острая токсичность
Острая токсичность ГПК очень низкая; она примерно в 10 раз меньше, чем у сульфата железа.
При пероральном введении мышам или крысам, значения LD50 у препарата Мальтофер® (ГПК) составляет более 2.000 мг/кг массы тела. Вследствие необходимости большого объема исследуемого раствора, и в связи с тем, что ГПК практически нетоксичен, дальнейших испытаний более высоких доз препарата не проводилось (см. Рис. 3-1).
Рисунок 3-1
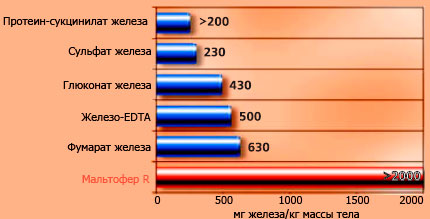
Токсичность препаратов железа при приеме внутрь. Сравнительная таблица токсичности LD50 различных препаратов железа при пероральном введении белым мышам (Geisser с соавторами, 1992; Forster с соавторами, 1993).
Geisser с соавторами (1992) проанализировал токсические эффекты нескольких препаратов железа (Fe-Ma: Мальтофер® ; Fe-DiSoCi: комплекс декстрин железа/сорбитол/лимонная кислота; Fe-SuGl: комплекс сахароза железа/глюконовая кислота; Fe-AA: железо аскорбиновая кислота/аллоксановая кислота; Fe-ChS: хондроитинсульфат железа) путем гистопатологического исследования печени, почек, надпочечников, легких и селезенки после внутривенного введения 200 мг тестируемого препарата на кг массы тела мыши. После введения препарата Мальтофер® было обнаружено несколько очагов некроза в ткани печени через 4 и 14 дней (спустя 14 дней наблюдалась фаза регенерации). Эти изменения контрастировали с тяжелыми и обширными поражениями, наблюдаемыми при назначении других препаратов железа, таких как, например, аскорбинат железа. Однако, меньшие дозы этих препаратов, например, 100 мг Fe на кг массы тела, вызывали значительно менее выраженную некротизацию тканей или вообще их не повреждали (см. Рис. 4-20).
Необходимо отметить, что отложения железа, происходящего из ГПК, обнаруживалась, в основном, в РЭС, а не в паренхиме печени (см. Рис. 3-2). Этот факт отражает несомненное преимущество данного соединения, т.к. индуцируемое железом перекисное окисление липидов, происходящее только в паренхиме, не может быть вызвано данным препаратом. Таким образом, экспериментально, с помощью гистологических исследований, было подтверждено, что Мальтофер® не вызывает повреждений печени.
Рисунок 3-2
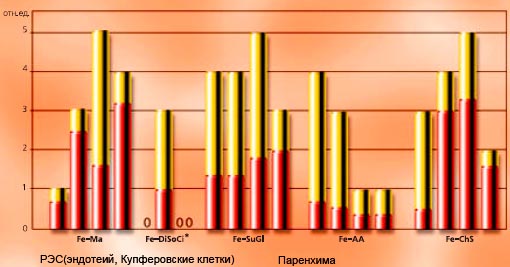
Распределение отложений железа. Гистологическая картина распределения отложений железа в срезах печени. Распределение указано в относительных единицах через 10 мин., 105 мин., 4 ч, и 14 дней (* соответствует 10 мин., 105 мин., 4 ч и 14 дням). Препарат железа клинически безопасен, когда отложения железа располагаются преимущественно в РЭС (Geisser с соавторами, 1992).
По результатам гистологических исследований, ГПК не оказывает повреждающего действия на ткани почек, надпочечников или легких. Однако, концентрация железа в этих органах выше по сравнению с комплексом декстрана железа, из-за более быстрой элиминации последнего с сывороткой и меньшей стабильности комплекса.
3.1.2. Субхроническая токсичность
При исследовании подострой токсичности (1 месяц) ГПК не оказывал отрицательного действия при введении внутрь крысам в дозе 2 мг (терапевтическая доза человека), 5 мг и 10 мг Fe на кг массы тела в день (Hausmann и Mueller, 1984).
3.1.3. Хроническая токсичность
Изучение хронической токсичности (6 месяцев) пероральных доз 2 мг (терапевтическая доза человека), 5 мг и 10 мг Fe/кг в день также проводились у крыс.
Ни одно из гематологических лабораторных исследований не выявило у экспериментальных животных признаков повреждения, которые могли бы быть отнесены за счет исследуемого вещества. Гематокрит, гемоглобин, количество эритроцитов и лейкоцитов оставались постоянными в течение контрольного времени (Hausmann и Mueller, 1984).
Гистопатологические исследования проводились у животных, которые получали 10 мг железа/кг в день и у всех контрольных животных. В желудочно-кишечном тракте не было обнаружено изменений слизистой или признаков эрозий, воспаления, язв или кровотечений. Только в селезенке были отмечены небольшие изменения. У крыс-самок наблюдались отложения железосодержащего пигмента (более выраженные и по размерам, и по числу). Это одинаково часто регистрировалось как у леченных, так и у не леченых групп животных.
3.1.4. Мутагенность
Не обнаружено мутагенной активности ГПК при проведении цитогенетических тестов in vitro. Мутагенный потенциал ГПК изучали в культуре лимфоцитов человека in vitro (Adams, 1996).
ГПК, независимо от дозы, не вызывал статистически значимого увеличения метафазных циклов, содержащих хромосомные аберрации, как в присутствии так и в отсутствии смеси S-9 по сравнению с контрольным раствором.
Все вещества, составляющие группу положительного контроля, а именно митомицин С и циклофосфамид, индуцировали статистически значимое увеличение пропорции аберрантных клеток.
3.2. Фармакодинамика
В свете особых свойств ГПК, который является органическим комплексом Fe (III) и который, как ожидается, будет использоваться в качестве заместительной терапии при железодефицитной анемии, фармакологические исследования были спроектированы так, чтобы продемонстрировать этот эффект у животных с экспериментально вызванной железодефицитной анемией.
Kreuzer и Kirchgessner (1991)
У крыс определялись показатели роста, гематологические параметры и задержка железа в различных тканях организма и в шкуре. В эксперименте № 1 изучали особенности отложения железа во время роста и при адекватном поступлении железа 40 ppm (ppm=частиц на миллион). В эксперименте № 2, в течение 20 дней 30 крыс получали диету с содержанием железа 3,6 ppm с добавлением 0,40 или 400 ppm Fe. Половине животных внутривенно ввели дополнительно 2,72 мг ГПК.
В обоих экспериментах, диеты, содержащие 40 ppm железа, давали возможность максимального роста и обеспечивали физиологический уровень гематологических параметров без увеличения отложения железа про запас. В эксперименте № 2, при отсутствии обеспечения железом в течение 20 дней, развивалась гипохромная микроцитарная железодефицитная анемия без заметного влияния на параметры роста. Диета с содержанием железа 40 ppm, обеспечивающая прием в общем 6,9 мг свободного железа в эксперименте № 2, была более эффективна при развившейся недостаточности железа, чем однократное внутривенное введение железа в дозе 2,72 мг. Избыточное пероральное или внутривенное поступление железа не влияло на гематологические параметры, за исключением уровня железа плазмы. В этих условиях, железо откладывалось про запас в типичных для него тканях и органах. Концентрация железа плазмы тесно коррелировала с содержанием железа в шкуре, печени, селезенке и бедренной кости, даже при избыточном поступлении железа извне.
Обнаружено, что при возрастании потребности в железе в связи с недостаточным его поступлением, отложения 59Fe увеличиваются практически во всех тканях, за исключением места инъекции.
Значительное снижение абсорбции железа наблюдалось во время назначения диеты, содержащей 400 ppm железа вследствие активации регуляторного механизма, препятствующего избыточному всасыванию железа. Диета, в состав которой входило 400 ppm ГПК, обеспечивала нормальный рост и поддерживала гематологические параметры на физиологическом уровне.
Вышеуказанные регуляторные механизмы характерны только для ГПК, а не сульфата железа. Иными словами, большие дозы простых солей железа могут быть токсичными из-за того, что нормально функционирующий в обычных условиях транспортный механизм уже не справляется, и свободные ионы железа проникают в кровоток после прохождения через барьер слизистой оболочки в линейной пропорции от введенной дозы.
Наличие ионизирующего или несвязанного железа в крови вызывает широкомасштабное нарушение функции клеток, включая повреждение гепатоцитов. Гибель клеток может происходить вследствие вмешательства перекисного окисления липидов в электронный транспорт. Менее выраженная токсичность проявляется в виде раздражения слизистой оболочки желудочно-кишечного тракта, приводящего к кровотечениям, и, в некоторых случаях, к слущиванию эпителия.
Было проведено несколько клинических исследований, которые представлены в следующей главе.
Предыдущий раздел | Оглавление | Следующий раздел
Комментарии
ПРАКТИКА ПЕДИАТРА
