Стратегия лечения пациентов с болью и соматической патологией
Статьи Опубликовано в журнале:CONSILIUM MEDICUM »» ТОМ 12 № 9, С. 111-114
А.В.Наумов, П.А.Семенов, А.Л.Верткин
ГОУ ВПО Московский государственный медико-стоматологический университет
Боль занимает лидирующие позиции по частоте обращений за медицинской помощью. Боль можно рассматривать и как самостоятельную болезнь, и как симптом. Однако очевидно, что боль сама по себе является целым каскадом патологических изменений как в остром периоде, так и в хронической форме.
Известно, что болевой синдром является причиной не только неприятных ощущений и эмоций (как следует из определения боли, IASP, 1992), но и сопровождается клинически значимым ответом практически со всех органов и систем организма. К примеру, болевой синдром, активируя симпатическую нервную систему, повышает число сердечных сокращений, артериальное давление, сердечный выброс, что в свою очередь провоцирует развитие ишемии миокарда. У больных с имеющейся кардиоваскулярной патологией это сопровождается дестабилизацией ишемической болезни сердца (ИБС), артериальной гипертензии (АГ) и т.д. Описаны случаи развития гипостатических и инфекционных пневмоний у пациентов с хроническим болевым синдромом, в первую очередь за счет снижения объема выдоха и жизненной емкости легких. Снижение венозного оттока и кровотока в конечностях при остром болевом синдроме является частой причиной тромбозов и тромбоэмболий. Симпатическая активация также способствует повышению активности мочевых сфинктеров, что является причиной острой задержки мочеиспускания при острых и хронических болевых синдромах.
Описанные выше ответы на болевой синдром со стороны систем организма в совокупности с долгосрочной «болевой памятью» мозга - основная причина хронизации боли, что является основополагающей проблемой обезболивания в соматической практике.
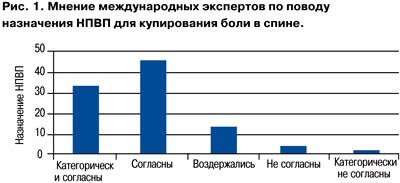
Исходя из практических рекомендаций по ведению хронической боли (An Updated Report by the American Society of Anesthesiologists Task Force on Chronic Pain Management and the American Society of Regional Anesthesia and Pain Medicine Anesthesiology 2010; 112: 81033), большинство международных экспертов считают необходимым назначение нестероидных противовоспалительных препаратов (НПВП) для купирования боли в спине (рис. 1).
Таким образом, выбор НПВП должен быть обдуманным и взвешенным, с оценкой соотношения риска и пользы конкретного препарата.
Следует отметить, что у пациентов с соматическими заболеваниями безопасность применения лекарственного препарата должна быть предпочтительным критерием выбора.
Однако анальгетическая активность не может оставаться в тени, поскольку адекватное обезболивание является решением проблемы хронизации и пролонгации как неприятных ощущений и эмоций, так и патологических изменений в системах организма.
Механизм обезболивающего эффекта НПВП обусловлен блокадой синтеза изоферментов циклооксигеназы (ЦОГ), в частности ЦОГ-2, которая ответственна за синтез провоспалительных цитокинов - триггерных факторов активации болевых рецепторов. Отметим, что блокада изофермента ЦОГ-1 большинством неселективных НПВП определяет сумму побочных эффектов этих препаратов. При этом, как правило, практический врач забывает, что блокада синтеза этого изофермента (ЦОГ-1) является причиной резкого снижения синтеза лейкотриенов, которые стимулируют синтез эндогенных опиоидов. Но отсутствие снижения концентрации динорфина и b-эндорфина в крови и тканях могло бы служить поводом к увеличению анальгетической активности. Из известных неселективных НПВП только лорноксикам шунтирует синтез арахидоновой кислоты до лейкотриенов без участия ЦОГ-1, что, соответственно, сохраняет синтез эндогенных опиоидов и повышает анальгетическую активность лорноксикама. Что и было доказано в большинстве рандомизированных клинических исследований (РКИ).
Метаанализ, включающий три исследования, проведенных на 673 пациентах, сравнивающий эффективность кеторолака, ацетилсалициловой кислоты и лорноксикама, продемонстрировал, что для всех доз лорноксикама, превышающих 2 мг, доверительный интервал не включал нулевую величину. Полученные данные свидетельствуют о том, что дозы, равные или превышающие 4 мг, являются достоверно более эффективными при обезболивающем лечении, чем плацебо. Эффективность ацетилсалициловой кислоты 1650 мг соответствует эффективности 4 мг лорноксикама, а эффективность кеторолака 10 мг аналогична эффективности лорноксикама при величине дозы между 8 и 16 мг.
Сопоставимую анальгетическую активность лорноксикам продемонстрировал и с наркотическими анальгетиками в исследованиях, моделью острой боли в которых явились болевые синдромы после удаления моляров.
Описанная в литературе индивидуальная чувствительность к разным НПВП зачастую определяет в РКИ результативную эффективность препарата. Индивидуальная чувствительность определяется влиянием полиморфизма цитохрома Р-450 на фармакокинетику препарата. Так, для метамизола натрия зарегистрировано лишь 2-4% «нечувствительных» пациентов, для диклофенака натрия до 25%.
В исследовании, оценивающем влияние полиморфизма Р-450 на фармакокинетику лорноксикама, было обнаружено, что кинетика лорноксикама и 5'-гидроксилорноксикама одинакова как у лиц, медленно метаболизирующих спартеин/дебризохин или мефенитоин, так и у лиц, быстро метаболизирующих эти вещества, что снижает процент не чувствительных к лорноксикаму пациентов до 2%.
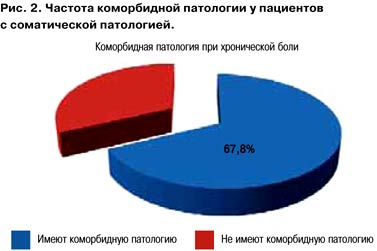
Чем же можно определить сегодня безопасность терапии? Естественный клинический ответ будет лежать в области коморбидности пациентов. Это неслучайно. При собственном многоцентровом анализе пациентов, страдающих хроническим болевым синдромом (n=950), установлено, что 67,8% пациентов имеют сочетанную соматическую патологию (рис. 2).
Литература, посвященная болевым синдромам, сегодня позиционирует боль не как симптом, а как болезнь, требующую комплексного подхода к ведению пациентов. Неслучайно в англоязычной медицинской литературе термин treatment (лечение) заменен на management (ведение) of acute pain (острой боли).
В условиях коморбидности этот вопрос приобретает иную актуальность в связи c изменением профиля безопасности лекарств при сочетании нескольких заболеваний и полипрагмазии.
К примеру, риск поражения слизистой оболочки гастродуоденальной зоны (в том числе и НПВП-гастропатия) имеет место у большинства пациентов отделений неотложной кардиологии, госпитализированных в многопрофильный стационар скорой медицинской помощи.
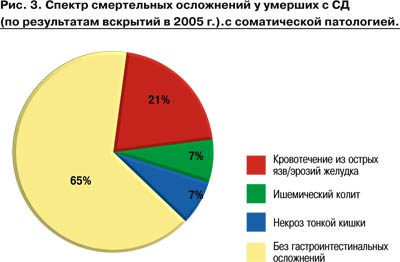
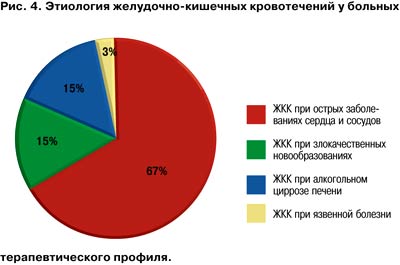
Например, желудочно-кишечные кровотечения (ЖКК) составляют около 20% (рис. 3, 4) среди всех смертельных осложнений - непосредственных причин летального исхода пациентов с сахарным диабетом (СД).
Кроме того, на практике эти больные нередко не получают адекватного лечения АГ и СД, не имеют доступа к оперативной реваскуляризации сердца.
Повсеместно риск ЖКК у этих пациентов не стратифицируется, и они не получают адекватной антисекреторной терапии ни в целях профилактики желудочных кровотечений в амбулаторных условиях, ни на фоне обострения ИБС в стационаре. В этих условиях активная и профилактическая антиагрегантная терапия при остром коронарном синдроме также является рискованной.
Таким образом, одной из основных задач ведения болевого синдрома является сокращение доз и сроков назначения НПВП.
Наиболее перспективными направлениями в лечении боли следует считать применение средств, действие которых затрагивает и патогенетические механизмы, и клинические проявления.
Понятно, что речь идет о других лекарственных препаратах, которые потенциально могли бы также обладать анальгетическим потенциалом и их клиническая эффективность была бы связана c ключевыми звеньями патогенеза.
Поскольку подобной направленностью действия обладают нейротропные витамины группы B, препаратами выбора для лечения боли разного генеза можно считать именно их. Традиционно к нейротропным относят три витамина группы B: тиамин (B1), пиридоксин (В6), цианокобаламин (B12). Объединяет их высокая значимость для нормального функционирования нервной ткани.
К примеру, тиамин в активной коферментной форме представляет собой тиаминпирофосфат или кокарбоксилазу и играет ключевую роль в энергетическом метаболизме, в частности в цикле Кребса. Дополнительно к функциям кофактора углеводного обмена тиамин является модулятором нейромышечной передачи, связываясь с n-холинергическими рецепторами. Опосредованно он участвует в метаболизме нейротрансмиттеров - серотонина и g-аминомасляной кислоты, которые играют важную роль в подавлении боли; участвует в обмене глютатиона, проявляя тем самым антиоксидантную активность. В нескольких исследованиях указано, что как комбинация, так и отдельное назначение витаминов B1, В6 и В12 обладает анальгетическим потенциалом. В экспериментальной работе по изучению эффектов комбинации витаминов В1, В6 и В12 при болях показано ингибирование ноцицептивных ответов, вызванных формальдегидом, не меняющееся после введения налоксона. Выдвинуто предположение, что антиноцицептивный эффект комбинированного витаминного комплекса может быть обусловлен ингибированием синтеза и/или блокированием действия воспалительных медиаторов. В другой работе показано, что комплекс витаминов группы В усиливает действие норадреналина и серотонина - главных «антиноцицептивных» нейромедиаторов. Пиридоксин (витамин В6) - групповое название трех производных пиримидина: пиридоксина, пиридоксаля и пиридоксамина. Активной формой В6 является пиридоксаль-5-фосфат (PLP) - важнейшая простатическая группа метаболизма аминокислот. PLP выступает в роли кофермента более чем в 100 ферментативных реакциях. Так, он служит кофактором для аминокислотных декарбоксилаз и трансаминаз, регулирующих белковый обмен, и тесно связан с процессами синтеза и разрушения катехоламинов, гистамина, дофамина, g-аминомасляной кислоты, превращения триптофана в никотиновую кислоту и серотонин. Пиридоксин является составной частью системы, отвечающей за синтез аминолевулиновой кислоты, первичного звена в синтезе веществ, составляющих гем. PLP влияет на процессы свертывания крови и агрегации тромбоцитов. Его действие связано с обменом холина и незаменимых ненасыщенных жирных кислот. Он непосредственно участвует в метаболизме белков, синтезе и транспортировке аминокислот, в обмене липидов, выработке энергии в организме; стимулирует синтез гемоглобина в эритроцитах; участвует в синтезе нейромедиаторов центральной и периферической нервной системы, а также в биосинтезе миелиновой оболочки нервов. Цианокобаламин (витамин В12) - комплексное соединение, имеющее в основе цикл коррина и содержащее координационно связанный ион кобальта. Витамин В12 играет важную роль в аминокислотном обмене, биосинтезе ацетилхолина, а также в процессах миелинизации нервных волокон. Известно, что высокие дозы цианокобаламина улучшают проведение возбуждения по периферическим нервам и их структурно-функциональную регенерацию.
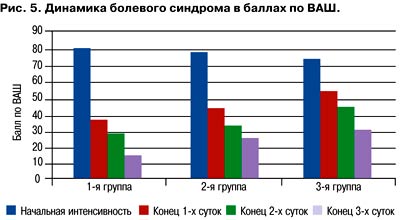
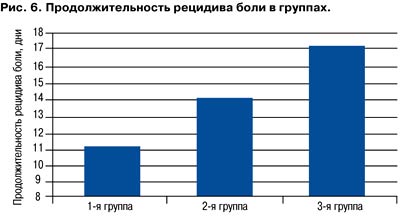
Цианокобаламин необходим для синтеза двух коферментов: метилкобаламина и 5-дезоксиаденозилцианокобаламина. Они принимают участие в двух типах реакций. Первой является реакция трансметилирования, в которой метилкобаламин выполняет роль промежуточного переносчика метильной группы (синтез метионина и ацетата). Синтез метионина происходит из гомоцистеина, поэтому недостаток В12 вызывает повышение уровня гомоцистеина. В основе второй группы реакций лежит перенос водорода и образование новой углеводородной связи: глутаматмутазная реакция (взаимопревращение глутаминовой и b-метиласпарагиновой кислот), реакция восстановления рибонуклеотидов до дезоксирибонуклеотидов, реакция синтеза липотропного фактора - холина (превращение метилмалоновой кислоты в янтарную, входящую в состав миелина), реакции дезаминирования и трансаминирования и др. Биологические свойства витамина В12 достаточно многообразны и изучены относительно подробно. Цианокобаламин оказывает гемопоэтическое, эритропоэтическое, противоанемическое, метаболическое действие; участвует в углеводном, белковом, липидном обмене; повышает регенерацию тканей; нормализует кроветворную функцию печени, функционирование нервной системы; регулирует свертывающую систему крови; снижает содержание холестерина и гомоцистеина в крови. Во многих исследованиях подчеркивается, что при лечении боли комбинация витаминов В1, В6 и В12 более эффективна, чем монотерапия каким-либо из них. Также продемонстрировано, что длительность терапии болевых вертебральных синдромов может быть уменьшена за счет применения комбинации витаминов В1, В6, В12 и НПВП вместо проведения монотерапии НПВП. Одной из актуальных лекарственных форм витаминов группы В является препарат Нейробион. Под нашим наблюдением находились 90 пациентов, которые обратились за медицинской помощью по поводу боли в нижней части спины. На основании проведенного дифференициального диагноза у всех пациентов были исключены такие причины боли в нижней части спины, как аневризма брюшного отдела аорты, остеопоротические переломы, метастатические поражения тел позвонков, инфекционные процессы и туберкулез. Ни у одного пациента не было выявлено грыжи межпозвоночного диска. Причиной боли в спине явились дегенеративно-дистрофические изменения позвоночника. Пациенты были рандомизированы на три группы по 30 пациентов в зависимости от назначенной терапии. Характеристика пациентов представлена в табл. 1. Как видно, из табл. 1, группы были сопоставимы по полу, возрасту и индексу массы тела (ИМТ). Видно, что все пациенты имели коморбидную соматическую патологию, что являлось ключевым для проведения нашего исследования. Статистически достоверной разницы между интенсивностью боли по визуальной аналоговой шкале (ВАШ) в момент обращения к врачу в группах не было. Во всех группах была констатирована хроническая боль, а настоящий рецидив боли - как минимум 4 в анамнезе. Фармакотерапия в группах представлена в табл. 2 В качестве оценки эффективности мы использовали оценку уровня интенсивности боли в момент обращения пациента и в конце 1, 2, 3-х суток терапии. Интенсивность боли оценивали по ВАШ. Также мы оценили продолжительность рецидива боли. Принималось к учету количество дней от начала боли до полного купирования. Во всех группах терапии к концу 1-х суток удалось достичь достоверного регресса болевого синдрома. К концу 3-х суток во всех группах отмечалась достоверная динамика нивелирования боли (рис. 5). Однако у пациентов 1-й группы уже к концу 1-х суток терапии интенсивность боли была достоверна меньше в сравнении c другими группами. Схожая тенденция сохранилась и к концу 3-х суток (р<0,05 в сравнении со 2 и 3-й группами). Оценивая время рецидива болевого синдрома мы также установили, что наименьшая его продолжительность была в 1-й группе (рис. 6), составив 11,4±2,3 дня, а в 3-й - 17,2±5,3 (р<0,05). Таким образом, наше наблюдение продемонстрировало, что включение препарата Нейробион в комплексную терапию пациентов c болью в нижней части спины приводит к более выраженному анальгетическому эффекту и сокращению длительности рецидива боли. Данная стратегия ведения пациентов позволит сократить время назначения НПВП, что сопровождается лучшим профилем безопасности купирования болевых синдромов.
Таблица 1. Характеристика пациентов
Характеристика
1-я группа, n=30
2-я группа, n=30
3-я группа, n=30
Средний возраст, годы
67,4±4,1
68,2±4,6
66,4±3,8
Пол, м/ж
13/17
11/19
12/18
ИМТ, кг/м
29,3±2,4
28,7±3,1
28,4±4,2
Формы ИБС
7 (23,3%)
5 (16,7%)
7 (23,3%)
АГ
100%
100%
100%
СД типа 2
12(40%)
10(33,3%)
8(26,7%)
Прочие
4(13,3%)
5(16,7%)
3(10%)
Таблица 2. Фармакотерапия в группах
Группа
Фармакотерапия
1-я
Лорноксикам: 1, 2, 3-и сутки - 16 мг внутримышечно, внутривенно;
далее - по потребности
Нейробион: 3 таблетки в день в течение 2 нед;
далее по 2 таблетке 2 раза в день на протяжении 2 нед 2-я
Лорноксикам: 1, 2, 3-и сутки - 16 мг;
далее - по потребности 3-я
Диклофенак натрия: 1, 2, 3-и сутки - 100 мг внутримышечно;
далее - по потребности