Ингибитор АПФ рамиприл снижает массу миокарда левого желудочка у больных артериальной гипертонией более эффективно, чем бета-блокатор атенолол. Результаты исследования RACE
Статьи Опубликовано в: "J. Hypertension", 1995г., №13, С. 1325-1334. A.Agabiti-Rosei, E.Ambrosioni, C. Dal Palu, M.Lorenza Muiesan, A.Zanchetti от имени исследователей RACEЦель. Сопоставить эффекты ингибитора ангиотензинпревращающего фермента (АПФ) рамиприла и бета-блокатора атенолола на регресс гипертрофии левого желудочка, АД и другие эхокардиографические показатели.
Дизайн. Использовали дизайн PROBE (проспективное рандомизированное открытое исследовании со слепым анализом конечных точек). Лечение рамиприлом или атенололом продолжали в течение 6 месяцев. Эхокардиографию проводили исходно и через 3 и 6 месяцев после начала лечения. Эхокардиограммы анализировались слепым методом в одном центре.
Методы. Для измерения толщины стенок и размеров левого желудочка использовали М-эхокардиографию под контролем двухмерного изображения. Массу миокарда рассчитали с помощью уравнения Penn.
Результаты. Количественный анализ эхокардиограмм был возможен у 111 из 196 больных, включенных в исследование в 16 центрах. Первичный анализ проводили в этой выборке. Дополнительно эхокардиограммы у 88 больных анализировали "в соответствие с протоколом" (в эту выборку включили пациентов с определенными исходными значениями массы миокарда левого желудочка). Систолическое и диастолическое АД значительно снизилось при лечении как рамиприлом, так и атенололом и существенно не отличалось между двумя группами. Частота сердечных сокращений значительно уменьшилась только в группе атенолола. Результаты первичного анализа и анализа, проведенного "в соответствие с протоколом", показали, что только рамиприл достоверно снижал массу левого желудочка. С помощью многофакторного анализа было подтверждено, что рамиприл вызывает значительно большее снижение массы миокарда левого желудочка, чем атенолол.
Заключение. Мы провели первое достаточно крупное исследование, в котором были прямо сопоставлены эффекты ингибитора АПФ и бета-блокатора на массу миокарда левого желудочка. Рамиприл превосходил атенолол по способности вызывать регресс гипертрофии левого желудочка у больных эссенциальной гипертонией.
Ключевые слова: регресс гипертрофии левого желудочка, ингибиторы АПФ, бета-блокаторы.
Введение
Гипертрофия левого желудочка — это один из фундаментальных механизмов адаптации сердца к повышенной нагрузке. При артериальной гипертонии гипертрофия левого желудочка первоначально является компенсаторным процессом, однако одновременно она представляет собой первый шаг к развитию сердечно-сосудистых осложнений, таких как застойная сердечная недостаточность [1], ишемическая болезнь сердца [2] и аритмии [3].
Фрамингемское исследование доказало, что гипертрофия левого желудочка, диагностированная с помощью ЭКГ или эхокардиографии, является неблагоприятным прогностическим признаком и независимым фактором риска развития сердечно-сосудистых заболеваний [4-7].
Эхокардиография — это информативный и воспроизводимый метод изучения анатомии и функции сердца. По чувствительности в диагностике гипертрофии левого желудочка она превосходит ЭКГ. Полагают (хотя это и не доказано), что регресс гипертрофии левого желудочка представляет собой благоприятный процесс [8]. Очевидно, что в обратное развитие гипертрофии миокарда могут вносить вклад не только гемодинамические, но и другие факторы [9-11]. Особое значение в этом отношении может иметь ренинангиотензиновая система [12,13].
При мета-анализах более 100 исследований более чем у 2000 больных было показано, что ингибиторы АПФ более эффективно уменьшают гипертрофию левого желудочка, чем другие антигипертензивные средства первой линии [12,13].
Однако большинство исследований, которые включали в мета-анализ, имели существенные ограничения. Многие из них были неконтролируемыми или нерандомизированными. Только немногие исследования обладали статистической силой, достаточной для подтверждения или исключения различий эффектов препаратов на гипертрофию левого желудочка [16,17]. Чтобы подтвердить, что антигипертензивные препараты определенного класса превосходят другие средства по влиянию на гипертрофию миокарда, необходимо было провести достаточно крупные плацебоконтролируемые или сравнительные исследования. Целью нашего исследования было сравнение эффектов ингибитора АПФ рамиприла и бета-блокатора атенолола на массу миокарда левого желудочка, которую оценивали с помощью эхокардиографии. Исследование было многоцентровым, однако анализ эхо-кардиографических изображений проводили централизованно. Дополнительными целями исследования служили сравнение переносимости двух антигипертензивных препаратов и их влияния на различные анатомические и функциональные эхокардиографические показатели.
Методы
При проведении исследования использовали дизайн PROBE (проспективное, рандомизированное, открытое исследование со слепым анализом конечных точек). Больных эссенциальной гипертонией рандомизировали на группы рамиприла (2,5-5 мг/сут внутрь) или атенолола (50-100 мг/сут внутрь). Эхокардиографические изображения анализировали слепым методом, что обеспечивало неискаженную оценку первичной конечной точки исследования (снижение массы миокарда левого желудочка под влиянием атенолола и/или рамиприла). Чтобы выявить различие динамики массы миокарда, равное 10%, в исследование следовало включить 120 пациентов (ошибка 0,05). В 16 центрах в него были включены 193 больных; у 111 из них оказался возможным количественный анализ эхокардиограмм.
Больные
В исследование включали больных в возрасте 25-70 лет с эссенциальной гипертонией, у которых диастолическое АД в положение сидя составляло 95-115 мм рт. ст. в конце 2-недельного периода плацебо и имелась гипертрофия левого желудочка (индекс массы миокарда более 98 г/м2 у женщин и более 120 г/м2 у мужчин), не сопровождавшаяся его дилатацией. Критериями исключения служили любые заболевания, способные помешать выполнению протокола, а также беременность, в том числе планируемая, или прием пероральных контрацептивов.
Предыдущую терапию у 102 больных (45 из группы рамиприла и 57 из группы атенолола) отменяли за 4 недели до исследования. В группе рамиприла 16 больных ранее получали ингибитор АПФ, 13 — антагонист кальция, 4 — бета-блокатор, 6 — диуретик и 6 — симпатолитический препарат центрального действия. В группе атенолола 22 пациента получали ингибиторы АПФ, 10 — антагонист кальция, 8 — бета-блокатор, 8 — диуретик и 9 — симпатолитические препараты центрального действия.
Протокол лечения
Во время 2-недельного вводного периода больные принимали плацебо один раз в день утром. Пациентов, которые соответствовали критериям отбора в конце вводного периода, распределяли на группы рамиприла и атенолола. Лечение рамиприлом начинали с дозы 2,5 мг один раз в день, атенололом — с дозы 50 мг один раз в день. Если диастолическое АД оставалось выше 90 мм рт. ст., то через 2 недели дозы удваивали. Еще через 2 недели при неадекватном контроле АД к лечению добавляли диуретик (фуросемид или гидрохлортиазид в дозе 25 мг один раз в день).
Измерения
Все измерения проводили утром вскоре после приема препарата. Тщательное обследование, включавшее в себя измерение АД и частоты сердечных сокращений (ЧСС) и оценку побочных эффектов, проводили в конце вводного периода, через 2 и 4 недели и 2 и 6 месяцев после начала лечения. Перед началом лечения и через 3 и 6 месяцев выполняли общий и биохимический анализы крови и регистрировали ЭКГ. АД измеряли с помощью ртутного сфигмоманометра (для оценки диастолического АД использовали Vфазу Короткова) после 10-минутного отдыха в положении сидя в тихом помещении. Фиксировали среднее значение. Кроме того, АД измеряли в положении лежа перед эхокардиографией. ЧСС определяли по частоте пульса на лучевой артерии в течение 30 с.
Эхокардиография
М-эхокардиограмму записывали на бумагу со скоростью 100 мм/с под контролем двухмерного изображения. Использовали следующее оборудование: Hewlett Packard Sonos 1000, Toshiba SG65A, ATL Ultra-mark 9, Aloka 870 SSD. В каждом центре эхокардиографию проводил один и тот же исследователь. Для стандартизации исследования все они получали подробные письменные инструкции.
Всех больных обследовали утром в положении на левом боку в конце выдоха после по крайней мере 30-минутного отдыха (в положении лежа). Все эхокардиографические изображения кодировали без указания проводимого лечения. Эхокардиограммы отсылали в случайном порядке в центр, где их анализировали слепым методом два исследователя. Они рассчитывали средние показатели на основании изучения по крайней мере 5 сердечных циклов. Размер левого желудочка, толщину межжелудочковой перегородки и задней стенки левого желудочка измеряли в соответствии с рекомендациями Американского общества эхокардиографии [18]. Рассчитывали отношение толщины задней стенки левого желудочка к половине его размера [19], которое считают чувствительным показателем геометрического типа гипертрофии [20]. Гипертрофию левого желудочка считали концентрической, если этот показатель был повышен (<0,45), и эксцентрической, если он был нормальным. Массу миокарда левого желудочка (ММЛЖ), индекс массы миокарда левого желудочка (ИММЛЖ), степень укорочения его размера и конечное систолическое напряжение рассчитали по следующим формулам:
ММЛЖ=1,04 [(КДР + ТМЖП + ТЗСЛЖ)3 - КДР3] - 13,6

где КДР — конечный диастолический размер левого желудочка, КСР — конечный систолический размер левого желудочка, ТМЖП — толщина межжелудочковой перегородки, ТЗСЛЖ — толщина задней стенки левого желудочка, САД — систолическое АД, ТЗСЛЖс — толщина задней стенки левого желудочка в систолу.
Интраиндивидуальная (отношение различия двух измерений к первому результату) и межиндивидуальная (отношение различия измерений, выполненных двумя исследователями, к величине, полученной первым из них) вариабельность результатов измерения массы миокарда левого желудочка составила 8,1 и 9,3% соответственно.
Статистический анализ
Статистический анализ проводили с помощью программы SPSS 4.0.3. Эффекты антигипертензивной терапии оценивали с помощью анализа вариации. Попарные сравнения проводили с помощью критерия t Стьюдента с поправкой Бонферрони. Непараметрические показатели анализировали с помощью методов Кокран или Фридмана, а для сравнения двух групп использовали методы МакНамара или Манна-Уитни.
Описательные характеристики анализировали с помощью критерия хи-квадрат, а дихотомные показатели — с помощью точного метода Фишера и/или Mantel-Haenszel. Различия считали статистически значимыми при р<0,05. Данные приведены в виде М±m, если не указано иное.
Результаты
Больные
В исследование были включены 193 больных. Они были рандомизированы на группы рамиприла (n=97; 57 мужчин и 40 женщин; возраст 53±1 год) и атенолола (n=96; 58 мужчин и 38 женщин; возраст 55±0,9 лет).
У 10 больных в каждой группе нельзя было оценить эффективность антигипертензивной терапии. В группе рамиприла лечение прекратили 10 больных (нежелательные явления у 4, отсутствие эффекта у 3, отказ от участия у 3), в группе атенолола — 10 пациентов (нежелательные явления у 5, сопутствующее заболевание у 1, отказ от участия у 4).
Качество эхокардиографических изображение не позволяло провести количественный анализ у 62 больных (у 31 в группе рамиприла и 31 в группе атенолола). Таким образом, в начале и в конце исследования эхокардиограммы анализировали у 111 больных (56 в группе рамиприла и 55 в группе атенолола). В первичный анализ включили всех этих 111 пациентов. Однако у 16 больных исходная масса миокарда левого желудочка была более чем на 10% ниже заранее выбранного показателя (у 8 в группе рамиприла и у 8 в группе атенолола), а у 7 больных размер левого желудочка превышал 60 мм (у 4 в группе рамиприла и у 3 в группе атенолола). Следовательно, в соответствие с протоколом анализ эхо кардиограмм провели у 88 больных, в том числе у 44 в группе рамиприла (24 мужчины и 20 женщин) и у 44 в группе атенолола (23 мужчины и 21 женщина).
Препараты в низкой дозе, в высокой дозе и в высокой дозе в сочетании с диуретиком получали соответственно 34, 39 и 27% больных группы рамиприла и 28, 47 и 25% больных группы атенолола.
Характеристики больных приведены в табл. 1-3.
Таблица 1. Характеристики больных в начале исследования, М±m
| Рамиприл (n=97) |
Атенолол (n=96) |
|
|---|---|---|
| Пол (мужчины/женщины) | 57/40 | 58/38 |
| Возраст (лет) | 53±1 | 54,7±0,9 |
| Диапазон возраста (лет) | 31-70 | 27-69 |
| Масса тела (кг) | 73±1,2 | 73,7±1,1 |
| Рост (см) | 167,3±0,9 | 167,7±0,8 |
| Длительность гипертонии (мес) | 58±6,2 | 59,4±5,9 |
| Не курят/курят | 75/22 | 70/26 |
| ЧСС (уд./мин) | 72,7±0,9 | 76,7±0,9 |
| Систолическое АД (мм рт. ст.) | 162,6±1,4 | 164,8±1,4 |
| Диастолическое АД (мм рт. ст.) | 102,9±0,5 | 103,5±0,6 |
| Выбыли из исследования (n(%)) | 10/97(10,3) | 10/96(10,4) |
Таблица 2. Характеристики больных, вкюченные в первичный анализ, М±m
| Рамиприл (n=56) |
Атенолол (n=55) |
|
|---|---|---|
| Пол (мужчины/женщины) | 33/23 | 33/22 |
| Возраст (лет) | 51,7±1,3 | 53,8±1,2 |
| Диапазон возраста (лет) | 31-69 | 27-69 |
| Масса тела (кг) | 72,5±1,3 | 73,9±1,5 |
| Рост (см) | 167,5±1,02 | 167±0,95 |
| Длительность гипертонии (мес) | 60,2±8,7 | 65,1±8,3 |
| Не курят/курят | 44/12 | 39/16 |
| ЧСС (уд./мин) | 71,5±1,1 | 74,3±1,3 |
| Систолическое АД (мм рт. ст.) | 160,9±1,6 | 165,2±1,8 |
| Диастолическое АД (мм рт. ст.) | 102,9±0,6 | 103,9±0,8 |
| ИММЛЖ (г/м2) | 134,8±6,4 | 132,3±4,2 |
Таблица 3. Характеристики больных, включенных в анализ, который проводили "в соответствии с протоколом", М±m
| Рамиприл (n=44) |
Атенолол (n=44) |
|
|---|---|---|
| Пол (мужчины/женщины) | 24/20 | 23/21 |
| Возраст (лет) | 51,2±1,5 | 54,8±1,3 |
| Диапазон возраста (лет) | 31-69 | 27-69 |
| Масса тела (кг) | 71,8±1,5 | 74,3±1,9 |
| Рост (см) | 167,1±1,1 | 166,4±1,1 |
| Длительность гипертонии (мес) | 66,3±10,3 | 68,6±9,5 |
| Не курят/курят | 33/11 | 33/11 |
| ЧСС (уд./мин) | 70,8±1,3 | 73,1±1,4 |
| Систолическое АД (ммрт. ст.) | 161,7±1,0 | 164,7±1,8 |
| Диастолическое АД (ммрт. ст.) | 102,9±0,7 | 103,0±0,8 |
| ИММЛЖ (г/м2) | 135,5±4,2 | 139±3,8 |
Изменения во время лечения
АД и ЧСС
У всех рандомизированных больных, продолжавших лечение, САД и ДАД значительно снизились при лечении как рамиприлом (p<0,001), так и атенололом (p<0,001); статистически значимого различия между двумя группами не выявили (рис. 1). Систолическое АД через 6 месяцев снизилось на 12% в обеих группах (со 162,6±1,4 до 143±1,4 мм рт.ст. в группе рамиприла и со 164,8±1,4 до 145,7±1,1 ммрт.ст. в группе атенолола), а диастолическое АД - на 15% в группе рамиприла(со 102,9±0,5 до 87,5±0,6 мм рт. ст.) и на 16% в группе атенолола (со 103,5±0,6 до 87,2±0,5 ммрт. ст.). ЧСС значительно снизилась (с 76±0,9 до 62,5±0,8 в минуту) только в группе атенолола (на 16%; p<0,001) (рис. 1). Динамика АД и ЧСС была сопоставимой в подгруппах больных, у которых проводили первичный анализ эхокардиограмм и анализ "в соответствие с протоколом" (табл. 4).
Таблица 4. Средние изменения АД, ЧСС, степени укорочения размера левого желудочка и конечного систолического напряжения (М±m)
| Рамиприл | Атенолол | |||||
|---|---|---|---|---|---|---|
| Исходно | 3мес | 6 мес | Исходно | 3мес | 6 мес | |
| Первичный анализ | ||||||
| АД, мм рт. ст. | 161/103±2/1 | 142/87±2/1 | 140/86±2/1* | 165/104/+2/1 | 144/86±1/1* | 144/86±1/1* |
| ЧСС, уд./мин | 72±1 | ±171 | ±171 | 74±1 | 62±1 | 61±1* |
| Степень укорочения, % | 40±1 | 40±1 | 39±1 | 40±1 | 40±1 | 40±1 |
| Систолическое напряжение, 103 дин/см2 | 62,1±2,5 | 55,4±2,3 | 55,5±2,8 | 61,2±2,9 | 56,3±2,2 | 57,3±2,5 |
| Анализ "в соответствие с протоколом" | ||||||
| АД, мм рт. ст. | 162/103±2/1 | 143/87±2/1 | 141/86±2/1* | 165/103+2/1 | 144/86±1/1* | 144/86±1/1* |
| ЧСС, уд./мин | 71±1 | 71±1 | 69±1 | 73±1 | 62±1 | 61±1* |
| Степень укорочения, % | 41±1 | 40±1 | 39±1 | 40±1 | 41±1 | 40±1 |
| Систолическое напряжение, 103 дин/см2 | 61,5±2,9 | 56,9±2,6 | 58.8±3,1 | 61,1±2 | 56,6±1,9 | 58,2±2,1 |
Побочные эффекты
Нежелательные эффекты наблюдались у 6 из 97 (6,2%) больных группы рамиприла и 8 из 96 больных (8,3%) больных группы атенолола. Основным побочным эффектом рамиприла был кашель, а атенолола — покалывание, снижение либидо и ночные кошмары. Из-за нежелательных явлений лечение было прекращено у 4 больных группы рамиприла и 5 больных группы атенолола.
Структура левого желудочка: первичный анализ
Масса миокарда левого желудочка значительно уменьшилась при лечении рамиприлом (анализ вариации: p<0,001), но не атенололом. Степень ее снижения в группе рамиприла составила 3% через 3 мес (с 245,6±11,7 до 239,± 13,3 г) и 11% через 6 мес (206,5±8,6 г), а в группе атенолола — 4% через 3 мес (с 243,2±8,7 до 232,0±8,8 г) и 3% через 6 мес (237,1±8,4 г). Сходные результаты были получены при анализе индекса массы левого желудочка. При лечении рамиприлом он снизился на 2% через 3 мес (со 134,8±6,4 до 131,8±7,3 г/м2) и на 10% через 6 мес (121,0±6,7 г/м2; p<0,001), а при лечении атенололом — на 4% через 3 мес (со 132,3±4,2 до 126,6±4,1 г/м2) и на 2% через 6 мес (129,7±4,1 г/с2). Изменения индекса массы левого желудочка изображены на рис. 2а (см. 2 стр. обложки).
Диастолический размер левого желудочка достоверно не изменился в обеих группах, хотя при лечении атенололом была отмечена тенденция к его увеличению (49,6±0,8 до 48,4±0,8 мм исходно и через 6 мес соответственно при лечении рамиприлом; 49,3±0,8 и 49,9±0,6 мм при лечении атенололом). Толщина межжелудочковой перегородки значительно снизилась только при лечении рамиприлом (анализ вариации: p<0,001; с 12,1±0,3 до 11,5±0,3 мм через 6 мес), в то время как толщина задней стенки левого желудочка достоверно не изменилась при лечении как рамиприлом (10,8±0,3 и 10,3±0,3 мм исходно и через 6 мес соответственно), так и атенололом (10,8±0,2 и 10,4±0,2 мм). Относительная толщина задней стенки несколько снизилась при лечении рамиприлом (с 0,44±0,01 до 0,43±0,01 через 6 мес) и атенололом (с 0,45±0,01 до 0,43±0,01), однако эти изменения не достигли статистической значимости.
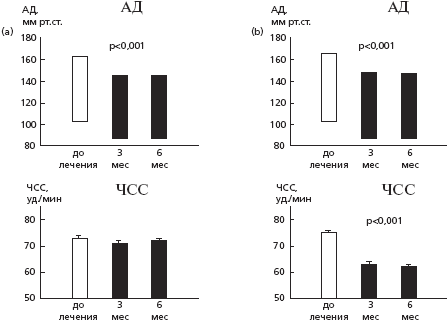
Рис. 1. Изменения АД и ЧСС при лечении
(a) рамиприлом (n=87) и(b) атенололом (n=86) (анализ ANOVA).
Структура левого желудочка: анализ "в соответствие с протоколом"
При анализе эхо кардиограмм, выполненном "в соответствие с протоколом", выявили снижение массы и индекса массы левого желудочка при лечении рамиприлом (p<0,001), но не атенололом. В группе рамиприла наблюдалось нарастающее уменьшение массы миокарда левого желудочка через 3 и 6 мес (с 246,3±9,4 до 234,3±11,3 г, или на 5%, через 3 мес и до 211,3±9,1 г, или на 14%, через 6 мес). Сходную динамику обнаружили при анализе индекса массы миокарда (со 135,5±4,2 до 129,4±5,4 г/м2, или на 4,5%, через 3 мес и до 117±4,4 г/м2, или на 14%, через 6 мес).
Снижение массы миокарда левого желудочка через 3 мес при лечении атенололом было небольшим и статистически недостоверным; через 6 мес не было отмечено нарастания эффекта препарата (снижение массы миокарда левого желудочка с 255,9±4,2 до 243,2±9,8 г , или на 5%, через 3 мес и до 244,2±8,4 г, или на 5%, через 6 мес; снижение индекса массы миокарда со 139±3,8 до 132,5±4,4 г/м2, или на 4%, через 3 мес и до 133±7 г/м2, или на 4%, через 6 мес). Изменения индекса массы миокарда левого желудочка изображены на рис. 2b (см. 2 стр. обложки).При сравнении результатов лечения в двух группах с помощью многофакторного анализа с поправкой на значения массы миокарда и индекса массы миокарда левого желудочка до и после лечения было показано, что рамиприл вызывает значительно большее их уменьшение, чем атенолол (р=0,04). Более высокая эффективность рамиприла сохранялась в различных подгруппах больных, в том числе получавших и не получавших диуретики, а также пациентов в возрасте более и менее 60 лет (табл. 5). Толщина межжелудочковой перегородки и задней стенки левого желудочка значительно уменьшились при лечении рамиприлом (перегородка: с 12,3±0,3 до 12,2±0,3 мм, или на 1%, через 3 мес и до 11,5±0,3 мм, или на 7%, через 6 мес; анализ вариации p<0,02; задняя стенка: с 11±0,3 до 10,5±0,3 мм, или на 5%, через 3 мес и до 10,2±0,3 мм, или на 7%, через 6 мес; анализ вариации p<0,01), в то время как в группе атенолола выявили только достоверное уменьшение толщины задней стенки через 6 мес (перегородка: с 12,6±0,3 до 12,1±0,3 мм, или на 4%, через 3 мес и до 12,3±0,3 мм, или на 3%, через 6 мес; задняя стенка: с 11±0,2 до 10,9±0,2 мм, или на 1%, через 3 мес и до 10,4±0,2 мм, или на 5%, через 6 мес, анализ вариации p<0,03). Диастолический размер левого желудочка достоверно не изменился при лечении обоими препаратами, хотя была отмечена тенденция к небольшому его увеличению в группе атенолола (рамиприл: 49,3±0,7 и 48,3±0,7 мм исходно и через 6 мес соответственно; атенолол: 49,8±0,7 и 50,4±0,7 мм).
Таблица 5. Изменения ИММЛЖ (анализ "в соответствие с протоколом") в различных подгруппах больных (n=44), М±m
| Рамиприл | Атенолол | |||||||
|---|---|---|---|---|---|---|---|---|
| n | Исходно | 3 мес | 6 мес | n | Исходно | 3 мес | 6 мес | |
| Возраст ≤60 лет | 34 | 133±5 | 127±6 | 116±5** | 34 | 141±4 | 133±5 | 136±4 |
| Возраст>60 лет | 10 | 144±8 | 138±12 | 121±1* | 10 | 133±7 | 131±8 | 122±7 |
| С добавлением диуретика | 10 | 136±11 | 132±13 | 118±11* | 12 | 137±7 | 127±7 | 132±5 |
| Без диуретика | 34 | 135±5 | 129±6 | 117±5** | 32 | 140±5 | 135±5 | 134±6 |
В начале исследования у 21 (48%) больного группы рамиприла и 17 (39%) больных группы атенолола имелась концентрическая гипертрофия левого желудочка (относительная толщина стенки 0,45). Относительная толщина стенки через 6 мес снизилась с 0,45±0,01 до 0,43±0,02 в группе рамиприла и с 0,45±0,01 до 0,42±0,01 в группе атенолола.
Систолическая функция левого желудочка Степень укорочения размера левого желудочка существенно не изменилась в обеих группах. Средние значения этого показателя, а также систолическое напряжение, АД и ЧСС приведены в табл. 4.
Обсуждение
Настоящее исследование убедительно доказало, что ингибитор АПФ рамиприл превосходит бета-блокатор атенолол по способности вызывать регресс гипертрофии левого желудочка, которую оценивали с помощью эхокардиографии. Благоприятное влияние рамиприла на гипертрофию миокарда ранее было продемонстрировано в открытом несравнительном исследовании с помощью магнитно-резонансной томографии [22]. Недавно Lievre и соавт. [23] показали, что 6-месячная терапия рамиприлом в дозах 5 или 1,25 мг/сут уменьшает массу миокарда левого желудочка у больных артериальной гипертонией по сравнению с фуросемидом в дозе 20 мг/сут.
Эти данные в целом согласуются с результатами мета-анализа большого числа небольших исследований. Dahlof и соавт. [15] и Cruicksbank и соавт. [16] установили, что ингибиторы АПФ вызывают более выраженный регресс гипертрофии миокарда, чем другие антигипертензивные средства первой линии независимо от длительности лечения и степени снижения АД. Однако авторы указали, что их рассчеты основываются на результатах небольших (10-15 больных) нерандомизированных, открытых, неконтролируемых исследований и могут быть подвержены системной ошибке. Поэтому полученные результаты следует интерпретировать осторожно. В прошлом в нескольких исследованиях прямо сравнивали эффекты двух препаратов на массу миокарда левого желудочка, однако они в основном проводились у очень небольшого числа пациентов и, соответственно не обладали статистической силой, необходимой для выявления значимых различий массы миокарда или АД. Тем не менее, Dahlof и соавт. [24] в сравнительном исследовании у 28 больных показали, что эналаприл вызывает более выраженное уменьшение массы миокарда левого желудочка, чем диуретик гидрохлортиазид, однако в группе эналаприла было отмечено также несколько более значительное снижение АД, которое могло достичь достоверности при большем объеме выборки. Bielen и соавт. [25] не выявили различий между лизиноприлом и исрадипином у 32 больных, которых наблюдали в течение 1 года. Результаты мета-анализа [26] четырех рандомизированных сравнительных исследований свидетельствуют о том, что ингибиторы ренинангиотензиновой системы по влиянию на массу миокарда левого желудочка существенно не отличаются от антагонистов кальция.
В крупном многоцентровом исследовании TOMHS [27] у 819 больных с мягкой артериальной гипертонией проводили эхокариографию исходно и через 4 года после начала лечения. Всем пациентам назначали немедикаментозное лечение по отдельности или в комбинации с диуретиком, бета-блокатором, альфа-блокатором, ингибитором АПФ или антагонистом кальция в низких дозах. Немедикаментозная терапия оказалась очень эффективной и привела к значительному снижению АД и массы миокарда левого желудочка, что затрудняло оценку влияния антигипертензивных препаратов на состояние сердца. Только хлорталидон вызвал более выраженное снижение массы миокарда левого желудочка (на 7 г по сравнению с плацебо), в основном за счет уменьшения его объема.
Результаты настоящего проспективного, рандомизированного, слепого сравнительного исследования впервые прямо продемонстрировали более высокую эффективность ингибитора АПФ по сравнению с бета-блокатором. Хотя атенолол оказывал менее выраженное влияние на гипертрофию левого желудочка, чем бета-блокаторы в других несравнительных и нерандомизированных исследованиях [15], тем не менее, в группе атенолола было отмечено умеренное, но достоверное уменьшение толщины стенки левого желудочка.
Степень снижения массы левого желудочка при лечении атенололом в нашем исследовании была лишь ненамного меньше, чем в другом достаточно крупном рандомизированном, двойном слепом исследовании, в котором в течение 1 года сравнивали атенолол и диуретик [28]. В этом исследовании у 45 больных, получавших атенолол в течение 12 мес, было отмечено небольшое, но статистически значимое снижение массы миокарда на 6% и более выраженное уменьшение толщины задней стенки левого желудочка.
Можно предположить, что тенденция к увеличению размера левого желудочка при уменьшении частоты сердечных сокращений могла быть причиной отсутствия влияния атенолола на массу левого желудочка. Schulman и соавт. [29] у пожилых больных также не выявили регресса гипертрофии левого желудочка при лечении атенололом. Более высокая эффективность ингибитора АПФ рамиприла по сравнению с атенололом может объясняться различиями механизмов их влияния на массу миокарда левого желудочка.
Учитывая сопоставимое снижение систолического и диастолического АД при лечении двумя препаратами, представляется мало вероятным, что различия их эффектов на гипертрофию левого желудочка могли быть следствием неодинаковых механизмов антигипертензивного действия. Хотя мы не проводили суточное мониторирование АД, известно, что и рамиприл, и атенолол оказывают длительное действие и вызывают достаточно плавное снижение АД. Более вероятным объяснением представляется различие эффектов двух препаратов на гемодинамическую нагрузку. Ингибиторы АПФ, а также нитраты и антагонисты кальция повышают податливость крупных артерий, в то время как бета-блокаторы не оказывают на нее влияния [30]. Этот эффект при лечении рамиприлом, но не атенололом, мог привести к более значительному снижению центрального систолического АД и, соответственно, посленагрузки сердца несмотря на сопоставимое снижение периферического систолического АД в двух группах [31].
Многочисленные клинические и экспериментальные исследования свидетельствуют о том, что несколько негемодинамических факторов вносят вклад в развитие и регресс гипертрофии левого желудочка; на некоторые из них оказывают специфическое действие ингибиторы АПФ [10,32,33].
Ангиотензин II и катехоламины могут выступать в роли факторов роста, поэтому подавление синтеза ангиотензина II и снижение адренергической активности [34, 35] под влиянием ингибиторов АПФ может ингибировать рост сердечных миоцитов и вызвать обратное развитие интерстициального фиброза, наблюдающиеся при гипертрофии левого желудочка [36,37]. Данные Lievre и соавт. [23] согласуются с концепцией о том, что ингибиторы АПФ особенно эффективно вызывают регресс гипертрофии миокарда. Эти авторы обнаружили значительное снижение массы левого желудочка при 6-месячной терапии рамиприлом у больных артериальной гипертонией несмотря на недостоверные изменения АД. У больных артериальной гипертонией гипертрофия левого желудочка является независимым фактором риска сердечно-сосудистой заболеваемости и смертности. Соответственно, регресс гипертрофии миокарда или профилактика ее прогрессирования представляют собой важные цели антигипертензивной терапии. Однако клиническое значение уменьшения гипертрофии миокарда требует подтверждения. Предварительные результаты наблюдения 166 больных артериальной гипертонией в течение 5,5 лет [38] показали, что сердечно-сосудистые осложнения были зарегистрированы у 16% больных, у которых отмечалось нарастание массы миокарда при эхокардиографии, и только 6% больных, у которых она уменьшилась (p<0,05). Мы получили сходные результаты у 151 больного, которого наблюдали в течение 10 лет [39]. Для дальнейшей оценки прогностического значения обратного развития гипертрофии левого желудочка необходимы дополнительные клинические исследования с твердыми конечными точками. Однако непрямые данные свидетельствуют о том, что уменьшение массы миокарда устраняет патологические последствия гипертрофии левого желудочка. Например, систолическая и диастолическая функция сердца в покое и при нагрузке давлением не менялась или даже улучшалась [40-43]. При регрессе гипертрофии левого желудочка выявлено также значительное улучшение рефлекторного контроля циркуляции и ответа сердца на бета-адренергическую стимуляцию [44,45]. Предварительные данные продемонстрировали возможность уменьшения желудочковых аритмий и улучшения коронарного резерва [46-49].
Регресс гипертрофии левого желудочка считают одной из главных целей антигипертензивной терапии. Результаты настоящего исследования показали, что при прочих равных условиях ингибитор АПФ оказывает на нее более выраженное влияние, чем бета-блокатор.
Литература
1.Strauer BE: The Heart in Hypertension, Berlin: Springer; 1981.2. Strauer BE: Ventricular function and coronary hemodynamics in hypertensive heart disease. Am J Cardiol 1979, 44:999-1006.
3. McLenachan JM, Henderson E, Morris KL, Dargie HJ: Ventricular arrhythmias in patients with hypertensive LVH, N Engl J
Med 1987, 317:787-792.
4. Kannel WB, Gordon T, Offut T: Left ventricular hypertrophy by electrocardiogram. Prevalence, incidence and mortality in the Framing-ham study. Ann Intern Med 1969, 71:89-105.
5. Levy D: Left ventricular hypertrophy. Epidemiological insights from the Framingham Heart Study. Drugs 1988, 35 (suppl 5): 1-5.
6.Levy D, Garrison RJ, Savage DD et al.: Prognostic implications of echocardiographically determined left ventricular mass in the Framing-ham Heart Study. N Engl J Med 1990, 322:1561-1566.
7.Casale PN, Devereux RB, Milner M, Zullo C, Harshfield GA, Pickering TG, et al.: Value of echocardiographic left ventricular mass in predicting cardiovascular morbid events in hypertensive men. Ann Intern Med 1986; 105:173-178.
8. Zanchetti A: Goals of antihypertensive treatment; prevention of cardiovascular events and prevention of organ damage. Blood Press 1992; 1:201-211.
9. Frohlich ED; Tarazi RC: Is arterial pressure the sole factor responsible for hypertensive cardiac hypertrophy? Am J Cardiol 1979, 44:459-463.
10. Agabiti Rosei E, Muiesan ML: Reversal of cardiovascular structural changes during long-term antihypertenslve therapy. J Hum Hyper-tens 1991, 5 (suppl 1):41-47.
11. Schmieder RE, Messerli FH, Garavaglia GE, Nimez B, MacPhee AA, Re RN; Does the renin-angiotensin-aldosterone system modify cardiac structure and function in essential hypertension? Am J Med 1988, 84 (suppl 3А): 136-139.
12. Schelling P, Fisher H, Ganten D: Angiotensin and cell growth: a link to cardiovascular hypertrophy? J Hypertens 1991, 9:9-13.
13. Dzau VE, Prett R, Gibbons G, Shunkert H, Lorell B, Interlfinger J: Molecular mechanism of angiotensin in the regulation of vascular and cardiac growth. J Mol Cell Cardiol 1989, 21 (suppl II):S7.
14. Dahlof 8, Penned K, Hansson L: Reversal of left ventricular hypertrophy in hypertensive patients. A meta-analysis of 109 treatment studies. Am J Hypertens 1992, 5:95-110.
15. Cruickshank JM, Lewis J, Moore V, Dodd C: Reversibility of left ventricular hypertrophy by differing types of antihypertensive therapy. J Hum Hypertens 1992, 6:85-90.
16. Zanchetti A, Sleight P, BirkenhagerWH: Evaluation of organ damage in hypertension. High Blood Press 1993, 2 (suppl 1):93-105.
17. Agabiti Rosel E, Muiesan ML, Castellano M: Methodology of studies on reversal of left ventricular hypertrophy. High Blood Press 1993, 2 (suppl 1):11-13.
18. Devereux RB, Alonso DR, Lertas EM, Gottlieb GJ, Campo E, Sachs I, et al.: Echocardiographic assessment on left ventricular hypertrophy: comparison to necropsy findings. Am J Cardiol 1986, 57:450-458.
19. Reicheck N, Devereux RB: Reliable estimation of peak left ventricular systolic pressure by M-mode echographic-determined end-dias-tolic relative wall thickness: identification of severe valvular aortic stenosis in adult patients. Am Heart J 1982, 103:202-203.
20. Ganau A, Devereux RB, Roman MJ, De Simone G, Pickering TG, Saba PS, et al.: Patterns of left ventricular hypertrophy and geometric remodeling in essential hypertension. J Am Coll Cardiol 1992, 19:1550-1558.
21. Koren MJ, Devereux RB, Casale PN, Savage DD, Laragh JH: Relation of left ventricular mass and geometry to morbidity and mortality in uncomplicated essential hypertension. Ann Intern Med 1991, 114:345-352.
22. Elchstaedt H, Danne O, Langer M, Cordes M, Schubert C, Felix R, el al.: Regression of left ventricular hypertrophy under ramipril treatment investigated by nuclear magnetic resonance imaging. J Cardio-vasc Pharmacol 1998, 13 (suppl 3):75-80.
23. Llevre M, Gueret P, Gayet C, Roudaut R, Haugh M, Delair S, et al., on behalf of the HYCAR Study Group: Ramipril-induced regression of left ventricular hypertrophy in treated hypertensive individuals. Hypertension 1995, 25:92-96.
24. Dahlof B, Hannson L: The influence of antihypertensive therapy on the structural vascular amplifying mechanism in essential hypertension. Different effects of enalaprll and hydrochlorothiazide. J Hypertens 1992, 10:1513-1524.
25. Bielen EC, Fagard RH, Lijnen PJ, Tjandra-Maga TB, Verbesselt R, Amery AK: Comparison of the effects of isradlpine and lisinopril on left ventricular structure and function in essential hypertension. Am J Cardiol 1992, 69:1200-1206.
26. Fagard R, Lijnen P, Staessen J, Thijs L, Amery A: Mechanical and other factors relating to left ventricular hypertrophy. Blood Press 1994, 3 (suppl 1):5-10.
27. Otterstad JE, Froeland G, Wasenius Soeyland AK, Knutsen KM, Ekeli T: Changes in left ventricular dimensions and systolic function in 100 mildly hypertensive men during one year's treatment with atenolol vs hydrochlorothiazide and amiloride (Moduretic): a double blind, randomized study. J Intern Med 1992, 231:493-501.
28. Neaton JD, Grimm RH, Prineas RJ, Stamler J, Grandits СA, Emler P, et al., on behalf of the Treatment of Mild Hypertension Study Research Group: Treatment of Mild Hypertension Study. Final results. JAMA 1993, 270:713-724.
29. Schulman S, Weiss J, Becker L, Goltlieb S, Woodruff K, Weisfeldt M, et al.: The effects of antihypertensive therapy on left ventricular mass in elderly patients. N Eng J Med 1990, 322;19:1350-1356.
30. Safar M, London GM: Arterial and venous compliance in sustained essential hypertension. Hypertension 1987, 10:133-139.
31. O'Rourke M: Systolic blood pressure: arterial compliance and early wave reflection, and their modification by antihypertensive therapy. J Hum Hypertens 1989, 3:47-52.
32. Linz W, Scholkens ВA, Ganten D: Converting enzyme inhibition specifically prevents the development and Induces regression of cardiac hypertrophy in rats. Clin Exp Hypertens (A) 1989, 2:1325-1350.
33. Chien KR, Knowlton KU, Zhu H, Chien S: Regulation of cardiac gene expression during miocardial growth and hypertrophy: molecular studies of an adaptative physiologic response. FASEB J 1991, 5:3037-3046.
34. Dominiak P: Modulation of sympathetic control by ACE-Inhibitors. Eur Heart J 1993; 14 (suppl 1):169-172.
35. Castellano M, Rizzoni D, Beschi M, Bohm M, Porteri E, Bettoni G, et al.: Chronic ACE-inhibitor treatment and adrenergic mechanisms in spontaneously hypertensive rats. J Cardiovasc Pharmacol 1995, 26:381-387.
36. Scheider MD, Parker TG: Cardiac myocites as targets for the action of peptide growth factors. Circulation 1990, 81:1443-1456.
37. Smith SH, Kramer MF, Reis I, Bishop SPf Ingwall JS: Regional changes in creatine kinase and myocyte size in hypertensive and non hypertensive cardiac hypertrophy. Circ Res 1990, 67:1334-1344.
38. Koren MJ, Ulin RJ, Laragh JH, Devereux RB: Reduction of LVM during treatment of essential hypertension is associated with improved prognosis [abstract], Am J Hypertens 1991, 4:1.
39. Muiesan ML, Salvetti M, Rizzoni D, Castellano M, Donato F, Agabiti-Rosel E: Association of change in left ventricular mass with prognosis during long-term antihypertensive treatment, J Hypertens 1995, 13:1091-1095.
40. Mulesan ML, Agabiti Rosel E, Romanelli G, Alari G, Barbier P, Fiorentini C: Left ventricular systolic function in relation to withdrawal of different treatments in hypertensives with left ventricular hypertrophy. J Hypertens 1988, 6 (suppl 4):97S-1O0S.
41. Trimarco B, De Luca N, Ricclardelli B, Rosiello G, Volpe M, Con-dorelli G, et al.: Cardiac function in systemic hypertension before and after reversal of left ventricular hypertrophy. Am J Cardiol 1988, 62:745-750.
42. Schmieder RE, Messerli FH, Sturgill D, Garavaglia GE, Nunez BD: Cardiac performance after reduction of myocardial hypertrophy. Am J Med 1989, 87:22-27.
43. Muiesan ML, Agabiti Rosel E, Romanelli G, Beschi M, Castellano M, Alari G, et al.: improved left ventricular systolic and diastolic function after regression of cardiac hypertrophy, treatment withdrawal and revedelopment of hypertension. J Cardiovasc Pharmacol 1991, 17 (suppl 2):179s-181s.
44. Agabiti Rosei E, Romanelli G, Muiesan ML, Beschi M, Castellano M, Rizzoni D, Muiesan C: Impaired response of the hypertrophied left ventricle to beta adrenerglc stimulation in hypertensive patients [abstract]. Circulation 1984, 70 (suppl II):61.
45. Grassi G, Gianattasio C, Cleroux J, Cuspidi C, Sampieri L, Mancia G: Cardtopulmonary reflex before and after regression of left ventricular hypertrophy in essential hypertension. Hypertension 1986, 12:227-237.
46. Messerli FH, Nunez BD, Nunez MM, Garavaglia GE, Schnieder RE, Ventura HO: Hypertension and sudden death: disparate effects of calcium entry blocker and diuretic therapy on cardiac disrhythmias. Arch Intern Med 1989, 149:1263-1267.
47. Gonzales-Fernandez RA, Rivera M, Rodriguez P, Fernandez-Martinez J, Soltero L, Diaz L, etal.: Prevalence of ectopic ventricular activity after left ventricular mass regression. Am J Hypertens 1993, 6:308-313.
48. Muiesan ML, Zulli R, Rizzoni D, Calebich S, Malerba M, Porteri E, ef al.: Effect of changes in blood pressure and left ventricular mass induced by antihypertensive treatment on ventricular arrhythmias in essential hypertension. J Hypertens 1993, 11 (suppl 5):S104-S105.
49. Magrini F, Reggiani P, Roberts N, Meazza R, Ciulla M, Zanchetti A: Effects of angiotensin blockade on coronary circulation and coronary reserve. Am J Med 1988, 84:55-60.
Приложение:
центры-участники исследования RACEClinica Medica Generale e Terapia Medica, University of Milan, Milan (Professor A. Zanchetti, Dr С Cuspidi); Clinica Medica Generale, University of Milan, Ospedale Sacco, Milan (Professor A. Libretti, Dr R. Sega); Cardiology Division, INRCA, Casatenovo Brianza (Como) (Professor С. Mazzola, Dr С. Piemonti); Cardiology Division, Ospedale Civile, Voghera (Pavia) (Professor С. Pasotti, Dr A. Capra); Cardiology Division, Ospedale Santa Croce, Cuneo (Professor E. Uslenghi, Dr G. Ugliengo); Clinica Medica I, University of Padua, Padua (Professor C. Dal Palu, Professor A. Semplicini); Cardiology Division, Ospedale Civile, Cittadella (Padua) (Professor P. Maiolino, Dr A. Rossi); Cardiology Division, Ospedale Civile, Mirano (Padua) (Professor P. Pascotto, Dr D. D'Este); Cardiology Division, Ospedale Civile II, Piove di Sacco (Padua) (Professor C. Martines, Dr D. Marchese); Cardiology Division, Ospedale Civile, Pordenone (Professor D. Zanuttini, Dr D. Pavan); Cardiology Division, Ospedale Civile, Rovigo (Dr P. Zonzin, Dr R. Fioren-cis); Internal Medicine Division, Ospedale Santa Chiara, Trento (Professor R. Miori, Dr G, De Venuto); Cardiology Division, Ospedale Mag-giore, Bologna (Professor D. Brachetti, Dr U. De Castro, Dr A. Brunel-li); Cardiology Division, Ospedale Civile, Cento (Ferrara) (Dr A. Alboni, Dr F. Ippolito); Cardiology Division, Ospedale Santa Maria delle Croci, Ravenna (Professor G. Tumiotto, Dr S. Bosi, Dr C. Guadagni) and Cardiology Division, Ospedale Civile, USSL 45, Asola (Mantova) (Dr R. Agosta).
