akvion.ru
akvion.ru

Комбинированный препарат для повышения мужской фертильности
далее...
Больше информации на сайтах:
www.reproduction.info
www.plan-baby.ru
Эффективность применения комплекса сперотон при мужском факторе бесплодия
СтатьиОпубликовано в журнале:
« Урология», №3, 2018
А. В. Кузьменко, В. В. Кузьменко, Т. А. Гяургиев
ФГБОУ ВО «Воронежский государственный медицинский университет им. Н. Н. Бурденко», Воронеж, Россия
Введение. В настоящее время одним из принципов терапии инфертильности у мужчин служат коррекция окислительного стресса, восполнение витаминов, микроэлементов и низкомолекулярных пептидов, в связи с чем широкое применение нашли многокомпонентные биологически активные комплексы, одним из которых является Сперотон.
Цель исследования: оценка влияния комплекса Сперотон на функциональные характеристики сперматозоидов и фертильность мужчин с патозооспермией.
Материалы и методы. Нами были обследованы 60 мужчин с диагностированным мужским бесплодием на фоне различных нарушений сперматогенеза. Возраст от 25 до 40 лет. Пациенты были рандомизированы на 2 группы по 30 человек. В контрольной группе (КГ) проведена общая терапия. В основной группе (ОГ) в сочетании с общей терапией пациенты получали Сперотон. Обследование мужчин проведено в ходе четырех визитов. Оценивались показатели спермограммы в соответствии с критериями ВОЗ: концентрация, подвижность, количество сперматозоидов с нормальной морфологией, объем и время разжижения эякулята, уровень фруктозы и цинка, а также случаи наступления беременности у партнерши.
Результаты. Применение комплекса Сперотон позволило увеличить объем эякулята на 10%, концентрацию сперматозоидов — на 15,6%, уменьшить время разжижения на 32%. Доля сперматозоидов с поступательным движением (категории А+В) увеличилась в 2,6 раза за счет активизации сперматозоидов категории C. Это, на наш взгляд, может быть связано с изменением ферментного состава эякулята, что косвенно подтверждается повышением уровня фруктозы в 1,6 раза, а также увеличением количества цинка на 15% в биохимическом анализе спермы. Эффективность терапии, проведенной в ОГ пациентов, также подтверждается четырьмя случаями спонтанной беременности, которая наступила на фоне качественных изменений показателей спермы. Заключение. Таким образом, применение Сперотона позволяет повышать подвижность и концентрацию сперматозоидов у пациентов с мужским фактором бесплодия, а также увеличивать количество спонтанных беременностей у их партнеров.
Ключевые слова: мужское бесплодие, олигозооспермия, астенозооспермия, олигоастенозооспермия, Сперотон
Авторы заявляют об отсутствии конфликта интересов.
Для цитирования: Кузьменко А.В., Кузьменко В.В., Гяургиев ТА. Эффективность применения комплекса Сперотон при мужском факторе бесплодия. Урология. 2018;3:00-00.
The effectiveness of the speroton complex in the management of male factor infertility
A.V. Kuz’menko, V.V. Kuz’menko, T.A. Gyaurgiev
Voronezh State Medical University n. a. N.N. Burdenko, Voronezh, Russiа
Introduction. One of the principles of contemporary management of male infertility is a correction of oxidative stress, replenishment of vitamins, microelements and low molecular weight peptides, and therefore multicomponent biologically active complexes, one of which is the Speroton, are widely used.
Aim. To investigate the effect of the Speroton complex on the functional sperm characteristics and fertility of men with pathozoospermia.
Materials and methods. We examined 60 men aged from 25 to 40 years old with male infertility against the background of various spermatogenesis disorders. Patients were randomized into two groups of 30 people each. A control group (CG) underwent general therapy. In the study group (SG) patients received a combination of general therapy and Speroton. The study participants were subsequently examined at four study visits. The parameters of the spermogram were assessed according to WHO criteria: sperm concentration, sperm motility, the total number of sperm with normal morphology, ejaculate volume and ejaculate liquefaction time, the level of fructose and zinc, and cases of pregnancy in the partner.
Results. The use of the Speroton complex resulted in a 10% increase in ejaculate volume, a 15.6% increase in sperm concentration, and a 32% reduction in liquefaction time. The proportion of progressively motile spermatozoa (grade A + B) showed a 2.6 fold increase due to activation of grade C spermatozoa. This, in our opinion, may be associated with a change in the ejaculate enzyme composition, which is indirectly confirmed by a 1.6 fold increase in the level of fructose and 15% increase in the amount of zinc in sperm biochemistry. The effectiveness of therapy in SG patients is also confirmed by 4 cases of spontaneous pregnancy, which occurred against a background of qualitative changes in sperm count.
Conclusion. The use of Speroton increases the sperm concentration and motility in patients with male factor infertility, and an increase in the number of spontaneous pregnancies in their partners.
Keywords: male infertility, oligozoospermia, astenozoospermia, oligoastenozoospermia, Speroton
Authors declare no conflict of interests for this article.
For citations: Kuz’menko A.V., Kuz’menko V.V., Gyaurgiev T.A. The effectiveness of the speroton complex in the management of male factor infertility. Urologiia. 2018;3:00-00 (in Russian)
Введение.
В 2015 г. Росстат опубликовал демографический прогноз до 2050 г., по данным которого население страны может сократиться более чем на 14 млн человек. Численность населения, согласно данному прогнозу, с учетом миграционного прироста может уменьшиться на 20% [1—3]. Россия стоит перед угрозой быстрой депопуляции. В этих условиях охрана репродуктивного здоровья населения — одна из важнейших государственных задач.
По данным Европейской ассоциации урологов, у 50% невольно бездетных пар имеет место фактор мужского бесплодия, который ассоциируется с аномальными показателями спермограммы [1, 2]. С 1980 г. отмечено четырехкратное увеличение количества мужчин, обратившихся по поводу патоспермии [3].
Известно, что оплодотворяющая способность сперматозоидов зависит от секреторной активности вспомогательных половых желез: придатков яичек, простаты и семенных пузырьков [4—6]. Нарушение функции этих органов способно приводить к снижению количественных и функциональных показателей эякулята: концентрации, подвижности и морфологии сперматозоидов [7]. Одной из основных причин, приводящих к нарушению мужской репродуктивной функции, считают избыточную продукцию активных форм кислорода (АФК) [4, 7].
Хотя свободные радикалы в сперматозоидах обнаружили еще в 1943 г., их роль в мужской репродуктивной физиологии изучили только в 1989 г. Известно, что в результате воздействия на организм мужчины различных негативных внутренних и внешних факторов происходит повышение генерации АФК [8]. При наличии небольшого количества АФК сохраняется нормальная функция сперматозоидов, возможны капацитация, гиперактивация, а также слияние с ооцитами и оплодотворение. Повышение количества свободных радикалов приводит к нарушению данных процессов [9].
От 40 до 80% мужчин с бесплодием имеют высокие уровни АФК. Появляется все больше доказательств того, что мощные антиоксиданты, содержащиеся в семенной плазме, защищают сперматозоиды от отрицательного воздействия свободных радикалов [10]. В том случае когда количество свободных радикалов превышает антиоксидантные резервы организма, возникает окислительный стресс. Он существенно ухудшает сперматогенез [11]. Таким образом, при бесплодии, связанном с повышенным уровнем кислородных радикалов в сперме, отмечается терапевтический эффект антиоксидантов.
Одним из наиболее важных биохимических маркеров нормального созревания сперматозоидов является L-карнитин, продуцируемый придатком яичка [9, 10]. Физиологическая роль придатка яичка заключается в создании условий для нормального развития сперматозоидов путем секреции ряда соединений, в том числе L-карнитина, участвующего в переносе ацилгруппы и окислительного фосфорилирования жирных кислот в митохондриях и как следствие — в обеспечении энергией, используемой сперматозоидами для созревания и активной подвижности. L-карнитин участвует в защите клеточной мембраны от свободных радикалов. Помимо L-карнитина качество спермы также зависит от поступления в организм витаминов и некоторых аминокислот [11].
Доказано, что прием витамина Е уменьшает тяжесть окислительного стресса в ткани яичек, повышает подвижность сперматозоидов и положительно влияет на их способность проникать в яйцеклетку [11—13]. Витамин E обладает эффектом синергизма с селеном, т.е. при одновременном приеме эти вещества проявляют выраженную эффективность в более низких дозах, чем при употреблении по отдельности, за счет взаимного предотвращения окисления (разрушения) как в кишечнике, так и в тканях.
Цинк — жизненно важный микроэлемент, который можно обнаружить практически в любых тканях организма [12, 13]. Цинк абсолютно необходим для клеточного дыхания, утилизации кислорода, воспроизведения генетического материала (ДНК и РНК), поддержания целости клеточных стенок и обезвреживания свободных радикалов. В организме человека цинк концентрируется во всех органах и тканях, в том числе в яичках, придатках яичек, предстательной железе, в достаточно большом количестве содержится в сперме. Он запускает и поддерживает процессы синтеза мужского полового гормона — тестостерона — и активизирует сперматогенез. Цинк активирует глутатионпероксидазу, необходимую для нормального созревания и подвижности сперматозоидов, а также участвует в регуляции активности ферментов спермы, способствует регуляции процессов разжижения эякулята и агглютинации.
Учитывая современные тенденции развития медицины, обусловленные недостаточной эффективностью общепринятых методов терапии, постоянно ведется поиск альтернативных стратегий лечения в урологии и андрологии [12—16]. В связи с этим широкое применение нашли многокомпонентные биологически активные комплексы [12, 13]. В настоящее время к патогенетически обоснованным принципам терапии инфертильности у мужчин относятся коррекция окислительного стресса, восполнение витаминов, микроэлементов и низкомолекулярных пептидов [11]. С этой целью обоснованным с точки зрения его состава является применение комплекса Сперотон.
Цель исследования:
оценить влияние комплекса Сперотон на функциональные характеристики сперматозоидов и фертильность мужчин с патозооспермией.
Материалы и методы.
Были обследованы 60 мужчин с диагностированным мужским бесплодием на фоне различных нарушений сперматогенеза в возрасте от 25 до 40 лет.
Критерии включения: патоспермия (олигозооспермия, астенозооспермия, олигоастенозооспермия) по данным спермограмм, концентрация сперматозоидов не менее 10 млн/мл, отсутствие эякуляторных нарушений, отсутствие предшествовавшей терапии по поводу бесплодия (в том числе гормональной), отказ от приема сопутствующей медикаментозной терапии на период исследования, отсутствие женского фактора бесплодия у партнерши по результатам осмотра гинеколога.
Критериями исключения служили наличие врожденных аномалий развития мочеполовой системы, онкологические и тяжелые сердечно-сосудистые заболевания, сахарный диабет, гипогонадизм, генетические заболевания, лабораторные и клинические признаки инфекционно-воспалительных заболеваний органов мочеполовой системы, инфекции, передаваемые половым путем.
Пациенты были рандомизированы на 2 группы по 30 человек.
В контрольной группе (КГ) проведена общая терапия (занятия спортом, отказ от курения и употребления алкоголя, соблюдение режима сна/бодрствования, регулярная половая жизнь, сбалансированное питание, при необходимости коррекция массы тела в соответствии с антропометрическими данными).
В основной группе (ОГ) в сочетании с общей терапией пациенты получали Сперотон по 1 саше 1 раз в день в течение 3 мес.
Обследование мужчин проходило в ходе 4 визитов. На первом визите (В1) оценивали исходный статус пациентов, соответствие критериям включения и выявление критериев исключения. Дальнейшая оценка эффективности терапии проводилась ежемесячно в ходе трех визитов — В2, В3 и В4.Оценивались показатели спермограммы в соответствии с критериями ВОЗ: концентрация, подвижность, количество сперматозоидов с нормальной морфологией, объем и время разжижения эякулята, проводился биохимический анализ эякулята с определением в нем уровня фруктозы и цинка. Также учитывали случаи наступления спонтанной беременности у партнерши.
Статистическую обработку результатов проводили с помощью программы MSExel 11.0 из стандартного пакета MS Office 2013, а также программного обеспечения IBM SPSS Statistics 21.0. При проверке статистических гипотез применяли методы параметрической (t-test Стьюдента) статистики. Для оценки статистической значимости различий между средними значениями выборок рассчитывали параметр р, вероятность справедливости нулевой гипотезы была принята равной 5% (р<0,05).
Результаты.
Исходно у всех пациентов были выявлены олигозооспермия, астенозооспермия и олигоастенозоо спермия, группы были однородными. В ходе наблюдения у пациентов отмечена различная динамика показателей спермограммы (см. таблицу).
Через месяц после начала терапии (В2) в КГ не было выявлено достоверных изменений исследуемых показателей (см. таблицу). В ОГ среднее значение объема эякулята увеличилось с 1,29±0,17 до 1,35±0,13 мл, что достоверно больше, чем в КГ. Время разжижения в ОГ значимо уменьшилось и составило 60,5±8,3 мин, что также достоверно отличалось от показателя контрольной группы. Сходная динамика отмечена и при сравнении концентрации сперматозоидов у пациентов двух групп. Среднее значение данного показателя составило 12,6±1,2 млн/мл и достоверно отличалось как от исходного значения, так и от результата в контрольной группе.
При анализе подвижности сперматозоидов была отмечена тенденция к ее повышению в обеих группах. Тем не менее статистически значимые изменения были выявлены только в группе пациентов, принимавших Сперотон. В ней количество сперматозоидов (категории А+В) с поступательным движением увеличилось в 1,5 раза, а количество сперматозоидов с непоступательным движением (категория С) и неподвижных сперматозоидов (категория D) снизилось до 19,7±7,4 и 65,8±4,8% соответственно (см. таблицу).
Анализ морфологии сперматозоидов достоверных изменений не выявил. Количество сперматозоидов с нормальной морфологией варьировалось в пределах нормальных значений в обеих группах пациентов.
При биохимическом исследовании эякулята уровень фруктозы значимо повысился только в ОГ и составил 9±1,35 ммоль. Уровень цинка в группах достоверно не различался.
К концу второго месяца терапии (В3) динамика показателей в группах сохранялась (см. таблицу). В ОГ статистически значимо увеличились концентрация сперматозоидов, объем эякулята, а также снизилось время его разжижения в основной группе пациентов. Количество сперматозоидов категории А+В в данной группе за прошедший период выросло в 2 раза и составило 19,6±2,6%, что также достоверно отличалось от показателя в КГ, который составил 10,3±1,5% и значимо не отличался от предыдущего результата. В ОГ доля сперматозоидов категорий С и D достоверно уменьшилась. В КГ указанные показатели также достоверно отличались от результатов, полученных в ходе В2, при этом количество сперматозоидов с непоступательным движением выросло до 22,6±9,4%, а неподвижных — снизилось до 67,1±8,1%.
Уровень фруктозы в эякуляте к В3 в ОГ достоверно увеличился до 10,1±1,24 ммоль, уровень цинка — до 2,01±0,13 ммоль. Динамика данных показателей в КГ была незначительной.
Через 3 мес. терапии (В4) в КГ пациентов по сравнению с результатами предыдущего визита (В3) достоверно изменилось количество сперматозоидов категорий С и D (см. таблицу). Их значения составили 23,8±10,2% и 65,7±9,1% соответственно. При анализе остальных параметров в данной группе значимых изменений выявлено не было.
В ОГ отмечена достоверная положительная динамика большинства показателей: концентрации и подвижности сперматозоидов, объема и времени разжижения эякулята (см. таблицу). Среднее значение содержания фруктозы увеличилось в 1,6 раза по сравнению с исходным показателем, достигнув 12,7±1,58 ммоль, а уровень цинка за 3 мес. вырос на 15% — до 2,2±0,17 ммоль. Значения всех исследуемых показателей по прошествии 3-месячного курса терапии (В4) в группе пациентов, принимавших Сперотон, были близкими к нормальным.
Таблица
Показатели спермограммы пациентов в течение 3-месячного курсатерапии
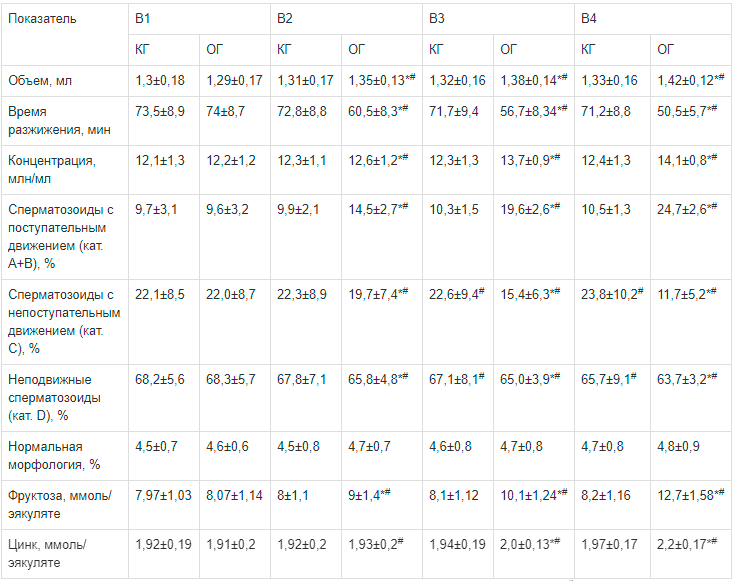 Примечание. Статистическая значимость различий: * — по сравнению с контрольной группой, # — по сравнению с результатами предыдущего визита при р<0,05.
Примечание. Статистическая значимость различий: * — по сравнению с контрольной группой, # — по сравнению с результатами предыдущего визита при р<0,05.В КГ за весь период наблюдения не было выявлено случаев беременности, тогда как на фоне приема комплекса Сперотон в четырех семейных парах была зафиксирована спонтанная беременность.
В целом к окончанию 3-месячной терапии в обеих группах отмечено значительное улучшение всех исследуемых показателей по сравнению с исходными значениями. Тем не менее в ОГ пациентов динамика оказалась статистически значимо более выраженной, что свидетельствует о большей эффективности проводимого лечения. Согласно полученным данным, применение комплекса Сперотон позволило увеличить объем эякулята на 10%, концентрацию сперматозоидов - на 15,6%, уменьшить время разжижения на 32%. Доля сперматозоидов с поступательным движением (категории А+В) увеличилась в 2,6 раза за счет активизации сперматозоидов категории C. Это, на наш взгляд, может быть связано с изменением ферментного состава эякулята, что косвенно подтверждается повышением уровня фруктозы в 1,6 раза, а также увеличением количества цинка на 15% в биохимическом анализе спермы, которое в свою очередь свидетельствует о высокой биодоступности Сперотона. Кроме того, применение данного комплекса позволило увеличить концентрацию сперматозоидов у пациентов основной группы, что может быть обусловлено влиянием его компонентов на антиоксидантную защиту организма и процесс сперматогенеза путем активации ферментативных реакций, метаболических процессов и стимуляции выработки гормонов. Однако данные механизмы требуют более углубленного изучения в ходе дальнейших исследований.
Эффективность терапии пациентов, проведенной в ОГ, также подтверждается четырьмя случаями спонтанной беременности, которая наступила на фоне качественных изменений показателей спермы.
Заключение.
Таким образом, применение Сперотона позволяет повышать подвижность и концентрацию сперматозоидов у пациентов с мужским фактором бесплодия, приближать их к нормальным значениям, а также увеличивать количество спонтанных беременностей у их партнеров. Мы рекомендуем применение комплекса Сперотон данной категорией больных с целью коррекции нарушений сперматогенеза.
Сведения об авторах:
Кузьменко А.В. - д.м.н., доцент, заведующий кафедрой урологии ФгБоУ ВО ВГМУ им. Н.Н. Бурденко, Воронеж, Россия;
Кузьменко В.В. - д.м.н., профессор кафедры урологии ФГБОУ ВО ВГМУ им. Н.Н. Бурденко, Воронеж, Россия;
Гяургиев Т.А. - ассистент кафедры урологии ФГБОУ ВО ВГМУ им. Н.Н. Бурденко, Воронеж, Россия.
Authors’ information:
Kuz’menko A.V. - Dr.Med.Sci., Associate Prof., Head of the Department of Urology, N.N. Burdenko VSMU, Voronezh, Russia.
Kuz’menko VV. - Dr.Med.Sci., Prof, of the Department of Urology, N.N. Burdenko VSMU, Voronezh, Russia.
Gyaurgiev T.A. - assistant Prof, of the Department of Urology, N.N. Burdenko VSMU, Voronezh, Russia.
1. Urology. Russian clinical guidelines. Ed. Alyaev Yu.G., Glybochko P.V., Pushkar D.Yu. M.: GEOTAR-Media. 2015;480 p. Russian (Урология. Российские клинические рекомендации. Под ред. Аляева Ю.Г., Глыбочко П.В., Пушкаря Д.Ю. М.: ГЭОТАР-Медиа. 2015;480 с.)
2. Stone В.А., Alex A., Werlin L.B., Marrs R.P. Age thresholds for changes in semen parameters in men. Fert and Ster. 2013;100(4):952-958.
3. En’kova E.V., Kuz’menko A.V., Khoperskaya O.V., Gaiskaya O.V., Gyaurgiev T.A. Male factor of miscarriage. Sistemnyi analiz i upravlenie v biomeditsinskikh sistemakh. 2017;16(3):555-564. Russian (Енькова Е.В., Кузьменко А.В., Хоперская О.В., Гайская О.В., Гяургиев Т.А. Мужской фактор невынашивания беременности. Системный анализ и управление в биомедицинских системах. 2017;16(3):555-564).
4. Nashivochnikova N.A., Krupin V.N., Selivanova S.A Antioxidant therapy of infertile marriage. Urologiia. 2015;3:71-74. Russian (Нашивочникова Н.А., Крупин В.Н., Селиванова С.А. Антиоксидантная терапия бесплодного брака. Урология. 2015;3:71-74).
5. Kuz’menko A.V., Kuz’menko V.V., Gyaurgiev T.A. Combination drug therapy for patients with BPH. Urologiia. 2018;1:101-105. Russian (Кузьменко А.В., Кузьменко В.В., Гяургиев Т.А. Комбинированная медикаментозная терапия больных с ДГПЖ. Урология. 2018;1:101-105).
6. Kuz’menko A.V., Kuz’menko V.V., Gyaurgiev T.A., Barannikov I.I. Chronobiological status of patients with chronic prostatitis against the background of prostate adenoma. Sistemnyi analiz i upravlenie v biomeditsinskikh sistemakh. 2017;16(3):513-516. Russian (Кузьменко А.В., Кузьменко В.В., Гяургиев Т.А., Баранников И.И. Хронобиологический статус больных с хроническим простатитом на фоне аденомы простаты. Системный анализ и управление в биомедицинских системах. 2017;16(3):513-516).
7. Bozhedomov V.A., Toroptseva M.V., Ushakova I.V. Sporish E.A., Lovygina N.A., Lipatova N.A. Active forms of oxygen and reproductive function of men: fundamental and clinical aspects (literature review). Androl. i genit. khir. 2011;3:10-16. Russian (Божедомов В.А., Торопцева М.В., Ушакова И.В. Спориш Е.А., Ловыгина Н.А., Липатова Н.А. Активные формы кислорода и репродуктивная функция мужчин: фундаментальные и клинические аспекты (обзор литературы). Андрол. и генит. хир. 2011;3:10-16).
8. Tremellen K. Oxidative stress and male infertility - a clinical perspective. Hum Reprod Update. 2008;14:243-258.
9. Agarwal A., Makker K., Sharma R. Clinical relevance of oxidative stress in male factor infertility: an up-date. Am J Reprod Immunol. 2008;59:2-11.
10. Vinogradov I.V., Blokhin A.V, Afanas’eva L.M., Gabliya M.Yu. The experience of using L-carnitine in the treatment of secretory infertility. Androl. i genit. khir. 2009;3:2-8. Russian (Виноградов И.В., Блохин А.В, Афанасьева Л.М., Габлия М.Ю. Опыт применения L-карнитина в лечении секреторного бесплодия. Андрол. и генит. хир. 2009;3:2-8).
11. Steinbrenner H, Al-Quraishy S., Dkhil M.A., Wunderlich F., Sies H. Dietary selenium in adjuvant therapy of viral and bacterial infections. Adv Nutr. 2015;6(1):73-82.
12. Kuz’menko A.V., Kuz’menko V.V., Gyaurgiev T.A., Stroeva D.E. Chronobiological aspects of the use of Prolit Super Septo in patients with infectious and inflammatory diseases of the urinary system . Urologiia. 2015;4:19-23. Russian (Кузьменко А.В., Кузьменко В.В., Гяургиев Т.А., Строева Д.Е. Хронобиологические аспекты применения пролита супер септо у больных инфекционновоспалительными заболеваниями органов мочевыделительной системы. Урология. 2015;4:19-23).
13. Kuz’menko A.V., Kuz’menko V.V., Gyaurgiev T.A., Stroeva D.E. Chronobiological aspects of using the complex «Neurodoz» in patients with erectile dysfunction. Urologiia. 2014;5:90-94. Russian (Кузьменко А.В., Кузьменко В.В., Гяургиев Т.А., Строева Д.Е. Хронобиологические аспекты применения комплекса «Нейродоз» у больных с эректильной дисфункцией. Урология. 2014;5:90-94).
14. Kuz’menko A.V., Kuz’menko V.V., Gyaurgiev T.A. Chronobiological approach to managing an exacerbation of chronic recurrent bacterial cystitis. Urologiia. 2017;2:60-65. Russian (Кузьменко А.В., Кузьменко В.В., Гяургиев Т.А. Хронобиологический подход к терапии хронического рецидивирующего бактериального цистита в стадии обострения. Урология. 2017;2:60-65).
15. Gyaurgiev T.A., Kuz’menko A.V., Lavrenov A.L. Morphometric analysis of the effectiveness of chronotherapy and phototherapy in the treatment of patients with chronic recurrent bacterial cystitis in the stage of exacerbation. Sistemnyi analiz i upravlenie v biomeditsinskikh sistemakh. 2015;14(3):477-481. Russian (Гяургиев Т.А., Кузьменко А.В., Лавренов А.Л. Морфометрический анализ эффективности хронотерапии и фототерапии в лечении больных хроническим рецидивирующим бактериальным циститом в стадии обострения. Системный анализ и управление в биомедицинских системах. 2015;14(3):477-481).
16. Gyaurgiev T.A., Kuz’menko A.V., Vakhtel’ V.M., Luk»yanovich P.A. Treatment of patients with chronic recurrent cystitis in the acute stage using combination therapy incuding phototherapy with the Svetozar device. Sistemnyi analiz i upravlenie v biomeditsinskikh sistemakh. 2014; 13(4): 821-824. Russian (Гяургиев Т.А., Кузьменко А.В., Вахтель В.М., Лукьянович П.А. Лечение больных с хроническим рецидивирующим циститом в стадии обострения в комплексе с фототерапией с использованием аппарата «Светозар». Системный анализ и управление в биомедицинских системах. 2014;13(4):821-824).
Комментарии
ПРАКТИКА ПЕДИАТРА