akvion.ru
akvion.ru

Комбинированный препарат для повышения мужской фертильности
далее...
Больше информации на сайтах:
www.reproduction.info
www.plan-baby.ru
Эффективность антиоксидантной терапии пациентов с идиопатической патозооспермией
СтатьиОпубликовано в журнале:
« Проблемы репродукции», №4, Т. 22, 2016
Представлен обзор современных данных литературы по вопросу функциональных изменений сперматозоидов и их роли в бесплодном браке. Приведены результаты исследования влияния комплекса Сперотон на функциональные характеристики сперматозоидов и реальную фертильность мужчин с идиопатической патозооспермией. Полученные данные позволяют селективно подходить к диагностике и терапии пациентов с идиопатической патозооспермией.
Сведения об авторах:
Г.Т. Сухих, академик РАМН, д.м.н., профессор, руководитель ФГБУ «Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова» Минздрава России;
A. Ю. Попова, к.м.н., старший научный сотрудник ФГБУ «Научный центр акушерства, гинекологии и перинатологии им. академика B. И. Кулакова» Минздрава России;
Р.И. Овчинников, к.м.н., заведующий по клинической работе ФГБУ «Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова» Минздрава России;
И.В. Ушакова, к.б.н., эмбриолог, научный сотрудник 1-го гинекологического отделения ФГБУ «Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова» Минздрава России
Бесплодие, согласно определению Всемирной организации здравоохранения (ВОЗ), является болезнью репродуктивной системы, характеризующейся неспособностью к зачатию по причине мужского или женского фактора. Настоящая проблема имеет пандемический характер, т. к. отмечено четырехкратное увеличение заболеваемости, начиная с 1980 г. [1]. На сегодняшний день мужской фактор является причиной бесплодия почти в половине случаев [2, 3]. Данный факт не только оказывает серьезное негативное влияние на качество жизни пациентов, но и приводит к огромным социальноэкономическим кризисам. Известно, что оплодотворяющая способность сперматозоидов зависит от секреторной активности вспомогательных половых желез: придатков яичек, простаты и семенных пузырьков [4]. Нарушение функции этих органов способно приводить к снижению количественных и функциональных показателей эякулята: концентрации, подвижности, морфологии сперматозоидов, нарушению акросомальной реакции (АР), образованию антиспермальных антител (АСАТ).
Одной из основных причин, приводящих к нарушению мужской репродуктивной функции, считают избыточную продукцию активных форм кислорода (АФК) [5]. АФК -окислители с высокой реакционной способностью, принадлежащие к классу свободных радикалов (ROS). Это очень неустойчивые окислители, поэтому они реагируют со многими биохимическими веществами, такими как липиды, аминокислоты, углеводы, белки и ДНК. Хотя наличие свободных радикалов в сперматозоидах обнаружили еще в 1943 г. [6], их роль в мужской репродуктивной физиологии изучили только в 1989 г. [7]. Известно, что в результате воздействия на организм мужчины различных негативных внутренних и внешних факторов происходит повышение генерации АФК. Низкий уровень АФК необходим для нормальной функции сперматозоидов, что обеспечивает капацитацию, гиперактивацию, АР, а также слияние и оплодотворение с ооцитами [8, 9]. А повышение ROS запускает капацитацию и АР в более ранние сроки, что приводит к нарушению их оплодотворяющей способности [10]. Другими словами, при повышении уровня АФК возникает каскад патологических состояний, которые отрицательно влияют на функцию сперматозоидов [11]. Примерно от 40 до 80% пациентов с бесплодием имеют высокие уровни АФК [4]. Интересно, что выявление повышенного уровня АФК в некоторых случаях может являться важным методом обработки спермы для искусственного оплодотворения.
Появляется все больше доказательств того, что мощные антиоксиданты, содержащиеся в семенной плазме, защищают сперматозоиды от пагубных ROS-эффектов. Защитные способности семенной плазмы имеют значительные индивидуальные колебания. И в том случае, когда производство АФК превышает антиоксидантную защиту, возникает окислительный стресс (ОС). ОС существенно ухудшает сперматогенез и функцию спермы, что может привести к мужскому бесплодию [12, 13]. ОС может привести к денатурации ДНК в одноцепочечной ДНК и двухнитевым разрывам ДНК [14]. В семенной плазме бесплодных мужчин уровень антиоксидантов значительно ниже, чем у фертильных мужчин. При бесплодии, связанном с повышенным уровнем кислородных радикалов в сперме, отмечается терапевтический эффект антиоксидантов, влияющих на уровень ROS. Поэтому тщательная диагностика нарушений функциональной способности сперматозоидов, а также выявление и успешное лечение пациентов с идиопатической пато зооспермией - путь к восстановлению утраченной способности к зачатию.
Наиболее важным биохимическим маркером нормального созревания сперматозоидов является L-карнитин, продуцируемый придатком яичка. Физиологическая роль придатка яичка заключается в создании условий для нормального развития сперматозоидов путем секреции ряда соединений, в т. ч. L-карнитина, участвующего в переносе ацилгруппы и окислительного фосфорилирования жирных кислот в митохондриях, и, как следствие, обеспечении энергией, используемой сперматозоидами для созревания и приобретения ими подвижности. Роль L-карнитина в защите клеточной мембраны от свободных радикалов приобрела большое значение в лечении мужского бесплодия в последнее время [4, 5]. Помимо L-карнитина качество спермы также зависит от поступления в организм витаминов и некоторых аминокислот.
Селен влияет как на адаптивный, так и на врожденный иммунитет, способствует пролиферации и дифференциации CD4+ Т-лимфоцитов в сторону Т-хелперов, поддерживая тем самым острый клеточный иммунный ответ [15]. Также потенциальной антивирусной активностью обладает витамин Е [16]. Доказано, что прием витамина Е уменьшает тяжесть окислительного стресса в ткани яичек, повышает подвижность сперматозоидов и положительно влияет на их способность проникать в яйцеклетку. Витамин E обладает эффектом синергизма с селеном, т. е. при одновременном приеме эти вещества проявляют выраженную эффективность в более низких дозах, чем при употреблении по отдельности, за счет взаимного предотвращения окисления (разрушения) как в кишечнике, так и в тканях. Цинк - жизненно важный микроэлемент, который можно обнаружить практически в любых тканях организма. Цинк абсолютно необходим для клеточного дыхания, утилизации кислорода, воспроизведения генетического материала (ДНК и РНК), поддержания целости клеточных стенок и обезвреживания свободных радикалов. В организме человека цинк концентрируется во всех органах и тканях, в т. ч. в яичках, придатках яичек, предстательной железе, в достаточно большом количестве содержится в сперме. Он запускает и поддерживает процессы производства мужского полового гормона - тестостерона и активизирует сперматогенез. Цинк активирует глутатионпероксидазу, которая необходима для нормального созревания и подвижности сперматозоидов, а также участвует в регуляции активности других ферментов спермоплазмы, способствует регуляции процессов коагуляции и разжижения эякулята.
Было проведено исследование по оценке влияния комплекса Спе ротон на функциональные характеристики сперматозоидов и реальную фертильность мужчин с идиопатической патозооспермией. В исследование были включены 40 ин фертильных мужчин в возрасте от 26 до 45 лет с различными идиопатическими нарушениями спермограммы. Средний возраст составил 34±3,2 года. Все пациенты случайным образом были разделены на 2 группы: 1-я группа (20 пациентов) получала исследуемый препарат Сперотон по 1 саше 1 раз в день в течение 3 мес.; 2-я контрольная группа (20 пациентов) получала плацебо по 1 саше 1 раз в день на протяжении 3 мес. Исследование показателей спермограммы осуществлялось в соответствии с требованиями ВОЗ до лечения и через 3 мес. от начала приема препарата. Оценивались концентрация, подвижность, морфология сперматозоидов по строгим критериям Крюгера, объем эякулята. Согласно концепции ок сидативного стресса, АФК появляются, когда естественные антиоксиданты не способны их блокировать. В исследовании уровень АФК оценивался методом OxiSperm - путем оценки повышенного количества супероксидных радикалов, присутствующих в эякуляте. Тест основан на химических свойствах ни тросинего тетразолия (NBT), который находится в наборе OxiSperm в виде реакционного геля (РГ). Оценка результатов производится в процентах. Оценка АР сперматозоидов была проведена методом проточной цитофлуорометрии. После обработки сперматозоидов определяли процент сперматозоидов, у которых прошла АР.
В исследовании приняли участие мужчины с бесплодием (отсутствие беременности у партнерши в браке более 12 мес. половой жизни без контрацепции) в возрасте от 20 до 45 лет с наличием в анализе спермограммы идиопатической патозоо спермии (олигозооспермия, астено зооспермия, тератозооспермия), нарушений АР сперматозоидов и повышения АФК; отсутствием клинических и лабораторных признаков воспалительных изменений придаточных половых желез; отсутствием при пальпации варикоцеле и других негативно влияющих на сперматогенез заболеваний органов мошонки, подтвержденное результатами ультразвукового исследования и допплерографией; отсутствием иммунной формы бесплодия (MAR-test IgG<10%); отсутствием выраженной соматической патологии. Критериями исключения стали: обструктивная или необструктивная азооспермия или иммунологическая форма бесплодия; наличие женского бесплодия у партнерши (непроходимость маточных труб, нарушения овуляции, распространенный эндометриоз и др.); возраст младше 20 и старше 47 лет; алкогольная или наркотическая зависимость; повышенная чувствительность к любому из компонентов препарата; нарушения функции печени и почек. Статистические тесты проводились как двухсторонние с уровнем а=5%. Для описания количественных переменных были использованы: количество пациентов, среднее значение, стандартное отклонение, стандартная ошибка, медиана, экстремальные значения. Статистическая достоверность изменений количественных переменных оценивалась с использованием парного t-теста Стьюдента или знакового критерия Уилкоксона.
Сбор анамнеза показал, что ни один из пациентов не подвергался воздействиям ионизирующих излучений и не употреблял наркотических средств, не наблюдалось и систематического употребления алкоголя. К сожалению, с помощью сбора анамнеза и подробного изучения медицинской документации выяснить этиологию заболевания не представлялось возможным. При осмотре у больных не отмечались внешние признаки гипогонадизма. При пальпации органов мошонки отмечался нормальный объем яичек. По данным УЗИ предстательной железы у 62,7% больных были выявлены ультразвуковые признаки хронического простатита. Результаты УЗИ органов мошонки патологических изменений не показали. При цветовом допплеровском картировании сосудов органов мошонки патологический рефлюкс на высоте пробы Вальсальвы не был регистрирован. При стандартном спермио логическом исследовании был поставлен диагноз «патозооспермия». Причем 42% больных имели астено зооспермию, 20% - астенотерато зооспермию, 9% - тератозооспер мию, 11% - олигоастенозооспер мию, 12% - полиастенотератозооспермию. По данным гормонального анализа крови изменений в средних показателях гормонов (ФСГ, ЛГ, тестостерона, ПЛ) не было.
Сравнительная динамика основных показателей спермограмм до лечения и через 3 мес. приема выявила достоверное увеличение концентрации сперматозоидов с поступательным движением (А+Б) в 1-й группе пациентов с 29,2 ± 1,2% до 43,6 ± 0,8%, по сравнению с пациентами 2-й группы с 28,2 ± 0,8 до 31,3 ± 1,2% (р < 0,05) (рис. 1).
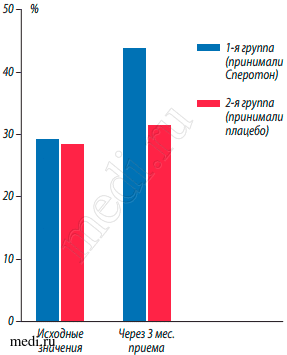 Рис. 1. Сравнительная динамика значений подвижности (А+В) сперматозоидов
Рис. 1. Сравнительная динамика значений подвижности (А+В) сперматозоидов
Также достоверно более значительное увеличение концентрации сперматозоидов в эякуляте наблюдалось у пациентов 1-й группы с 13,2 ± 0,5 до 18,9 ± 0,8 млн/мл, по сравнению с пациентами 2-й группы с 11,3 ± 0,5 до 12,7 ± 0,5 млн/мл через 3 мес. соответственно (р < 0,05) (рис. 2).
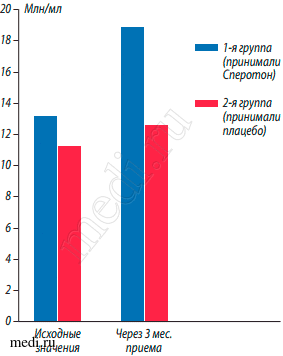 Рис. 2. Сравнительная динамика значений концентрации сперматозоидов
Рис. 2. Сравнительная динамика значений концентрации сперматозоидов
Отмечалось увеличение количества морфологически нормальных форм сперматозоидов через 3 мес. - более значительное в 1-й группе (с 2 ± 0,7% до 4,2 ± 0,8%) по сравнению со 2-й группой (с 2,3 ± 0,7% до 3,0 ± 0,5%).
Также отмечались положительные изменения физических и химических показателей спермы (АФК, АР). По результатам лечения в основной группе показатели OxiSperm-теста значимо улучшились после 3 мес. приема препарата. Снижение показателей ОС ROS (по данным OxiSperm-теста) в основной группе составило 27,3% по сравнению с исходным значением, при этом в контрольной группе показатели ухудшились на 6,5%.
Таблица 1.
Сравнительная динамика показателей АФК
| OxiSperm | ||
| Исходное значение, % | После 3 мес. приема,% | |
1-я группа | 22 | 16 |
2-я группа | 23 | 24,5 |
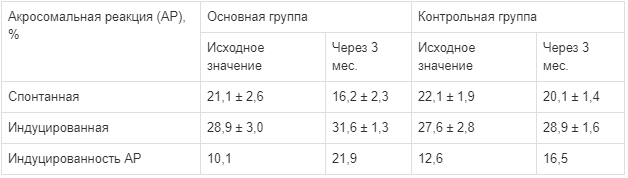
Доля пациентов с улучшением показателей АР через 3 мес. после исходного анализа в основной группе была значимо выше, чем в контрольной. Так, спонтанная АР в исследуемой группе составила 16,2 ± 2,3% и 21,1 ± 5,3% соответственно, тогда как индуцируемая реакция -31,6 ± 1,3% и 28,9 ± 1,6% соответственно (р < 0,05), что в свою очередь демонстрирует положительную динамику индекса АР (табл. 2).
Таблица 2.
Акросомальная реакция (АР) сперматозоидов в основной и контрольной группах
На фоне приема препарата Сперотон ни у одного пациента не наблюдалось нежелательных эффектов. У 3 семейных пар из 1-й группы была зафиксирована клиническая беременность.
В настоящее время имеется достаточное количество работ, посвященных роли антиоксидантов в улучшении мужской фертильности. Нам известно, что различные антиоксиданты являются некой «системой обороны», которая включает как ферментативные, так и неферментативные молекулы. Как правило, антиоксиданты семенной плазмы выступают против АФК, чтобы поддерживать их нормальный уровень, необходимый для выполнения ими своей физиологической функции [16]. Другими словами, антиоксиданты в семенной плазме и сперматозоидах поддерживают устойчивое состояние уровня ROS в сперме путем преобразования свободных радикалов в нереагирующие вещества. Эта способность определяется зрелостью сперматозоида, имеющего цитоплазму. Цитоплазма является основным источником антиоксидантов, ее отсутствие в зрелом сперматозоиде вызывает дефицит как антиоксидантной защиты, так и эндогенного механизма восстановления. В последнее время роль L-карнитина в защите клеточной мембраны от свободных радикалов приобрела большое значение в лечении мужского бесплодия [4, 5]. Карнитин обеспечивает сперматозоидам энергию для подвижности и созревания через бета-окисление длинноцепочечных жирных кислот в митохондрии. С учетом данных фактов пациентам, имеющим идиопатическое нарушение сперматогенеза и желающим сохранить или максимально быстро восстановить свою фертильность, в комплексной терапии рекомендовано использование антиоксидантов. Антиоксидантные комплексы позволят восстановить дисбаланс между АФК и антиоксидантной емкостью спермы, что в свою очередь нормализует моторику и устраняет дефекты ДНК сперматозоидов. Таким образом, у мужчин с идиопатическим бесплодием, получавших антиоксидантный комплекс Сперотон, отмечалась положительная динамика показателей спермограммы, а также индуцируемости АР и снижение АФК, что в свою очередь позволяет говорить об увеличении вероятности благоприятных исходов как естественной беременности, так и программ ВРТ. Однако требуются дополнительные исследования для получения более подробных данных.
Комплекс Сперотон является перспективным видом терапии, которая, улучшая функциональную способность сперматозоидов, способствует естественному зачатию у супружеских пар с исходным идиопатическим бесплодием у мужчин. На основании полученных данных можно сделать вывод о том, что комплексная консервативная терапия, включающая в себя антиоксиданты, является эффективной в коррекции различных форм патозооспермии. Рекомендуется проведение дальнейших исследований в этой области для достижения высокой эффективности лечения бесплодия у мужчин, а также уменьшения сроков восстановления фертильности для пациентов, прибегающих к экстракорпоральному оплодотворению.
1. Maheshwari A., Hamilton M., Bhattchary S. Effect of female age on the diagnostic categories of infertili ty//Hum Reprod. 2008. Vol. 23(3). Р. 538-542.
2. Stone ВА., Alex А., Werlin L.B., Marrs R.P. Age thresholds for changes in semen parameters in men. Fert and Ster. 2013. Vol. 100(4). P. 952-958.
3. Irvine D.S. Epidemiology and aetiology of male infertility // Hum. Reprod. 1998. Vol. 13(1). P. 33-44.
4. Lenzi A., Lombardo F., Sgro P. et al. Use of carnitine therapy in selected cases of male factor infertility: a double-blind crossover trial//Fertil Steril. 2003. Vol. 79(2). Р. 292-300.
5. Lenzi A., Sgro P., Salacone P. et al. A placebo-controlled double-blind randomized trial of the use of combined L-carnitine and L-acetyl-carnitine treatment in men with asthenozoospermia // Fertil Steril. 2004. Vol. 81. Р. 1578-1584.
6. Olayemi F.O. A review on some causes of male infertility// Afr J Biotechnol. 2010. Vol. 9. Р. 2834-3842.
7. Abd-Allah A.R., Aly H.A., Moustafa A.M. et al. Adverse testicular effects of some quinolone members in rats//Pharmacol Res. 2000. Vol. 41. Р. 211-219.
8. Khaki A., Heidari M., Ghaffari Novin M., Khaki A.A. Adverse effects of ciprofloxacin on testis apoptosis and sperm parameters in rats //Iran J Reprod Med. 2008. Vol. 6. Р. 71-76.
9. Aral F., Karacal F., Baba F. The effect of enrofloxacin on sperm quality in male mice //Res Vet Sci. 2008. Vol. 84. Р. 95-99.
10. El-Bahrawy K., El-Hassanein E.S., Kamel Y.M. Comparison of gentamycin and ciprofloxacin in dromedary camels' semen extender //World J Agric Sci. 2010. Vol. 6. Р. 419-424.
11. Sies H. Strategies of antioxidant defense // Eur J Biochem. 1993. Vol. 215. Р. 213-219.
12. Tremellen K. Oxidative stress and male infertility - a clinical perspective// Hum Reprod Update. 2008. Vol. 14. Р. 243-258.
13. Agarwal A., Makker K., Sharma R. Clinical relevance of oxidative stress in male factor infertility: an update //Am J Reprod Immunol. 2008. Vol. 59. Р. 2-11.
14. Agarwal A., Prabakaran S.A., Sikka C. Clinical relevance of oxidative stress in patients with male factor infertility: Evidence based analysis // American Urological Association Update Ser. 2007. Vol. 26. Р. 1-11.
15. St. Steinbrenner H., Al-Quraishy S., Dkhil M.A. et al. Dietary selenium in adjuvant therapy of viral and bacterial infections // Adv Nutr. 2015. Vol. 6(1). Р. 73-82.
16. Fiorino S., Bacchi-Reggiani L., Sabbatani S. et al. Possible role of tocopherols in the modulation of host microRNA with potential antiviral activity in patients with hepatitis B virus-related persistent infection: a systematic review // Br J Nutr. 2014. Vol. 112(11). Р. 1751-1768.
Комментарии
ПРАКТИКА ПЕДИАТРА