Комбинированная антиэпилептическая терапия
Статьи
ЖУРНАЛ "MEDI.RU - ЭПИЛЕПСИЯ"
И.Г. Рудакова,
ГБУЗ МО «Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского»
Предметом пристального внимания последних лет стали вопросы о выборе тактики лечения после первой неудачной терапии и выборе антиэпилептического препарата (АЭП) для первой дополнительной терапии. Какая последующая тактика более оптимистична: альтернативная монотерапия или переход к политерапии? Эта проблема порождена появлением на рынке генерации новых АЭП и обоснованным пониманием того, что каждая последующая схема терапии ухудшает перспективу достижения ремиссии, каждый новый припадок, обладая негативными нейропластическими эффектами, может стать той гранью, до которой эпилепсия еще курабельна, а после – фармакорезистентна.
Парадигма «Монотерапия – золотой стандарт лечения» родилась в 70-х годах, когда большинство комбинаций АЭП строилось на сочетании карбамазепина (КБМ), фенитоина (ФТН) и фенобарбитала (ФБЛ) и когда было показано, что у многих пациентов улучшается контроль над приступами и переносимость терапии при переходе от политерапии к монотерапии (Shorvon S.D. et al., 1979, Schmidt D., 1983). Сегодня основными аргументами против применения политерапии в ранних схемах лечения являются: увеличение лекарственной нагрузки, ухудшение переносимости лечения, (Schmidt D., 1975), проблемы контроля эпилептических приступов, возникающие в связи с лекарственными взаимодействиями (Lammers M.W. et al., 1995), увеличение расходов на лечение (Scottish Intercollegiate Guidelines Network).
Важный вопрос сегодняшнего дня: какая тактика на ранних этапах лечения наиболее рациональна в том случае, если первый АЭП неэффективен? Решению этого вопроса посвящен ряд исследований. Анализ базы данных Глазго впервые продемонстрировал преимущества как по частоте развития ремиссий, так и по показателю частоты возникновения побочных эффектов у пациентов с ранней политерапией, назначенной сразу после первой неудачной монотерапии (Kwan P. , Brodie M.J., 2000). Аналогичные результаты были получены в более поздних репрезентативных исследованиях, в том числе выполненных по дизайну мультицентровых рандомизированных контролируемых (Deckers C.L.P. et al., 2001, Beghi E. et al., 2003).
В 2013 г. опубликованы данные мультицентрового проспективного обсервационного исследования (331 пациент из 58 центров Италии), в котором сравнены и проанализированы не только эффективность и переносимость, но и другие параметры лечения, касающиеся качества жизни, ретенции и расходов на лечение. Сравнительный анализ двух выделенных групп пациентов, после первой неудачной терапии переключенных на политерапию или альтернативную монотерапию, не выявил различий по параметрам: удержание на терапии, время госпитализаций, пропуски работы и учебы, качество жизни, прямые и косвенные затраты. Различия касались только частоты побочных эффектов, которые встречались реже в группе пациентов, получающих лечение в режиме политерапии. Недостаточная эффективность и нежелательные явления (НЯ) в этом исследовании были чаще отмечены в группе пациентов с монотерапией. В том числе это касалось НЯ, связанных с лечением, и показателя прекращения лечения в связи с НЯ (Milul A. et al., 2013). Следует отметить, что в данном исследовании для альтернативной монотерапии наиболее часто были использованы вальпроаты (ВПА), КБМ, топирамат (ТПМ) и окскарбазепин (ОКС), а в дополнительной терапии наиболее часто к ВПА, КБМ, ФБЛ и ОКС были добавлены ТПМ или леветирацетам (ЛЕВ). Таким образом, достаточно убедительно продемонстрировано, что рационально построенная ранняя политерапия с использованием основных АЭП – базовых (ВПА, КБМ) и новых (ОКС, ТПМ, ЛЕВ), – назначенная сразу после неудачи стартовой монотерапии, как минимум не уступает альтернативной монотерапии по показателям «эффективность», «переносимость», «удержание и качество жизни».
Несомненно, эффективность и переносимость лечения эпилепсии определяются прежде всего адекватностью выбора АЭП.
Какой препарат из множества современных АЭП следует выбрать для получения максимальной эффективности? Прежде всего необходимо выбрать препарат с профилем активности, побочных эффектов и взаимодействия, который может привести пациента к ремиссии как можно раньше и обеспечить эффективность лечения при длительном применении.
Выбор должен идеально соответствовать типу приступов пациента и/или эпилептическому синдрому, возрасту, полу, весу, психиатрическому анамнезу, другим показателям заболевания, сопутствующему лечению, образу жизни больного (Brodie M.J., 2005, 2011). Широкий спектр современных АЭП позволяет врачу сделать выбор максимально индивидуализированным. Однако возникает важный практический вопрос: обладают ли те или иные АЭП преимуществами эффективности и переносимости?
Наиболее систематизированный анализ этой проблемы представлен в работе Bodalia N.A. и соавт. (2013). В анализ включено 43 исследования по эффективности и переносимости различных АЭП при фармакорезистентной парциальной эпилепсии (общее число пациентов – 6212 человек), большая часть которых выполнена с плацебо-контролем. Эффективность лечения оценивалась по числу респондеров (процент пациентов, у которых частота приступов изменилась на >50% сравнению с исходной частотой), непереносимость лечения оценивалась по числу пациентов, закончивших участие преждевременно. Результаты представлены на графике (рис. 1).
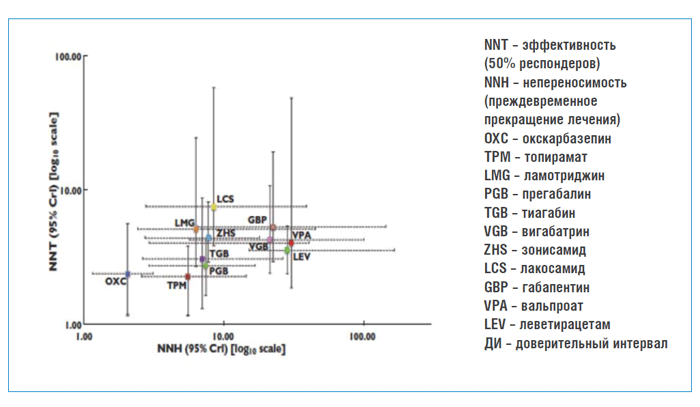
Рисунок 1. Соотношение эффективности и переносимости основных АЭП в лечении фармакорезистентной
парциальной эпилепсии. Данные метаанализа (95% ДИ) (Bodalia N.A. и соавт., 2013)
АЭП, расположенные в правой части графика (ВПА, ЛЕВ), соответствуют наилучшим показателям эффективности и переносимости (максимальная эффективность при минимальной непереносимости), в левой части графика (ОКС) – наихудшим показателям. Все остальные АЭП – вигабатрин (ВГБ), габапентин (ГБП), прегабалин (ПГБ), тиагабин (ТГБ), зонисамид (ЗНС), лакоса-мид (ЛСМ), топирамат (ТПМ), ламотриджин (ЛТЖ) – заняли промежуточное положение между максимально позитивным и негативным секторами графика. Однако в выводах метаанализа авторами было отмечено, что статистически значимых различий в эффективности между разными АЭП не обнаружено. Выявленные различия касаются лишь кратковременной переносимости.
Исследователями также отмечена некорректность ранжирования АЭП с учетом усредненной «эффективности и переносимости», поскольку понятия «неэффективность» и «непереносимость» не всегда имеют отношение к одному и тому же пациенту. Основным результатом проведенного анализа был вывод о том, что решающими факторами в дифференцированном выборе АЭП должны быть не показатели эффективности, полученные в исследованиях, а такие параметры, как стоимость, режим дозирования, лицензированные показания и противопоказания (Bodalia N.A., 2013). Аналогичные результаты представлены в систематическом обзоре и метаанализе, проведенном в Португалии (2011), включающем 62 рандомизированных клинических исследования (n = 12 902) и 18 прямых сравнительных исследований (n = 1370). Его выводы сформулированы следующим образом: выявленные различия не позволяют судить о преимуществах отдельных АЭП; принятие решения о выборе АЭП в большей степени зависит от характеристик отдельных пациентов, чем от наличия доказательств, полученных в исследованиях (Costa J. et al., 2011).
В настоящее время рациональный выбор сочетания лекарств базируется больше на предотвращении фармакодинамических или фармакокинетических побочных эффектов, чем на доказательствах их совокупной эффективности (French J.A. et al., 2009). Наиболее полно рейтинг фармакокинетиче-ского профиля (ФКП) современных АЭП, зарегистрированных до 2010 г., представлен в монографии Panayiotopoulos C.P. (2010) (рис. 2).
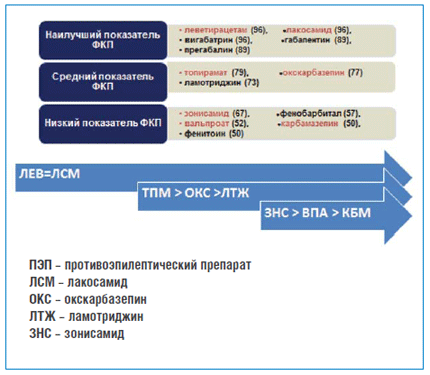
Рисунок 2. Рейтинг фармакокинетического профиля ПЭП (ФКП).
Panayiotopoulos C.P., 2010
Для всех современных АЭП была произведена оценка 16 параметров ФКП в баллах. В результате по сумме баллов АЭП ранжированы в три группы: группа АЭП с наилучшим ФКП – ЛЕВ, ЛСМ, ВГБ, ПГБ, ГБП; группа АЭП со средним показателем ФКП – ТПМ, ОКС, ЛТЖ; группа АЭП с низким ФКП – ЗНС, ВПА, ФТН, ФБЛ, КБМ. Обращает на себя внимание тот факт, что два АЭП, представляющих собой эталонную эффективность лечения, – КБМ при фокальных приступах и ВПА при генерализованных приступах – заняли в этом рейтинге самые низкие позиции. С позиции современных подходов к выбору лечения АЭП с лучшими показателями ФКП должны быть оптимальны с точки зрения комбинируемости.
Однако следует отметить, что, занимая низкую позицию в представленном рейтинге ФКП, в клинической практике ВПА относятся к высокоэффективным АЭП с максимально благоприятным профилем комбинируемости, что обеспечивается следующими основными характеристиками препарата (Зенков Л.Р., 2001):
- широкий терапевтический спектр – эффективность относительно всех типов приступов;
- мультимодальность механизмов действия;
- отсутствие влияния на эффективность большинства совместно применяемых АЭП и препаратов других групп;
- хорошая переносимость и отсутствие значимых нежелательных явлений, связанных с комбинированием;
- отсутствие потенциала аггравации приступов.
В отличие от ВПА, у КБМ, занимающего в представленном рейтинге ФКП аналогичную позицию, в политерапии в полной мере проявляются его негативные свойства, связанные с особенностями фармакокинетики. Являясь мощным индуктором печеночных оксигеназ цитохрома Р450 (2С9, 2С19 и 3А4), КБМ ускоряет элиминацию большинства совместно применяемых АЭП, а также ускоряет разрушение совместно применяемых препаратов других групп, в том числе жизненно необходимых (варфарин, статины, стероиды, в том числе половые, блокато-ры кальциевых каналов и др.), метаболизируемых 2С9, 2С19 и 3А4. Весьма негативным фармакодинамическим эффектом КБМ является высокий риск НЯ, в том числе жизнеугрожающих, при его комбинации с блокаторами натриевых каналов (БНК), которые являются препаратами выбора в лечении фокальных приступов. И наконец, КБМ обладает максимально высоким потенциалом аггравации эпилептических приступов (инструкция по применению).
Таким образом, при создании комбинаций АЭП следует учитывать не рейтинг ФКП отдельных АЭП, а их приемлемость с позиции потенциала эффективности и клинически значимого потенциала фармакокинетических и фармакодинамических негативных последствий.
Важнейшим моментом, который необходимо учитывать при создании комбинаций АЭП, является тот факт, что рациональный выбор АЭП для политерапии прямо зависит от характера предшествующей терапии. В связи с этим наиболее значимый принцип выбора АЭП для альтернативной монотерапии или политерапии может быть представлен следующим образом: если первый АЭП не относится к препаратам с максимальным потенциалом эффективности для данной формы эпилепсии, то второй должен таковым являться. В частности, для лечения симптоматической фокальной эпилепсии (СФЭ) с парциальными приступами с вторичной генерализацией или без – это должен быть АЭП, активным механизмом действия которого является блокада натриевых каналов (БНК): КБМ, ОКС, ЛСМ, ЭСЛ, ФТН, ЛТЖ. Для лечения идиопатической эпилепсии с первично-генерализованными или фокальными приступами – ВПА (Cretin B., Hirsch E., 2010).
И наконец, следующий шаг в рациональном построении стратегии выбора: при идиопатических эпилепсиях в случае недостаточного контроля при применении ВПА необходимо рассмотреть возможность его комбинации с ЛЕВ, ТПМ, ЛТЖ. Для СФЭ при недостаточном эффекте БНК – рассмотреть возможность применения другого БНК или АЭП с мультимодальным механизмом действия (Cretin B., Hirsch E., 2010).
При комбинациях АЭП широкого спектра действия для лечения идиопатической (генетической) эпилепсии практически не возникает проблем негативных фармакодинамических взаимодействий. Необходимо лишь учитывать преимущества спектра эффективности отдельных АЭП в лечении различных типов приступов. Например, этосуксимид (ЭСМ) эффективен для лечения абсансов, перампанел (ПЕР) – для лечения изолированных первично-генерализованных тонико-клонических судорожных приступов, ламотриджин не следует применять для лечения миоклонуса в связи с риском аггравации и т. д.
Напротив, при лечении СФЭ создание комбинаций АЭП сопряжено с проблемой фармакодина-мических взаимодействий, проявляющихся ослаблением эффективности (при сочетании с АЭП-индукторами – КБМ, ФБЛ, ФТН, ЛТЖ) и развитием побочных эффектов, приводящих к снижению ретенции (при комбинации двух БНК).
С учетом увеличения потенциала фармакокинетических и фармакодинамических взаимодействий АЭП для лечения фокальных приступов выстраиваются следующим образом: ЛСМ, далее ОКС, ЭСЛ, ЛТЖ, далее КБМ и ФТН. То есть препаратом предпочтительного выбора для комбинированной терапии фокальных припадков с точки зрения фармакокинетических и фармакодинамических преимуществ является ЛСМ. КБМ здесь обладает благоприятным профилем комбинируемости, только если первым АЭП был ЛЕВ, имеющий минимальный потенциал взаимодействий с КБМ.
ЛСМ может успешно комбинироваться с большинством АЭП, это представлено в анализе трех двойных слепых рандомизированных мультицентровых исследований эффективности и переносимости (1294 пациента) (Rosenfeld W. et al., 2009). Однако, как было показано в последующих клинических исследованиях применения ЛСМ в реальной клинической практике, его эффективность при комбинации с АЭП, не обладающими механизмом БНК (ВПА, ЛЕВ), вдвое превышает таковую в комбинациях с БНК. Это касается как общего показателя редукции приступов, так и частоты достижения ремиссии (Villanueva V. et al., 2015). Важно учитывать, что назначение ЛСМ в первой политерапии в 10 раз чаще приводит к ремиссии по сравнению с его поздним назначением (Stephen et al., 2011). Тщательно проведенные исследования эффективности и переносимости ЛСМ при фармакорезистентной парциальной эпилепсии с высокой степенью доказательности продемонстрировали ряд основных постулатов современной комбинированной терапии эпилепсии: наиболее эффективны ранние схемы терапии и поэтому они должны строиться на принципах оптимальности; наименьшим потенциалом эффективности и переносимости обладают комбинации БНК между собой.
В заключение следует отметить следующее. Проблема создания комбинаций АЭП наиболее актуальна для лечения СФЭ. Наиболее эффективными средствами для лечения СФЭ, в том числе в схемах рациональной политерапии, являются АЭП, обладающие механизмом БНК. Однако на эффективность БНК существенное влияние оказывают совместно применяемые АЭП посредством фармакокинетических и фармакодинамических взаимодействий. Риск нежелательных клинических последствий минимален при добавлении БНК к ВПА, ЛЕВ и ГБП и максимален при комбинации БНК между собой. На сегодняшний день наиболее рациональными комбинациями для лечения СФЭ являются комбинации, вовлекающие БНК и стимуляцию ГАМК (ВПА, ТПМ, ЛЕВ) (Deckers C.L.P. et al., 2000) и АЭП с мультимодальным механизмом действия (ВПА, ТПМ, ЛЕВ, ЗНС, ГБП) (Kwan P., Brodie M.J., 2000).
Нельзя не отметить высокую востребованность ВПА в схемах рациональной комбинированной терапии как генерализованных, так и фокальных эпилепсий, сохраняющуюся, несмотря на появление генерации новых высокоэффективных АЭП.
Клинические и фармакоэкономические характеристики ВПА делают их незаменимыми средствами современной фармакотерапии эпилепсии. Высокая эффективность при большинстве форм эпилепсии и типов приступов, хорошая переносимость, оптимальные показатели удержания на терапии и минимальный потенциал аггравации наряду с доступностью для абсолютного большинства пациентов определяют преимущества выбора ВПА в комбинированной терапии эпилепсии.
Список литературы: 1. Shorvon S.D., Reynolds E.N. Reduction in pоlypharmacy for epilepsy // Br. Med. J., 1979; 2: 1023–25.
2. Schmidt D. Reduction of two-drug therapy in intractable epilepsy // Epilepsia, 1983; 24: 368–376.
3. Schmidt D., Gram L. Monotherapy versus polytherapy in epilepsy. A reappraisal // CNS Drugs, 1995; 3: 194–208.
4. Lammers M.W., Hekster Y.A. Keyser A et al. Monotherapy or poly- therapy for epilepsy revisited: a quanti tative assessment // Epilepsia, 1995; 36: 440–6.
5. Scottish Intercollegiate Guidelines Network. Diagnosis and management of epilepsy. www.sign.ac.uk/pdf/sign70.pdf (accessed July 31, 2004).
6. Kwan P. , Brodie M.J. Epilepsy after the first drug fails: substitution or add-on? // Seizure, 2000; 9: 464–8.
7. Beghi E., Gatti G., Tonini C., Ben-Menachem E., Chadwick D.W., Nikanorova M. et al. Adjunctive therapy versus alternative monother-apy in patients with partial epilepsy failing on a single drug: a multicen-tre, randomized, pragmatic controlled trial // Epilepsy Res., 2003; 57: 1–13.
8. Deckers C.L.P., Hekster Y.A., Keyser A. et al. Monotherapy versus polytherapy for epilepsy: a multicenter double-blind randomized study // Epilepsia, 2001; 42: 1387–94.
9. Milul A. , Iudice A. , Adami M. et al. Alternative monotherapy or add-on therapy in patients with epilepsy whose seizures do not respond to the first monotherapy: An Italian multicenter prospective observational study // Epilepsy & Behavior, 2013; 28: 494–500.
10. Bodalia N.A., Grosso A.M., Sofat R. et al. Comparative efficacy and tolera-bility of anti-epileptic drugs for refractory focal epilepsy: systematic review and network meta-analysis reveals the need for long term comparator trials // Br. J. Clin. Pharmacol., 2013; 76 (5): 649–667.
11. Costa J., Fareleira F. , Ascencao R. et al. Clinical comparability of the new antiepileptic drug in refractory partial epilepsy: A systematic review and meta-analisis // Epilepsia, 2011; 52 (7): 1280–1291.
12. French J.A., Faught E. Rational polytherapy // Epilepsia, 2009; 50 (suppl. 8): 63–68.
13. Panayiotopoulos C.P. Principles of therapy in the epilepsies, 2010.
14. Зенков Л.Р. Лечение эпилепсии // Ремедиум, 2001.
15. Инструкции по применению grls.rosminzdrav.ru/Default.aspx, дата доступа: ноябрь 2015 г.
16. Cretin B., Hirsch E. Adjunctive antiepileptic drugs in adult epilepsy: how the first add-on could be the last // Expert Opin. Pharmacother., 2010; 11 (7).
17. Rosenfeld W. , Chesterfield M.O., Rudd G.D. et al. Lacosamide effi cacy is independent of concomitant AED(s) treatment // Neurology, 2009; 72 (11, suppl. 3): A353–A353
18. Villanueva V. , Garceґs M., Lo E. et al. Early add-on Lacosamide in a real-life Setting: results of the REALLY Study // Clin. Drug Investig., 2015; 35: 121–131.
19. Stephen et al. Epi. Behav., 2011; 22 (3): 499–504.
20. Deckers C.L.P., Czuczwar S.J., Hekster Y.A. et al. Selection of antiepileptic drug polytherapy based on mechanisms of action: the evidence reviewed // Epilepsia, 2000; 41: 1364–74.
21. Kwan P. , Brodie M.J. Epilepsy after the first drug fails: substitution or add-on? // Seizure, 2000; 9: 464–8.
