Способность препарата Эргоферон подавлять инфицирующую активность респираторно-синцитиального вируса in vitro
Статьи Опубликовано в журнале:
« ИММУНОЛОГИЯ » № 4, 2015 Шиловский И.П., Прозорова М.С., Хаитов М.Р.
ФГБУ ГНЦ «Институт иммунологии» ФМБА, 115 478, г. Москва
Вирусные инфекции нижних отделов респираторного тракта являются одной из основных причин заболеваемости и смертности среди детей, людей пожилого возраста и лиц с иммунодефицитными состояниями. Респираторно-синцитиальный вирус (РСВ) является наиболее частой причиной бронхитов, бронхиолитов и пневмоний у новорожденных детей. ежегодно в мире регистрируется до 1 млн смертельных исходов РСВ-инфекции. Большинство существующих препаратов против РСВ недостаточно эффективны, дороги и зачастую имеется риск развития осложнений при их применении. Препарат «Эргоферон» представляет собой комплекс на основе смеси поликло-нальных антител к интерферону гамма, рецептору CD4 и гистамину в релиз-активной форме. В рамках данного исследования препарата «Эргоферон» было проведено изучение его возможного влияния на инфицирующую способность РСВ. Показано, что предварительная инкубация препарата с вирусным материалом приводит к двукратному снижению его инфицирующей способности. Предположительно эффект препарата реализуется через воздействие на вирусные белки RSV-G и RSV-F, которые необходимы для проникновения вириона в клетки-мишени.
Ключевые слова: респираторно-синтициальный вирус; РСВ-инфекции; противовирусные препараты.
Введение
Вирусные инфекции нижних отделов респираторного тракта являются одной из основных причин заболеваемости и смертности среди детей, людей пожилого возраста и лиц с иммунодефицитными состояниями. Респираторно-синцитиальный вирус (РСВ) – это РНК-содержащий вирус из семейства Paramyxoviridae , вызывающий заболевания нижних дыхательных путей. Ежегодно РСВ, наравне с вирусом гриппа, ответственен за значительную долю случаев инфекционных респираторных заболеваний по всему миру. Наибольшая частота встречаемости заболеваний, вызываемых РСВ, имеет место среди детей младшего возраста, в том числе новорожденных. РСВ является наиболее частой причиной бронхитов, бронхиолитов и пневмоний у новорожденных детей, что обусловливает высокий риск для жизни ребенка и приводит к необходимости госпитализации [1]. Эпидемии РСВ, приходящиеся преимущественно на осенне-зимний период, по данным ВОЗ (Всемирной организации здравоохранения), охватывает более 60% детей, из которых 80% – дети 1-го года жизни. До 70% случаев бронхиолитов у детей преимущественно в тяжелой форме развиваются в результате осложнения инфекции, вызванной РСВ. Ежегодно в мире регистрируется до 1 млн смертельных исходов от РСВ-инфекции [2].
В настоящее время ведется поиск и разработка эффективных лекарственных средств для лечения и профилактики РСВ. Однако эффективность зарегистрированного противовирусного препарата рибавирина, применяемого при РСВ инфекциях, ставится под сомнение некоторыми авторами, кроме того, его высокая стоимость и риск осложнений сильно ограничивают его широкое применение [3]. Попытки создать эффективную вакцину против РСВ также не имели успеха. В качестве альтернативы противовирусным препаратам предлагается использование моноклональных антител, способных препятствовать распространению вируса внутри респираторного тракта. Несмотря на эффективность, препараты этой группы имеют и ряд недостатков, в числе которых высокая стоимость лечения, непродолжительность протективного действия, а также необходимость госпитализации для проведения курса внутривенного введения иммуноглобулина. Тем не менее на сегодняшний день на рынке существует группа препаратов, представляющая собой антитела в релиз-активной форме, для которой показана противовирусная активность широкого спектра. Кроме того, препараты этой группы безопасны и разрешены к применению у детей, в том числе у детей младшего возраста. Фармакологические свойства этих препаратов позволяют использовать их длительное время, в том числе для профилактики вирусных заболеваний.
Препарат «Эргоферон» (производство компании ООО НПФ «Материа Медика Холдинг») представляет собой комплекс на основе смеси поликлональных антител к интерферону гамма, рецептору cD4 и гистамину в релиз-активной форме [8]. В ходе ранее проведенных исследований in vitro была показана противовирусная активность Эргоферона в отношении РСВ: препарат подавлял репликацию РСВ в клетках, значимо снижая вирусную нагрузку [4]. В рамках продолжения исследования препарата «Эргоферон» было проведено изучение характера противовирусной активности Эргоферона и оценка его возможного влияния на инфицирующую способность РСВ.
Материал и методы
Клеточная линия, питательные среды, штамм вируса
Исследование проводилось на культуре клеток эмбриональной почки макаки МА-104, которая является чувствительной к РСВ [5]. Для культивирования клеток использовалась полная среда DMEM, содержащая 600 мг/л L-глутамина, 80 мг/л гентамицина, 20 mM буфера Hepes, 10% фетальной бычьей сыворотки. Для заражения клеток использовался респираторно-синцитиальный вирус штамм A2(источник: Airway Disease Infection Section and MRc & Asthma UK centre in Allergic Mechanisms of Asthma national Heart and Lung Institute, Imperial college London, UK). Исходный титр вируса 1–3×106TCID50/мл. После заражения клетки культивировали в поддерживающей бессывороточной среде DMEM (1200 мг/л L-глутамина, 80 мг/л гентамицина, 20 mM буфера Hepes).
Оценка цитотоксического действия растворителя.
В связи с тем, что в исследовании тестировался водный раствор Эргоферона, для исключения цитотоксического действия растворителя (воды) на клетки (осмотическая гибель клеток) на первом этапе исследования проводился подбор оптимального разведения растворителя средой для культивирования.
Подобранный объем растворителя при добавлении к клеткам не должен вызывать их не специфическую гибель и влиять на их жизнеспособность. Это позволяет исключить влияние растворителя на клетки при изучении противовирусного действия препарата в основном эксперименте. Осмотическая цитотоксичность воды оценивалась колориметрическим методом, основанным на митохондри-альном метаболизме клеток - МТТ-тест (соль метилтетразолия, Sigma). Для проведения МТТ-теста клетки засеивали цв 96-луночный планшет в количестве 2×104 кл./лун. в объеме 100 мкл полной питательной среды DMEM. Подсчет концентрации клеток осуществляли с использованием камеры Горяева и инвертированного микроскопа. Инкубировали 1 сутки в 5% атмосфере СО2 при 37°С до образования монослоя. Затем к клеткам добавляли препарат без разведения, в разведениях 1/2, 1/4, 1/8, 1/16 и 1/32 (от общего объема пробы). В качестве положительного контроля использовали стерильную дистиллированную воду, которая вызывает осмотическую гибель клеток. В качестве отрицательного контроля использовали неразведенную питательную среду DMEM без добавления каких-либо препаратов. Инкубировали 1 сутки в 5% атмосфере СО2 при 37°С. Затем в лунки планшета, не удаляя среду, добавляли 25 мкл MTT в концентрации 4 мг/ мл в фосфатно-солевом буфере. Инкубировали 4 часа в 5% атмосфере СО2 при 37°С. Затем добавляли 50 мкл раствора додецилсульфата натрия (20% SDS на воде с 0,02 H2SO4). Инкубировали 18 часов в 5% атмосфере СО при 37°С. Измеряли оптическую плотность при 570 и 650 нм. По результатам данного эксперимента определяли разведение, в котором не наблюдали осмос-опосредованной неспецифической гибели или ингибирования роста клеток.
Соответствующий объем растворителя использовали в качестве максимального объема препаратов, добавляемых к клеткам, в последующих экспериментах по определению противовирусной активности.
Оценка противовирусной активности Эргоферона.
Тестирование образцов проводилось на культуре клеток эмбриональной почки макаки МА-104. В качестве контроля использовалась вода очищенная, прошедшая технологическую обработку аналогичную Эргоферону (Контроль 1), и вода очищенная без какой-либо технологической обработки (Контроль 2). Клетки засеивали в 96-луночный планшет в количестве 20 тыс. кл. на лунку в объеме 100 мкл полной среды DMEM. На второй день эксперимента готовили смесь исследуемых образцов и вируса РСВ-A2 в объемном соотношении 1:3 (125 мкл препарата и 375 мкл вируса с титром 1-3 х 106TCID50/мл) и инкубировали при комнатной температуре в течение 1 часа. Перед внесением смеси образцов и вируса в культуру клеток планшеты с клетками отмывали стерильным физиологическим раствором 100 мкл/лунку, после чего вносили по 100 мкл/лунку бессывороточной среды.
Затем в культуру клеток вносили смесь вируса и исследуемых образцов и титровали, разводя смесь в десять раз. Использовали следующие разведения смеси: без разведения, 1/10, 1/100, 1/1тыс, 1/10 тыс., 1/100 тыс., 1/1 млн. Каждая точка разведения ставилась в четырех повторах. После внесения смеси вируса и препаратов в лунки, клетки инкубировали в течение 3-5 суток в СО2-инкубаторе при 37°С до появления цитопатического действия. После чего проводили оценку противовирусной активности препарата визуально с помощью световой микроскопии, а именно подсчитывали количество бляшек (синцитиев), образовавшихся на монослое в результате репродукции вируса. Эксперимент был поставлен в 10 независимых повторах.
Статистическая обработка результатов.
Для оценки показателей цитотоксичности вируса РСВ в отношении культуры клеток МА-104 использовался метод пробит-анализа, являющийся разновидностью регрессионного анализа для бинарных показателей. Пробит-модель позволяет оценить вероятность гибели/выживания клеток при заданном значении факторов, в нашем случае - разведении вируса. Использованный метод является более сложным по сравнению с часто применяющимся методом Кербера-Спирмена, но вместе с этим и более точным. По полученным данным строились кривые доза-эффект, по которым определялись разведения вируса, оказывающие цитопатический эффект на 10%, 50% и 90% клеток соответственно.
Результаты отражают показатели TCID10, TCID50 и TCID90, представляемые в виде прогнозируемого значения степени разведения (титра) вируса в экспериментальной культуре клеток с 95% доверительными интервалами. Таким образом, протективное действие препарата должно проявляться в снижении титра вируса на уровне TCID10, TCID50 или TCID90, т.е. возникновение цитопатогенного эффекта на указанных уровнях должно происходить в культуре с бóльшей концентрацией вируса по сравнению с Контролями 1 и 2.
Полученные кривые и рассчитанные показатели цито-токсичности в группах Эргоферона, Контроля 1 и Контроля 2 сравнивались между собой методом нелинейных смешанных моделей. Полученные отличия считались статистически значимыми при p Pезультаты и обсуждение
Оценка цитотоксического действия растворителя Клетки, к которым добавляли неразбавленную стерильную дистиллированную воду (положительный контроль), погибали из-за осмотического шока, и, соответственно, средняя оптическая плотность в данном случае была низкой. Клетки, которые инкубировались в неразведенной питательной среде DMEM (отрицательный контроль), не проявляли признаков цитотоксичности. При внесении в культуру клеток растворителя препарата «Эргоферон» в чистом виде (без разведения средой) наблюдалась выраженная осмотическая цитотоксичность, поскольку растворитель представляет собой очищенную воду. При разведении образца в 2 раза средой DMEM выраженной гибели клеток не происходило, однако наблюдался замедленный рост и сниженная жизнеспособность клеток, что выражалось в снижении оптической плотности почти в 2 раза по сравнению с отрицательным контролем (средой DMEM). По всей видимости, такой эффект обусловлен разведением питательной среды и снижением концентрации ее компонентов, необходимых для роста и жизнедеятельности клеток. При внесении в клетки растворителя препарата в разведении 1/4 и выше не наблюдалось изменения оптической плотности (рис. 1), поэтому в дальнейших экспериментах использовалось разведение исследуемых препаратов средой DMEM в соотношении 1/4, которое исключало неспецифическое цитотоксическое действие растворителя (воды очищенной) при изучении противовирусного действия Эргоферона.
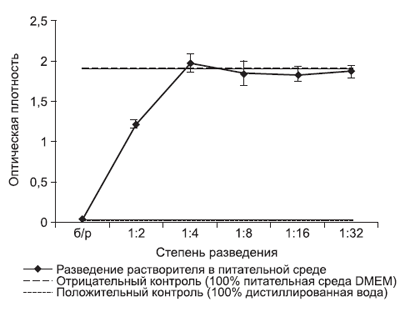
Рис. 1. Изменение оптической плотности в зависимости от разведения растворителя
питательной средой в МТТ-тесте.
Для контролей линиями указаны показатели оптической плотности для раствора контроля без разведения (неразведенная питательная среда DMEM и стерильная дистиллированная вода соответственно).
Оценка противовирусного действия препарата «Эргоферон».
Было показано, что при внесении к образцам клеток препарата «Эргоферон» в смеси (1:3v/v) с вирусом РСВ штамма A2 (исходный титр 1–3×106TCID50/мл), полученные значения титра вируса на уровне TCID10и TCID50в группе Эргоферона являются наименьшими из всех тестируемых групп (рис. 2, см. таблицу).
Противовирусная активность исследуемых образцов при разведении 1/4.
Титр вируса на уровне TCID10, TCID50 и TCID90 по данным пробит-анализа
| Препарат | Показатель | Пробит-анализ TCID |
|---|---|---|
| Прогнозируемый титр вируса TCID/ml [95% Доверительный интервал] | ||
| Эргоферон | TCID90 TCID50 TCID10 | 7910 [4080-12094] 28025 [19495-40408]* 99290 [64641-194558]# |
| Контроль 1 | TCID90 TCID50 TCID10 | 13209 [6173-21285] 58771 [39728-87465] 261491 [160723-571739] |
| Контроль 2 | TCID90 TCID50 TCID10 | 7298 [3211-12431] 43936 [28704-67650] 264501 [153601-614987] |
| * – титр вируса на уровне TCID50 в группе Эргоферона статистически значимо ниже такового в группах контроля 1 и 2 (p # – титр вируса на уровне TCID10 в группе Эргоферона статистически значимо ниже такового в группах контроля 1 и 2 (p | ||
Методом нелинейных смешанных моделей было показано статистически достоверное (p 10и TCID50в группе Эргоферона по сравнению с Контролями. Значения TCID10 составили 99,3 [64,6–194,6](×103) /мл против 261,5 [160,7– 571,7] (×103)/мл и 264,5 [153,6-614,99] (×103) /мл для Эргоферона, Контроля 1 и Контроля 2 соответственно. Значения TCID50 составили 28,03 [19,5–40,4](×103) /мл и 58,8 [39,7– 87,5](×103) /мл, для Эргоферона, Контроля 1 и Контроля 2 соответственно. Полученные данные свидетельствуют о наличии у Эргоферона противовирусного эффекта в отношении вируса РСВ штамма A2.
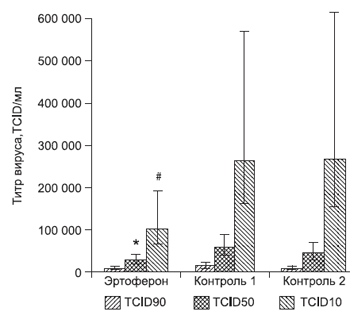
Рис. 2. Противовирусная активность Эргоферона: показатели гибели клеток MA-104,
зараженных разными дозами респираторно-синцитиального вируса.
Представлены расчетные значения титра вируса на уровнях TCID10, TCID50 и TCID90, полученные методом пробит-анализа на основании выживаемости клеток при заражении вирусом РСВ штамма А2 после его инкубации с образцами (в разведении 1/4) в течение 1 ч.
* – титр вируса на уровне TCID50 в группе Эргоферона статистически значимо ниже такового в группах Контроля 1 и 2 (p 10 в группе Эргоферона статистически значимо ниже такового в группах Контроля 1 и 2 (p
Предыдущие исследования показали способность Эргоферона оказывать протективное действие на клетки in vitro , при их заражении различными инфекционными дозами РСВ: препарат ингибировал репликацию РСВ, снижая вирусную нагрузку на экспериментальные клетки [4]. Дизайн данного исследования предполагал изучение прямого воздействия Эргоферона на вирус путем их совместной инкубации в течение 1 часа и последующего заражения этой смесью чувствительной культуры клеток (МА-104). Более того, после внесения смеси вируса и Эргоферона в культуру клеток, проводилось ее десятичное титрование, поэтому можно говорить о том, что эффект препарата непосредственно на экспериментальную культуру клеток был незначительным в виду высокого его разведения. Это позволяет предположить, что в условиях проведенного эксперимента эффект препарата реализуется через воздействие на вирусные частицы и их инфицирующую способность.
Механизм инфицирующего действия РСВ опосредован белком вируса RSv-G, обеспечивающего адгезию к клетке [6], и RSv-F, обеспечивающего слияние оболочки вируса с мембраной клетки [7]. Показано, что с переводом в релиз-активную форму характер действия антител меняется и релиз-активные формы антител приобретают особое свойство оказывать модифицирующее действие на структуру исходного вещества, или же структурно сходные белки, вызывая конформационные изменения этих молекул, что сопровождается изменением физико-химических и биологических свойств [8]. Это позволяет предположить, что Эргоферон, содержащий антитела в релиз-активной форме, способен выполнять роль аллостерического модулятора, воздействующего на вирусные белки RSv-G и RSv-F, что снижает способность вирусных частиц связываться с клетками и проникать в них.
Эти предположения о механизме действия препарата «Эргоферон» требуют дополнительных исследований для своего подтверждения. Тем не менее, полученные в данном исследовании и предыдущих экспериментах [4, 9] результаты позволяют утверждать, что Эргоферон является перспективным препаратом с комбинированным противовирусным, противовоспалительным и антигистаминным действием. Отдельное исследование in vitro не позволяет реализовать в полном объеме все возможные эффекты Эргоферона, поскольку его трехкомпонентная формула рассчитана на реализацию фармакологического действия в отношении различных компонентов иммунной системы, в частности на усиление противовирусного клеточно-опосредованного иммунного ответа, а также на воздействие на группу провоспалительных медиаторов. Системное противовирусное действие Эргоферона in vivo будет более выражено, поскольку позволит реализовать эти комбинированные эффекты.
Заключение
Таким образом, подводя итог проведенного исследования, выявленное в данной работе прямое противовирусное действие Эргоферона в отношении РСВ позволяет утверждать, что препараты на основе релиз-активных разведений антител способны восполнить недостаток действенных противовирусных средств, т.к. они могут проявлять активность широкого спектра, как в плане целевых вирусных агентов, так и в плане реализуемых механизмов фармакологической активности. Литература 1. Resch B., Kurath S., Manzoni P. Epidemiology of respiratory syncytial virus infection in preterm infants. Open Microbiol. J. 2011; 5: 135–43.
2. Blanco del val A., Eiros Bouza J.M., Mayo Iscar A. et al. Respiratory syncytial virus infection: a decade of contributions. Infez. Med. 2012; 20(3): 169–75.
3. Turner T.L., Kopp B.T., Paul G. et al. Respiratory syncytial virus: current and emerging treatment options. Clinicoecon. Outcomes Res. 2014; 6: 217–25.
4. Шиловский И.П., Корнилаева Г.В., Хаитов М.Р. Новые возможности в терапии респираторно-синцитиальной вирусной инфекции: данные доклинического исследования препарата «Эргоферон». Иммунопатология и клиническая иммунология. 2012; 3: 144–8.
5. Акимов В.С., Хаитов М.Р., Файзулоев Е.Б. и др. Подавление репродукции респираторно-синцитиального вируса методом siRnA. Вопросы вирусологии. 2007; 2: 8–12.
6. Levine S., Klaiber-Franco R., Paradiso P.R. Demonstration that glycoprotein G is the attachment protein of respiratory syncytial virus. J. Gen. Virol. 1987; 68 (9): 2521–4.
7. young-In K., Devincenzo J. P., Jones B.G. et al. Respiratory syncytial virus human experimental infection model: Provenance, production, and sequence of low-passaged memphis-37 challenge virus. PLoS One. 2014; 9(11): e113100.
8. Эпштейн О.И. Феномен релиз-активности и гипотеза «пространственного» гомеостаза. Успехи физиологических наук. 2013; 44 (3): 54–76.
9. Жавберт Е.С., Дугина Ю.Л., Эпштейн О.И. Противовоспалительные и противоаллергические свойства антител к гистамину в релиз-активной форме: обзор экспериментальных и клинических исследований. Детские инфекции. 2014; 1: 40–3.


