Использование препарата силодозин для лечения СНМП у мужчин с подозрением на ДГПЖ: Результаты
Статьи ChristopherR. Chapple, FrancescoMontorsi, TeuvoL.J. Tammela, Manfred Wirth, EvertKoldewijn, Eldiberto Fernandez FernandezПредыдущий раздел | Содержание | Следующий раздел
3. Результаты
3.1. Распределение участников клинического исследования
В общей сложности скрининг прошли 1 228 пациентов, из которых 955 были рандомизированы на 3 группы. Пациенты первой группы получали силодозин в дозе 8 мг (381), пациенты второй группы - тамсулозин в дозе 0,4 мг (384), а пациенты третьей - плацебо (190). Первый пациент был включен в исследование 18 мая 2006 г., а последний пациент завершил участие в исследовании 10 мая 2007 г На рис. 1 показано распределение пациентов. Основными причинами прерывания участия в исследовании были нарушение протокола (2,5%) и добровольное прекращение терапии участниками (2,4%). Во всех группах уровень прерывания терапии вследствие TEAE был невысоким (≤ 2,1%).
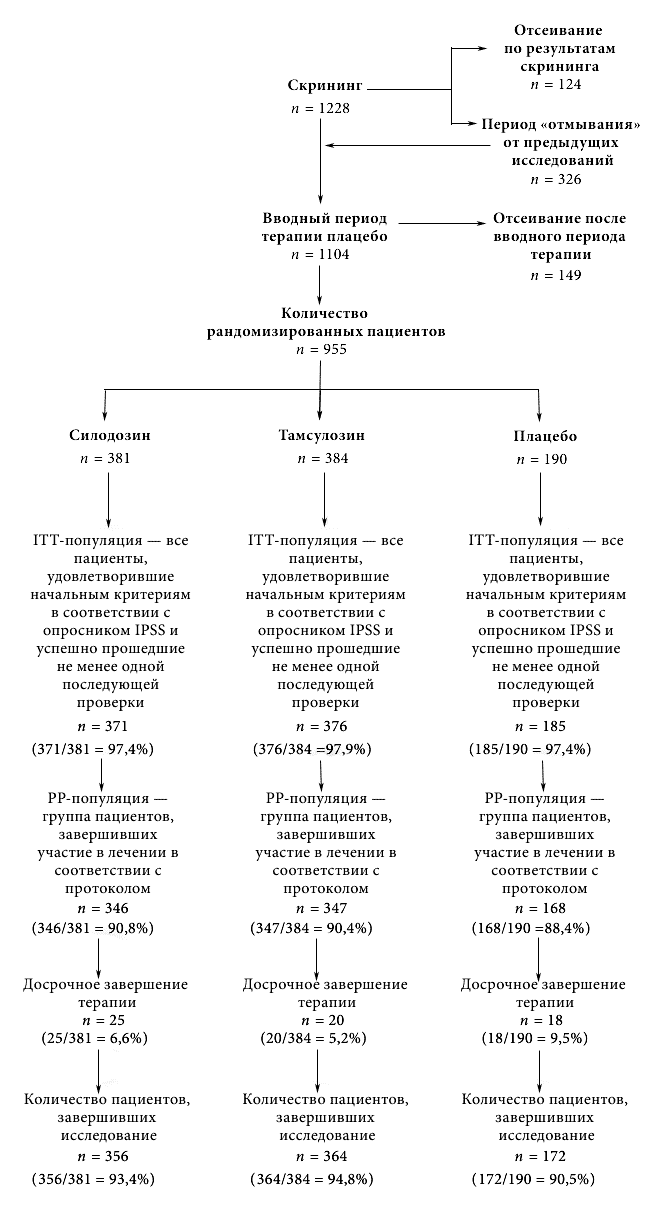
Рис. 1. Распределение участников исследования. ITT = пациенты, удовлетворившие начальным критериям в соответствии с опросником IPSS и успешно прошедшие не менее одной последующей проверки; PP = группа пациентов, завершивших участие в лечении в соответствии с протоколом.
3.2. Демографические характеристики и прочие параметры начальной точки исследования
В табл. 1 представлены демографические характеристики и прочие параметры начальной точки исследования для безопасной популяции.
Таблица 1. Демографическая характеристика участников исследования и параметры начального уровня
| Силодозин 8 мг (n = 381) | Тамсулозин 0,4 мг (n = 384) | Плацебо (n = 190) | Общее количество участников исследования (n = 955) | Значение p | |
| Возраст, лет, n (%) | |||||
| 50-64 | 158 (41,5) | 157 (40,9) | 75 (39,5) | 390 (40,8) | |
| 65-74 | 168 (44,1) | 183 (47,7) | 93 (48,9) | 444 (46,5) | |
| ≥ 75 | 55 (14,4) | 44 (11,5) | 22 (11,6) | 121 (12,7) | |
| Среднее ± SD | 65,8 ± 7,70 | 65,9 ± 7,41 | 66,0 ± 7,37 | 65,8 ± 7,51 | |
| Среднее | 66,0 | 66,5 | 67,0 | 67,0 | |
| Минимум-Максимум | 50-87 | 50-85 | 50-81 | 50-87 | 0,957 |
| Расовая принадлежность, n (%) | |||||
| Европеоиды | 381 (100,0) | 384 (100,0) | 190 (100,0) | 955 (100,0) | Определить невозможно |
| Индекс массы тела, кг/м2, n (%) | |||||
| < 25 | 84 (22,0) | 109 (28,4) | 46 (24,2) | 239 (25,0) | |
| 25-29 | 238 (62,5) | 214 (55,7) | 118 (62,1) | 570 (59,7) | |
| ≥ 30 | 59 (15,5) | 61 (15,9) | 25 (13,2) | 145 (15,2) | 0,624 |
| Общий балл по опроснику IPSS | |||||
| Среднее ± SD | 19,1 ± 4,23 | 18,9 ± 4,37 | 19,3 ± 4,33 | 19,1 ± 4,30 | |
| Среднее | 19,0 | 18,0 | 19,0 | 18,0 | |
| Интервал | 13-33 | 8-3 | 13-35 | 8-35 | 0,517 |
| Балл IPSS по подшкале накопления мочи | |||||
| Среднее ± SD | 7,9 ± 2,49 | 7,9 ± 2,51 | 8,0 ± 2,64 | 7,9 ± 2,53 | |
| Среднее | 8,0 | 8,0 | 8,0 | 8,0 | |
| Интервал | 1-15 | 0-15 | 1-15 | 0-15 | 0,836 |
| vБалл IPSS по подшкале нарушения опорожнения мочевого пузыря | |||||
| Среднее ± SD | 11,3 ± 3,13 | 11,0 ± 3,27 | 11,3 ± 3,22 | 11,2 ± 3,20 | |
| Среднее | 11,0 | 11,0 | 11,0 | 11,0 | |
| Интервал | 2-20 | 3-20 | 4-20 | 2-20 | 0,481 |
| Качество жизни, связанное с симптомами нарушения мочевых путей, n (%) | |||||
| Прекрасное (Delighted) | 0 (0,0) | 3 (0,8) | 0 (0,0) | 3 (0,3) | |
| Хорошее (Pleased) | 2 (0,5) | 6 (1,6) | 0 (0,0) | 8 (0,8) | |
| В целом удовлетворительное (Mostly satisfied) | 27 (7,1) | 23 (6,0) | 12 (6,3) | 62 (6,5) | |
| Смешанное (Mixed) | 98 (25,7) | 105 (27,3) | 44 (23,2) | 247 (25,9) | |
| В целом неудовлетворительное (Mostly dissatisfied) | 140 (36,7) | 135 (35,2) | 65 (34,2) | 340 (35,6) | |
| Плохое (Unhappy) | 98 (25,7) | 95 (24,7) | 57 (30,0) | 250 (26,2) | |
| Ужасное (Terrible) | 16 (4,2) | 17 (4,4) | 10 (5,3) | 43 (4,5) | |
| Оценка не дана | 0 (0,0) | 0 (0,0) | 2 (1,1) | 2 (0,2) | |
| Среднее ± SD | 3,9 ± 1,01 | 3,9 ± 1,09 | 4,0 ± 1,00 | 3,9 ± 1,04 | |
| Среднее | 4,0 | 4,0 | 4,0 | 4,0 | |
| Интервал | 1-6 | 0-6 | 2-6 | 0-6 | 0,141 |
| Скорость тока мочи Q max , мл/с | |||||
| Среднее ± SD | 10,78 ± 2,726 | 10,27 ± 2,726 | 10,32 ± 2,816 | 10,49 ± 2,752 | |
| Среднее | 11,00 | 10,20 | 10,60 | 10,60 | |
| Интервал | 4,0-28,3 | 4,0-20,8 | 4,6-15,0 | 4,0-28,3 | 0,026 |
Qmax = максимальная скорость мочетока;
SD = стандартное отклонение.
Существенных статистических различий в параметрах возраст, индекс массы тела, общий балл IPSS, баллы подшкал накопления мочи и опорожнения мочевого пузыря, а также снижения качества жизни вследствие наличия симптомов нижних мочевых путей между тремя группами выявлено не было. Необходимо отметить, что гипертензию наблюдали у 424 пациентов (44,4%). При этом большое количество пациентов проходили лечение антигипертензивными препаратами. На исходном уровне многие пациенты имели в анамнезе эректильную дисфункцию (24,0%) или жалобы на нарушение эякуляции. Данные нарушения включали снижение количества семени, выбрасываемого при оргазме (8,3%), снижение интенсивности семяизвержения (6,9%) и отсутствие семяизвержения при оргазме (0,8%). Суммарная доля нарушений эякуляции до начала терапии составила 24%.
3.3. Результаты исследования эффективности
3.3.1. Изменение общего балла международного индекса симптомов при заболеваниях простаты (первичного параметра эффективности) по сравнению с начальным уровнем
Изменение общего балла IPSS (вопросы 1-7) в разных группах пациентов по сравнению с начальным уровнем, а также различия после активной терапии и использования плацебо представлены в табл. 2 и на рис. 2 соответственно.
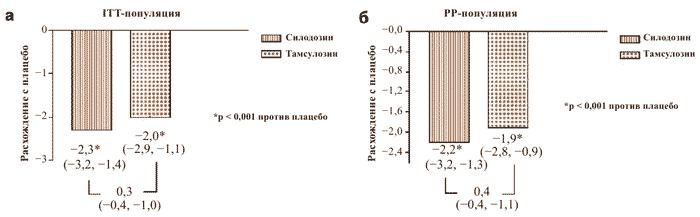
Рис. 2. Расхождения в общем балле Международного индекса симптомов при заболеваниях предстательной железы по сравнению с плацебо
ITT = пациенты, удовлетворившие начальным критериям в соответствии с опросником IPSS и успешно прошедшие не менее одной последующей проверки; PP = все пациенты, завершившие исследование без нарушений протокола
Таблица 2. Изменение общего балла Международного индекса симптомов при заболеваниях простаты
| Силодозин,8 мг | Тамсулозин, 0,4 мг | Плацебо | |
| ITT-популяция | n = 371 | n = 376 | n = 185 |
| Начальный уровень, среднее ± SD | 19 ± 4 | 19 ± 4 | 19 ± 4 |
| Изменение между начальным и конечным уровнями, скорректированные средние величины | -7,0 | -6,7 | -4,7 |
| Расхождение между активной терапией против плацебо (95% CI) | -2,3 (-3,2; -1,4) a | -2,0 (-2,9; -1,1) a | - |
| Расхождение для тамсулозина и силодозина (95% ДИ) | 0,3 (-0,4; 1,0) b | - | - |
| PP-популяция | n = 346 | n = 347 | n = 168 |
| Начальный уровень, среднее ± SD | 19 ± 4 | 19 ± 4 | 19 ± 4 |
| Изменение между начальным и конечным уровнями, скорректированные средние величины | -7,0 | -6,7 | -4,8 |
| Расхождение между активной терапией против плацебо (95% ДИ) | -2,2 (-3,2; -1,3) a | -1,9 (-2,8; -0,9) a | - |
| Расхождение для тамсулозина и силодозина (95% ДИ) | 0,4 (-0,4; 1,1) b | - | - |
ДИ = доверительный интервал;
ITT = пациенты, удовлетворившие начальным критериям в соответствии с опросником IPSS и успешно прошедшие не менее одной последующей проверки;
PP = все пациенты, завершившие исследование без нарушений протокола;
SD = стандартное отклонение.
ap < 0,001 против плацебо
b Не меньшая эффективность
Во всех группах ответ на лечение не выходил на фазу плато. Однако максимальное снижение общего балла IPSS происходило очень быстро в течение первых двух недель после начала лечения. Как в ITT-, так и в PP-популяциях во всех контрольных точках наблюдали более высокую эффективность активных режимов терапии по сравнению с плацебо, и при этом изменения были статистически значимыми (p <0,001).
3.3.2. Частота ответа на лечение на основании общего балла IPSS
Во всех трех группах наблюдали непрерывное увеличение количества пациентов, ответивших на лечение на основании общего балла IPSS между началом и 12-й неделей терапии. В конечной точке исследования улучшение наблюдали у 66,8 и 65,4% пациентов, получавших силодозин и тамсулозин соответственно, при этом аналогичный показатель в группе пациентов, получавших плацебо, составил 50,8%.
Различие данных, полученных в результате активной терапии по сравнению с плацебо, было высоко статистически значимым (p < 0,001), тогда как при сравнении силодозина и тамсулозина результаты не были статистически значимыми.
3.3.3. Баллы по подшкалам накопления мочи и опорожнения мочевого пузыря
В табл. 3 представлено среднее изменение баллов по подшкалам накопления мочи (вопросы 2, 4 и 7) и опорожнения мочевого пузыря (вопросы 1, 3, 5 и 6) за время исследования.
Таблица 3. Изменения баллов в подпунктах "накопление мочи" и "мочеиспускание" по Международному индексу симптомов при заболеваниях простаты
| Группа | Нарушение накопления мочи, балл по IPSS | Нарушение мочеиспускания, балл по IPSS | Изменение по сравнению с начальным уровнем | Расхождение по сравнению с плацебо (95% CI) | Изменение по сравнению с начальным уровнем | Расхождение по сравнению с плацебо (95% ДИ) |
| Силодозин | -2,5 | -0,7 a (-1,1; -0,2) | -4,5 | -1,7 b (-2,2; -1,1) |
| Тамсулозин | -2,4 | -0,6 a (-1,1; -0,2) | -4,2 | -1,4 b (-2,0; -0,8) |
| Плацебо | -1,8 | -2,9 | ||
IPSS = Международный индекс симптомов при заболеваниях простаты.
ap < 0,001 против плацебо.
b p = 0,002 против плацебо.
Во всех контрольных точках наблюдали статистически значимое отличие эффективности обоих режимов активной терапии по сравнению с плацебо в лучшую сторону. При сравнении силодозина и тамсулозина статистически значимых различий выявлено не было, несмотря на то, что балл подшкалы накопления мочи по IPSS для силодозина был несколько выше. Необходимо отметить, что в подгруппе пациентов с никтурией перед началом исследования (n = 764) наиболее значимое уменьшение проявления никтурии по сравнению с плацебо показал силодозин (изменение на -0,9; -0,8 и -0,7 по сравнению с начальным уровнем для силодозина, тамсулозина и плацебо соответственно; для пары силодозин-плацебо p = 0,013, для пары силодозин-тамсулозин p = 0,314).
3.3.4. Качество жизни
Во всех группах пациентов, получавших лечение по причине наличия симптомов мочевых путей, наблюдали более выраженное улучшение качества жизни по сравнению с начальным уровнем (вопрос 8 опросника IPSS): -1,1 для силодозина, -1,1 для тамсулозина и -0,8 для плацебо. Во всех контрольных точках наблюдали высоко статистически значимые различия между результатами для активной терапии и приема плацебо, которые в конечной точке составили p = 0,002. После окончания исследования доля пациентов с отрицательным (в целом неудовлетворительное, плохое, ужасное) качеством жизни вследствие наличия симптомов мочевых путей в группах силодозина и тамсулозина стало меньше более чем на 50% (от 66,9% до 34,0% и от 64,1% до 29,0% соответственно) и лишь на 1/3 - в группе плацебо (от 69,7% до 45,4%) (табл. 4).
Таблица 4. Обобщенные данные по качеству жизни пациентов с нарушением мочевых путей
| Силодозин, количество (%) | Тамсулозин, количество (%) | Плацебо, количество (%) | |
| Исходный уровень | |||
| Прекрасное, хорошее или в целом удовлетворительное | 29 (7,8) | 32 (8,5) | 12 (6,5) |
| Смешанное: удовлетворительное и неудовлетворительное примерно в равной степени | 94 (25,3) | 103 (27,4) | 43 (23,2) |
| В целом неудовлетворительное, плохое или ужасное | 248 (66,9) | 241 (64,1) | 129 (69,7) |
| 12-я нед. a | |||
| Прекрасное, хорошее или в целом удовлетворительное | 163 (44,0) | 168 (44,7) | 63 (34,0) |
| Смешанное: удовлетворительное и неудовлетворительное примерно в равной степени | 82 (22,1) | 99 (26,3) | 38 (20,5) |
| В целом неудовлетворительное, плохое или ужасное | 126 (34,0) | 109 (29,0) | 84 (45,4) |
a Анализ данных на 12-й нед. проводили на основании последних полученных результатов.
3.3.5. Максимальная скорость потока мочи
В обеих группах пациентов, получавших активную терапию, наблюдали значительный рост Qmax по сравнению с группой плацебо, однако это увеличение не было статистически значимым. Скорректированная средняя величина изменения между начальным и конечным уровнями составила 3,77 мл/с для силодозина (p = 0,089 по сравнению с плацебо); 3,53 мл/с для тамсулозина (p = 0,221 по сравнению с плацебо) и 2,93 мл/с для плацебо. Доля пациентов, у которых наблюдали увеличение Qmax, была выше в группах, получавших терапию силодозином и тамсулозином, по сравнению с группой плацебо. Однако для обеих получавших терапию групп пациентов статистически значимые различия по сравнению с плацебо в контрольных точках были единичными вследствие высокого результата, продемонстрированного плацебо. В конечной точке исследования доля пациентов, ответивших на лечение, составила 46,6% (p = 0,155 по сравнению с плацебо) и 46,5% (p = 0,141 по сравнению с плацебо) для групп, получавших силодозин и тамсулозин, и 40,5% для группы, получавшей плацебо. Данное различие не являлось статистически значимым.
3.4. Результаты исследования безопасности препарата
3.4.1. Возникшие во время лечения нежелательные явления
В группе, получавшей силодозин, у 34,9% (133 из 381) пациентов наблюдали не менее одного TEAE, у 28,9% (111 из 384) - в группе, получавшей тамсулозин, и у 24,2% (46 из 190) - в группе, получавшей плацебо (в паре силодозин-плацебо: p = 0,0094; силодозин-тамсулозин: p = 0,0749). В число наиболее распространенных TEAE (> 2%) вошли следующие нежелательные явления: снижение или отсутствие эякуляции при оргазме (в медицинском словаре нормативно-правовой деятельности данные эффекты объединены под термином "ретроградная эякуляция") и головная боль. Ретроградную эякуляцию наблюдали у 14,2% (54 из 381) пациентов, принимавших силодозин, что значительно превышало аналогичные показатели в группах пациентов, принимавших тамсулозин и плацебо (соответственно 2,1% (6 из 384) и 1,1% (2 из 190)). Данный термин включал следующие понятия: оргазм без семяизвержения, снижение качества эякулята и собственно ретроградную эякуляцию. В группе пациентов, получавших тамсулозин, частота возникновения головной боли в качестве нежелательного явления была выше (5,5%; 21 из 384) по сравнению с группой пациентов, принимавших силодозин (2,9%; 11 из 381). Однако данное значение было сопоставимым с частотой головных болей в группе пациентов, получавших плацебо (4,7%; 9 из 190).
Доля пациентов, прервавших лечение по причине TEAE, была небольшой и не была статистически различной для разных групп (силодозин 2,1% - 8 пациентов; тамсулозин 1,0% - 4 пациента; плацебо 1,6% - 3 пациента). Наиболее частой причиной досрочного прерывания лечения было отсутствие эякуляции (5 пациентов в группе силодозина и 1 в группе тамсулозина). Данное нежелательное явление носило обратимый характер и исчезало после прекращения терапии.
У 9 пациентов из 955 (0,9%) наблюдали TEAE серьезной степени тяжести, 3 из которых могли быть связаны с использованием исследуемого препарата: рак предстательной железы и наджелудочковая аритмия (силодозин), а также беспокойство (тамсулозин). За время проведения исследования было зарегистрировано 2 случая летального исхода, оба из которых никак не связаны с исследуемыми препаратами.
3.4.2. Прочие параметры безопасности
Ни в одной группе пациентов за время проведения исследования клинически значимых изменений лабораторных параметров, основных физиологических показателей или ЭКГ зарегистрировано не было. В табл. 5 представлены значения ДАД, САД и ЧП в положении лежа на спине, а также изменения этих показателей в результате приема препаратов силодозин, тамсулозин и плацебо по сравнению с начальным уровнем. При использовании препарата силодозин клинически релевантных или статистически значимых расхождений по сравнению с плацебо отмечено не было. Важной характеристикой препарата является отсутствие клинически релевантных или статистически значимых изменений артериального давления или ЧП по сравнению с приемом плацебо, тогда как при приеме препарата тамсулозин было отмечено небольшое, но статистически значимое расхождение данных параметров по сравнению с плацебо.
Таблица 5. Артериальное давление в положении лежа на спине
| Силодозин, 8 мг (n = 381) | Тамсулозин, 8 мг (n = 384) | Плацебо (n = 190) | |
| Систолическое артериальное давление в положении лежа на спине | |||
| Исходный уровень (среднее ± SD) | 133,8 (12,61) | 133,0 (13,29) | 132,8 (13,57) |
| CFB в конечной точке (скорректированные средние значения) | -1,8 | -2,2 | -0,4 |
| Расхождения между активной терапией и плацебо (95% CI) | -1,4 (-3,0; -0,1) | -1,4 (-3,0; -0,1) | - |
| Значение p против плацебо | 0,075 | 0,022 | - |
| Расхождение между тамсулозином и силодозином (95% CI) | -0,4 (-1,7; -0,9) | - | - |
| Значение p против тамсулозина | 0,536 | ||
| Диастолическое артериальное давление в положении лежа на спине | |||
| Начальный уровень (среднее ± SD) | 80,6 (7,47) | 80,5 (7,99) | 80,6 (7,70) |
| CFB в конечной точке (скорректированные средние значения) | -1,0 | -1,6 | -0,6 |
| Расхождения между активной терапией и плацебо (95% CI) | -0,3 (-1,4; 0,7) | -1,0 (-2,1; 0,0) | - |
| Значение p против плацебо | 0,515 | 0,060 | - |
| Расхождение между тамсулозином и силодозином (95% CI) | -0,7 (-1,5; 0,2) | - | - |
| Значение p против тамсулозина | 0,132 | - | - |
| Частота пульса в положении лежа на спине | |||
| Начальный уровень (среднее ± SD) | 67,4 (8,83) | 67,8 (9,10) | 67,3 (8,43) |
| CFB в конечной точке (скорректированные средние значения) | 0,8 | 1,3 | 1,1 |
| Расхождения между активной терапией и плацебо (95% CI) | -0,3 (-1,6; 1,0) | -0,2 (-1,1; 1,5) | - |
| Значение p против плацебо | 0,643 | 0,753 | - |
| Расхождение между тамсулозином и силодозином (95% CI) | 0,5 (-0,5; 1,5) | - | - |
| Значение p против тамсулозина | 0,340 | - | - |
CFB = изменение по сравнению с начальным уровнем;
ДИ = доверительный интервал;
SD = стандартное отклонение.
При проведении ортостатической пробы среди пациентов, прошедших рандомизацию и принявших первую дозу препарата, заметного снижения артериального давления не наблюдали ни у одного из пациентов. В обеих группах пациентов, получавших активную терапию, увеличение ЧП до значения > 20 уд ./мин наблюдали лишь у нескольких пациентов, при этом клинически значимых изменений САД или ДАД отмечено не было.
