Роль L-карнитина в лечении постнатальной гипотрофии у недоношенных детей после выписки из неонатологического стационара
СтатьиОпубликовано в :
Вопросы практической педиатрии, 2017, том 12, №3, с. 7-12
Clinical Practice in Pediatrics, 2017, volume 12, No 3, p. 7-12
DOI: 10.20953/1817-7646-2017-3-7-12
М.Я.Ледяев, Т.Е.Заячникова
Волгоградский государственный медицинский университет, Волгоград, Российская Федерация
Цель. Изучение эффективности и безопасности применения препарата L-карнитина в комплексном лечении недоношенных детей с постнатальной гипотрофией на этапе выписки из неонатологического стационара.
Пациенты и методы. Проведено сравнительное исследование эффективности коррекции метаболических нарушений у недоношенных детей с постнатальной гипотрофией L-карнитином в дозе 100 мг/кг/день. Первая группа, получавшая препарат Элькар (n = 30), - дети, родившиеся с массой тела от 690 до 1180 г, на сроках гестации от 25 до 33 нед, имевшие клинические признаки постнатальной гипотрофии на момент выписки из стационара. Вторую группу (группу сравнения) составили 30 детей гестационного возраста от 28 до 35 нед, родившиеся с массой тела от 870 до 1320 г, не имевшие симптомов постнатальной гипотрофии. Оценивались физическое развитие, динамика неврологической, соматической симптоматики. Проводились ультразвуковое исследование головного мозга, сердца и сосудов, ЭКГ, клинические анализы крови, уровень глюкозы крови.
Результаты. К 50 нед постконцептуального возраста выявлено существенное повышение среднесуточных прибавок массы тела, нормализация показателей физического и психомоторного развития на фоне лечения L-карнитином у недоношенных детей с постнатальной гипотрофией после выписки из неонатологического стационара.
Заключение. Проведенное исследование подтверждает эффективность курсового применения препарата L-карнитина (Элькар) в дозе 100 мг/кг/день у недоношенных детей в комплексном лечении постнатальной гипотрофии.
Ключевые слова: недоношенные дети, постнатальная гипотрофия, Элькар, L-карнитин
Для цитирования: Ледяев М.Я., Заячникова Т.Е. Роль L-карнитина в лечении постнатальной гипотрофии у недоношенных детей после выписки из неонатологического стационара. Вопросы практической педиатрии. 2017; 12(3): 7-12. DOI: 10.20953/1817-7646-2017-3-7-12
Для корреспонденции:
Ледяев Михаил Яковлевич, доктор медицинских наук, профессор, заведующий кафедрой детских болезней Волгоградского государственного медицинского университета
Адрес: 400131, Россия, Волгоград, площадь Павших Борцов, 1
Телефон: (8442) 95-7809
E-mail: ledyaevmikhail@gmail.com
For correspondence:
Mikhail Ya. Ledyaev, MD, PhD, DSc, professor, head of the chair of paediatric diseases, Volgograd State Medical University
Address: 1 Pavshikh Bortsov Sq., Volgograd, 400131, Russian Federation
Phone: (8442) 95-7809
E-mail: ledyaevmikhail@gmail.com
The article was received 22.05.2017, accepted for publication 14.06.2017
Уровень здоровья плода и новорожденного складывается из показателей роста и физического развития, уровня метаболической стабильности организма и адаптационных возможностей, опосредуемых через деятельность сердечнососудистой, нейровегетативной и иммунной систем [1]. Проблема дефицита постнатального роста у детей с экстремально низкой (ЭНМТ) и очень низкой массой тела (ОНМТ) при рождении остается нерешенной и в настоящее время. От 40 до 90% детей с массой тела при рождении менее 1500 г во время пребывания в стационаре имеют показатели физического развития в области низких и крайне низких величин (ниже 10-го перцентиля) и достаточно долго характеризуются таковыми [2, 3]. На низкие темпы прироста показателей физического развития влияют многие факторы: тяжесть состояния ребенка в перинатальном периоде в связи с выраженной морфологической, метаболической и функциональной незрелостью всех органов и систем в условиях стресса. Это значительно затрудняет процесс адаптации в неонатальном периоде и требует больших энергетических затрат [4]. Нарушение роста и постнатальная гипотрофия являются сдерживающими факторами для выписки из стационара, увеличивают длительность госпитализации и экономические затраты на дальнейшее выхаживание [5].
Общеизвестна взаимосвязь между физическим и психомоторным развитием. Так, 67% детей, у которых отмечалась значительная задержка физического развития на протяжении первого года жизни (низкие показатели роста, веса, окружности головы), в 2 и более раз чаще имеют риск неврологических нарушений [6]. Наличие гипотрофии сопряжено с развитием таких серьезных осложнений, как бронхоле-гочная дисплазия, ретинопатия недоношенных, метаболический синдром, и других тяжелых заболеваний, определяющих высокий удельный вес инвалидности у детей с ОНМТ и ЭНМТ при рождении [1, 2, 7].
Карнитин - это витаминоподобное соединение, производное аминокислоты, которое обеспечивает перенос жирных кислот через мембраны митохондрий, улучшая, таким образом, их доступность для бета-окисления и улавливая потенциально токсичные органические соединения. По сути, кар-нитин является трансмембранным переносчиком жирных кислот [8].
Недоношенный ребенок рождается с ограниченным запасом карнитина и зависим от экзогенных источников его поступления [9]. Дети с ОНМТ имеют высокие энергетические потребности для поддержания адекватного постнаталь-ного роста. Согласно современным представлениям, недоношенные дети являются группой риска по развитию недостаточности карнитина в связи с незрелостью механизмов, участвующих в синтезе и сохранении запасов карнитина, а также со сниженным поступлением его от матери при преждевременных родах [9-11]. Жир транспортируется в плазме в виде триглицеридов, которые получены либо из диеты, либо путем липогенеза de novo [12]. Биологически активным является природный L-стереоизомер карнитина, поэтому в качестве пищевой добавки или лекарственного препарата должен применяться только L-карнитин. Он практически полностью всасывается в желудочно-кишечном тракте человека, и прием внутрь препаратов L-карнитина способен обеспечить оптимальную физиологическую потребность.
У пациентов с недостаточностью карнитина могут развиваться миопатия, слабость и миалгии, кардиомиопатия, задержка развития, гепатомегалия, аномальные функции печени, рецидивирующие инфекции, повышенный уровень три-глицеридов в сыворотке крови, гипогликемия, гипокетонемия и панцитопения [8, 13]. Если запасов карнитина недостаточно для поддержания нормального энергетического обмена, это может выразиться в слабом росте, высоких уровнях триглице-ридов и низком кетогенезе (из-за окисления жирных кислот) [11]. Научные данные о дотации карнитина при проведении парентерального питания противоречивы.
Так, рядом исследований показано, что среди недоношенных новорожденных кратковременное назначение низких доз L-карнитина (в дозе 50-70 ммоль/кг/день) улучшает толерантность к липидам, кетогенез и дает кратковременную прибавку в весе [6, 11]. В то же время изучение рутинного долгосрочного применения L-карнитина у недоношенных детей в дозах больше или равных 50 ммоль/кг/день не показало улучшения прироста веса [14]. Дотация карнитина при парентеральном питании не приводила к улучшению краткосрочных исходов госпитализации у недоношенных детей с ОНМТ [9].
Показано, что энтеральное назначение L-карнитина в дозе 50 мг/кг в день в течение 1 месяца на этапе стационарного лечения способствует выраженному улучшению клинического статуса, оптимизации постнатальной перестройки деятельности сердечно-сосудистой системы, нормализации гемодинамики, лучшему набору массы тела у недоношенных детей, сокращению продолжительности зондового кормления, снижению частоты развития анемии недоношенных и длительности неонатальной желтухи [15].
Попытки обоснования необходимости дотации карнитина, связанные с определением уровня свободного карнитина в крови, показали, что такой подход не всегда отражает истинный карнитиновый статус у недоношенного ребенка, в связи с чем назначение препаратов L-карнитина при наличии у ребенка клинических проявлений энергетического дефицита рекомендовано как в случае снижения содержания свободного карнитина в крови, так и при наличии повышенных или нормальных показателей [10, 11, 16].
Учитывая высокую медицинскую и социальную значимость проблемы состояния здоровья детей с ЭНМТ и ОНМТ при рождении, особый интерес для врачей-неонатологов представляет поиск эффективных и безопасных методов медикаментозной коррекции метаболических нарушений и расстройств питания на фоне постнатальной гипотрофии после выписки из неонатологического стационара.
Цель - оценить эффективность и безопасность применения препарата L-карнитина в комплексном лечении недоношенных детей с постнатальной гипотрофией на этапе выписки из неонатологического стационара.
Пациенты и методы
В условиях кабинета катамнеза проведено проспективное исследование 60 недоношенных детей, выписанных на амбулаторное наблюдение после курса стационарного лечения в клинической больнице №5 г. Волгограда. Исследование проводилось с января 2015 г. по декабрь 2016 г. В 1-ю группу (n = 30) были включены дети, родившиеся с массой тела от 690 до 1180 г, на сроках гестации от 25 до 33 нед, имевшие клинические признаки постнатальной гипотрофии на момент выписки из стационара, т.е. значения массы тела в возрасте старше 28 дней были ниже 10-го перцентиля относительно постконцептуального возраста (ПКВ). Вторую группу составили 30 детей гестационного возраста от 28 до 35 нед, родившиеся с массой тела от 870 до 1320 г, не имевшие симптомов постнатальной гипотрофии при выписке из стационара.
Все дети после выписки получали медикаментозную терапию: препараты железа, витамин D, пробиотики. Детям из 1-й группы дополнительно был назначен per os лекарственный препарат L-карнитина (Элькар®, ООО «ПИК-ФАРМА») в дозе 100 мг/кг/день в 3 приема курсом 30 дней. Наблюдение проводилось вплоть до достижения каждым ребенком ПКВ 50 нед и заключалось в оценке физического развития, динамики неврологической и соматической симптоматики с проведением ультразвукового исследования головного мозга, сердца и сосудов, ЭКГ, клинических анализов крови, глюкозы крови. Еженедельно проводился расчет и коррекция питания всем детям, включенным в исследование.
Оценка физического развития проводилась в соответствии с нормативами гестационного возраста с использованием кривых Fenton T.R. [17], психомоторного развития - по стандартной методике исследования неврологического статуса ребенка первого года жизни. Также проводилась количественная оценка уровня психомоторного развития (ПМР) по методу Л.Т.Журба, Е.М.Мастюковой в возрасте 1, 2 и 3 мес корригированного возраста (КВ) [18]. Количественная оценка уровня ПМР проводилась на основе показателей по 4-балльной системе с учетом динамики нормального развития ребенка и включала динамические показатели (коммуникабельность, голосовые реакции, безусловные рефлексы, мышечный тонус, сенсорное и моторное поведение) и факторы риска (стигмы, черепные нервы, патологические движения). Оптимальная оценка по шкале возрастного развития соответствовала 30 баллам, вариантом возрастной нормы считались значения 27-29 баллов, при оценке 23-26 баллов ребенка можно было отнести к группе риска (угроза задержки развития), 13-22 балла соответствовали задержке психомоторного развития (ЗПР) [18]. В соответствии с тремя основными уровнями - задержка, угроза и норма -выделялись различные варианты ПМР.
Критерии исключения: хромосомные и генетические заболевания, врожденные пороки развития, хирургическая стадия некротизирующего энтероколита в анамнезе, острые инфекционные заболевания во время исследования. Статистическая обработка материала осуществлялась на персональном компьютере с помощью программы Microsoft Exсel с использованием методов вариационной статистики. Проводился расчет t-критерия Стьюдента, тест на значимые различия для двух независимых выборок (z-test).
Результаты исследования и их обсуждение
Клиническая характеристика исследуемых групп на момент выписки из неонатологического стационара представлена в табл. 1.
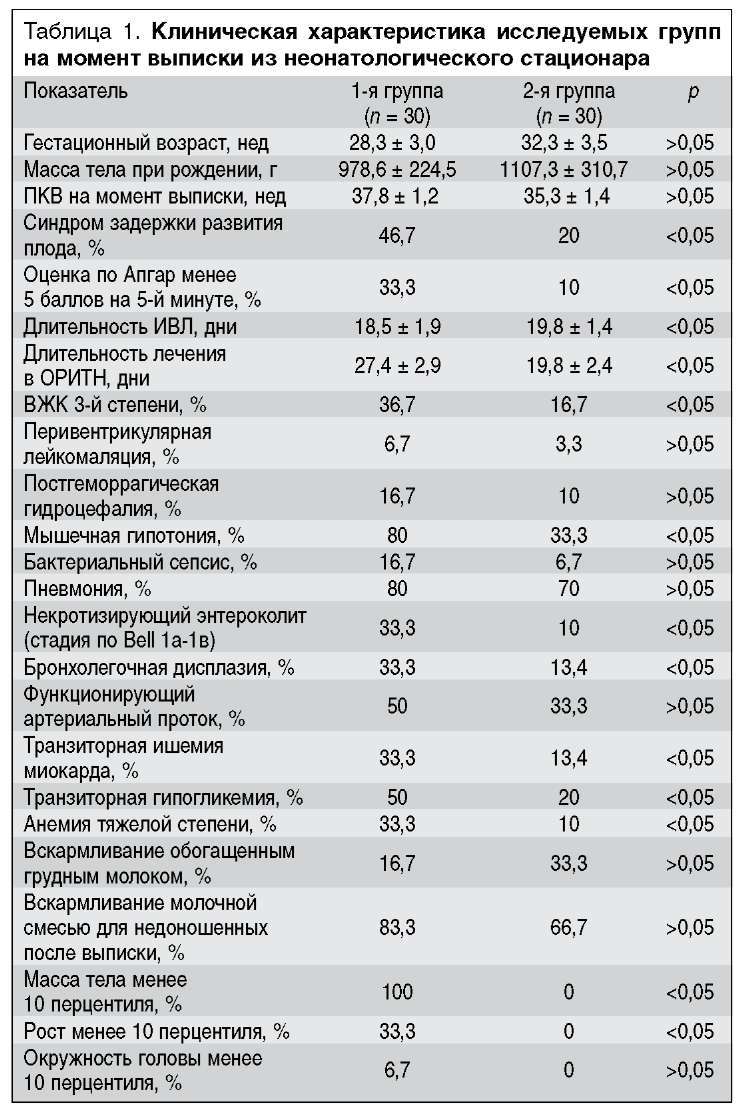
Группы были сопоставимы по гестационному возрасту, массе тела при рождении, ПКВ на момент выписки, а также по характеру вскармливания. Течение перинатального периода для детей 1-й группы можно охарактеризовать в целом как более тяжелое по сравнению со 2-й группой. Дети из 1-й группы чаще имели синдром задержки развития плода, асфиксию тяжелой степени при рождении; потребность в продленной искусственной вентиляции легких (ИВЛ) и продолжительном лечении в отделении реанимации и интенсивной терапии новорожденных в 1-й группе были достоверно выше, чем во 2-й. Среди перенесенных заболеваний у детей в 1-й группе достоверно чаще отмечались: внутрижелудочковые кровоизлияния (ВЖК) 3-й степени, нарушения мышечного тонуса, бронхолегочная дисплазия, транзиторная ишемия миокарда, транзиторная гипогликемия, анемия тяжелой степени, начальные проявления не-кротизирующего энтероколита. Частота таких заболеваний, как бактериальный сепсис новорожденных, врожденная пневмония, постгеморрагическая гидроцефалия, функционирующий артериальный проток в сравниваемых группах значимо не отличалась.
К моменту выписки из неонатологического стационара все дети 1-й группы имели клинические признаки постна-тальной гипотрофии, причем, помимо отставания в массе тела, у 33,3% выявлена задержка роста, а у 6,7% - замедление темпов прироста окружности головы. Дети, имевшие отставание по массе, росту и окружности головы, родились с гипопластической формой синдрома задержки развития плода. Все обследованные дети в обеих группах к моменту выписки имели клинические и неврологические симптомы гипоксически-ишемической энцефалопатии, однако 80% детей в 1-й группе и только 33,3% во 2-й имели вялый сосательный рефлекс, мышечную гипотонию и гипорефлексию, синдром срыгивания и рвоты. Достоверных различий в характере вскармливания в обеих группах не обнаружено (табл. 1).
Динамика массы тела у детей в исследуемых группах по достижении ПКВ 50 нед, а также до и после лечения L-карнитином представлены в таблице 2.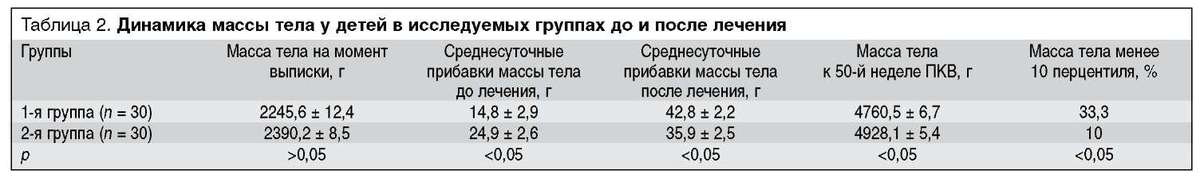
Средняя масса тела на момент выписки из неонатологи-ческого стационар у детей в обеих группах достоверно не отличалась, несмотря на то, что дети из 1-й группы выписывались в среднем на 2 нед позже ввиду большей тяжести состояния и необходимости продления стационарного лечения в этой связи. Это подтверждается и значимыми различиями в ежедневных прибавках массы тела на момент выписки (табл. 2). После окончания курса лечения препаратом L-карнитина 66,7% недоношенных детей 1-й группы вышли из состояния постнатальной гипотрофии, среднесуточная прибавка массы тела у них составила 42,8 ± 2,2 г, что было достоверно выше, чем во 2-й группе (35,9 ± 2,5, р < 0,05). Отставание в физическом развитии выявлено у детей с бронхолегоч-ной дисплазией на фоне тяжелой морфофункциональной незрелости [19]. Средние значения массы тела у детей 1-й группы по достижении ими ПКВ 50 нед были ниже, чем во 2-й группе, что объясняется тем, что в 1-й группе симптомы постнатальной гипотрофии сохранялись у 33,3% детей. В то же время у 10% детей 2-й группы, не получавших дотацию L-карнитина, развилась постнатальная гипотрофия, хотя на момент выписки из стационара физическое развитие всех детей 2-й группы соответствовало гестационному возрасту.
На момент выписки из стационара и в 1 мес КВ детей обеих групп можно было отнести к уровню ЗПР. При динамическом исследовании количественных показателей ПМР в возрасте 3 мес КВ дети 1-й группы, получавшие дотацию L-карнитина, имели показатели ПМР, соответствующие возрастной норме, в то время как темпы ПМР у детей, не получавших L-карнитин, были достоверно ниже (табл. 3).
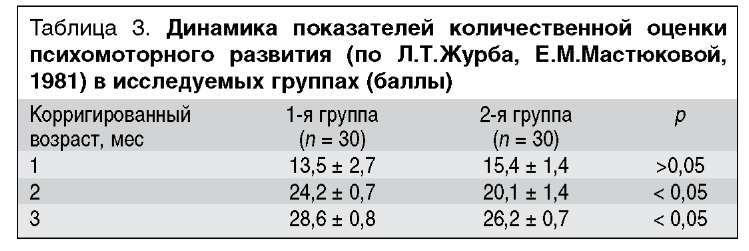
Анализ структуры вариантов ПМР в исследуемых группах (табл. 4) показал, что, несмотря на одинаковые исходные показатели ПМР у обследуемых детей, у большинства получавших L-карнитин (63%) переход из группы ЗПР в категорию возрастной неврологической нормы произошел уже к концу 3-го месяца КВ, в то время как в группе сравнения только 40% детей приблизились к показателям возрастной неврологической нормы в этом возрасте (различия в группах достоверны). Положительная динамика ПМР в рамках угрозы ЗПР, а также стабильное течение в рамках ЗПР и углубление ЗПР в обеих группах отмечались одинаково часто. Только у 2 детей, получавших L-карнитин (6,7%), показатели ПМР не вышли из рамок угрозы ЗПР, в то время как в группе детей, не получавших L-карнитин, этот вариант встречался достоверно чаще - у 9 детей (30%).
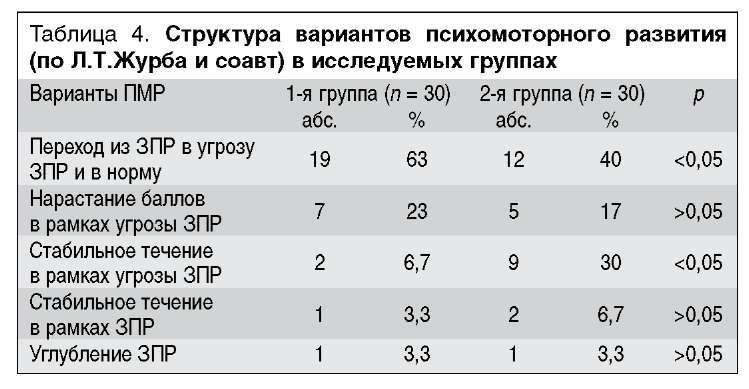
Углубление ЗПР было выявлено у 2 детей с тяжелыми церебральными проблемами: перивентрикулярной лейкома-ляцией, постгеморрагической гидроцефалией, бронхолегоч-ной дисплазией, что сочеталось с глубокой морфофункцио-нальной незрелостью и постнатальным отставанием в физическом развитии.
Необходимо отметить хорошую переносимость препарата L-карнитина (Элькара) у всех пациентов, включенных в исследование, отсутствие побочных эффектов и нежелательных реакций, простоту и удобство в применении.
Заключение
Проведенное исследование подтверждает эффективность курсового применения препарата L-карнитина (Элькар®) в дозе 100 мг/кг/день у недоношенных детей в комплексном лечении постнатальной гипотрофии.
К 50 нед ПКВ выявлено существенное повышение среднесуточных прибавок массы тела, нормализация показателей физического и психомоторного развития на фоне лечения L-карнитином у недоношенных детей после выписки из неонатологического стационара.
Литература
1. Петров ВИ, Ледяев МЯ, Заячникова ТЕ. Применение препарата элькар у новорожденных с малой массой тела при рождении, конъюгационной желтухой и транзиторными изменениями миокарда. Российский вестник перинатологии и педиатрии. 2004;49(1):23-8.
2. Дегтярева АВ, Пучкова АА, Рюмина ИИ. Основные закономерности роста и принципы вскармливания глубоконедоношенных детей после выписки из стационара. Неонатология: новости, мнения, обучение. 2015;2(8):42-50.
3. Дмитриев АВ, Блохова ЕЭ, Гудков РА, Федина НВ. Особенности развития и формирование сочетанной патологии у детей первого года жизни, родившихся с очень низкой и экстремально низкой массой. Российский медико-биологический вестник имени академика И.П.Павлова. 2015;4:91-6.
4. Волянюк ЕВ Параметры физического развития недоношенных детей и современные подходы к нутритивной поддержке на амбулаторном этапе. Вестник современной клинической медицины. 2014;7(6):17-20.
5. Рюмина ИИ, Нароган MB, Трошева ЕВ, Дегтярева АВ. Трудные вопросы энте-рального вскармливания недоношенных детей. Доктор Ру: Педиатрия Гастроэнтерология. 2014;3(91):12-7.
6. Cooke RJ. Postnatal growth and development in the preterm and small for gestational age infants. Importance of growth for health and development. Nestle Nutr. Inst. Workshop Ser Pediatr Program. 2010;65:85-98.
7. Seonga SH, Chob SCh, Parkc Y, Chaa YS. L-Carnitine-supplemented parenteral nutrition improves fat metabolism but fails to support compensatory growth in premature Korean infants. Nutrition Research. 2010;30:233-9. DOI: 10.1016/j. nutres.2010.04.004
8. Crill CM, Storm MC, Christensen ML, Hankins CT, Bruce Jenkins M, Helms RA. Carnitine supplementation in premature neonates: effect on plasma and red blood cell total carnitine concentrations, nutrition parameters and morbidity. Clin Nutr. 2006;25:886-96. DOI: 10.1016/j.clnu.2006.05.002
9. Clark RH, Chace DH, Spitzer AR. Impact of L-carnitine supplementation on metabolic profiles in premature infants. Journal of Perinatology. 2017;37(5):566-71. DOI: 10.1038/jp.2016.253
10. Горбань ТС, Дегтярева МВ, Бабак ОА, Воронцова ЮН, Захарова ЕЮ, Байдакова ГВ, и др. Динамика концентрации карнитина в сыворотке крови у детей с очень низкой массой тела при рождении. Вопросы практической педиатрии. 2011;6(4):28-32.
11. Cairns PA, Stalker DJ. Carnitine supplementation of parenterally fed neonates (Cochrane review). The Cochrane Database of Systematic Reviews. 2000;4 Available from: nichd.nih.gov/cochrane_data/cairnsp_01/cairnsp_01. html. DOI: 10.1002/14651858.CD000950
12. Garg M, Bassilian S, Bell C, Lee S, Lee WN. Hepatic de novo lipogenesis in stable lowibirth-weight infants during exclusive breast milk feedings and during parenteral nutrition. J Parenter Enteral Nutr. 2005;29(2):81 -6. DOI: 10.1177/014860710502900281
13. Гармаева ВВ, Дементьева ГМ, Сухоруков ВС, Фролова МИ. Недостаточность карнитина у недоношенных детей с респираторным дистресс-синдромом. Российский вестник перинатологии и педиатрии. 2008;53(3):17-22.
14. Pande S., Brion LP, Campbell DE, Gayle Y. Lack of Effect of L-Carnitine Supplementation on Weight Gain in Very Preterm Infants. Journal of Perinatology. 2005;25(7):470-7. DOI: 10.1038/sj.jp.7211334
15. Балыкова ЛА, Гарина СВ, Назарова ИС, Буренина ЛВ. Оценка эффективности применения Элькара (L-карнитин) у недоношенных новорожденных. Вестник Мордовского университета. 2016;26(2):168-79. DOI: 10.15507/02362910.026.201602.168-179
16. Алямовская ГА, Золкина ИВ, Кешишян ЕС. Вторичная карнитиновая недостаточность у недоношенных детей с массой тела при рождении менее 1500 г в патогенезе энергетического дефицита на первом — втором году жизни и возможности ее коррекции. Российский вестник перинатологии и педиатрии. 2012;57(4-2):126-31.
17. Fenton TR, Kim JH. A systematic review and meta-analysis to revise the Fenton growth chart for preterm infants. BMC Pediatrics. 2013;13:59. DOI: 10.1186/14712431-13-59
18. Журба ЛГ, Мастюкова ЕМ. Нарушение психомоторного развития детей первого года жизни. М.: Медицина; 1981, с. 115-157.
19. Овсянников ДЮ, Ахвледиани СД. Нарушение питания и нутритивная поддержка у детей с бронхолегочной дисплазией. Неонатология: новости, мнения, обучение. 2016;1(11):55-73.
References
1. Petrov VI, Ledyaev MYa, Zayachnikova TE. Primenenie preparata el'kar u novorozhdennykh s maloi massoi tela pri rozhdenii, kon"yugatsionnoi zheltukhoi i tranzitornymi izmeneniyami miokarda. Rossiyskiy Vestnik Perinatologii i Pediatrii (Russian Bulletin of Perinatology and Pediatrics). 2004;49(1):23-8. (In Russian).2. Degtyareva AV, Puchkova AA, Ryumina II. Basic laws of growth and feeding of extremely preterm infants after hospital discharge. Neonatology: news, opinions, training. 2015;2(8):42-50. (In Russian).
3. Dmitriev AV, Blohova EE, Gudkov RA, Fedin NV. Outcomes and formation of comorbidity among infants born with very low and extremely low birth weight. I.P. Pavlov Russian Medical Biological Herald (Rossiyskiy mediko-biologicheskiy vestnik imeni akademika I.P.Pavlova). 2015;4:91-6. (In Russian).
4. Volyanyuk EV. Physical development parameters in preterm infants and modern approach to nutritional support for outpatients. The Bulletin of Contemporary Clinical Medicine. 2014;7(6):17-20. (In Russian).
5. Ryumina II, Narogan MV, Grosheva EV, Degtyareva AV. Premature Babies: Challenging Issues in Enteral Nutrition. Doctor.Ru. 2014;3(91):12-7. (In Russian).
6. Cooke RJ. Postnatal growth and development in the preterm and small for gestational age infants. Importance of growth for health and development. Nestle Nutr. Inst. Workshop Ser Pediatr Program. 2010;65:85-98.
7. Seonga SH, Chob SCh, Parkc Y, Chaa YS. L-Carnitine-supplemented parenteral nutrition improves fat metabolism but fails to support compensatory growth in premature Korean infants. Nutrition Research. 2010;30:233-9. DOI: 10.1016/j. nutres.2010.04.004
8. Crill CM, Storm MC, Christensen ML, Hankins CT, Bruce Jenkins M, Helms RA. Carnitine supplementation in premature neonates: effect on plasma and red blood cell total carnitine concentrations, nutrition parameters and morbidity. Clin Nutr. 2006;25:886-96. DOI: 10.1016/j.clnu.2006.05.002
9. Clark RH, Chace DH, Spitzer AR. Impact of L-carnitine supplementation on metabolic profiles in premature infants. Journal of Perinatology. 2017;37(5):566-71. DOI: 10.1038/jp.2016.253
10. Gorban' TS, Degtyareva MV, Babak OA, Vorontsova YuN, Zakharova EYu, Baydakova GV, et al. Dynamics of carnitine concentrations in blood serum in infants with very low birth weight. Clinical Practice in Pediatrics. 2011;6(4):28-32. (In Russian).
11. Cairns PA, Stalker DJ. Carnitine supplementation of parenterally fed neonates (Cochrane review). The Cochrane Database of Systematic Reviews. 2000;4 Available from: nichd.nih.gov/cochrane_data/cairnsp_01/cairnsp_01.
html. DOI: 10.1002/14651858.CD000950
12. Garg M, Bassilian S, Bell C, Lee S, Lee WN. Hepatic de novo lipogenesis in stable lowibirth-weight infants during exclusive breast milk feedings and during parenteral nutrition. J Parenter Enteral Nutr. 2005;29(2):81-6. DOI: 10.1177/014860710502900281
13. Garmayeva VV, Dementyeva GM, Sukhorukov VS, Frolova MI. Carnitine deficiency in preterm infants with respiratory distress syndrome. Rossiyskiy Vestnik Perinatologii i Pediatrii (Russian Bulletin of Perinatology and Pediatrics). 2008;
53(3):17-22. (In Russian).
14. Pande S., Brion LP, Campbell DE, Gayle Y. Lack of Effect of L-Carnitine Supplementation on Weight Gain in Very Preterm Infants. Journal of Perinatology.
2005;25(7):470-7. DOI: 10.1038/sj.jp.7211334
15. Balykova LA, Garina SV, Nazarova IS, Burenina LV. Evaluating the effectiveness of Elkar (L-carnitine) in premature infants. Mordovia University Bulletin. 2016;26(2):168-79. (In Russian). DOI: 10.15507/0236-2910.026.201602.168-179
16. Alyamovskaya GA, Zolkina IV, Keshishian ES. Secondary carnitine deficiency in low birth weight (less than 1500 g) premature infants in the pathogenesis of energy deficiency during their first-second years of life and possibilities of its correction. Rossiyskiy Vestnik Perinatologii i Pediatrii (Russian Bulletin of Perinatology and Pediatrics). 2012;57(4-2):126-31. (In Russian).
17. Fenton TR, Kim JH. A systematic review and meta-analysis to revise the Fenton growth chart for preterm infants. BMC Pediatrics. 2013;13:59. DOI: 10.1186/14712431-13-59
18. Zhurba LG, Mastyukova EM. Narushenie psikhomotornogo razvitiya detei pervogo goda zhizni [Disorder of psychomotor development of children first year of life]. Мoscow: "Meditsina" Publ., 1981, pp. 115-157.
19. Ovsyannikov DYu, Akhvlediani SD. Nutritional disorders and nutritional support for children with bronchopulmonary dysplasia. Neonatology: news, opinions, training. 2016;1(11):55-73. (In Russian).
Информация о соавторе:
Заячникова Татьяна Евгеньевна, кандидат медицинских наук, доцент, заведующий кафедрой педиатрии и неонатологии факультета усовершенствования врачей Волгоградского государственного медицинского университетаАдрес: 400131, Россия, Волгоград, площадь Павших Борцов, 1
Телефон: (8442) 95-6939
E-mail: pedneonatalfuv@mail.ru
Information about co-author:
Tatyana E. Zayachnikova, MD, PhD, associate professor, head of the chair of paediatrics and neonatolgy, faculty of advanced medical training, Volgograd State Medical University
Address: 1 Pavshikh Bortsov Sq., Volgograd, 400131, Russian Federation
Phone: (8442) 95-6939
E-mail: pedneonatalfuv@mail.ru
Статья поступила 22.05.2017 г., принята к печати 14.06.2017 г
The role of L-carnitine in treatment of postnatal hypotrophy in premature infants after discharge from a neonatological hospital
M.Ya.Ledyaev, T.E.Zayachnikova
Volgograd State Medical University, Volgograd, Russian Federation
The objective. To study the efficacy and safety of using a L-carnitine preparation in complex treatment of premature children with postnatal hypotrophy at the stage of discharge from a neonatological hospital.
Patients and methods. We performed a comparative study of the efficacy of correcting metabolic disorders in premature infants with postnatal hypotrophy using L-carnitine in the dose 100 mg/kg/day. The first group received the drug Elkar (n = 30) and comprised infants born with body weight 690 to 1180 grams at terms of gestation 25 to 33 weeks, had clinical signs of postnatal hypotrophy at the moment of discharge from hospital. The second (control) group included 30 infants of gestational age 28 to 35 weeks, born with body weight 870 to 1320 grams, did not have symptoms of postnatal hypotrophy. Physical development, dynamics of neurological and somatic symptoms were assessed. Ultrasound examination of the brain, heart and vessels, ECG, clinical blood tests were performed, blood glucose levels were examined.
Results. By the 50th week of postconceptual age, a considerable increase of average daily body weight gain, normalisation of parameters of physical and psychomotor development were found against the background of L-carnitine treatment in premature infants with postnatal hypotrophy after discharge from a neonatological hospital.
Conclusion. The study confirms the efficacy of a course of L-carnitine administration (Elkar) in the dose 100 mg/kg/day in premature infants in complex treatment of postnatal hypotrophy.
Key words: premature children, postnatal hypotrophy, Elkar, L-carnitine
For citation: Ledyaev M.Ya., Zayachnikova T.E. The role of L-carnitine in treatment of postnatal hypotrophy in premature infants after discharge from a neonatological hospital. Vopr. prakt. pediatr. (Clinical Practice in Pediatrics). 2017; 12(3): 7-12. (In Russian). DOI: 10.20953/1817-7646-2017-3-7-12
