Возможность применения препарата Кокарнит при лечении диабетической полинейропатии
СтатьиОпубликовано в "Эффективная фармакотерапия. Эндокринология." №4 2016
A.M. Мкртумян1, Т.Н. Маркова1,2, СВ. Подачина1
Адрес для переписки: Ашот Мусаелович Мкртумян, vagrashot@mail.ru
1 Московский государственный медико-стоматологический университет им. А.И. Евдокимова
2 Городская клиническая больница № 52, Москва
Диабетическая полинейропатия - осложнение сахарного диабета, развивающееся, наряду с другими осложнениями (ангиопатия), в результате хронического воздействия гипергликемии. Достижение нормогликемии является главным условием профилактики и лечения диабетических осложнений. К сожалению, поддерживать нормальный уровень глюкозы в крови удается у небольшого числа таких больных, что диктует необходимость поиска лекарственных средств, препятствующих токсическому влиянию глюкозы на ткани. Одним из таких препаратов считается Кокарнит, доказавший свою эффективность в ряде исследований.
Ключевые слова: сахарный диабет, ангиопатия, полинейропатия, Кокарнит
The Possibility of Using Cokarnit Drug in the Treatment of Diabetic Polyneuropathy
1 A.I. Yevdokimov Moscow State University of Medicine and Dentistry
2 City Clinical Hospital № 52, Moscow
Contact person: Ashot Musaelovich Mkrtumyan, vagrashot@mail.ru
Diabetic polyneuropathy - a complication of diabetes, along with other complications (angiopathy), develops as a result of chronic exposure to hyperglycemia. Achieving normoglycemia is essential for prevention and treatment of diabetic complications. Unfortunately, to maintain a normal blood glucose level in a small number manage these patients, which dictates the need to find drugs that prevent the toxic effects of glucose on tissue. One such drug consider Cokarnitproven effective in several studies.
Key words: diabetes mellitus, angiopathy, polyneuropathy, Cokarnit
Диабетическая полинейропатия (ДПН) - осложнение сахарного диабета (СД), которое, наряду с другими осложнениями (ангиопатия), является следствием хронического воздействия гипергликемии. Заболевание обусловливает развитие синдрома диабетической стопы (язва, гангрена, ложный сустав), безболевых форм инфаркта миокарда, поражение желудочно-кишечного тракта и урогенитальные расстройства. Диабетическая периферическая полинейропатия (ДППН) характеризуется комплексом клинических проявлений, имеет четкие диагностические критерии и служит маркером висцеральной, в частности опасной для жизни кардиальной, диабетической нейропатии [1,2]. В настоящее время однозначные данные о распространенности ДПН отсутствуют. Считается, что в среднем более 50% пациентов с СД страдают указанным заболеванием. Среди факторов риска развития выделяют длительность СД, продолжительность периодов выраженной гипергликемии, уровень гликированного гемоглобина, наличие сердечно-сосудистой патологии, артериальной гипертензии, употребление алкоголя, курение. Так, распространенность ДППН при длительности СД до пяти лет и более 30 лет возрастает с 14 до 44% соответственно. Риск развития ДПН повышается на 10-15% при увеличении уровня глюкозы натощак на 1 ммоль/л или гликированного гемоглобина на 1%.
На данный момент существуют две взаимодополняющие гипотезы развития ДПН: метаболическая и сосудистая. Однако необходимо помнить, что ключевая роль в патогенезе принадлежит хронической гипергликемии, которая запускает каскад биохимических реакций, приводящих к дегенерации и демиелинизации нервных волокон. Свой вклад в развитие ДПН вносит и гипогликемия. Так, частые эпизоды тяжелой гипогликемии ассоциируются с демиелинизацией нервного волокна и патологией переднего рога серого вещества спинного мозга [3].
Некоторые ученые считают, что на ранних стадиях развития заболевания преобладают метаболические факторы, они также превалируют при диффузном повреждении нервов, на поздних стадиях и при фокальных нейропатиях увеличивается роль сосудистых [4].
В основе метаболической теории патогенеза лежит активация полиолового пути обмена глюкозы, что приводит к накоплению сорбитола. Как следствие, отек тканей как нервной, так и сосудистой стенки, нарушение эндоневрального кровотока и гипоксия нервов. Важно отметить, что в норме только 1-2% глюкозы превращается в сорбитол, в условиях гипергликемии скорость данного процесса увеличивается в семь - десять раз. Активация полиолового пути влияет также на образование оксида азота (NO) внутри клеток. Известно, что при уменьшении концентрации данного высокоактивного радикала снижается интраневральный кровоток, в результате замедляется скорость проведения возбуждения по нервному волокну. Данный механизм определяет начальные изменения периферической нервной системы в ответ на гипергликемию [4-6]. Еще один патобиохимический путь повреждения - увеличение образования конечных продуктов гликиро-вания. Это приводит к нарушению структуры базальной мембраны капилляров, внутриклеточных белков, в том числе митохондриальных, процессов окисления глюкозы с развитием окислительного стресса [7, 8]. Окислительному стрессу в последние годы отводится особое место в патогенезе ДПН. Повышенная продукция свободных радикалов и сниженная антиоксидантная защита - важная патобиохими-ческая характеристика СД. Окислительный стресс лежит в основе развития и микрососудистых осложнений, и прогрессирования атеросклероза [7, 9].
Клинически ДППН проявляется снижением чувствительности всех модальностей в дистальных отделах ног, ахилловых и коленных рефлексов, слабостью мышц голени и стопы [3, 10].
Кроме того, очень часто хроническим заболеваниям, в том числе сахарному диабету, сопутствует астеновегетативный синдром (fatigue sindrom). Он характеризуется повышенной утомляемостью, слабостью, раздражительностью, неспособностью концентрировать внимание, снижением удовлетворенности жизнью, работоспособности и обусловливает ухудшение качества жизни пациентов и снижение комплаентности лечению [11]. Особенность симптоматики ДППН затрудняет диагностику, как следствие, упускается время и процессы становятся необратимыми. По данным опроса врачей-хирургов, занимающихся оперативным лечением пациентов с синдромом диабетической стопы, 43-85% перенесших ампутацию конечности могли бы избежать этого, если бы профилактическая терапия была начата своевременно [4].
На сегодняшний день патогенетическая терапия заболевания предполагает прием препаратов, влияющих на окислительный стресс, и витаминов группы В [3, 4, 10]. Целью настоящего исследования стала оценка влияния препарата Кокарнит (лиофилизат для приготовления раствора для внутримышечного введения) при применении один раз в сутки внутримышечно в дозе 2 мл в течение девяти дней на динамику нейропа-тической симптоматики у больных диабетической полинейропатией. Задачи исследования:
1) изучение влияния препарата Кокарнит на нейропатическую симптоматику;
2) оценка влияния препарата Кокар-нит на общее клиническое впечатление об изменении симптомов нейро-патии и частоты побочных реакций.
Материал и методы
В исследование включено 34 пациента (14 мужчин и 19 женщин) с сахарным диабетом: СД 1 типа -у 4, СД 2 типа - у 29. Средний возраст участников составил 53,6 ± 2,4 [24-74] года, длительность диабета- 9,8 ± 0,1 [1-31]года. Каждый участник подписал информированное согласие на включение в клиническое исследование и обработку результатов обследования. Все пациенты получали основную сахароснижающую терапию: инсулин, пероральные сахароснижа-ющие препараты, гипотензивные препараты, препараты для лечения сочетанных заболеваний. К схеме лечения был добавлен Кокарнит. Прием препаратов, содержащих витамины группы В и альфа-липоевую кислоту, не допускался. Препарат Кокарнит представляет собой рационально подобранный комплекс метаболических веществ и витаминов: трифосаденина динатрия тригидрат, кокарбоксилаза, цианокобаламин, никотинамид. Трифосаденина динатрия тригидрат является производным аденозина, стимулирует метаболические процессы. Вещество оказывает вазодилатирующее воздействие, в том числе на коронарные артерии и артерии головного мозга. Улучшает метаболизм и энергообеспечение тканей. Обладает гипотензивным и антиаритмическим действием. Под влиянием аденозинтрифосфата снижается артериальное давление, расслабляется гладкая мускулатура, улучшается проведение нервных импульсов. Кокарбоксилаза - кофермент, образующийся в организме из поступающего извне тиамина (витамина В,).
Входит в состав фермента карбокси-лазы, катализирующего карбоксилирование и декарбоксилирование альфа-кетокислот. Опосредованно способствует синтезу нуклеиновых кислот, белков и липидов. Снижает концентрацию молочной и пиро-виноградной кислот в организме, способствует усвоению глюкозы. Улучшает трофику нервной ткани. Цианокобаламин (витамин В12) в организме превращается в метил-кобаламин и 5-дезоксиаденозилко-баламин. Метилкобаламин участвует в превращении гомоцистеина в метионин и 8-аденозилметионин -ключевой реакции метаболизма пи-римидиновых и пуриновых оснований (следовательно, ДНК и РНК). В случае недостатка витамина его может замещать метилтетрагидро-фолиевая кислота, при этом нарушаются фолиевопотребные реакции метаболизма. 5-дезоксиаденозилко-баламин служит кофактором при изомеризации L-метилмалонил-КоА в сукцинил-КоА - важной реакции метаболизма углеводов и липидов. Дефицит витамина В12 приводит к нарушению пролиферации быс-троделящихся клеток кроветворной ткани и эпителия, а также образования миелиновой оболочки нейронов.
Никотинамид - одна из форм витамина РР, участвует в окислительно-восстановительных процессах в клетке, улучшает углеводный и азотистый обмен, регулирует тканевое дыхание. Схема применения препарата Кокар-нит предполагала внутримышечное введение 2 мл в течение девяти дней, затем- на 12-й, 15-й и 18-й день. Курс терапии - 12 инъекций. Основные критерии оценки эффективности исследуемого препарата:
1) динамика нейропатической симптоматики по TSS (Total Symptom Score - общая оценка симптомов невропатии);
2) нейропатической симптоматики по NIS-LL (Neuropathy Impairment Score - Lower Limb - шкала невропатических нарушений нижних конечностей);
3) показателей MFI-20 (Multidimensional Fatigue Inventory - субъективная шкала оценки астении).
Второстепенные показатели:
1) динамика общего клинического впечатления об изменении симптомов нейропатии по опроснику GCIC (Global Clinical Impression Change);
2) частота побочных эффектов терапии.
Продолжительность наблюдения составила 12 недель. Другие виды лечения, назначаемые в течение исследования, отмечались в индивидуальной регистрационной карте пациентов. Дизайн исследования предполагал три визита. Первый - включение в исследование (первый день), второй - через три дня после окончания курса инъекций (21-й день), третий - через 42 дня от начала терапии. Во время всех визитов состояние пациентов оценивалось по TSS, NIS-LL, GCIC и MFI-20. Кроме того, во время первого и второго визитов проведены стандартные общий и биохимический анализы крови, третьего - сделано общее заключение об эффективности лечения: выраженное улучшение, умеренное улучшение, минимальное улучшение, без динамики, небольшое ухудшение, умеренное ухудшение, значительное ухудшение - и о наличии побочных реакций. Исходя из полученных результатов рассчитывали среднее арифметическое (M), стандартную ошибку (m), относительную величину (р, %). Для подтверждения достоверности различий между выборками использовали t-критерий Стьюдента. Вероятность ошибки указывали как р и считали приемлемой при < 0,05.
Статистическая обработка данных проведена с помощью программы Statistica 6.0.
Результаты
Все пациенты, включенные в исследование, имели клинические проявления ДППН. Так, 60,6% пациентов жаловались на умеренно выраженные боль, жжение, парестезии, онемение, 36,3% - выраженные их проявления (по TSS) (табл. 1). Через 21 день на фоне терапии препаратом Кокарнит у 54,1% больных зафиксировано снижение симптоматики ДППН до нормы, у 45,4% - до умеренно выраженной степени. К данному моменту выраженная симптоматика заболевания не отмечалась ни у одного пациента (табл. 1). Положительная динамика наблюдалась и во время третьего визита.
Средние показатели по TSS составили: первый визит - 6,32 ± 0,8 балла (р < 0,001), второй -3,74 ± 0,3 балла, третий визит -3,0 ± 0,3 балла (р < 0,01 между первым и третьим визитами).
Оценка нейропатического дефицита по NIS-LL (мышечная сила, рефлексы, тактильная, температурная, вибрационная, проприоцептивная чувствительность) показала, что исходно доля больных с выраженной нейропатией составляла 21,2%, умеренной - 69,8% (табл. 2). В результате проведенной терапии доля первых сократилась до 9,1%, вторых - до 48,4%. При этом количество пациентов с отсутствием нейропатического дефицита к концу исследования увеличилось с 9,1 до 30,3% (первый и третий визиты соответственно) (табл. 2). Необходимо отметить, что наиболее выраженный эффект лечения наблюдался через 21 день (второй визит). Через 42 дня зафиксировано замедление положительной динамики, однако число пациентов с умеренной нейропатией оставалось высоким.
Средние показатели по NIS-LL: первый визит - 10,1 ± 0,8 балла, второй - 6,8 ± 0,7 балла (р < 0,01), третий визит - 7,0 ± 0,65 балла (р < 0,01 между первым и третьим визитами). Динамика проявлений астении определялась по MFI-20. Данный опросник включает 20 вопросов для оценки общей, физической, психической астении, снижения мотивации в обследуемой группе. В таблице 3 представлено изменение физического и психического состояния пациентов на фоне лечения препаратом Кокарнит. Уменьшение симптомов заболевания позволило расширить физические возможности пациентов, улучшить их общее состояние и эмоциональный фон.
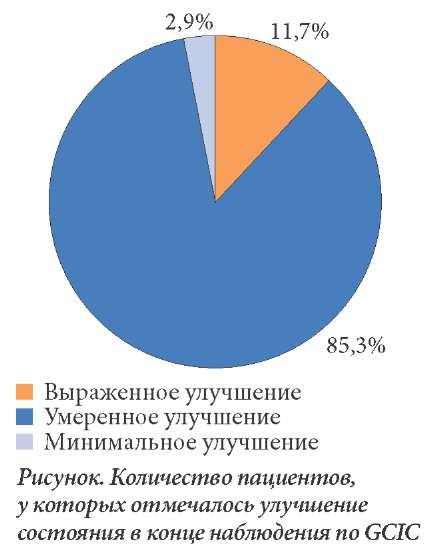
По данным GCIC, терапия препаратом Кокарнит способствует улучшению нейропатической симптоматики. Общее заключение об эффективности лечения представлено на рисунке. В отношении побочных эффектов и осложнений у больных при проведении курса терапиинеобходимо отметить следующее. Одна пациентка из 35 выбыла из исследования, так как после первой инъекции у нее развилась аллергическая реакция в виде сыпи. У остальных участников каких-либо побочных эффектов не наблюдалось.
|
Таблица 1. Динамика нейропатической симптоматики по TSS на фоне терапии препаратом Кокарнит, % |
|||||
|
Первый визит |
Второй визит |
Третий визит |
Р между первым и вторым визитами |
Р между первым и третьим визитами |
|
|
Норма (0-3 балла) |
3,0 ± 2,9 |
54,1 ± 8,7 |
63,6 ± 8,4 |
< 0,001 |
< 0,001 |
|
Умеренно выраженная (4-7 балла) |
60,6 ± 8,4 |
45,4 ± 8,7 |
36,4 ± 8,4 |
- |
< 0,05 |
|
Выраженная (более 8 баллов) |
36,3 ± 8,4 |
0 ± 10,8 |
0 ± 10,8 |
< 0,05 |
< 0,05 |
Таблица 2. Динамика нейропатической симптоматики по NIS-LL на фоне терапии препаратом Кокарнит, % | |||||
Симптоматика | Первый визит | Второй визит | Третий визит | Р между первым и вторым визитами | Р между первым и третьим визитами |
Норма (0-4 балла) | 9,1 ± 5,0 | 39,4 ± 8,5 | 30,3 ± 8,0 | < 0,01 | < 0,01 |
Умеренная нейропатия (5-13 баллов) | 69,8 ± 5,0 | 48,4 ± 8,7 | 57,5 ± 8,6 | - | - |
Выраженная нейропатия (более 14 баллов) | 21,2 ± 7,1 | 9,1 ± 5,0 | 9,1 ± 5,0 | ||
Таблица 3. Динамика симптомов астении по MFI-20 на фоне терапии препаратом Кокарнит, балл | |||||
Показатели | Первый визит | Второй визит | Третий визит | Р между первым и вторым визитами | Р между первым и третьим визитами |
Общая астения | 14,6 ± 2,5 | 11,6 ± 3,1 | 9,9 ± 3,1 | < 0,001 | < 0,001 |
Пониженная активность | 12,1 ± 2,5 | 8,9 ± 3,1 | 8,5 ± 3,1 | < 0,001 | < 0,001 |
Сниженная мотивация | 10,8 ± 3,2 | 8,1 ± 2,3 | 7,6 ± 2,8 | < 0,001 | < 0,001 |
Физическая астения | 13,5 ± 2,0 | 10,4 ± 3,3 | 9,8 ± 2,5 | < 0,001 | < 0,001 |
Психическая астения | 11,1 ± 4,3 | 7,8 ± 3,1 | 7,9 ± 2,9 | < 0,001 | < 0,001 |
Заключение
Проведенное исследование показало, что пациентов с СД необходимо регулярно обследовать на предмет выявления признаков ДППН. Длительная неудовлетворительная компенсация СД обусловливает развитие осложнений. Для предотвращения более тяжелых поражений нервной системы, развития синдрома диабетической стопы и кардиопатии необходимо проведение профилактических, а также лечебных мероприятий (на стадии клинических проявлений заболевания).
Витамины группы В относятся к нейротропным препаратам и признаются патогенетической терапией ДПН [4, 6].
Результаты исследования также свидетельствуют, что лечение препаратом Кокарнит ассоциируется с выраженным и умеренным улучшением нейропатической симптоматики, общего состояния пациентов.
Литература
1. Аметов А.С., Строков И.А. Диабетическая полинейропатия: настоящее и будущее // Российские медицинские вести. 2001. Т. 6. № 1. С. 35-40.2. Ефимова О.В. Диабетическая дистальная полинейропатия (вопросы диагностики и лечения): автореф. дис. ... канд. мед. наук. М., 1993.
3. Строков И.А. Фармакотерапия диабетической поли-нейропатии, реальность и перспективы // Неврологический журнал. 2001. № 5. С. 4-8.
4. Гурьева И.В., Кузина И.В., Воронин А.В. и др. Синдром диабетической стопы. Методические рекомендации. М., 2000.
5. Котов С.Б., Калинин А.П., Рудакова И.Г. Диабетическая нейропатия. М.: Медицина, 2000.
6. Кравчун Н.А. Оптимизация медикаментозного лечения диабетической нейропатии: все необходимое доступно // Здоровье Украины. 2007. № 15-16. С. 65.
7. Dyck P.J., Karnes J.L., O'Brien P.C. et al. The Rochester Diabetic Neuropathy Study: reassessment of tests and criteria for diagnosis and staged severity // Neurology. 1992. Vol.42. №6. P. 1164-1170.
8. Brownlee M. The pathobiology of diabetic complications: a unifying mechanism // Diabetes. 2005. Vol. 54. № 6. P. 1615-1625.
9. Thornelley P.J. Glyoxalase I - structure, function and a critical role in the enzymatic defence against glycation // Bio-chem. Soc. Trans. 2003. Vol. 31. Pt. 6. P. 1343-1348.
10. Мохорт Т.В. Нейропатии при сахарном диабете: современные принципы лечения // Медицинские новости. 2008. № 1. С. 40-47.
11. Ba A. Metabolic and structural role of thiamine in nervous tissues // Cell. Mol. Neurobiol. 2008. Vol. 28. № 7. P. 923-931. A.M. Mkrtumyan1, T.N. Markova1,2, S.V. Podachina1
