Современные принципы лечения фибромиалгии
СтатьиОпубликовано в журнале:
«Русский медицинский журнал», 2011, Том 19, № 15, с. 1-9
Профессор Г.Р. Табеева
1 МГМУ имени И.М. Сеченова
Фибромиалгия (ФМ) - хроническое заболевание, проявляющееся распространенным болевым синдромом и болезненностью в определенных анатомических зонах [106]. Отличительной особенностью больных ФМ является разнообразие жалоб и клинических проявлений заболевания. Весьма характерно наличие множества психических и соматических симптомов, среди которых наиболее частыми являются выраженная слабость, нарушения сна, когнитивные нарушения, повышенная чувствительность к стрессу, тревога и депрессия [28]. Эти симптомы резко усугубляются под воздействием самых разных факторов: физического и психического стресса, гормональных флюктуации, травм, а также холодной и сырой погоды, недостатка сна и гиподинамии [51].
В последние 20 лет в клинической практике проблеме ФМ уделяется особое внимание, что связано с совершенствованием диагностических подходов и разработкой новых подходов к ее лечению. Значительный прогресс в понимании социального и медицинского значения этого заболевания был достигнут благодаря разработке в 1990 г. Американским колледжем ревматологов диагностических критериев ФМ [106] и введению их в клиническую практику и клинические исследования. Это позволило прежде всего установить истинную распространенность этого заболевания. Так, исследования, проведенные после 1990 года, показывают, что ФМ страдают около 5 млн. американцев [70], а некоторые авторы предполагают, что ее распространенность увеличивается [44] (хотя это может быть связано и с повышением уровня диагностики) [2,82]. Эпидемиологические исследования показывают, что распространенность ФМ в США и Канаде составляет примерно 2% в популяции [85] с существенным доминированием у женщин (3,4%) по сравнению с мужчинами (0,5%) [70]. В детской популяции диагноз ФМ практически не ставится, в связи с чем считается, что средний возраст начала заболевания составляет 29-37 лет [6] с последующим увеличением заболеваемости в старших возрастных категориях [70].
Улучшение диагностики ФМ позволило выявить, что она является одной из ведущих причин обращений к ревматологам - либо в виде самостоятельного заболевания, либо в сочетании с другими ревматологическими заболеваниями [12]. Между тем, как показывают отдельные клинические исследования, больных ФМ достаточно много и в практике других врачебных специальностей -неврологов, терапевтов, психиатров и др., что вполне объяснимо, учитывая наличие у этих пациентов множества нарушений со стороны соматической, нервной и психической сфер. Все это обусловливает актуальность и междисциплинарный характер этой проблемы.
Лечение больных ФМ представляется весьма трудной задачей. Эффективность существующих способов ее лечения не велика, и требуется регулярная переоценка состояния пациента для подбора оптимальных схем терапии [1]. Современные стратегии лечения ФМ основываются на данных многочисленных клинических исследований, показывающих рациональность комплексного подхода, сочетающего различные фармакологические и нефармакологические методы терапии, а также необходимость выполнения ряда общих рекомендации по ведению больных ФМ.
Общие рекомендации по ведению больных фибромиалгией
Ключевыми элементами ведения больных ФМ являются рекомендации по изменению стиля жизни. Выполнение пациентом советов врача по соблюдению оптимального режима сна и бодрствования, режима двигательной активности, диеты и следование рекомендациям по нефармакологическому и фармакологическому лечению являются обязательными составляющими программы эффективного ведения больных, страдающих ФМ.
Клинические наблюдения за пациентами с ФМ убедительно показывают, что подавляющее большинство симптомов заболевания вызывают резкое ухудшение состояния пациента при появлении нарушений сна, а течение основных проявлений прямо коррелирует с качественными и количественными характеристиками сна. С другой стороны, эффективное лечение нарушений сна сопровождается значительным улучшением общего состояния пациентов [3]. Поэтому пациенту необходимо стремиться к оптимальному режиму сна. Основные меры, направленные на его обеспечение, должны начинаться с вопросов гигиены сна. Пациенту следует стремиться использовать удобную постель в помещении с хорошей изоляцией от света, шума (выключение телефона, часов с боем и др. источников звуков) и оптимальным температурным режимом в помещении. За 0,5-1 час до планируемого отхода ко сну пациент может заняться любыми делами, оказывающими успокаивающее, релаксирующее действие (чтение, просмотр телевидения, прослушивание любимых мелодий, теплая ванна и др.). Следует рекомендовать пациенту стремиться ложиться спать и вставать утром в одно и то же время суток. Необходимо ограничивать потребление жидкости в вечернее время, а также исключить или максимально ограничить потребление никотина и алкоголя, поскольку они вызывают фрагментацию сна и могут существенно влиять на его глубину [4]. С целью медикаментозной коррекции значимых и устойчивых нарушений сна можно рекомендовать пациенту использовать фитопрепараты или препараты мелатонина [13]. При неэффективности всех предпринимаемых нефармакологических подходов необходимо обратиться к специалисту. Возможно использование рецептурных снотворных средств, поскольку тяжесть испытываемых вследствие нарушений сна симптомов превосходит потенциальный вред от снотворных препаратов.
Врачи, занимающиеся ведением пациентов с ФМ. давно подметили, что пациенты могут отмечать явное улучшение состояния, если они используют диету включающую питательные, хорошо сбалансированные блюда с оптимальным содержанием белков, комплексных углеводов (таких как овощи, злаки и фрукты), полезных жиров и достаточным количеством (6-8 стаканов) воды или напитков, не содержащих кофеин. Кроме этого, у пациентов с ФМ важно соблюдать режим питания с оптимальным содержанием витаминов и определенных минералов. Особое значение для них имеет контроль содержания в повседневном рационе двух минералов - кальция и магния. Суточная норма потребления кальция для женщин составляет 1200 мг, для мужчин - 1000 мг. Женщинам постменопаузального возраста рекомендована суточная доза кальция до 1500 мг с целью профилактики остеопороза, учитывая, что подавляющее большинство пациентов с ФМ - это женщины старшей возрастной группы, аостеопороз сам по себе может явиться причиной стойкого болевого синдрома [13].
При выработке оптимального режима питания больных ФМ другим важнейшим микроэлементом является магний. В исследовании J. Eisinger с соавт. [33] выявлено, что пациенты с ФМ в целом характеризуются дефицитом магния. В частности, снижено его содержание в эритроцитах, что, возможно, связано с дефицитом глубокого медленного сна и снижением содержания гормона роста. Магний является жизненно важным микроэлементом, например, для функционирования костей, мышечной ткани и активности многих энзимов, которые превращают продукты питания в АТФ - основной источник энергии у человека. Рекомендуется потреблять кальций и магний совместно, поскольку эти два минерала работают, как синергисты. Норма суточного потребления магния составляет 420 мг для мужчин и 320 мг -для женщин. При этом наиболее широко рекомендуемое соотношение кальций:магний = 2:1. Для пациентов, плохо переносящих соответствующие добавки, содержащие магний, следует рекомендовать диету с использованием продуктов, обогащенных магнием (табл. 1).
Таблица 1. Продукты, богатые магнием
|
Еще один важный компонент, который должен быть рассмотрен при составлении диеты для пациента с ФМ - яблочная кислота. Эта фруктовая кислота является ключевым элементом оптимального функционирования и максимальной утилизации АТФ. G.E. Abraham и J.D. Flechas в 1992 г. провели клиническое исследование эффективности применения яблочной кислоты (1200-2400 мг) и магния (300-600 мг) при ФМ. Результаты 8-недельного лечения пациентов продемонстрировали очень быструю редукцию болевого синдрома (в течение 48 часов) и значительное снижение количества тендерных точек в течение первых 4 недель у большей части пациентов [5].
По мнению некоторых специалистов, у больных ФМ отмечается определенный негативный эффект табакокурения. Давно замечено, что никотин может провоцировать или ухудшать течение проявлений ФМ у некоторых пациентов, поскольку чрезмерное потребление никотина сопряжено, в частности, с более грубыми нарушениями сна. Так, сравнение курящих и некурящих пациентов с ФМ выявило достоверное более частые клинические проявления и более грубые нарушения структуры сна у первой категории больных [104].
У пациентов с ФМ следует учитывать и возможное влияние климатических факторов. Хотя жалобы на общее ухудшение самочувствия в холодную сырую погоду весьма часты среди пациентов с ФМ, в различных исследованиях получены противоречивые данные относительно влияния температуры, влажности и барометрического давления на основные проявления заболевания. Между тем рекомендации по ношению теплой одежды в холодное дождливое время года и регулярные тепловые процедуры (например, теплый душ или купание в бассейне с подогревом), несомненно, в целом оказывают благоприятное воздействие на пациентов.
Чрезмерная утомляемость является ключевым симптомом ФМ и одним из главных факторов дезадаптации пациентов. Борьба с этим расстройством может быть эффективной только при соблюдении целого комплекса факторов и условий. Пациентам с ФМ необходима дозированная физическая нагрузка, поскольку инактивность и гиподинамия также провоцируют и усугубляют основные проявления скованности и слабости [104]. Поэтому крайне важными являются рекомендации проведения регулярных и дозированных физических упражнений. Известно, что адекватная физическая нагрузка способна увеличивать содержание эндорфинов, что может влиять на редукцию боли и улучшать характеристики сна, увеличивать энергетический потенциал, мышечную силу, растяжимость и гибкость, а также способствовать снижению веса. Пациенты должны начинать физическую активность с тех упражнений, которые для них легко выполнимы на момент начала программы, и прибавлять в неделю примерно по 10% активности от исходного уровня. Рекомендуется применять максимальные нагрузки в утренние часы после теплого душа, особенно если пациента беспокоит выраженная утренняя скованность. В целом пациент должен стараться самостоятельно планировать последовательность различных видов деятельности с расстановкой приоритетов таким образом, чтобы делать наиболее важные и ответственные дела в первую очередь. Следует в беседе с пациентом сосредоточить внимание на стремлении к разносторонней деятельности с обязательным участием в делах семьи, друзей, коллег по работе, а также не пренебрегать помощью и участием близких людей (табл. 2).
Таблица 2. Общие рекомендации пациентам с фибромиалгией
|
Нефармакологическое лечение фибромиалгии
В настоящее время для лечения пациентов с ФМ используется широкий спектр терапевтических возможностей, который включает не только фармакологические средства, но и фитопрепараты, диетические добавки, когнитивно-поведенческую терапию, акупунктуру, инъекции в тендерные точки и мануальные манипуляции [41]. В общей стратегии лечения больных ФМ в последнее время достаточную популярность приобретают физические методы лечения, основной целью которых является поддержание определенного уровня повседневного функционирования пациента [47]. Среди методов физической терапии, которые доказали свою эффективность в клинических исследованиях и нашли свое применение у пациентов с ФМ в клинической практике, относятся занятия аэробикой, езда на велосипеде, пешие прогулки и танцы [82].
В настоящее время накопилось достаточно данных, показывающих рациональность занятий больных с ФМ аэробикой, хотя эффективность применяемых программ весьма различается в разных исследованиях. Проведенный недавно мета-анализ 4 исследований [101] подтвердил наблюдения из клинической практики о том, что позитивные эффекты занятий аэробикой достигаются в наибольшей степени при использовании 20-минутных программ дважды в неделю при интенсивности нагрузок, при которых достигается ЧСС от 55% до 90% от максимальных для пациента ее индивидуальных значений. Результаты исследований демонстрируют улучшение от этих занятий у 17% пациентов основной группы в сравнении с положительной динамикой у 0,5% лиц в группе сравнения. Кроме того, у 28% больных наблюдалось достоверное снижение порогов боли в тендерных точках, в то время как в контрольной группе отмечалось некоторое ухудшение по этому параметру [18].
Ходьба является простым, доступным и легко осуществимым методом борьбы с гиподинамией, которая не только весьма характерна для пациентов с ФМ, но и провоцирует основные проявления заболевания. В нескольких исследованиях проводилась оценка дозированных пеших прогулок, включенных в комплекс реабилитационных программ, что позволило сформулировать выводы относительно их эффективности. Большинство авторов считают такой подход весьма эффективным при соблюдении условий умеренной степени активности с постепенным медленным наращиванием степени нагрузок и индивидуального подхода [18].
Другой формой физической терапии являются занятия в бассейне, которые могут дополнительно включать аэробику, упражнения на растяжимость и гибкость. Занятия в бассейне с температурным режимом воды 30-34°С оказывают позитивный эффект не только на выраженность боли, но также способствуют уменьшению таких симптомов как скованность, общая слабость и болезненность в тендерных точках, а также увеличивают общую стрессоустойчивость пациентов с ФМ [87]. Специальные исследования позволяют констатировать, что именно этот вид физической реабилитации сопровождается достаточно стойким эффектом, длительность которого составляет в среднем 6 месяцев после окончания лечения. Курс лечения длится от 6 до 24 недель и состоит из сеансов продолжительностью 30-60 мин, которые осуществляют несколько раз в неделю.
Когнитивно-поведенческая терапия (КПТ) в настоящее время является одним из наиболее широко используемых методов в практике ведения пациентов с ФМ. КПТ обычно включает три фазы: 1) обучение пациента; 2) тренинг, то есть меры, направленные на повышение возможности применения пациентом когнитивных и поведенческих приемов с целью увеличения степени самоконтроля над своим состоянием и соматическими симптомами; 3) самостоятельное применение навыков КПТ. Успешное применение методов КПТ при других формах болевых синдромов делает логичным использование ее у больных ФМ. Среди всех техник КПТ наиболее успешным в отношении редукции болевых проявлений при ФМ является релаксационный тренинг [72]. Наряду с этим одним из эффективных, особенно у некоторых категорий больных, является применение метода биологической обратной связи (БОС) с контролем различных параметров, но чаще всего показателей электромиографии. Регулярные занятия, направленные на обучение поддержанию прогрессивной мышечной релаксации, сопровождаются уменьшением выраженности спонтанной боли, скованности и количества болевых точек [36].
Одним из перспективных методов лечения пациентов с ФМ является фототерапия. Как альтернативный метод, фототерапия обладает целым рядом преимуществ, связанных с его безопасностью, возможностью комбинирования с другими методами терапии и патогенетической обоснованностью. Фототерапия представляет собой физический метод воздействия ярким белым светом. Она обладает целым рядом доказанных эффектов: противоболевым, сомногенным, антидепрессивным, антитревожным, хронобиологическим [107]. Воздействие фототерапии у больных ФМ проявляется в снижении уровня боли и количества тендерных точек, улучшении параметров сна и редукции симптомов депрессии. Механизм фототерапевтического воздействия при ФМ связан с антидепрессивным эффектом, стимуляцией систем, организующих дельта-сон, а также с противоболевым действием, обусловленным воздействием на серотонинергические механизмы [4].
Фармакологическое лечение фибромиалгии
Несмотря на доступность большого арсенала фармакологических подходов, ФМ относится к заболеваниям, которые рассматриваются большинством специалистов как труднокурабельное. Несмотря на существующие патогенетические подходы, основанные на современных представлениях о механизмах развития хронической боли при ФМ, эффективность лечения в целом остается весьма ограниченной. Одной из главных причин рассматривается высокая коморбидность ФМ с целым рядом расстройств, которые сами по себе утяжеляют течение заболевания и требуют самостоятельного лечения [106]. Как правило, коморбидные расстройства включают множество проявлений в различных системах (таких как слабость, скованность, когнитивные расстройства, нарушения сна, депрессия, тревога) [11]. Это обстоятельство диктует необходимость комплексного лечения, в том числе с включением нескольких классов фармакологических средств. Между тем клиническая практика показывает, что подавляющее большинство пациентов получают монотерапию, используя для лечения боли и других проявлений ФМ лишь один из препаратов. Так, анализ паттернов лечения большой выборки пациентов с ФМ, проведенный P. Duccias с со-авт. [31] в период с февраля 2009 г. по январь 2010 г., показал, что 82% пациентов принимают только один препарат; 12% используют 2 препарата и 6% пациентов врачи выписывают три и более фармакологических средства. Наиболее частым классом препаратов являются антидепрессанты, которые применяют 46% пациентов. Вторым по частоте применения классом являются антиконвульсанты (35%), за которыми следуют остальные наиболее часто используемые препараты (анальгетики - 25%; мышечные релаксанты - 8%; снотворные средства - 2%). При этом среди пациентов, находящихся на монотерапии, наиболее часто используемым препаратом является прегабалин, который в период исследования получали 21% пациентов; вторым по частоте применения был дулоксетин (20%); милнаципран получали 10% пациентов.
Число рандомизированных контролируемых исследований (РКИ) эффективности лечения ФМ в последние десять лет значительно выросло [82,85]. Фармакологические исследования сфокусированы в основном на лекарственных препаратах нейротропного действия, таких как трициклические антидепрессанты (ТЦА), селективные ингибиторы обратного захвата серотонина (СИОЗС), мышечные релаксанты (MP), и анальгетики (например, НПВП и опиоиды). Большая часть применяемых в настоящее время средств при ФМ используется не по прямому показанию. При этом некоторые из них (ТЦА, СИОЗС, MP) демонстрируют более высокую эффективность, чем другие (НПВП, опиоиды) [28,41]. В частности, нет доказательных данных, что НПВП эффективны в монотерапии ФМ. Между тем существуют некоторые клинические исследования, результаты которых допускают, что пациенты с ФМ могут получить дополнительные терапевтические преимущества при использовании НПВП вместе с другими средствами [81]. К настоящему времени нет сведений о РКИ опиоидов при ФМ, однако отдельные работы показывают, что они практически не эффективны у этих пациентов, хотя это требует дальнейшего изучения [28]. Ингибиторы обратного захвата серотонина и норадреналина (СИОЗСН) являются классом антидепрессантов, которые показали свою эффективность в лечении пациентов с ФМ. Трудности лечения таких пациентов связаны еще и с тем, что у них весьма часто наблюдаются случаи непереносимости многих классов фармакологических средств, что ограничивает эффективность существующих подходов и диктует необходимость разработки и изучения новых фармакологических препаратов [39].
В последние годы достигнуты значительные успехи в понимании патофизиологии боли при ФМ, что позволило определить новые терапевтические мишени. Так. мишенью действия СИОЗСН в отличие от СИОЗС, которые более селективно воздействуют на серотонинергическую трансмиссию, является увеличение уровней как серотонина, так и норадреналина. Значение этих нейротрансмиттеров в процессах поддержания сна, внимания, когнитивных функций, и, возможно, что более важно, в модуляции нисходящего ингибирующего контроля боли, объясняет регресс симптомов ФМ на фоне лечения СИОЗСН [96]. Созданное первоначально как антиконвульсивное средство, прегабалин (Lyrica®) оказывает свое терапевтическое действие путем связывания и снижения активности альфа-2-дельта субъединицы вольтаж-зависимых кальциевых каналов (ВЗКК) [38]. Активность ВЗКК, как известно, играет интегративную роль в ноцицептивной трансмиссии, особенно в развитии и поддержании ноцицептивной гиперчувствительности. Прегабалин (Lyrica®) стал первым рекомендованным FDA средством для лечения ФМ в июне 2007 г Позже для лечения ФМ FDA были одобрены СИОЗСН duloxetine (Cymbalta®) и milnacipran (Savella®) в июне 2008 и январе 2009 соответственно [82] (табл. 3).
Таблица 3. Фармакологические средства, применяемые для лечения больных с фибромиалгией
| Фармакологическое лечение | Механизм действия | APS 2005 [22] | EULAR 2007 [23] | Показания при ФМ |
| Стандартное лечение | ||||
| НПВП (например, ацетилсалициловая кислота, напроксен, ибупрофен) | Селективные или неселективные ингибиторы Ц0Г-1,2 | н/д | н/д | н/у |
| Опиоиды (например, морфин, кодеин, фентанил, налбуфин) | Связывание с Mu- kappa-, delta—opioid рецепторами | н/д | н/д | н/у |
| Трамадол | Опиоидный анальгетик Связывание с Mu-опиоидными рецепторами | у/э | в/э | н/у |
| Амитриптилин | ТЦА (адъювантный аналгетик) Ингибиция Na+ ионных каналов; блокада NMDA рецепторов | в/э | в/э | н/у |
| Флуоксетин | СИОЗ (адъювантный анальгетик) | у/э | в/э | н/у |
| Габапентин | Антиконвульсант (адъювантный анальгетик) Лигант alpha—2—delta субъединиц ВЗКК |
н/п | н/п | н/у |
| S-adenosylmethionine | Антидепрессант (адъювантный анальгетик) | у/э | н/п | н/у |
| Cyclobenzaprine | Мышечный релаксант | в/э | н/п | н/у |
| Гормон роста | Гормон | у/э | н/п | н/у |
| Новое лечение | ||||
| Прегабалин | Антиконвульсант (адъювантный анальгетик) Лигант alpha—2—delta субъединиц ВЗКК | у/э | в/э | рекомендовано FDA (2007) |
| Дулоксетин | Антидепрессант СИОЗСН (адъювантный анальгетик) | у/э | в/э | рекомендовано FDA (2008) |
| Милнаципран | Антидепрессант СИОЗСН (адъювантный анальгетик) | у/э | в/э | рекомендовано FDA (2009) |
| Вспомогательное лечение | ||||
| Прамипексол | Неэрготаминовый агонист D2, D3, и D4 дофаминовых рецепторов | н/п | в/э | н/у |
| Декстрометорфан | Антагонист NMDA рецепторов (адъювантный анальгетик) | н/п | н/п | н/у |
| Кетамин | Антагонист NMDA рецепторов (адъювантный анальгетик) | н/п | н/п | н/у |
| Sodium oxybate | Взаимодействие с GABAB и GHB рецепторами | н/п | н/п | н/у |
| Naltrexone | Опиоидный антагонист | н/п | н/п | н/у |
| Delta-9-THC | Психоактивный каннабиоид | н/п | н/п | н/у |
| Примечания: APS - American Pain Society; EULAR - European League Against Rheumatism; FDA - Food and Drug Administration; ЦОГ - циклооксигеназа; н/п - не применяется; н/д - нет данных; н/у - не утвержден; у/э - умеренная эффективность; в/э - высокая эффективность; н/э - низкая эффективность | ||||
Эффективность дулоксетина при ФМ оценивалась в 5 рандомизированных двойных слепых плацебо-контролируемых исследованиях [8,9,23,62,86]. Первое исследование [8] включало 207 пациентов, которые получали дулоксетин в дозе 60 мг/сут. В сравнении с группой плацебо группа, получавшая дулоксетин, продемонстрировала статистически значимое улучшение по общему баллу шкалы Fibromyalgia Impact Questionnaire (FIQ) (p=0,027), однако по уровню боли шкалы FIQ статистически значимой разницы с группой плацебо получено не было (р=0,13). Хотя дулоксетин снижал уровень боли и тяжесть симптомов ФМ у большинства пациентов, в целом статистически значимое улучшение наблюдалось только у пациентов женского пола. При этом результаты лечения не зависели от наличия симптомов большой депрессии. Во втором исследовании оценивали эффект дулоксетина в дозе 60 мг/сут. по сравнению с плацебо у 354 женщин с ФМ с наличием большого депрессивного расстройства и без него [9]. Пациенты обеих групп дулоксетина показали статистически более значимое улучшение по параметрам шкал Brief Pain Inventory (BPI), FIQ, Clinical Global Impression of Severity (CGIS), Patient Global Impression of Improvement (PGM), и качества жизни в сравнении с плацебо. Эти результаты не зависели от степени влияния на настроение и наличия большой депрессии.
Оставшиеся три исследования [23,62,86] оценивали долгосрочные эффекты дулоксетина. В 2008 г A.S. Chappell с соавт. [23] опубликовали результаты рандомизированного двойного слепого плацебо-контролируемого с параллельными группами исследования эффективности дулоксетина в дозе 60 мг/сут. в течение 6 месяцев. У пациентов, у которых не удавалось достичь >50% редукции боли по шкале BPI, на 13-й неделе исследования доза препарата исследования поднималась до 120 мг/сут. Дулоксетин в дозе 60/120 мг/сут. не продемонстрировал статистически значимого по сравнению с плацебо улучшения боли по шкале BPI (р=0,053) и PGII (р=0,073). Между тем отмечалось улучшение в отношении некоторых вторичных параметров эффективности по сравнению с плацебо, в том числе по шкале боли вопросника FIQ, Multidimensional Fatigue Inventory, CGIS, и общему баллу Beck Depression Inventory—II [23].
В этих исследованиях эффективность дулоксетина значительно различалась по разным параметрам в зависимости от дозы препарата и длительности лечения. L.M. Arnold с соавт. [7] предприняли объединенный анализ первых 4-х из этих исследований: 2-х краткосрочных [8,9] и 2-х долгосрочных [23,86] с анализом результатов лечения 1 411 пациентов с ФМ. Авторы сделали вывод о более высокой эффективности дулоксетина при средней тяжести болевого синдрома. Кроме того, дулоксетин оказывает более значимые, чем в группе плацебо, эффекты (рПрограмма исследования эффективности милнаципрана у больных с ФМ включала два открытых неконтролируемых 12-недельных исследования [69,100], в которых милнаципран оценивался в дозах 30-100 мг/сут. и показал облегчение боли и улучшение общего состояния пациентов. Примечательно, что только у пациентов с отсутствием симптомов депрессии отмечалось достоверное снижение боли по ВАШ к концу исследования. В 2004 г. в США было завершено первое мультицентровое рандомизированное двойное слепое плацебо-контролируемое исследование милнаципрана в дозе 200 мг/сут. у 125 пациентов с ФМ [103]. Как и в открытых исследованиях, лучшие результаты по снижению боли были получены в группах пациентов, не имеющих исходно симптомов депрессии. В 4 рандомизированных двойных слепых плацебо-контролируемых исследованиях оценивалась эффективность милнаципрана в дозе 100 или 200 мг/сут. в течение 3-6 месяцев (1 196, 888. 884 и 449 пациентов соответственно) [24,61]. Лечение милнаципраном достоверно снижало боль и другие симптомы ФМ, такие как слабость, когнитивные нарушения, нарушения сна. Рекомендуемая по данным этих исследований доза милнаципрана составила 100-200 мг/сут. [101]. Учитывая достаточно высокую частоту побочных эффектов в начале терапии, рекомендовано начинать лечение со стартовой дозы 12,5 мг/сут., постепенно увеличивая ее каждую неделю до 100 мг/сут.. А доза 200 мг/сут. должна использоваться исходя из индивидуальной переносимости препарата.
Для оценки эффективности прегабалина в лечении больных ФМ было предпринято 4 рандомизированных двойных слепых плацебо-контролируемых исследования [10,12,26,27,62,74]: краткосрочные исследования продолжительностью от 8 до 14 недель [10,26,27] и длительное исследование - более 6 месяцев [26].
В исследования включались пациенты с ФМ в возрасте >18 лет, диагноз которым выставлялся в соответствии с критериями ACR (1990 г.). Уровень боли у них соответствовал значениям в среднем >4 по 10-балльной рейтинговой шкале и >40 мм по 100 мм визуальной аналогов шкале (ВАШ). Были использованы различные способы оценки эффективности лечения: опросник влияния ФМ (FIQ), дневник качества сна, анкета сна (MOS)-sleep measure), краткая версия Мак-Гилловского болевого опросника (McGill Pain Questionnaire (SF-MPQ), шкала многомерной оценки слабости (Multidimensional Assessment of Fatigue (MAF), SF-36, Госпитальная шкала тревоги и депрессии (Hospital Anxiety and Depression Scale (HADS) [74]. Пациентам, включенным в 8-недельное исследование, также применяли оценку по шкалам общего клинического впечатления по мнению пациента и мнению врача (Patient Global Impression of Change (PGIC) и Clinical Global Impression of change (CGIC). Первичным параметром эффективности во всех трех краткосрочных исследованиях было изменение средних значений шкалы боли от исходного уровня.
В 8-недельном исследовании проводилась оценка прегабалина в дозах 150, 300 и 400 мг/сут. [27]. Только в группе пациентов, принимавших прегабалин в дозе 450 мг/сут., наблюдались статистически значимое снижение уровня боли (0,93 по 10-балльной шкале; рВ 13-недельном исследовании проводилась оценка влияния прегабалина на болевые проявления у 748 пациентов с ФМ, которые были рандомизированы на три группы, получавшие прегабалин соответственно в дозах 300, 450 и 600 мг/сут. [62]. Первичным параметром эффективности было значение средних уровней боли в баллах в разных группах препарата исследования и плацебо. Параметры PGIC и общий балл по FIQ были использованы, как вторичные параметры оценки лечения ФМ. Пациенты во всех трех группах, получавших прегабалин, характеризовались статистически более существенным улучшением по средним значениям шкалы PGIC в сравнении с плацебо (р=0,0449: 300 мг/сут.. 0,43; р=0,0449: 450 мг/сут., 0,47; р=0,007: 600 мг/сут., 0,66).
В другом исследовании, которое проводилось в течение 14 недель [10], были получены сходные результаты. Среднее изменение уровня боли в конечной точке в группах, получавших прегабалин, было значительно больше, чем в группе плацебо (рВ целом 41% пациентов, получавших прегабалин. оценивали свое состояние, как «очень сильно улучшилось» или «сильно улучшилось», в то время как в группе плацебо такая оценка эффективности лечения отмечалась лишь в 23% случаев. В соответствии с параметрами шкалы PGIC пациенты, принимавшие прегабалин во всех трех дозах, отмечали улучшение достоверно чаще, чем в группе плацебо (рис. 1) [10].
Рис. 1. Показатели шкалы общего клинического впечатления (PGIC) по мнению пациентов с фибромиалгией, получавших разные дозы прегабалина (Лирика®)
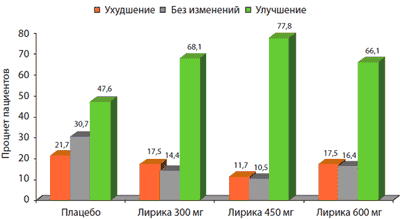
Для оценки устойчивости эффектов прегабалина было предпринято длительное исследование, в котором 6-месячному периоду двойной слепой фазы предшествовала 6-недельная открытая фаза для определения оптимальной дозы препарата (300, 450, 600 мг/сут.) и выявления «респондентов» (тех пациентов, которые в открытой фазе исследования отметили снижение боли на >50% по ВАШ или «значительное улучшение» по шкале PGIC) [26]. Первичным параметром эффективности было время потери терапевтического ответа, которая определялась по мнению исследователя, как редукция боли на Эффективность прегабалина, полученная в ходе описанных РКИ (как в режиме монотерапии, так и в качестве адъювантной терапии), подтверждена результатами и других менее масштабных исследований при ФМ [21,32]. Рассматривая в совокупности результаты этих исследований, сделаны выводы об эффективности, краткосрочных и долгосрочных исходах терапии прегабалином. Наиболее высокая эффективность снижения боли достигалась на дозах 300-600 мг/сут., с началом терапевтического ответа в пределах первой недели терапии [101]. Доза 600 мг/сут. характеризовалась увеличением количества побочных эффектов и некоторым дополнительным эффектом редукции боли. Более низкие дозы, хотя и не обеспечивают значимую редукцию боли, зачастую облегчают сопровождающие симптомы, такие, как например, слабость, нарушения сна и др., что необходимо учитывать в общей картине эффектов лечения больных ФМ.
Лечение больных ФМ является трудным в связи со значительным числом случаев, резистентных к различным видам терапии. B.R. Stacey с соавт. провели исследование эффективности длительной терапии прегабалином резистентных случаев фибромиалгии [94]. В этом исследовании резистентность определялась, как отсутствие адекватного снижения боли при применении, по крайней мере, трех из перечисленных классов препаратов в среднетерапевтических дозах: трициклические антидепрессанты, габапентин и другие антикон-вульсанты, СИОЗС, СИОЗСН, НПВП (селективные ингибиторы ЦОГ-2), комбинированные аналгетики, опиои-ды, трамадол. Пациенты получали прегабалин в гибкой дозировке 150-600 мг/сут. в течение 3 месяцев, после чего следовал период отмены прегабалина (лекарственные каникулы) длительностью в среднем 3-4 дня. Пациенты, у которых отмечался рецидив (возврат боли до исходного уровня), возобновляли прием препарата в следующие 3 месяца. Общая длительность исследования составила 15 месяцев, в течение которых 76% больных завершили исследование. Большинство пациентов (88%) в процессе терапии продолжали прием обезболивающих препаратов, несмотря на полную устойчивость к ним, и у 70% пациентов исходно отмечался высокий уровень боли. Средний уровень боли в процессе лечения прегабалином уменьшился на 30% по сравнению с исходным значением.
Примечательным результатом лечения прегабалином было значимое снижение истенсивности боли: через 3 месяца терапии прегабалином снижение на >30% и >50% отмечали 54 и 50% пациентов соответственно [94]. А в конце курсалечения через 15 месяцев >30%- и >50%-ую редукцию уровня боли отмечали 46 и 38% пациентов соответственно. Основным доказательством высокой эффективности, связанной с лечением, был тот факт, что в начале терапии исходно высокий уровень боли по данным теста ВАШ краткой версии McGill Pain Questionnaire отмечался у 68% пациентов, а в конце 15-месячного курса лечения только у 38%. Важно, что через 15 месяцев 42% пациентов оценили уровень боли как «нет/слабая боль». Примерно половина пациентов, имеющих >30% редукцию боли в первые 3 месяца лечения, в дальнейшем продолжали отмечать клинически значимое уменьшение ее выраженности в процессе терапии прегабалином (рис. 2).
Рис. 2. Распределение пациентов с фибромиалгией с различной интенсивностью боли в процессе лечения прегабалином
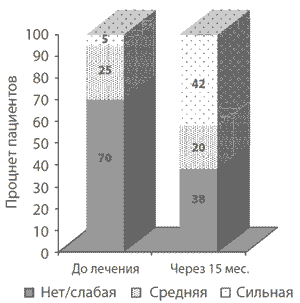
Примечания: уровень боли по ВАШ (McGill Pain Qiestionnaire) соответствовал значениям: «нет/слабая боль» = 40мм до 70 мм
Это исследование еще раз подчеркивает длительность эффектов прегабалина и возможность лечения рефрактерных случаев заболевания, при которых эффективность лечения достигается применением более продолжительного курсалечения.
ЛИТЕРАТУРА
1. Табеева Г.Р., Азимова Ю.Э. Фибромиалгия: современное понимание патогенеза и новые подходы к лечению (совм. с Азимовой Ю.Э.). Боль. 2007, №4 (17), с. 9-13.
2. Табеева Г.Р., Короткова С.Б., Вейн А.М. Фибромиалгия (обзор). Журнал неврологии и психиатрии им. С.С.Корсакова. 2000;4:69-77.
3. Табеева Г.Р. Нарушения сна у больных фибромиалгией. РМЖ, 2006, т. 14, №21(273), 1530-1534.
4. Ханунов И.Г. Клинико-психологическое, нейрофизиологическое исследование и фототерапия больных фибромиалгией. Автореф канд дисс... мед наук. М. 2000,23с.
5. Abraham G.E., Rechas J.D. Management of fibromialgia: rationale for the use of magnesium and malic acid. J Nutr Med. 1992; 3:49-59
6. American Pain Society Guidelines for the management of fibromyalgia syndrome pain in adults and children, www.ampainsoc.org/pub/fibromyalgia.htm. 2005.
7. Arnold L.M., Clauw DJ, Wohlreich MM, et al. Efficacy of duloxetine in patients with fibromyalgia: Pooled analysis of 4 placebo-controlled clinical trials. Prim Care Companion J Clin Psychiatry. 2009;11(5):237-244.
8. Arnold L.M., Lu Y., Crofford U., et al. A double-blind, multicenter trial comparing duloxetine with placebo in the treatment of fibromyalgia patients with or without major depressive disorder. Arthritis Rheum. 2004;50(9):2974-2984.
9. Arnold L.M., Rosen A., Pritchett Y.L., et al. A randomized, double-blind, placebo-controlled trial of duloxetine in the treatment of women with fibromyalgia with or without major depressive disorder. Pain.2005;119(1-3):5-15
10. Arnold L.M., Russell U., Diri E.N., et al. A 14-week, randomized, double-blinded, placebo-controlled monotherapy trial ofpregabalin in patients with fibromyalgia. J Pain. 2008;9(9):792-805.
11. Arnold L.M. Strategies for managing fibromyalgia. Am J Med. 2009; 122(12 Suppl):31-43.
12. Bennett R.M., Jones J., Turk D.C., Russell U, Matallana L An internet survey of 2,596 people with fibromyalgia. BMC Musculoskelet Disord. 2007;8:27.
13. Bling S.A., Susko T.M. Lifestyle and environmental interventions in fibromyalgia and related conditions. In: Fibromyalgia and other central pain syndromes. Wallace DJ., Claw DJ., eds. Lippincott Williams & Wilkins. 2005; 321-328.
14. Blumenfeld H., Taylor L.A. The role of serotonin norepinephrine reuptake inhibitors in the treatment of fibromyalgia: A guide for the physician assistant. The Internet J of Academ Phys Assist. 2005;4(2)
15. Branco J., Bragee G., Zachrisson 0., et al. Milnacipran for the treatment of fibromyalgia syndrome: A European multicenter, double-blind, placebo-controlled trial [Abstract! Eur Neuropsychopharmacol. 2008; 18(S4):574-575
16. Briley M. Milnacipran, a well-tolerated specific serotonin and norepinephrine reuptake inhibiting antidepressant. CNS Drug Reviews. 1998;4:137-148.
17. Brosschot J.F., Aarsse H.R. Restricted emotional processing and somatic attribution in fibromyalgia. Int J Psychiatry Med. 2001;31(2):127-148.
18. Busch A., Schachter C., Peloso P. Exercise for treating fibromyalgia syndrome. In: The Cocrane library. Oxford: Update Software, 2002
19. Buskila D., Sarzi-Puttini P. Biology and therapy of fibromyalgia. Genetic aspects of fibromyalgia syndrome. Arthritis Res Ther. 2006;8(5):218.
20. Bymaster F.P., Beedle E.E., Findlay J., etal. Duloxetine (Cymbalta), a dual inhibitor of serotonin and norepinephrine reuptake. Bioorg Med Chem Lett. 2003; 13(24):4477-4480.
21. Calandre E.P., Morillas-Arques P., Rodriguez-Lopez C.M., Rico-Villademoros F., Hidalgo J. Pregabalin augmentation ofquetiapine therapy in the treatment of fibromyalgia: An open-label, prospective trial. Pharmacopsychiatry. 2007;40(2):68-71.
22. Carville S.F., Arendt-Nielsen S., Bliddal H., et al. EULAR evidence-based recommendations for the management of fibromyalgia syndrome. Ann Rheum Dis. 2008;67(4):536-541.
23. Chappell A.S., Bradley L.A., Wiltse C., Detke M.J., D'Souza D.N., Spaeth M. A six-month double-blind, placebo-controlled, randomized clinical trial of duloxetine for the treatment of fibro myalgia. Int J Gen Med. 2008; 1:91-102
24. Clauw D.J., Mease P., Palmer R.H., Gendreau RM, Wang Y Milnacipran for the treatment of fibromyalgia in adults: A 15-week, multicenter, randomized, double-blind, placebo-controlled, multiple-dose clinical trial. Clin Ther. 2008;30(11):1988-2004
25. Clauw D.J. Alpha-2-delta ligands in fibromyalgia: Is the glass half empty or full? Pain. 2009; 145(1-2):8-9.
26. Crofford U., Mease P.J., Simpson S.L., et al. Fibromyalgia relapse evaluation and efficacy for durability of meaningful relief (FREEDOM): A 6-month, double-blind, placebo-controlled trial with pregabalin. Pain. 2008;136(3):419-431.
27. Crofford U., Rowbotham M.C., Mease P.J., et al. Pregabalin for the treatment of fibromyalgia syndrome: Results of a randomized, double-blind, placebo-controlled trial. Arthritis Rheum. 2005;52(4):1264-1273.
28. Crofford L.J. Pharmaceutical treatment options for fibromyalgia. Curr Rheumatol Rep. 2004;6(4):274-280.
29. Detke M.J., Lu Y., Goldstein D.J., McNamara R.K., Demitrack M.A. Duloxetine 60 mg once daily dosing versus placebo in the acute treatment of major depression. J Psychiatr Res. 2002;36(6):383-390.
30. Dobkin P.L., Sita A., Sewitch M.J. Predictors of adherence to treatment in women with fibromyalgia. Clin J Pain. 2006;22(3):286-294.
31. Duccias P., Kalali A.H., Staud P.P. Treatment of fibromyalgia. Psychiatry. 2010;5(7):15-18.
32. Dworkin R., Sharma U., Stacey B., Chambers R., Siffert J. Long-term treatment of neuropathic pain and fibromyalgia syndrome with pregabalin in treatment-refractory patients. J Pain. 2005; 6(З):30-30.
33. Eisinger J., Plantamura A., Marie P.A. Selenium and magnesium status in fibromyalgia. Magn Res. 1994;7:285-288.
34. Hi Lilly and Co Cymbalta (duloxetine) product information. http://pi.IHIy. com/us/cymbalta-pi.pdf 2009.
35. Engleman E.A., Perry K.W., Mayle D.A., Wong D.T. Simultaneous increases of extracellular monoamines in microdialysates from hypothalamus of conscious rats by duloxetine, a dual serotonin and norepinephrine uptake inhibitor. Neuropsychopharmacology. 1995;12(4):287-295.
36. Ferraccioli G., Ghirelli L., Scita F. EMG-biofeedback training in fibromyalgia syndrome. J Rheumatol. 1987;14(4):820-825
37. Fietta P., Manganelli P. Fibromyalgia and psychiatric disorders. Acta Biomed. 2007;78(2):88-95.
38. Gajraj N.M. Pregabalin: Its pharmacology and use in pain management. Anesth Analg. 2007;105(6):1805-1815
39. Geisser M.E., Strader Donnell C., Petzke F., Gracely R.H., Clauw D.J., Williams D.A. Comorbid somatic symptoms and functional status in patients with fibromyalgia and chronic fatigue syndrome: Sensory amplification as a common mechanism. Psychosomatics. 2008;49(3):235-242.
40. Gendreau R.M., Thorn M.D., Gendreau J.F., et al. Efficacy of milnacipran in patients with fibromyalgia. J Rheumatol. 2005;32(10):1975-1985
41. Goldenberg D.L., Burckhardt C., Crofford L. Management of fibromyalgia syndrome. JAMA 2004;292(19):2388-2395
42. Goldenberg D.L., Clauw D.J., Palmer R.H., Mease P., Chen W., Gendreau R.M. Durability of therapeutic response to milnacipran treatment for fibromyalgia, results of a randomized, double-blind, monotherapy 6-month extension study. Pain Med. 2009.
43. Gracely R.H., Jensen K., Petzke F. The effect of milnacipran on pain modulatory systems in fibromyalgia: An fMRI analysis [Abstract] Ann Rheum Dis. 2008;67(Suppl 2):255.
44. Gran J.T. The epidemiology of chronic generalized musculoskeletal pain. Best Pract Res Clin Rheumatol. 2003;17(4):547-561.
45. Gray P. Pregabalin in the management of central neuropathic pain. Expert Opin Pharmacother. 2007;8(17):3035-3041.
46. Greden J.F. Duloxetine and milnacipran. In: Schatzberg AF, NemeroffCB, editors. Essentials of Clinical Psychopharmacology. 2nd ed. Arlington, VA: American Psychiatric Publishing, Inc; 2006. pp. 171-180.
47. Hassett A.L., Gevirtz R.N. Nonpharmacologic treatment for fibromyalgia: Patient education, cognitive-behavioral therapy, relaxation techniques, and complementary and alternative medicine. Rheum Dis Clin North Am. 2009;35(2):393-407.
48. Katz R.S., Wolfe F., Michaud К Fibromyalgia diagnosis: A comparison of clinical, survey, and American College of Rheumatology criteria. Arthritis Rheum. 2006,54(1): 169-176.
49. Kihara T., Ikeda M. Effects of duloxetine, a new serotonin and norepinephrine uptake inhibitor, on extracellular monoamine levels in rat frontal cortex. J Pharmacol Exp Ther. 1995,272(1): 177-183.
50. Krsnich-Shriwise S. Fibromyalgia syndrome: An overview. Phys Ther. 1997;77(1):68-75.
51. Krypel L.L. Fibromyalgia: A review of its pathophysiology and drug treatment. J Pharmacy Practice. 2009,22(1 ):6-16.
52. Lantz R.J., Gillespie Т.А., Rash T.J., et al. Metabolism, excretion, and pharmacokinetics of duloxetine in healthy human subjects. Drug Metab Dispos. 2003;31(9): 1142-1150.
53. Lawson К. Are complex therapies required as pharmacological treatments of fibromyalgia? Fut Rheumatol. 2007;2(6):599-605
54. Lawson К. Treatment options and patient perspectives in the management of fibromyalgia: Future trends. Neuropsychiatr Dis Treat. 2008;4(6):1059-1071.
55. Leknes S., Tracey I. A common neurobiology for pain and pleasure. Nat Rev Neurosci. 2008;9(4):314-320
56. Lobo E.D., Quintan T., O'Brien L., Knadler M.P., Heathman M. Population pharmacokinetics of orally administered duloxetine in patients: Implications for dosing recommendation. Clin Pharmacokinet. 2009;48(3):189-197
57. Mainguy Y. Functional magnetic resonance imagery (fMRI) in fibromyalgia and the response to milnacipran. Hum Psychopharmacol. 2009;24(Suppl 1): 19-23.
58. Maj J., Rogoz Z., Dlaboga D., Dziedzicka-Wasylewska M. Pharmacological effects of milnacipran, a new antidepressant, given repeatedly on the alphal-adrenergic and serotonergic 5-HT2A systems. J Neural Transm. 2000; 107(11): 1345-1359
59. Malefic V., Raison C.L. Neurobiology of depression, fibromyalgia and neuropathic pain. Front Biosci. 2009;14:5291-5338.
60. Martinez-Lavin M., Hermosillo A.G. Autonomic nervous system dysfunction may explain the multisystem features of fibromyalgia. Semin Arthritis Rheum. 2000,29(4): 197-199.
61. Mease P.J., Clauw D.J., Gendreau R.M., etal. The efficacy and safety of milnacipran for treatment of fibromyalgia. A randomized, double-blind, placebo-controlled trial. J Rheumatol. 2009;36(2):398-409.
62. Mease P.J., Russell I.J., Arnold L.M., et al. A randomized, double-blind, placebo-controlled, phase III trial of pregabalin in the treatment of patients with fibromyalgia. J Rheumatol. 2008;35(3):502-514.
63. Mease P.J., Russell U., Kajdasz D.K., et al. Long-term safety, tolerability, and efficacy of duloxetine in the treatment of fibromyalgia. Semin Arthritis Rheum. 2009;Jan: 17.
64. Michael E.S., Burns J.W. Catastrophizing and pain sensitivity among chronic pain patients: Moderating effects of sensory and affect focus. Ann Behav Med. 2004,27(3): 185-194.
65. Millan M.J., Brocco M., Veiga S., Cistarelli L., Melon C., Gobert A. WAY 100,635 enhances both the 'antidepressant' actions of duloxetine and its influence on dialysate levels of serotonin in frontal cortex. Eur J Pharmacol. 1998;341(2-3):165-167
66. Moret C., Briley M. Effect of antidepressant drugs on monoamine synthesis in brain in vivo. Neuropharmacology. 1992;31(7):679-684.
67. Moret C., Briley M. Effects of milnacipran and pindolol on extracellular noradrenaline and serotonin levels in guinea pig hypothalamus. J Neurochem. 1997;69(2):815-822.
68. Moret C., Charveron M., Finberg J.P., Couzinier J.P., Briley M. Biochemical profile of midalcipran (F 2207), 1-phenyl-1-diethyl-aminocarbonyl-2-aminomethyl-cyclopropane (Z) hydrochloride, a potential fourth generation antidepressant drug. Neuropharmacology. 1985,24(12): 1211-1219.
69. Nagaoka S., Ohno M., Sekiguchi A. An open-label clinical trial of milnacipran in fibromyalgia syndrome with co-morbid depressive symptoms. Int Clin Psychiatry Clin Practice. 2004;8:47-51.
70. Neumann L., Buskila D. Epidemiology of fibromyalgia. Curr Pain Headache Rep. 2003;7(5):362-368.
71. Niddam D.M., Chan R.C., Lee S.H., Yeh T.C., Hsieh J.C. Central modulation of pain evoked from myofascial trigger point. Clin J Pain. 2007;23(5):440-448
72. NIH Technology Assessment Panel on Integration of Behavioral and Relaxation Approaches into the Treatment of Chronic Pain and Insomnia. N.I.H. Integration on behavioral and relaxation appro-achesinto the treatment of chronic pain and insomnia. J Am Med Assoc. 1996;276(4):313-318.
73. Owen R.T. Milnacipran hydrochloride: Its efficacy, safety and tolerability profile in fibromyalgia syndrome. Drugs Today (Bare) 2008;44(9):653-660.
74. Owen R.T. Pregabalin: Its efficacy, safety and tolerability profile in fibromyalgia syndrome. Drugs Today (Bare) 2007;43(12):857-863
75. Рае C.U., Luyten P., Marks D.M., et al. The relationship between fibromyalgia and major depressive disorder: A comprehensive review. Curr Med Res Opin. 2008;24(8):2359-2371.
76. Plesh 0., Wolfe F., Lane N. The relationship between fibromyalgia and temporomandibular disorders: Prevalence and symptom severity. J Rheumatol. 1996,23(11):1948-1952.
77. Puozzo C., Albin H., Vincon G., Deprez D., Raymond J.M., Amouretti M. Pharmacokinetics of milnacipran in liver impairment. Eur J Drug Metab Pharmacokinet. 1998;23(2):273-279.
78. Puozzo C., Lens S., Reh C., et al. Lack of interaction of milnacipran with the cytochrome p450 isoenzymes frequently involved in the metabolism of antidepressants. Clin Pharmacokinet. 2005;44(9):977-988
79. Puozzo C., Leonard B.E. Pharmacokinetics of milnacipran in comparison with other antidepressants. Int Clin Psychopharmacol. 1996; 11(Suppl 4): 15-27
80. Puozzo C., Pozet N., Deprez D., Bailie P., Ung H.L., Zech P. Pharmacokinetics of milnacipran in renal impairment. Eur J Drug Metab Pharmacokinet. 1998;23(2):280-286
81. Rao S.G., Clauw D.J. The management of fibromyalgia. Drugs Today (Bare) 2004;40(6):539-554
82. Recla J.M. New and emerging therapeutic agents for the treatment of fibromyalgia: an update. J Pain Res. 2010; 3:89-103.
83. Richelson E. The clinical relevance of antidepressant interaction with neurotransmitter transporters and receptors. Psychopharmacol Bull. 2002;36(4):133-150
84. Rogoz Z., Margas W., Dlaboga D., Goralska M., Dziedzicka-Wasylewska M., Maj J. Effect of repeated treatment with milnacipran on the central dopaminergic system. Pol J Pharmacol. 2000;52(2):83-92.
85. Rooks D.S. Fibromyalgia treatment update. Curr Opin Rheumatol. 2007; 19(2): 111-117
86. Russell I.J., Mease P.J., Smith T.R., et al. Efficacy and safety of duloxetine for treatment of fibromyalgia in patients with or without major depressive disorder: Results from a 6-month, randomized, double-blind, placebo-controlled, fixed-dose trial. Pain. 2008;136(3):432-444.
87. Saltsk r Jentoft E., Grimstvedt Kvalvik A., Mengchoel A.V. Effecte of pool-based and land-based aerobic exercise on women with fibromyalgia/chronic widespread muscle pain. Arthritis Care Res. 2001;45:42-47.
88. Scholz B.A., Hammonds C.L., Boomershine C.S. Duloxetine for the management of fibromyalgia syndrome. Journal of Pain Research. 2009;2:99-108
89. Selak I. Pregabalin (Pfizer) Curr Opin Investig Drugs. 2001 ;2(6):828-834. US Prescribing Information for Lyrica (Pfizer), www.lyrica.com/. 2009.
90. Sewitch M.J., Dobkin P.L., Bernatsky S., et al. Medication non-adherence in women with fibromyalgia. Rheumatology. 2004;43(5):648-654.
91. Sharma A., Goldberg M.J., Cerimele B.J. Pharmacokinetics and safety of duloxetine, a dual-serotonin and norepinephrine reuptake inhibitor. J Clin Pharmacol. 2000,40(2): 161-167.
92. Shuto S., Ono S., Hase Y., et al. Synthesis and biological activity of conformationally restricted analogs of milnacipran: (1S,2R)-1-phenyl-2-[(S)-1-aminopropyl]-N,N-diethylcyclopropanecarbo-xamide, an efficient noncompetitive N-methyl-D-aspartic acid receptor antagonist. J Med Chem. 1996;39(24):4344-4352.
93. Sills G.J. The mechanisms of action of gabapentin and pregabalin. Curr Opin Pharmacol. 2006Д1):108-113
94. Stacey B.R., Emir В., Petersel D., Murphy К. Pregabalin in the treatment-refractory fibromyalgia. The Open Rheum J. 2010;4:35-38
95. Stahl S.M., Grady M.M., Moret, Briley M. SNRIs: Their pharmacology, clinical efficacy, and tolerability in comparison with other classes of antidepressants. CNS Spectr. 2005; 10(9):732-747.
96. Stahl S.M. Fibromyalgia pathways and neurotransmitters. Hum Psychopharmacol. 2009;24(Suppl I): 11-17
97. Staud R. Biology and therapy of fibromyalgia: Pain in fibromyalgia syndrome. Arthritis Res Ther. 2006;8(3):208.
98. Staud R. Evidence of involvement of central neural mechanisms in generating fibromyalgia pain. Curr Rheumatol Rep. 2002;4(4):299-305
99. Tatsumi M., Groshan K., Blakely R.D., Richelson £ Pharmacological profile of antidepressants and related compounds at human monoamine transporters. Eur J Pharmacol. 1997;340(2-3):249-258.
100. Toyofuku A., Miyako H. A case of temporo-mandibular disorder with fibromyalgia treated with the antidepressant, milnacipran. Hum Psychopharmacol. 2004; 19(5):357-358.
101. US Prescribing Information for Savella (Forest Laboratories, Inc.) www.savella.com/.2009.
102. Vera-Uonch M., Sadosky. A, Dukes E., Oster G. Impact of pregabalin on the cost of pharmacotherapy for fibromyalgia from a US perspective [Abstract! J Pain. 2008;9(4):50.
103. Vitton O., Gendreau M., Gendreau J., Kranzler J, Rao S.G. A double-blind placebo-controlled trial of milnacipran in the treatment of fibromyalgia. Hum Psychopharmacol. 2004;19(Suppl 1):27-35.
104. Wallace D., Brock Wallade J. All about fibromyalgia. Oxford: Oxford University Press. 2002:129
105. Wolfe F., Smythe H.A., Yunus M.B., et al. The American College of Rheumatology 1990 Criteria for the Classification of Fibromyalgia. Report of the Multicenter Criteria Committee. Arthritis Rheum. 1990;33(2): 160-172.
106. Wolfe F., Smythe H.A., Yunus M.B., et al. The American College of Rheumatology 1990 criteria for the classification of fibromyalgia. Report of the Multicenter Criteria Committee. Arthritis Rheum. 1990;33(2): 160-172.
107. Yyldyz A., Sachs G.S. Administration of antidepressants. Single versus split dosing: Meta-analysis. J Affect Disord. 2001 ;66(2-3): 199-206.
