Адаптогенные эффекты мексидола при хронической ишемии головного мозга
Статьи Опубликовано в журнале, Неврологии и психиатрии, 3, 2012 Е.А. АнтипенкоКафедра неврологии, психиатрии и наркологии факультета повышения квалификации врачей Нижегородской государственной медицинской академии
Цель работы - изучение влияния иитопротектора и антиоксиданта мексидола на адаптационные возможности организма у пациентов с хронической ишемией головного мозга (диширкуляторной энцефалопатией - ДЭ). Обследованы пациенты с ДЭ I, II и III стадий, 50 из которых на стационарном этапе лечения получали базовую терапию - кавинтон и пирацетам внутривенно, а 48-в дополнение к базовой терапии получали мексидол. Адаптационный профиль организма определялся по психоэмоциональному состоянию (госпитальная шкала тревоги и депрессии), функциональному состоянию головного мозга (простая зрительно-моторная реакция и краткая шкала оценки психического статуса), вегетативным тестам (индекс Кердо), устойчивости к гипоксии (пробы Штанге и Генчи), адаптивным реакциям крови (лейкоцитарная формула и электрофоретическая подвижность эритроцитов), состоянию эндогенной антиоксидантной защиты (система глутатиона эритроцитов). Влияние терапии на адаптационный профиль определялось по динамике основных показателей, выраженной в процентах от результатов группы контроля (50 здоровых). Включение мексидола в терапевтический комплекс усиливало эффекты базовой терапии и повышало адаптационные резервы организма при ДЭ I и II стадий, что могло быть связано с реализацией реакций срочной адаптации, возможной лишь при достаточном потенциале адаптационных возможностей индивидуума. Через 1 год наблюдения выявлено, что включение мексидола в терапевтический комплекс достоверно снижало риск прогредиентного ухудшения (нарастания деменции и инсультов).
Ключевые слова: хроническая ишемия головного мозга, дисциркуляторная энцефалопатия, адаптация, адаптогенное действие, стресс, мексидол.
Adaptogenic effects of mexidol in chronic cerebral ischemia
E.A. Antipenko
The data on the effect of the succinate-containing antioxidant mexidol on the adaptation abilities of patients with chronic brain ischemia are presented. We studied 98 patients with discirculatory encephalopathy of I, II and III stages. A set of indices for psychoemotional status, functional state of the brain, autonomic status, nonspecific stability to hypoxia, adaptive reactions of the blood system and status of antioxidant defense have been used to evaluate adaptive abilities of the body. It has been shown that the introduction of the antioxidant in the treatment set strengthens the effects of basic treatment by increasing adaptive reserves of the body in stages I and II of disease that is related with the realization of reactions of urgent adaptation. The introduction of mexidol in the treatment set increases the frequency of favorable outcomes after one year of follow-up.
Key words: brain ischemia, discirculatory encephalopathy, adaptation, adaptogenic effect, stress.
Высокая распространенность и тяжелые медико-социальные последствия хронической ишемии головного мозга, а также недостаточная эффективность общепринятых методов лечения делают проблему поиска новых подходов к лечению дисциркуляторной энцефалопатии (ДЭ) крайне актуальной. Несмотря на определенные достижения в лечении основных неврологических проявлений хронической ишемии головного мозга, его эффективность остается все еще недостаточной, повышается частота развития инсультов и сосудистой деменции [1-3].
Множественность факторов риска ишемии головного мозга, тесная связь цереброваскулярной недостаточности со стрессовыми расстройствами и другими заболеваниями свидетельствуют о дизрегуляторном характере патологии. В связи с этим представляется целесообразным интегральный подход к проблеме цереброваскулярной недостаточности как к патологии адаптации. В представленном исследовании хроническая ишемия головного мозга рассматривается с позиции процессов дизадаптации и адаптогенеза.
Теоретической предпосылкой для исследования возможности управления адаптационно-приспособительными процессами явилось положение о цикличной смене фаз общего адаптационного синдрома, приводящей к формированию долговременной адаптации при стрессмодулирующем воздействии. При длительно действующем стрессорном факторе, каким является хроническая ишемия головного мозга, адаптационный процесс характеризуется не только стадийностью, но и цикличностью течения: пройдя три основные фазы - активации, резистентности и истощения - организм выходит на следующий цикл приспособления к условиям существования [4].
Существует мнение [5], что селективность фармакологических инструментов не всегда нужна для увеличения толерантности головного мозга к стрессорным влияниям. Неселективное вещество может в большей степени обеспечить комплексное воздействие на мозг. К группе неспецифических цитопротекторов и энергокорректоров относятся антиоксиданты, повышающие возможности адаптации на клеточном и митохондриальном уровне. Нами применялся препарат мексидол (этилметилгидроксипиридина сукцинат) - неспецифический цитопротектор и антиоксидант. Установлено, что мексидол улучшает функцию мембран и синаптическую передачу, усиливает эффекты нейротрансмиттеров. Нейропротективное действие препарата в условиях ишемии связано с активацией аэробного гликолиза и усвоения кислорода в ткани головного мозга [6].
Цель работы - изучение влияния мексидола на адаптационные возможности организма у пациентов с хронической ишемией головного мозга.
Материал и методы
Работа проводилась на базе Нижегородской областной клинической больницы им. Н.А. Семашко. В соответствии с действующей в России классификацией выраженность хронической ишемии головного мозга определялась как стадия ДЭ. Диагностика ДЭ проводилась в соответствии с рекомендациями Научного центра неврологии РАМН [7, 8] на основании клинических данных и результатов нейровизуализации.
Под наблюдением находились 98 пациентов, 38 мужчин и 60 женщин в возрасте от 35 до 55 лет (средний - 47,7±5,6 года), с ДЭ I, II и III стадий. Длительность заболевания составила от 2 до 17 лет. У 32 наблюдавшихся больных была диагностирована ДЭ I стадии, у 33 - ДЭ II стадии и еще у 33 - ДЭ III стадии.
Из исследования исключались пациенты с декомпенсированной соматической патологией; в остром и раннем восстановительном периоде инсульта; с острой психотической симптоматикой; с тяжелой деменцией, не позволяющей провести необходимые тесты; одновременно или менее чем за 2 мес до включения в исследование принимавшие препараты адаптогенного действия.
Комплексное обследование больных с хронической ишемией головного мозга, находившихся на стационарном лечении в неврологической клинике, включало проведение стандартных клинических, лабораторных и инструментальных исследований, подтверждающих диагноз, а также применение методов оценки адаптационных возможностей организма.
Адаптационные возможности организма изучали на разных уровнях реализации процессов адаптации. Исследовались психоэмоциональное состояние пациентов, функциональное состояние головного мозга, вегетативный статус, неспецифическая устойчивость к гипоксии, адаптивные реакции крови, состояние эндогенной антиоксидантной защиты. Показатели уровня адаптации у пациентов с ДЭ сравнивались с показателями здоровых из группы контроля. Адаптационный профиль пациентов с ДЭ оценивался до включения в исследование (на диаграммах - 0-й день), на 21-й день, через 6 мес и 1 год после включения в исследование. Влияние терапии на адаптационный профиль в целом оценивали по динамике основных показателей адаптационного процесса, выраженной в процентах от показателей группы контроля.
Предпочтение отдавалось методикам, доступным для применения в широкой клинической практике. Для оценки психоэмоционального состояния применялась госпитальная шкала тревоги и депрессии (Hospital anxiety and depression scale - HADS) [9]. Функциональное состояние головного мозга оценивалось с помощью исследования простой зрительно-моторной реакции и количественной оценки когнитивного дефицита. Исследование простой зрительно-моторной реакции (ПЗМР) проводилось по методике М.П. Мороз. Количественная оценка когнитивного дефицита осуществлялась с помощью краткой шкалы оценки психического статуса (MMSE). Для оценки вегетативного тонуса вычисляли вегетативный индекс Кердо (ВИК): ВИК = (1 - артериальное давление диастолическое/частота сердечных сокращений) х 100%. Для углубленного изучения вегетативного статуса применяли методику исследования вариабельности сердечного ритма (ВСР). Для изучения устойчивости к гипоксии использовали пробу Штанге и пробу Генчи. Для исследования адаптивных реакций крови подсчитывали лейкоцитарную формулу и измеряли электрофоретическую подвижность эритроцитов (ЭФПЭ). Активность эндогенной антиоксидантной защиты оценивалась по состоянию системы глутатиона эритроцитов.
Распределение пациентов по группам проводилось с помощью стратифицированной рандомизации с использованием таблиц случайных чисел. Все больные во время стационарного этапа лечения получали базовую терапию, включавшую кавинтон (винпоцетин) - по 4 мл (20 мг) внутривенно капельно на 200 мл физиологического раствора 1 раз в сутки ежедневно в течение 10 дней и пирацетам - по 5 мл (1000 мг) внутривенно струйно на 10 мл физиологического раствора 1 раз в сутки ежедневно в течение 10 дней. I группу составили 50 пациентов, получавших только базовую терапию; во 2-ю группу вошли 48 больных, дополнительно получавших неспецифическую цитопротективную терапию - мексидол по 2 мл (100 мг) внутримышечно 1 раз в сутки в течение 10 дней.
Не менее чем за 6 мес до включения в исследование и через 6 мес после окончания курса лечения все пациенты получали в амбулаторных условиях курс плановой нейропротективной терапии: кавинтон внутрь в суточной дозе 30 мг в течение 1 мес. По поводу фоновых сосудистых заболеваний - гипертонической болезни и ишемической болезни сердца - за период исследования больные также получали постоянную терапию в соответствии с национальными рекомендациями. За время наблюдения схемы лечения оставались стабильными. В случае развития преходящего или стойкого острого нарушения мозгового кровообращения (ОНМК) за период продолженного наблюдения пациенты получали по месту жительства необходимое лечение в соответствии со стандартами оказания медицинской помощи.
Дополнительно были обследованы 50 здоровых добровольцев, 37 женщин и 13 мужчин в возрасте от 35 до 55 лет (средний - 46,7±6,2 года), составившие группу контроля. Показатели группы контроля принимались за "физиологический коридор", с которым сравнивали показатели адаптационных процессов у больных ДЭ.
На каждого пациента заполнялась индивидуальная карта, куда вносились все полученные данные. Через 1 год от начала исследования оценивали клинический исход заболевания. Выделяли следующие варианты исхода:
- улучшение состояния;
- стабилизация состояния;
- прогредиентное ухудшение;
- повторяющиеся преходящие нарушения мозгового кровообращения (ПНМК);
- инсульт первичный или повторный;
- летальный исход.
Результаты и обсуждение
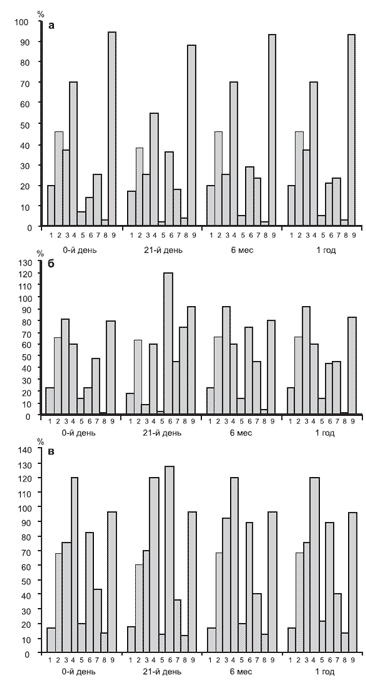
Динамика адаптационных возможностей организма под влиянием базовой терапии. На рис. 1 представлена динамика адаптационного профиля у пациентов 1-й группы.
 | 1 — Уровень тревоги 2 — Уровень депрессии 3 — ПЗМР 4 — Показатели латерометрии 5 — Когнитивные тесты 6 — Вегетативный статус 7 — Устойчивость к гипоксии 8 — Адаптивные реакции крови 9 — Антиоксидантная система глутатиона |
Рис. 1. Динамика адаптационного профиля при применении базовой терапии.
Здесь и на рис. 2: на оси ординат отражена степень отклонения от показателей группы контроля в %. А - у пациентов с ДЭ I стадии, Б - с ДЭ II стадии, В - с ДЭ III стадии.
Как видно из представленных диаграмм, курс базовой терапии оказывал корригирующее воздействие на течение адаптационного процесса лишь при ДЭ I стадии. На этой стадии заболевания выявлено позитивное влияние проведенной терапии на психологический статус, функциональное состояние головного мозга, устойчивость к гипоксии, при этом также снижалась избыточная активность адаптивных реакций крови. Эти показатели приближались к результатам контрольной группы, но улучшение функционального состояния не сохранялось при продолженном наблюдении.
При ДЭ II стадии адаптивные реакции крови отражали нарастание исходно избыточной реакции стресс-активации, также достоверно усиливались вегетативный дисбаланс и нарушения функции эндогенной антиоксидантной системы глутатиона (р<0,05). Выявлялось достоверное улучшение функционального состояния головного мозга сразу после окончания курса лечения, отражающее нейропротективное действие базовой терапии.
При ДЭ III стадии "адаптационный профиль" в целом отдалялся от показателей группы контроля. Статистически значимая положительная динамика имелась по когнитивным показателям и пробам на устойчивость к гипоксии, что могло быть связано с нейропротективным, ноотропным и антигипоксантным действием пирацетама и кавинтона.
Воздействие на механизмы неспецифической адаптации не носило корригирующего характера, а при II и III стадиях ДЭ дизадаптационные проявления усугублялись. В связи с этим отмечавшаяся сразу по окончании курса стационарного лечения положительная клиническая динамика в отношении основных неврологических синдромов ДЭ, отмеченная и в результатах многочисленных ранее проведенных исследований [3, 10-14], заставляет задуматься о "цене адаптации" при проведении базовой терапии.
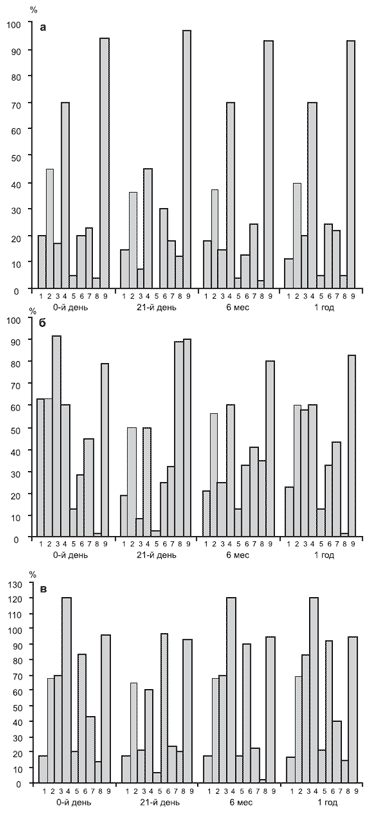
Динамика адаптационных возможностей организма под влиянием цитопротективной терапии. Применение мексидола у пациентов с ДЭ I стадии оказывало достоверное позитивное воздействие на психоэмоциональный статус, функциональное состояние головного мозга и устойчивость к гипоксии (рис. 2).
 | 1 — Уровень тревоги 2 — Уровень депрессии 3 — ПЗМР 4 — Показатели латерометрии 5 — Когнитивные тесты 6 — Вегетативный статус 7 — Устойчивость к гипоксии 8 — Адаптивные реакции крови 9 — Антиоксидантная система глутатиона |
Рис. 2. Динамика адаптационного профиля при применении мексидола на фоне базовой терапии.
А - у пациентов с ДЭ I стадии, Б - с ДЭ II стадии, В - с ДЭ III стадии.
По-видимому, неспецифическое цитопротективное действие препарата способствует повышению адаптационных возможностей. Вместе с тем после проведенного курса лечения отмечалось усиление вегетативного дисбаланса (р=0,03), указывающее на активацию стресс-реализующих механизмов. Об этом же свидетельствовали и показатели адаптивных реакций крови: лейкоцитарного коэффициента (р=0,04) и ЭФПЭ (р=0,03). Не отмечено повышения активности эндогенной антиоксидантной системы глутатиона, что объясняется эффектом введения экзогенного антиоксиданта.
При ДЭ II стадии по окончании курса лечения отмечено достоверно более выраженное, чем при I стадии заболевания, воздействие на психоэмоциональную составляющую адаптационного процесса, функциональное состояние головного мозга и устойчивость к гипоксии; при этом показатели адаптивных реакций свидетельствовали об избыточной активации адаптационных механизмов.
При ДЭ III стадии не выявлялось позитивного влияния лечения на уровни тревоги и депрессии. После окончания курса лечения отмечалось улучшение функционального состояния головного мозга, которое не сохранялось при продолженном наблюдении. Нарастание вегетативного дисбаланса имело стойкий характер. Динамика адаптивных реакций крови свидетельствовала об истощении адаптационных резервов по окончании курса, но через 6 мес показатели приближались к "физиологическому коридору".
Таким образом, включение цитопротектора в терапевтический комплекс при ДЭ усиливает эффекты базовой терапии, повышая адаптационные резервы организма при I и II стадиях заболевания. По-видимому, это связано с тем, что сукцинат-содержащие препараты способствуют реализации реакций срочной адаптации, что возможно лишь при достаточном потенциале адаптационных возможностей индивидуума.
При анализе клинических исходов выявлено, что включение мексидола в терапевтический комплекс повышает частоту благоприятных исходов и снижает риск прогредиентного ухудшения (рис. 3).
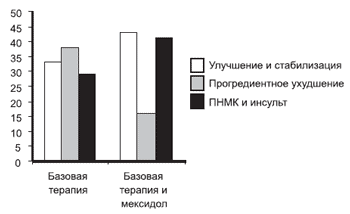
Рис. 3. Клинические исходы в сравниваемых группах.
На оси ординат отражена частота исходов в процентах.
Благоприятные исходы в виде улучшения и стабилизации состояния были более характерны для I и II стадий ДЭ (48 и 52% соответственно). Увеличение числа неблагоприятных исходов у пациентов с III стадией заболевания можно объяснить истощением адаптационных резервов организма.
Полученные результаты закономерны, если учитывать особенности адаптогенного действия сукцинатсодержащих цитопротекторов. Известно, что сукцинатоксидазный путь митохондриального ферментативного каскада играет роль срочного компенсаторного механизма в условиях острой гипоксии, но не участвует в формировании долгосрочных механизмов адаптации [15]. Воздействие мексидола на адаптационные механизмы при гипоксии сравнимо с эффектом прекондиционирования [16, 17]. Классическая форма прекондиционирования соответствует стадии срочной адаптации и характеризуется мобилизацией предшествующих адаптационных механизмов - гиперфункцией или началом формирования функциональной системы, ответственной за адаптацию [18], при этом антиоксидантная защита рассматривается как один из механизмов периферического звена стресслимитирующей системы, эффект которого реализуется на уровне реагирующего органа или ткани.
Таким образом, включение мексидола в терапевтический комплекс у пациентов с хронической ишемией головного мозга усиливает клинические и адаптогенные эффекты базовой терапии за счет неспецифической активации механизмов срочной адаптации. Литература
1. Гусев Е.И. Проблема инсульта в России. Журн неврол и психиат 2003; 9: 3-5.
2. Скворцова В.И., Стаховская Л.В., Айриян Н.Ю. Проблема инсульта в Российской Федерации. Сердце 2005; 6: 309-311.
3. Чуканова Е.И. Опыт длительного курсового применения нейрометаболических препаратов в лечении хронической церебральной сосудистой недостаточности (фармакоэкономические аспекты). Качественная клиническая практика 2003; 4: 3-6.
4. Бирюкова О.В. Общие закономерности адаптации: фазы и циклы адаптационного процесса. Аспекты адаптации: сборник научных трудов. Под ред. А.Г. Кочеткова. Нижний Новгород: Изд-во НижГМА 2001; 94-103.
5. Александровский Ю.А. Психофармакотерапия: Учебное пособие для студентов высших учебных заведений. М: Издательский центр "Академия" 2005; 128.
6. Шток В.Н. Клиническая фармакология вазоактивных средств и фармакотерапия цереброваскулярных расстройств: Руководство для врачей. М: ООО "Медицинское информационное агентство" 2009; 584.
7. Кадыков А.С., Манвелов Л.С., Шахпаронова Н.В. Хронические сосудистые заболевания головного мозга (дисциркуляторная энцефалопатия). СПб: ГЭОТАР-Медиа 2006; 236.
8. Справочник по формулированию клинического диагноза болезней нервной системы. Под ред. В.Н. Штока, О.С. Левина. М: ООО "Медицинское информационное агентство" 2006; 520.
9. ZigmondA.S., Snaith R.P. The Hospital Anxiety and Depression scale. Acta Psychiat Scand 1983; 67: 361-370.
10. Бойко А.Н., Чугунов А.В., Камчатное П.Р. Сосудистые когнитивные расстройства-современные возможности лечения. Трудный пациент 2008; 6: 10: 3-6.
11. Одинак М.И., Вознюк И.А., Янишееский С.Н. Ишемия мозга. Нейро-протективная терапия: дифференцированный подход. СПб: ВМедА 2002; 76.
12. Путилина М.В. Современные представления о ноотропных препаратах. Лечащий врач 2006; 5: 9-14.
13. Скоромец А.А., Мельникова Е.В., Голикова Р.В. Рациональный подход к сосудистой терапии хронической недостаточности мозгового кровообращения. Атмосфера. Нервные болезни 2005; 1: 29-31.
14. Суслина З.А., Варакин Ю.Я., Верещагин Н.В. Сосудистые заболевания головного мозга: Эпидемиология. Основы профилактики. М: МЕДпресс-информ 2006; 256.
15. Лукьянова Л.Д., Цыбина Т.А., Дудченко А.М. Сигнальная функция ми-тохондриального ферментного комплекса II при гипоксии и адаптации. Патогенез 2008; 3: 74.
16. NacanoA., Cohen M.V., Downey J.M. Ischemic preconditioning. From basis mechanism to clinical applications. Pharmacol Ther 2000; 86: 263-275.
17. Kremastinos D. The phenomenon of preconditioning today. Helenic J Cardiol 2005; 46: 1-4.
18. Сидоренко Г.И., Комиссарова С.М., Островский Ю.П. Вопросы адаптации в клинической кардиологии (количественная оценка резервов адаптации по данным прекондиционирования). Кардиология 2006; 3: 19-24.
