Алгоритм выбора антитромбоцитарной терапии у больного с инфарктом миокарда с подъемом сегмента ST (клинический пример)
Статьи Опубликовано в журнале:«АТМОСФЕРА. НОВОСТИ КАРДИОЛОГИИ»; № 1; 2014; стр. 18-24.
Н.А. Козиолова, О.М. Лапин, О.Г. Каракулов
В статье представлен клинический пример больного с инфарктом миокарда с подъемом сегмента ST с научно обоснованной аргументацией выбора антитромбоцитарной терапии в зависимости от выбранной стратегии ведения пациента в соответствии с международными рекомендациями.
Ключевые слова: ишемическая болезнь сердца, острый коронарный синдром, инфаркт миокарда с подъемом сегмента ST, двойная антиагрегантная терапия, ацетилсалициловая кислота + клопидогрел, монотерапия клопидогрелом.
Больной Т., 49 лет, перед выпиской из специализированного отделения неотложной кардиологии предъявлял жалобы на сжимающие боли за грудиной и в левой половине грудной клетки, возникающие при чрезмерной эмоциональной нагрузке, иррадиирующие в левое плечо, левую руку, купирующиеся после применения изокета спрея через 3-5 мин. Ангинозные приступы возникали редко, длительностью менее 20 мин. Кроме того, больного беспокоили одышка и сердцебиение при обычной физической нагрузке.
Из анамнеза известно, что ишемическая болезнь сердца (ИБС) дебютировала стенокардией напряжения, которая через 6 мес стабилизировалась на уровне III функционального класса (ФК). Пациент при ангинозных болях пользовался только изокетом спреем, отказывался от постоянного приема препаратов и проведения коронароангиографии.
Через 8 мес после дебюта стенокардии у больного развился инфаркт миокарда (ИМ) задней стенки с зубцом Q и элевацией ST, подтвержденный клинически и электрокардиографически. Качественный тест на тропонин T, выполненный на догоспитальном этапе, был отрицательным. Больному на догоспитальном этапе через 4 ч от начала развития болевого синдрома был проведен тромболизис с помощью тенектеплазы без осложнений. На рис. 1 представлены электрокардиограммы (ЭКГ) стандартных и грудных отведений до тромболитической терапии.
Рис. 1. ЭКГ больного Т., 49 лет, до проведения тромболитической терапии через 4 ч от начала развития затянувшегося болевого синдрома в грудной клетке: а -стандартные отведения, б - грудные отведения.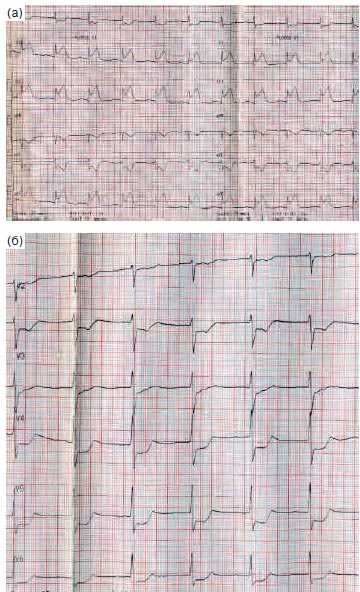
На рис. 2 представлена ЭКГ больного Т. после проведения тромболитической терапии. На ЭКГ видно, что элевация сегмента ST в отведениях II, III, aVF уменьшилась более чем на 50%.
Рис. 2. ЭКГ того же больного после проведения тромболитической терапии. 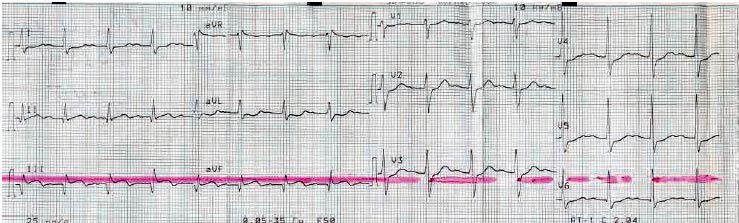
Эта динамика была расценена как положительная, а проведенный догоспитальный тромболизис - как успешный. Положительные изменения на ЭКГ подтверждались клиническими данными: болевой синдром был купирован полностью.
Затем больной был доставлен в специализированное отделение неотложной кардиологии, где ему с целью оценки коронарного кровотока в 1-е сутки была проведена коронароангиография.
На рис. 3 представлена коронарограмма больного Т., на которой видно, что кровоток в инфарктсвязанной правой коронарной артерии соответствует по шкале TIMI (Thrombolysis In Myocardial Infarction) лишь TIMI 1 (частичное просачивание контраста ниже точки окклюзии) на значительном протяжении сосуда, что объективно свидетельствует о низком эффекте догоспитального тромболизиса, несмотря на положительную клиническую и ЭКГ-динамику.
Рис. 3. Коронарограмма правой коронарной артерии того же больного после проведения догоспитального тромболизиса. 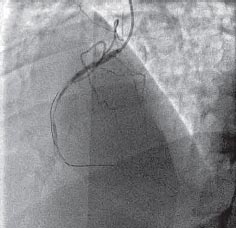
Было принято решение о выборе у этого больного фармакоинвазивной стратегии лечения ИМ с подъемом сегмента ST, которая регламентируется последними рекомендациями Американской коллегии кардиологов/Американской ассоциации кардиологов (2013) [1]. Суть фармакоинвазивного подхода заключается в обоснованности проведения “спасительного” чрескожного коронарного вмешательства (ЧКВ) при несостоявшейся реперфузии после тромболитической терапии в течение 24 ч.
В последнем опубликованном метаанализе суммированы все доступные основания для проведения ЧКВ “спасения” [2]. Сравнение ЧКВ “спасения” с консервативным лечением проводили на основании данных 8 рандомизированных клинических исследований (РКИ), включавших 3157 больных ИМ с подъемом сегмента ST. Было установлено, что в случае проведения ЧКВ “спасения” риск смерти, повторного ИМ и ишемии к 30-му дню снижался на 48% (относительный риск (ОР) 0,52; 95% доверительный интервал (ДИ) 0,42-0,65; р = 0,048), а риск повторного ИМ - на 43% (ОР 0,57; 95% ДИ 0,40-0,81; p = 0,002) без увеличения риска больших и смертельных кровотечений (ОР 1,07; 95% ДИ 0,78-1,46; p = 0,69; ОР 0,86; 95% ДИ 0,62-1,20; p = 0,38 соответственно). Последующие завершенные РКИ будут отражать в большей степени клиническую практику и в дальнейшем смогут гарантировать выяснение реальной пользы от ЧКВ “спасения”.
Больному Т. в 1-е сутки после тромболитической терапии было выполнено стентирование правой коронарной артерии голометаллическим стентом без осложнений.
На рис. 4 представлена коронарограмма больного Т. после имплантации голометаллического стента в правую коронарную артерию с восстановлением кровотока TIMI 3.
Рис. 4. Коронарограмма правой коронарной артерии того же больного после выполнения стентирования правой коронарной артерии голометаллическим стентом. 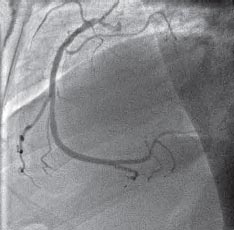
Из анамнеза жизни больного известно, что он в течение 2 лет страдает гипертонической болезнью, при этом постоянной антигипертензивной терапии не принимает. Курит более 25 лет по пачке сигарет в сутки. Наследственность по ИБС у больного отягощена: у отца развился фатальный ИМ в 53 года, старший брат перенес ИМ в 55 лет. Пациент не соблюдает липидкорригирующую диету.
При объективном обследовании больного обращало на себя внимание повышение артериального давления на правой руке в покое сидя до 156/94 мм рт. ст. Частота сердечных сокращений 76 в 1 мин. Окружность талии 84 см, индекс массы тела 27,4 кг/м2. Симптомов острой сердечной недостаточности, задержки жидкости не зарегистрировано. Других отклонений при объективном обследовании не выявлено.
При проведении лабораторных исследований не обнаружено отклонений от нормальных значений показателей общего анализа мочи и крови, в том числе при повторных измерениях. В стационаре динамика фермента МВ-КФК составила 48, 26, 19 ЕД/л в течение 3 дней. В моче нормоальбуминурия. Биохимический анализ крови: глюкоза 4,13 ммоль/л, калий 4,1 мкмоль/л, аланинаминотрансфераза 18,2 ЕД/л, аспартатаминотрансфераза 37,0 ЕД/л, креатинин 79,0 мкмоль/л, мочевая кислота 345,0 ммоль/л. В липидном спектре отмечалось повышение уровня общего холестерина до 5,45 ммоль/л, холестерина липопротеидов низкой плотности - до 3,65 ммоль/л при снижении уровня холестерина липопротеидов высокой плотности до 0,99 ммоль/л и нормальном уровне триглицеридов -1,59 ммоль/л. Скорость клубочковой фильтрации, рассчитанная по формуле MDRD, составила 96 мл/мин/1,73 м2.
При проведении ультразвукового допплерографического исследования артерий нижних конечностей были обнаружены стенозы правой и левой большеберцовых артерий в средней трети до 30%, гемодинамически незначимые.
При дуплексном сканировании сонных артерий выявлена атеросклеротическая бляшка в бифуркации сонной артерии справа со стенозированием до 30%, максимальная толщина комплекса интима-медиа составила 1,1 мм.
По данным эхокардиографии у больного была отмечена тенденция к дилатации левого желудочка (ЛЖ), гипокинез его задней стенки. Систолическая функция ЛЖ снижена, фракция выброса ЛЖ 43% (по Simpson). Выявлены диастолическая дисфункция I типа, митральная регургитация I степени. Аорта уплотнена, не расширена. Индекс массы миокарда ЛЖ в пределах нормальных значений.
Таким образом, перед выпиской из отделения клинический “портрет” больного был следующим:
Необходимость применения двойной антиагрегантной терапии при остром коронарном синдроме (ОКС), как с подъемом сегмента ST, так и без него, доказана в многочисленных больших РКИ и представлена во всех международных рекомендациях [3-5]. Тем не менее алгоритм выбора антитромбоцитарной терапии у данного больного был затруднен в силу того, что имеются значительные расхождения в выборе второго антиагреганта (клопидогрел, тикагрелор, прасугрел) дополнительно к ацетилсалициловой кислоте (АСК) в рекомендациях Европейского общества кардиологов и Американской коллегии кардиологов/ Американской ассоциации кардиологов, особенно в части лечения больных с ОКС без подъема сегмента ST [1, 4]. Это, с одной стороны, создает трудности для врача в принятии решения о необходимости назначения больному комбинированной терапии, а с другой - снижает статус доверия рекомендациям, поскольку доказательная база по эффективности и безопасности антиагрегантов известна и доступна каждому эксперту [6]. В итоге страдают пациенты. Так, в рекомендациях Европейского общества кардиологов декларируется приоритет прасугрела и тикагрелора над клопидогрелом, который аргументируется лишь данными анализа в подгруппах (!) всего одного исследования (!) по каждому из “предпочтительных” препаратов - TRITON-TIMI 38 (Trial to assess improvement in therapeutic outcomes by optimizing platelet inhibition with prasugrel-thrombolysis in myocardial infarction 38) и PLATO (Platelet Inhibition and Patient Outcomes) соответственно [4, 7, 8]. Однако при анализе безопасности прасугрела в исследовании TRITON-TIMI 38 было выявлено, что этот препарат в сравнении с клопидогрелом достоверно увеличивает риск больших кровотечений, не связанных с коронарным шунтированием (ОР 1,32; 95% ДИ 1,03-1,68; p = 0,03), особенно в подгруппе больных, перенесших инсульт или транзиторную ишемическую атаку (ОР 1,54; 95% ДИ 1,02-2,32; p = 0,04) [9]. На основании этих данных FDA (Food and Drug Administration - Управление по контролю качества пищевых продуктов и медикаментов) 3 февраля 2009 г. рекомендовало в аннотацию препарата прасугрел внести противопоказание для его приема у больных с анамнезом инсульта или транзиторной ишемической атаки. Более того, в исследование TRITON-TIMI 38 согласно дизайну были включены больные, которым при ОКС выполнялось ЧКВ, что ограничивает возможность применения прасугрела у больных без реперфузии или при использовании тромболитической терапии [10]. При анализе результатов применения прасугрела в зависимости от длительности его использования в составе комбинированной терапии у больных с ОКС было установлено, что преобладание пользы над риском имело место только при краткосрочной оценке, по мере удлинения времени приема препарата это соотношение менялось в неблагоприятную сторону [11].
В отношении антиагреганта тикагрелора, который изучали в исследовании PLATO в сравнении с клопидогрелом у больных с ОКС, в отчете FDA выражена серьезная обеспокоенность по поводу надежности полученных результатов [12]. Медицинский эксперт FDA указал 10 пунктов, которые ставят под сомнение полученные данные. Из основной публикации результатов исследования PLATO известно о том, что в группе тикагрелора частота больших кровотечений, не связанных с коронарным шунтированием, была выше, чем в группе клопидогрела (р = 0,03), наряду с такими побочными эффектами, как одышка и высокая частота пауз при ЭКГ и суточном мониторировании ЭКГ в 1-ю неделю лечения без установления генеза их развития [13, 14].
С учетом изложенных данных позиция в отношении использования клопидогрела, прасугрела и тикагрелора при ОКС в рекомендациях Американской коллегии кардиологов/Американской ассоциации кардиологов представляется более взвешенной и аргументированной, ее суть заключается в отсутствии дополнительного преимущества одного антагониста P2Y12-рецепторов тромбоцитов над другим [1, 3]. Более того, в рекомендациях отмечено, что прасугрел противопоказан больным, перенесшим транзиторную ишемическую атаку или инсульт. Положения по антиагрегантной терапии в рекомендациях Европейского общества кардиологов в отношении превосходства прасугрела и тикагрелора над клопидогрелом являются чрезмерно оптимистичными, не имеющими строгих, научно обоснованных доказательств [4, 5].
Выбор антагониста P2Y12-рецепторов тромбоцитов для комбинированной антиагрегантной терапии у больных с ОКС в России имеет свои, национальные проблемы. С одной стороны, российские рекомендации по тактике ведения больных ИМ и антитромбоцитарной терапии, в частности, датируются 2008-2009 годами, в них не учитываются данные последних больших РКИ и, следовательно, не определен современный выбор второго антиагреганта к АСК [15]. С другой стороны, в России в условиях специализированного стационара ведение больных с ИМ и нестабильной стенокардией должно осуществляться в соответствии с федеральными медико-экономическими стандартами, в которые, к сожалению, не включены ни тикагрелор, ни прасугрел как антиагреганты, зарегистрированные в Российской Федерации и имеющие научное обоснование их применения при ОКС. Следовательно, в российских условиях выбор врача при ОКС ограничен двумя антиагрегантами -АСК и клопидогрелом.
Во всех рекомендациях также отмечается, что выбор второго антиагреганта для двойной терапии в первый год после ОКС зависит от выбранной стратегии ведения больного. Наибольшее значение для прогноза и безопасности этот выбор имеет у больных ИМ с подъемом сегмента ST. В табл. 1 и 2 представлен выбор антагониста P2Y12-рецепторов тромбоцитов для двойной антитромбоцитарной терапии у больных ИМ с подъемом сегмента ST согласно рекомендациям Европейского общества кардиологов и Американской коллегии кардиологов/Американской ассоциации кардиологов [1, 4].
Таблица 1.
Выбор антагониста P2Y12-рецепторов тромбоцитов для двойной антитромбоцитарной терапии у больных ИМ с подъемом сегмента ST (рекомендации Европейского общества кардиологов, 2012)
| Препарат | Доза |
| Реперфузия (первичное ЧКВ) | |
| Ацетилсалициловая кислота | Нагрузочная - 150-300 мг, поддерживающая - 75-100 мг/сут |
| Клопидогрел | Нагрузочная - 600 мг, поддерживающая - 75 мг/сут |
| Прасугрел | Нагрузочная - 60 мг, поддерживающая - 10 мг/сут |
| Тикагрелор | Нагрузочная - 180 мг, поддерживающая - 90 мг 2 раза в сутки |
| Реперфузия (догоспитальный, госпитальный тромболизис) | |
| Ацетилсалициловая кислота | Нагрузочная - 150-500 мг/сут, поддерживающая - 75-100 мг/сут |
| Клопидогрел | Нагрузочная - 300 мг у пациентов ≤75 лет, поддерживающая - 75 мг/сут; у пациентов >75 лет - без нагрузочной дозы |
| Без реперфузионной стратегии | |
| Ацетилсалициловая кислота | Нагрузочная - 150-500 мг/сут, поддерживающая - 75 мг/сут |
| Клопидогрел | 75 мг/сут |
Таблица 2.
Выбор антагониста P2Y12-рецепторов тромбоцитов для двойной антитромбоцитарной терапии у больных ИМ с подъемом сегмента ST (рекомендации Американской коллегии кардиологов/Американской ассоциации кардиологов, 2013)
| Препарат | Доза |
| Реперфузия (первичное ЧКВ) | |
| Ацетилсалициловая кислота | Нагрузочная - 162-325 мг, поддерживающая - 81-325 мг/сут |
| Клопидогрел | Нагрузочная - 600 мг, поддерживающая - 75 мг/сут |
| Прасугрел | Нагрузочная - 60 мг, поддерживающая - 10 мг/сут |
| Тикагрелор | Нагрузочная - 180 мг, поддерживающая - 90 мг 2 раза в сутки |
| Реперфузия (догоспитальный, госпитальный тромболизис) | |
| Ацетилсалициловая кислота | Нагрузочная - 162-325 мг, поддерживающая - 81-325 мг/сут |
| Клопидогрел | Нагрузочная - 300 мг у пациентов ≤75 лет, поддерживающая - 75 мг/сут; у пациентов >75 лет - без нагрузочной дозы |
| Фармакоинвазивный подход (ЧКВ после тромболизиса) | |
| Ацетилсалициловая кислота | Нагрузочная - 162-325 мг вместе с тромболизисом, поддерживающая -81-325 мг/сут после ЧКВ |
| Клопидогрел | 75 мг/сут для пациентов, получивших нагрузочную дозу с тромболизисом; нагрузочная доза 300 мг при ЧКВ ≤24 ч после троболизиса, 600 мг (ЧКВ >24 ч) |
| Прасугрел | 75 мг/сут для пациентов, получивших нагрузочную дозу с тромболизисом; нагрузочная доза 60 мг при ЧКВ >24 ч |
Как видно из таблиц, при выборе стратегии, связанной с проведением тромболитической терапии или без реперфузии, препаратом выбора для комбинации с АСК остается клопидогрел, независимо от используемых рекомендаций.
Доказательная база, обеспечивающая аргументами благоприятное влияние клопидогрела в комбинации с АСК на прогноз больных ИМ с подъемом сегмента ST, обширна.
Двойная антитромбоцитарная терапия (АСК и клопидогрел) изучалась в большом РКИ CLARITY-TIMI 28 (Clopidogrel as Adjunctive Reperfusion Therapy (CLARITY) Thrombolysis in Myocardial Infarction (TIMI) 28 study), в которое был включен 3491 больной ИМ с подъемом сегмента ST [16]. Основной стратегией выбора лечения ИМ в этом исследовании согласно дизайну была тромболитическая терапия. Уже на 30-й день применение АСК с клопидогрелом в сравнении с монотерапией АСК обеспечило снижение относительного риска любых сердечно-сосудистых событий на 30% (p < 0,03) без значимого увеличения частоты внутричерепных, больших и малых кровотечений [16]. В другом большом РКИ, COMMIT/CCS-2 (ClOpidogrel and Metoprolol in Myocardial Infarction Trial/Chinese Cardiac Study), выполненном в Китае, также были получены данные о том, что комбинированная терапия клопидогрелом и АСК независимо от выбранной стратегии (тромболизис, без реперфузии) снижает риск смерти, инсульта, повторного ИМ уже в первые 4 нед от начала развития ИМ [17]. При этом не было зарегистрировано больших церебральных, фатальных кровотечений, а также геморрагий, требующих переливания крови, даже при сочетании с тромболитической терапией и у пожилых. Результаты этого большого РКИ позволили рассчитать, что лечение 1 млн. пациентов в течение ~2 нед предотвращает 5000 смертей и 5000 нефатальных событий [18].
Новый антиагрегант, антагонист P2Y12-рецепторов тромбоцитов - тикагрелор в больших РКИ у больных ИМ с подъемом сегмента ST, которым проводилась тромболитическая терапия, не изучался, поэтому его использование в данной ситуации не рекомендуется [13]. Но в инструкции к препарату возможность его назначения у больных с тромболизисом не включена в раздел “противопоказания”, а отмечена в графе “с осторожностью” [19]. Следовательно, ответственность за возможные неблагоприятные исходы при включении тикагрелора в сочетании с АСК в терапию больных, получивших тромболизис, ложится на плечи врача. Поэтому выбор антитромбоцитарной терапии у больного ИМ - это ответственное решение, которое должно приниматься только на основании научно обоснованных доказательств, полученных в больших РКИ.
Доказательства благоприятного влияния на прогноз клопидогрела и АСК у больных ИМ с подъемом сегмента ST, в тактике ведения которых была избрана стратегия реперфузии в виде ЧКВ, были получены при лечении в течение 12 мес после завершения РКИ CREDO (Clopidogrel for the Reduction of Events During Observation) уже в первые 28 дней от начала развития ИМ [20]. Ранее аналогичные данные были представлены в субанализе РКИ PCI-CURE (Percutaneous Coronary Intervention Clopidogrel in Unstable angina to prevent Recurrent Events), в котором снижение риска повторного ИМ и сосудистой смерти составило 31% (p < 0,002) при использовании в течение года двойной антиагрегантной терапии (АСК и клопидогрел) у больных с ОКС без подъема сегмента ST [21] .
Таким образом, в клиническом примере больному в соответствии с международными рекомендациями и научно обоснованной доказательной базой была назначена двойная антитромбоцитарная терапия: АСК и клопидогрел с использованием нагрузочной дозы последнего в дебюте ИМ [1, 4]. Кроме этих препаратов в соответствии с международными рекомендациями больному был назначен ингибитор ангиотензинпревращающего фермента рамиприл, при приеме которого у пациента развился такой побочный эффект, как кашель, что потребовало отмены препарата и замены его на антагонист ангиотензина II валсартан, который обладает наибольшим спектром научно обоснованных факторов благоприятного влияния на прогноз при ИМ и хронической сердечной недостаточности среди сартанов (РКИ VALIANT (Valsartan in Acute Myocardial Infarction Trial) и Val-HeFT (Valsartan Heart Failure Trial)) [22, 23]. Больной также получал p-адреноблокаторы (бисопролол), статины (розувастатин), антагонисты минералокортикоидных рецепторов (эплеренон). Такая рекомендуемая 6-компонентная (для некоторых больных - 5-компонентная схема, без антагонистов минералокортикоидных рецепторов) схема лечения ИМ в течение года несет большую финансовую нагрузку для больного, если используются оригинальные препараты. Не все пациенты готовы выполнить такие рекомендации. Поэтому врачу необходимо знать и препараты-генерики для лечения ИМ, которые имеют три уровня эквивалентности оригинальному препарату, в частности, из “клопидогрелов” может быть выбран Лопирел (Actavis).
Одним из дискуссионных вопросов в тактике ведения больного, перенесшего ИМ, через год лечения вновь является выбор антитромбоцитарной терапии: АСК или клопидогрел (или другой антагонист P2Y12-рецепторов тромбоцитов). В этом аспекте имеются значительные расхождения как между различными рекомендациями, так и между научно обоснованными фактами и рекомендациями. Так, в рекомендациях по антитромбоцитарной терапии Европейского общества кардиологов, Американской коллегии кардиологов/Американской ассоциации кардиологов, Всероссийского научного общества кардиологов указывается, что через год после ИМ следует перейти на монотерапию АСК, при ее непереносимости - на клопидогрел [1, 4, 15]. В феврале 2012 г. Американская коллегия торакальных врачей, которая является мировым ориентиром по антитромботической терапии и профилактике тромбозов, обновила рекомендации, и современная стратегия выбора антитромбоцитарной терапии у больных со стабильной стенокардией, а также при ИБС через 1 год после ОКС или реваскуляризации, у лиц со стенозами более 50% при коронароангиографии и с ишемией, выявленной с помощью диагностических тестов, заключается в назначении АСК 75-100 мг/сут или клопидогрела 75 мг/сут на длительное время (уровень доказательности 1A) [24]. Впервые сравнялись и стали равнозначными у данной категории пациентов позиции АСК и клопидогрела, и последний может применяться не только при непереносимости АСК. Такое решение в рекомендациях Американской коллегии торакальных врачей было принято на основании большой накопленной базы научно обоснованных фактов, которые аргументированно доказывают, что преимущество АСК над другими антиагрегантами в монотерапии во многих клинических ситуациях утрачено как в аспекте безопасности, так и в вопросе прогностической эффективности [25-29].
Так, по данным субанализа исследования CAPRIE (Clopidogrel Versus Aspirin in Preventing Acute Myocardial Infarction in Patients with Symptomatic Atherothrombosis), применение клопидогрела по сравнению с АСК у больных с ОКС обеспечило достоверно более выраженное снижение риска повторного ИМ - на 19,2% (р = 0,008) [30].
В сравнительном анализе безопасности медикаментозных вмешательств в исследовании CAPRIE была установлена значительно меньшая частота развития побочных эффектов со стороны желудочно-кишечного тракта при использовании клопидогрела по сравнению с АСК: на 69% меньше была частота развития язвы желудочно-кишечного тракта и на 76% меньше - частота развития гастритов [31].
Следует отметить, что “новые” антиагреганты, такие как тикагрелор и прасугрел, в качестве монотерапии через год после ОКС в больших РКИ не изучались.
В представленном клиническом примере врач принял решение, что по истечении 12 мес двойной антитромбоцитарной терапии больному будет назначена монотерапия клопидогрелом.
В заключение следует отметить, что разнообразие клинических форм атеросклероза, формирующих различные варианты острых и стабильных состояний, в том числе в сочетании с коморбидной патологией, при выборе антитромбоцитарной терапии нередко ставит врача в такую ситуацию, при которой нет однозначного решения в силу отсутствия научно обоснованных фактов или их противоречивости, например: антитромбоцитарная терапия у больных с ИМ и фибрилляцией предсердий, на фоне бессимптомного каротидного атеросклероза у пациентов, получающих статины, при выполнении транскатетерных имплантаций клапанов, после некардиоэмболических геморрагических инсультов давностью более 5 лет на фоне контролируемой артериальной гипертонии. Это диктует необходимость изучения антитромбоцитарной терапии в таких клинических ситуациях, а также инициации и проведения новых РКИ.
Наталья Андреевна Козиолова - профессор, зав. кафедрой пропедевтики внутренних болезней № 2 Пермской государственной медицинской академии им. акад. Е.А. Вагнера, главный внештатный терапевт Министерства здравоохранения Пермского края.
Олег Михайлович Лапин - зав. отделением кардиологии для лечения инфаркта миокарда городской клинической больницы № 4, Пермь.
Олег Геннадьевич Каракулов - зав. отделением рентгенохирургических методов диагностики и лечения городской клинической больницы № 4, Пермь.
ЛИТЕРАТУРА
1. O’Gara P.T., Kushner F.G., Ascheim D.D. et al. 2013 ACCF/AHA guideline for the management of ST-elevation myocardial infarction: executive summary: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines: developed in collaboration with the American College of Emergency Physicians and Society for Cardiovascular Angiography and Interventions // Cathet. Cardiovasc. Interv. 2013. V. 82. № 1. P. E1-27.
2. Zhang B.C., Zhou Z.W., Hou L. et al. A meta-analysis of early percutaneous coronary intervention within 24 hours of thrombolysis in acute ST-elevation myocardial infarction // Zhonghua Yi Xue Za Zhi. 2011. V. 91. № 28. P. 1961-1965.
3. Anderson J.L., Adams C.D., Antman E.M. et al. 2012 ACCF/AHA focused update incorporated into the ACCF/AHA 2007 guidelines for the management of patients with unstable angina/non-ST-elevation myocardial infarction: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines // J. Am. Coll. Cardiol. 2013. V. 61. № 23. P. e179-347.
4. Task Force on the management of ST-segment elevation acute myocardial infarction of the European Society of Cardiology (ESC); Steg P.G., James S.K., Atar D. et al. ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation // Eur. Heart J. 2012. V. 33. № 20. P. 2569-2619.
5. Hamm C.W., Bassand J.P., Agewall S. et al. ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation: the Task Force for the management of acute coronary syndromes (ACS) in patients presenting without persistent ST-segment elevation of the European Society of Cardiology (ESC) // Eur. Heart J. 2011. V. 32. № 23. P. 2999-3054.
6. Norgard N.B., Dinicolantonio J.J. Clopidogrel, prasugrel, or ticagrelor? A practical guide to use of antiplatelet agents in patients with acute coronary syndromes // Postgrad. Med. 2013. V. 125. № 4. P. 91-102.
7. Montalescot G., Wiviott S.D., Braunwald E. et al. Prasugrel compared with clopidogrel in patients undergoing percutaneous coronary intervention for ST-elevation myocardial infarction (TRITON-TIMI 38): double-blind, randomised controlled trial // Lancet. 2009. V. 373. № 9665. P. 723-731.
8. Cannon C.P., Harrington R.A., James S. et al. Comparison of ticagrelor with clopidogrel in patients with a planned invasive strategy for acute coronary syndromes (PLATO): a randomised double-blind study // Lancet. 2010. V. 375. № 9711. P. 283-293.
9. Schafer J.A., Kjesbo N.K., Gleason P.P. Critical review of prasugrel for formulary decision makers // J. Manag. Care Pharm. 2009. V. 15. № 4. P. 335-343.
10. Spinler S.A., Rees C. Review of prasugrel for the secondary prevention of atherothrombosis // J. Manag. Care Pharm. 2009. V. 15. № 5. P. 383-395.
11. Antman E.M., Wiviott S.D., Murphy S.A. et al. Early and late benefits of prasugrel in patients with acute coronary syndromes undergoing percutaneous coronary intervention: a TRITON-TIMI 38 (TRial to Assess Improvement in Therapeutic Outcomes by Optimizing Platelet InhibitioN with Prasugrel-Thrombolysis In Myocardial Infarction) analysis // J. Am. Coll. Cardiol. 2008. V. 51. № 21. P. 2028-2033.
12. DiNicolantonio J.J., Tomek A. Inactivations, deletions, non-adjudications, and downgrades of clinical endpoints on ticagrelor: serious concerns over the reliability of the PLATO trial // Int. J. Cardiol. 2013. V. 168. № 4. P. 4076-4080.
13. James S., Akerblom A., Cannon C.P. et al. Comparison of ticagrelor, the first reversible oral P2Y(12) receptor antagonist, with clopidogrel in patients with acute coronary syndromes: rationale, design, and baseline characteristics of the PLATelet inhibition and patient Outcomes (PLATO) trial // Am. Heart J. 2009. V. 157. № 4. P. 599-605.
14. Marciniak T.A. Memorandum: Ticagrelor for acute coronary syndromes, NDA 22-433. Letter to the US food and drug administration. 2010. [Last accessed on 2012 Feb 11]
15. Национальные рекомендации по диагностике и лечению больных острым инфарктом миокарда с подъемом сегмента ST ЭКГ // Кардиоваск. тер. и профилакт. 2007. № 6(8). Прилож. 1.
16. Sabatine M.S., Cannon C.P., Gibson C.M. et al. Addition of clopidogrel to aspirin and fibrinolytic therapy for myocardial infarction with ST-segment elevation // N. Engl. J. Med. 2005. V. 352. № 12. P. 1179-1189.
17. Chen Z.M., Jiang L.X., Chen Y.P. et al.; COMMIT (ClOpidogrel and Metoprolol in Myocardial Infarction Trial) collaborative group. Addition of clopidogrel to aspirin in 45,852 patients with acute myocardial infarction: randomised placebo-controlled trial // Lancet. 2005. V. 366. № 9497. P. 1607-1621.
18. Chen Z.M., Pan H.C., Chen Y.P. et al.; COMMIT (ClOpidogrel and Metoprolol in Myocardial Infarction Trial) collaborative group. Early intravenous then oral metoprolol in 45,852 patients with acute myo cardial infarction: randomised placebo-controlled trial // Lancet. 2005. V. 366. № 9497. P. 1622-1632.
19. Steinhubl S.R., Berger P.B., Mann J.T. 3rd et al.; CREDO Investigators. Clopidogrel for the Reduction of Events During Observation. Early and sustained dual oral antiplatelet therapy following percutaneous coronary intervention: a randomized controlled trial // JAMA. 2002. V. 288. № 19. P. 2411-2420.
20. Mahoney E.M., Mehta S., Yuan Y. et al. Long-term cost-effectiveness of early and sustained clopidogrel therapy for up to 1 year in patients undergoing percutaneous coronary intervention after presenting with acute coronary syndromes without ST-segment elevation // Am. Heart J. 2006. V. 151. № 1. P. 219-227.
21. McMurray J., Solomon S., Pieper K. et al. The effect of valsartan, captopril, or both on atherosclerotic events after acute myocardial infarction: an analysis of the Valsartan in Acute Myocardial Infarction Trial (VALIANT) // J. Am. Coll. Cardiol. 2006. V. 47. № 4. P. 726-733.
22. Carson P., Tognoni G., Cohn J.N. Effect of Valsartan on hospitalization: results from Val-HeFT // J. Card. Fail. 2003. V. 9. № 3. P. 164-171.
23. Vandvik P.O., Lincoff A.M., Gore J.M. et al.; American College of Chest Physicians. Primary and secondary prevention of cardiovascular disease: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines // Chest. 2012. V. 141. № 2. Suppl. P. e637S-668S.
24. CAPRIE Steering Committee. A randomised, blinded, trial of clopidogrel versus aspirin in patients at risk of ischaemic events (CAPRIE). CAPRIE Steering Committee // Lancet. 1996. V. 348. № 9038. P. 1329-1339.
25. Brooks J., Warburton R., Beales I.L. Prevention of upper gastrointestinal haemorrhage: current controversies and clinical guidance // Ther. Adv. Chronic Dis. 2013. V. 4. № 5. P. 206-222.
26. Diener H.C., Bogousslavsky J., Brass L.M. et al. Aspirin and clopidogrel compared with clopidogrel alone after recent ischaemic stroke or transient ischaemic attack in high-risk patients (MATCH): randomised, double-blind, placebo-controlled trial // Lancet. 2004. V. 364. № 9431. P. 331-337.
27. Jones W.S., Schmit K.M., Vemulapalli S. et al. Treatment Strategies for Patients With Peripheral Artery Disease [Internet]. Rockville (MD): Agency for Healthcare Research and Quality (US); 2013 May. Report No.: 13-EHC090-EF. AHRQ Comparative Effectiveness Reviews.
28. Beckman J.A. Management of asymptomatic internal carotid artery stenosis // JAMA. 2013. V. 310. № 15. P. 1612-1618.
29. Cannon C.P.; CAPRIE Investigators. Effectiveness of clopidogrel versus aspirin in preventing acute myocardial infarction in patients with symptomatic atherothrombosis (CAPRIE trial) // Am. J. Cardiol. 2002. V. 90. № 7. P. 760-762.
30. Harker L.A., Boissel J.P., Pilgrim A.J., Gent M. Comparative safety and tolerability of clopidogrel and aspirin: results from CAPRIE. CAPRIE Steering Committee and Investigators. Clopidogrel versus aspirin in patients at risk of ischaemic events // Drug Saf. 1999. V. 21. №4. P. 325-335.
