Применение метапрота в качестве средства метаболической защиты головного мозга при острых нарушениях мозгового кровообращения
Статьи Клиническая фармакология метапрота, нового противоастенического препарата с психоактивирующими свойствами© П. Д. Шабанов
Военно-медицинская академия им. С. М. Кирова МО РФ, Санкт-Петербург
Ишемический инсульт и патология сердечнососудистой системы (инфаркт миокарда, пороки клапанов сердца), диктующие необходимость кардиохирургического вмешательства в условиях искусственного кровообращения, часто сопряжены с неадекватным кровоснабжением мозга (Funahashi Т. et al., 1994; Зарубина И. В., Шабанов П. Д., 2004). Они занимают одно из ведущих мест среди ишемических повреждений центральной нервной системы. Так, с конца 1970-х гг. инцидентность тяжелых повреждений нервной системы при кардиохирургической агрессии стабилизировалась на уровне около 5%, и сейчас она не имеет тенденции к дальнейшему снижению (Яснецов В. В., Новиков В. Е., 1994; Siesjo В. К. et al., 1996). Частота легких неврологических нарушений, по данным литературы, достигает 60%, а по наблюдениям Е. D. Hall (1996) они встречаются у подавляющего числа больных после операций с искусственным кровообращением. По сведениям Е. И. Гусева (2006), обобщившим этот аспект проблемы, в России к трудовой деятельности возвращается 20% перенесших инсульт, а показатель резкой степени инвалидности составляет 0,32 на 1000 населения.
В настоящем разделе исследования оценена эффективность применения метапрота в сравнении с пирацетамом и глиатилином в качестве средств метаболической защиты головного мозга при острых нарушениях мозгового кровообращения. Обследованы 53 больных в возрасте от 49 до 69 лет с острыми нарушениями мозгового кровообращения по ишемическому и смешанному типам (32 мужчины и 21 женщина). Для избежания субъективизма в оценке состояния пациента и с целью формализации клинических показателей для последующей статистической обработки использовали шкалу MAST. Нами был оценен клинический эффект при применении метапрота и пирацетама у 31 больного с острыми нарушениями мозгового кровообращения по ишемическому типу в бассейне средней мозговой артерии на фоне базисной терапии, включавшей внутривенное введение реополиглюкина, натрия хлорида, калия хлорида, трентала, рибоксина, лазикса, аскорбиновой кислоты, папаверина; внутримышечное введение анальгина, тавегила; подкожное введение гепарина и энтеральный прием аспирина.
В клиническом исследовании ориентировались на разовую дозу метапрота, эквивалентную экспериментальной в 12,5 мг/кг и на суточную дозу соответствующую 25 мг/кг. Так как наряду с актопротектором метапротом в течение двух недель в качестве традиционной церебропротекторной терапии использовали пирацетам, то оценивали соответственно их комплексный метаболический эффект. При длительном назначении метапрота после его 7-дневного курса делали 2-дневный перерыв с последующим возобновлением приема лекарственного средства.
Обследуемые были разделены на 4 группы. Первая группа (n = 7), начиная с первого дня заболевания получала комбинацию пирацетама (ежедневная внутривенная инфузия 20 мл 20%-го раствора пирацетама в течение 2-х недель) с сочетанным пероральным приемом метапрота по 4 таблетки (0,25 г в 1 таблетке) 2 раза в сутки в течение 5 дней с 2-х дневным перерывом и последующим 7-дневным приемом по 0,25 г 2 раза в сутки после еды. Вторая (n = 8) и третья (n = 7) группы получали соответственно метапрот по 2 и по 1 таблетке 2 раза в сутки в течение 5 дней с 2-х дневным перерывом и последующим 7-дневным приемом по 0,25 г 2 раза в сутки после еды на фоне внутривенного введения аналогичной дозы пирацетама. В четвертой группе (n = 9) использовали один пирацетам в той же дозе. Помимо этого у 22 больных с аналогичной патологией изучали влияние на церебральный метаболизм церебролизина и глиатилина. Все пациенты были разделены на однородные группы. В 1-й группе (n = 8) метаболическая защита проводилась церебролизином с 1 -го по 6-й день. У всех больных суточная доза препарата традиционно составляла 20 мл. Во 2-й группе (n = 12) комплексная терапия в первые 6 дней дополнялась глиатилином. Основываясь на данных, полученных при экспериментальном исследовании и особенностей проникновения холина альфосцерата (глиатилина) через гематоэнцефалический барьер при парентеральном введении в дозе превышающей 10 мг/кг у пациентов с гемисферным ишемическим инсультом вводили внутивенно капельно 2 грамма препарата 1 раз в сутки, что соответствовало экспериментальной разовой дозе 25 мг/кг. Уточнение диагноза и эффективность медикаментозной коррекции оценивали с помощью шкалы MAST, данных компьютерной томографии и церебральной оксиметрии.
У всех пациентов в плазме крови определяли концентрацию спонтанного и индуцированного малонового диальдегида, концентрацию восстановленного глутатиона, а также активность глутатионредуктазы и глутатионтрансферазы (Смирнов В. В., 1995; Wass С. Т., Lanier W. L, 1996; Зарубина И. В., Шабанов П. Д., 2002). Кровь для исследования забирали из периферических вен в одно и то же время суток.
Для изучения влияния глиатилина и метапрота на состояние больных, перенесших аортокоронарное шунтирование и протезирование клапанов сердца в условиях искусственного кровообращения, а также уточнения информативной значимости церебральной оксиметрии обследованы 28 пациентов. Среди прооперированных было 20 мужчин и 8 женщин в возрасте от 47 до 61 года.
Вводный наркоз осуществляли внутривенным введением калипсола (2 мг/кг) и фентанила (15 мкг/кг). ИВЛ проводили в режиме контролируемой механической вентиляции (CMV) аппаратами Engstrom Erica из расчета минутного объема вентиляции 15 л/кг в минуту при объеме вдоха 10 мл/кг и при 60% кислорода во вдыхаемой смеси. Поддержание анестезии проводили фентанилом (10 мкг/кг в час). Операции выполнялись с использованием искусственного кровообращения, умеренной гипотермии и фармако-холодовой кардиоплегии. Регистрация соматосенсорных вызванных потенциалов (ССВП) с обеих верхних конечностей производилась на аппарате НМА-4-01 «Нейромиан» (Россия) перед и после операцией до возвращения показателей к предоперационному уровню. Мониторирование насыщения мозговой ткани кислородом проводилось с помощью транскраниального оксиметра «INVOS 3100» (США) за сутки до операции и до последней регистрации ССВП.
Так, у больных с легкой и средней степенью тяжести патологии первая группа пациентов (n = 5), начиная с первых часов после операции, в течение 6 дней получала метапрот в дозе 2 г/сут. Вторая группа (n = 5) получала глиатилин в дозе 2 г/сут в течение 6 дней. В третьей (n = 5) и четвертой (n = 5) группах в качестве церебропротекторной терапии больные получали соответственно нимодипин и пирацетам по 0,01 г/сут и 4 г/сут соответственно в течение 6 дней. Пациенты с тяжелой степенью энцефалопатии были распределены на две группы, получавших соответственно пирацетам в суточной дозе 8 г и глиатилин в суточной дозе 2 г. Все препараты вводили внутривенно капельно, за исключением метапрота, для которого был использован пероральный чреззондовый путь введения. Эффективность медикаментозной коррекции оценивали по шкале Глазго и данным церебральной оксиметрии.
Кроме того, в динамике определяли содержание в плазме уровни спонтанного и индуцированного малонового диальдегида и восстановленного глутатиона. У кардиохирургических больных забор крови производили из яремной вены как во время операции, так и в послеоперационный период. После забора крови плазму отделяли, подвергали быстрому замораживанию в жидком азоте и в дальнейшем хранили в сосуде Дюара с жидким азотом вплоть до биохимического исследования. У пациентов с тяжелой степенью энцефалопатии проводили спинномозговые пункции через 24 и 48 ч после оперативного вмешательства. В полученном ликворе определяли концентрации лактата и пирувата.
Статистическая обработка полученных данных производилась с использованием дискриминантного и корреляционного анализа, реализованных в пакете статистических программ Statistica for Windows 95 v.5.0.
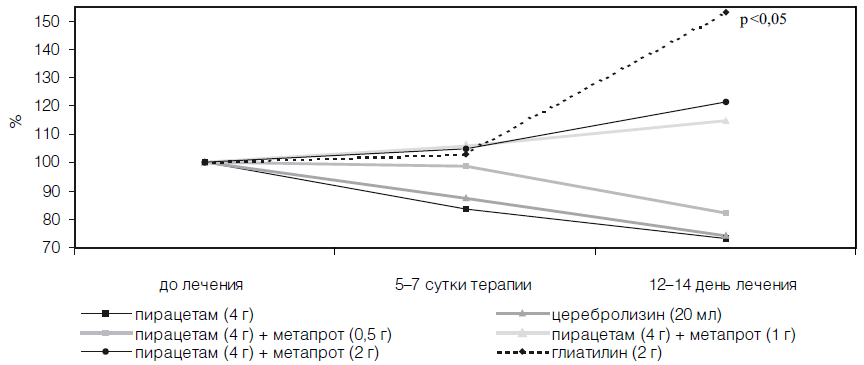
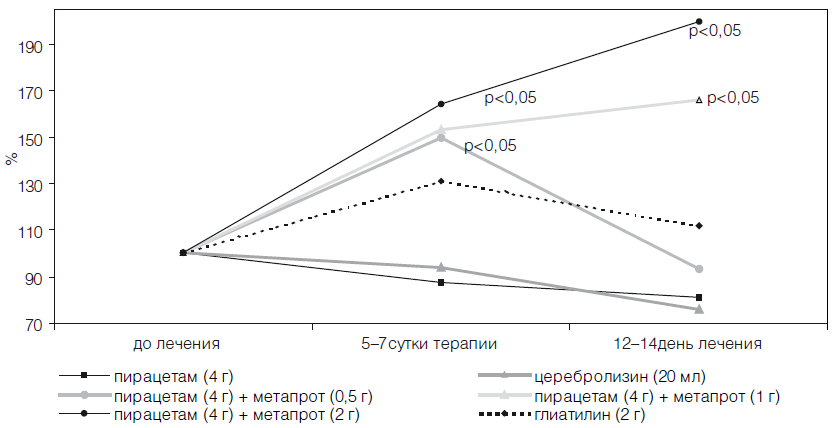
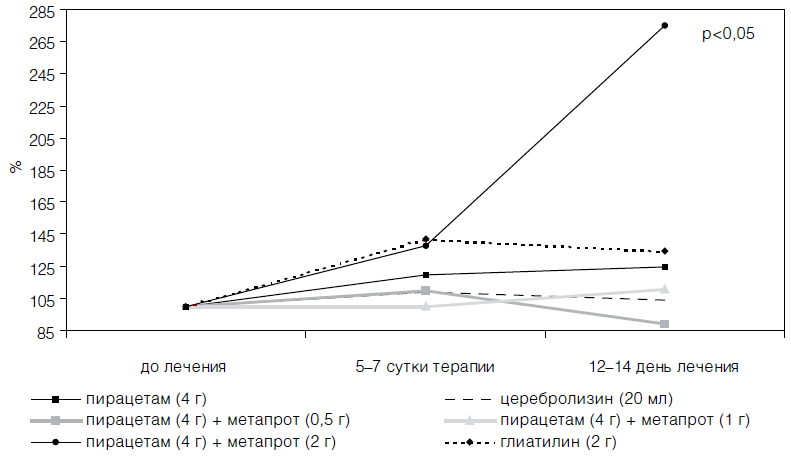
В изучаемых группах больных наблюдали достоверную однородность по интегральному показателю шкалы MAST на момент госпитализации пациентов. Однако на 21 -й день с момента появления неврологического дефицита значимыми по сравнению с контрольной группой больных оказались лишь коэффициенты улучшения у пациентов, принимавших комбинацию пирацетама (4 г/сут) и метапрота (2 г/сут), а также глиатилина (2 г/сут) после курсового назначения препаратов.
Достоверный положительный эффект в динамике неврологического статуса больных наблюдали лишь к концу острого периода инсульта, что свидетельствует об эффективности лишь курсового назначения препаратов (табл. 21). Однако об определенном позитивном прогнозе, при использовании комбинации пирацетама с метапротом и глиатилина в дозах, приближающихся к максимальным суточным, уже на 6-е сутки терапии свидетельствовало достоверное снижение по данным транскраниальной оксиметрии содержания кислорода в венозном русле головного мозга, сохранявшееся у глиатилина в течение двух недель (табл. 22).
Таблица 21. Динамика неврологического статуса у больных с гемисферным ишемическим инсультом на фоне метаболической защиты пирацетамом, церебролизином и метапротом
| Показатели | Церебролизин 20 мл/сут (n = 8) | Пирацетам 4 г/сут + метапрот 0,5 г/сут (n = 7) | Пирацетам 4 г/сут (n = 9) | ||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Шкала MAST (интегральная оценка) | При поступлении | 65±6,1 | 62,5±5,67 | 66±4,85 | |||||||||||||||||||||||||
| На 6-й день | 72,3±4,2 | 68,9±5,7 | 69,75±5,8 | ||||||||||||||||||||||||||
| На 21-й день | 83,5±4,9 | 86,9±6,2 | 84,7±4,48 | ||||||||||||||||||||||||||
| Примечание. * — р Таблица 22. Динамика неврологического статуса у больных с гемисферным ишемическим инсультом на фоне метаболической защиты пирацетамом, метапротом и глиатилином
| |||||||||||||||||||||||||||||
Комментарии
ПРАКТИКА ПЕДИАТРА