Влияние антигипертензивных средств разных фармакологических групп на реакцию артериального давления в условиях стресс-тестирования Часть II
СтатьиЕ. А. ПРАСКУРНИЧИЙ, О.П. ШЕВЧЕНКО, СВ. МАКАРОВА, В.А. ЖУКОВА, С.А. САВЕЛЬЕВА
Российский государственный медицинский университет. 117437 Москва, ул. Островитянова, 1
Effect of Antihypertensive Agents From Various Pharmacological Groups on Blood
Pressure Reaction During Stress —Testing. Part II. Value of Various Strategies of Potentiation of Systemic Vasodilation
E.A. PRASKURNITCHY, O.P. SHEVTCHENKO, S.V. MAKAROVA, V.A. ZHUKOVA, S.A. SAVELIEVA
Russian State Medical University; ul. Ostrovityanova 1, 117437 Moscow, Russia
Значение симпатической нервной системы в развитии стресс-индуцированного повышения АД убедительно продемонстрировано в ходе клинических и экспериментальных исследований [1—4]. Вместе с тем необходимо отметить, что особую роль в патогенезе артериальной гипертонии (АГ) играет взаимодействие нейрогуморальных систем, в частности симпатической и ренин-ангиотензиновой [5, 6]. Так, показано, что их взаимная стимуляция способствует сохранению гиперактивности симпатической нервной системы у больных АГ. С одной стороны, высвобождение ренина контролируется симпатическими нервными волокнами и β1-адренорецепторами почек. С другой стороны, ангиотензин II, который образуется в реакции, катализируемой ренином, взаимодействует с регуляторными центрами периферической нервной системы и головного мозга, что сопровождается симпатико-адреналовой активацией и потенцированием высвобождения катехоламинов [7].
Обеспечение в подобных условиях эффективного контроля за активностью нейрогуморальных систем является важной задачей антигипертензивной терапии. Не меньшее значение имеет и мониторинг ее результативности, что осуществляется благодаря не только динамическому контролю АД и суточному мониторированию АД (СМАД), но и результатам стресс-тестирования. Кроме того, в целом ряде исследований показано, что максимальный уровень АД, достигнутый во время выполнения нагрузочной пробы, выступает в качестве независимого фактора риска смерти от сердечно-сосудистых причин [8].
В настоящее время в клинической практике используются различные варианты нагрузочных проб, которые у лиц с АГ могут выполняться как на диагностическом этапе, так и при контроле эффективности проводимого лечения. При этом наиболее рациональный подход — проведение комплексного стресс-тестирования, включающего различные методики и позволяющего моделировать различные варианты стресса. С этой целью у одного и того же пациента могут быть проведены динамическая и изометрическая нагрузочная пробы, психоментальное тестирование, а при наличии специальных показаний — целый ряд других исследований.
Эффективным подходом к коррекции гемодинамических нарушений, верифицируемых в ходе стресс-тестирования, служит включение в терапию β-адреноблокаторов. Определенными преимуществами среди препаратов данной фармакологической группы в отношении подавления гипертензивной реакции, возникающей в условиях динамической физической нагрузки, обладает карведилол — комбинированный β1- и β2-адреноблокатор, который дает дополнительный вазодилатирующий эффект, связанный с α1-адренергической блокадой [9].
Тем не менее, ключевое значение в ослаблении стресс-индуцированных гипертензивных реакций у пациентов с АГ под влиянием тех или иных антигипертензивных препаратов имеет возможность последних модифицировать активность нейрогуморальных систем. Подобные свойства наряду с карведилолом присущи и препаратам других фармакологических групп, в частности ингибиторам ангиотензинпревращающего фермента (АПФ) и антагонистам рецепторов ангиотензина II, антигипертензивное действие которых обеспечивается благодаря реализации раз личных механизмов вазодилатации. Однако возможность и результативность коррекции нарушений гемо динамики, возникающих во время стресс-тестирования, на основе использования указанных антигипертензивных средств нуждаются в уточнении.
В связи с изложенным целью настоящего исследования была сравнительная характеристика эффективности антигипертензивных препаратов с различными механизмами вазодилатирующего действия — ингибитора АПФ лизиноприла, антагониста рецепторов ангиотензина II эпросартана, антагониста кальция амлодипина, а также β-адреноблокатора карведилола — в отношении подавления стресс-индуцированного повышения АД, возникающего в условиях динами ческой и статической физической нагрузки.
Материал и методы
В исследование были включены 117 человек в возрасте от 48 до 62 лет с АГ 1—2-й степени. В качестве критериев исключения из исследования выступали клинические проявления ИБС, застойной сердечной недостаточности, почечной недостаточности, сахарного диабета, бронхиальной астмы, а также указание в анамнезе на перенесенный инфаркт миокарда, острое и преходящее нарушение мозгового кровообращения. Включению в исследование пациентов, получавших ранее антигипертензивную терапию, предшествовал двухнедельный «отмывочный» период. Все пациенты были рандомизированы в группы антигипертензивной терапии. Больные 1-й группы (n=26) получали лизиноприл в дозе 10—40 мг/сут, больные 2-й группы (n=28) — эпросартан в дозе 600—1200 мг/сут, 3-ю группу составили 42 пациента, которые получали амлодипин в суточной дозе 5—10 мг, пациенты 4-й группы (n=21) принимали карведилол (Акридилол®, ОАО “АКРИХИН”, Россия) в дозе 50—75 мг/сут. В ходе исследования последовательно увеличивали дозы препаратов с целью достижения целевого уровня АД, по данным казуальных измерений. Все препараты, за исключением β-адреноблокатора, больные принимали один раз в день, утром натощак; карведилол принимали 2 раза в сутки. Все препараты назначались в виде монотерапии, комбинации с другими антигипертензивными средствами не допускалось.
Кроме того, в целях определения референтных значений параметров кардиоваскулярного тестирования была обследована контрольная группа практически здоровых лиц (n=28) в возрасте от 27 до 60 лет (в сред нем 51,4±7,2 года) с уровнем клинического АД менее 140/90 мм рт.ст, среднесуточного АД — менее 125/80 мм.рт.ст.; у всех был нормотензивный тип реакции АД в условиях проведения велоэргометрической (ВЭМ) пробы.
Пациентам, включенным в исследование, проводили следующие исследования: клиническое измерение АД, СМАД, нагрузочная проба с дозированной физической нагрузкой на велоэргометре в положении лежа, изометрическая и ортостатическая пробы, а также оценка вариабельности ритма сердца (ВРC). Первичное комплексное исследование проводили через 14 дней после отмены антигипертензивной терапии. Методика клинического контроля АД, СМАД, проведения изометрической, ВЭМ- и ортостатической проб, а также анализа ВРС изложены в Части I.
Статистический анализ проводили с помощью пакета программ Exel 7.0 и BIOSTAT с использованием рекомендованных критериев. Результаты представлены в виде M±m. Различия считали достоверными при pРезультаты
По данным клинических измерений АД (табл. 1) и результатов СМАД (табл. 2) на фоне терапии всеми препаратами степень снижения АД, по данным суточного мониторирования, существенно не отличается. Различия исходного уровня АД и уровня АД на терапии в подгруппах достоверно не отличаются. Антигипертензивная терапия ингибитором АПФ лизиноприлом, антагонистом рецепторов ангиотензина II эпросартаном, антагонистом кальция амлодипином и β-адреноблокатором карведилолом характеризовалась сопоставимой эффективностью. Выраженность антигипертензивного эффекта у лизиноприла, эпросартана, амлодипина и карведилола в исследуемых дозах существенно не различалась.
Таблица 1. Динамика АД и ЧСС, по данным клинических измерений, на фоне терапии
| Показатель | Лизиноприл | Эпросартан | Амлодипин | Карведилол | ||||
| до лечения | на фоне лечения | до лечения | на фоне лечения | до лечения | на фоне лечения | до лечения | на фоне лечения | |
| САДкл., мм.рт.ст. | 154,6±23,7 | 120,8±14,4* | 150,1 ± 18,2 | 125,0±9,5* | 159,5±22,2 | 129,7±12,9* | 150,8±11,6 | 129,7±11,3* |
| ДАДкл., мм.рт.ст. | 93,9±9,6 | 78,5±6,9* | 91,3±15,5 | 76,7±5,4* | 94,2±10,17 | 94,2±10,17 | 70,7±7,1 | 63,3±10,1* |
| ЧССкл., уд/мин | 72,85±9,4 | 68,8±9,9 | 65,7±5,6 | 61,3±4,2 | 75,5±9,2 | 72,3±9,5 | 105,5±5,3 | 60,1±7,3* |
Примечание: САДкл. — клиническое систолическое АД, ДАДкл. — клиническое диастолическое АД, ЧССкл. — клиническая частота сердечных сокращений, * — различия достоверны по сравнению с исходными данными (p
Таблица 2. Динамика показателей сутоточного мониторирования АД на фоне терапии
| Показатель | Лизиноприл | Эпросартан | Амлодипин | Карведилол | ||||
| до лечения | на фоне лечения | до лечения | на фоне лечения | до лечения | на фоне лечения | до лечения | на фоне лечения | |
| САД, мм.рт. ст. | ||||||||
| среднесуточное | 144,2±17,0 | 130,8±13,3* | 146,1±10,8 | 128,7±7,3* | 148,0±16,3 | 132,0±11,0* | 135,2±12,4 | 123,2±7,1* |
| среднедневное | 149,6±16,2 | 134,9±13,4* | 142,8±11,0 | 130,2±6,9* | 153,6±15,7 | 134,8±10,8* | 141,1 ± 14,3 | 129,0±5,1* |
| средненочное | 132,0±19,7 | 122,9±14,8* | 123,1±8,8 | 114,7±7,3* | 136,5±18,1 | 125,9±12,1* | 121,0±12,0 | 113±8,0 |
| ДАД, мм.рт. ст. | ||||||||
| среднесуточное | 85,4±7,1 | 77,0±6,0* | 82,1±5,8 | 75,2±3,3* | 86,1±7,4 | 78,5±4,2* | 89,1±7,2 | 80,0±4,2* |
| среднедневное | 90,5±6,5 | 81,7±5,9* | 87,0±5,1 | 80,2±3,4* | 91,2±7,2 | 82,0±4,6* | 95,3±10,2 | 85,0±10,0* |
| средненочное | 73,5±9,3 | 67,7±6,0* | 70,3±7,1 | 63,4±6,2* | 75,1±9,8 | 71,2±6,3* | 77,2±4,1 | 70,0±6,0 |
| ЧСС, уд/мин | ||||||||
| среднесуточная | 77,9±7,4 | 74,5±9,4 | 71,0±9,3 | 70,2±5,3 | 76,2±10,5 | 75,8±8,2 | 76,0±6,0 | 65,0±5,0* |
| среднедневная | 83,2±8,2 | 78,6±9,4 | 76,6±11,8 | 77,7±6,9 | 80,8±11,0 | 81,2±8,9 | 83,0±7,0 | 71,0±7,0* |
| средненочная | 67,3±8,5 | 66,2±8,6 | 58,5±7,1 | 57,3±6,5 | 67,1 ± 10,8 | 64,7±8,3 | 61,0±6,0 | 55,0±5,0* |
Примечание: САД — систолическое АД, ДАД — диастолическое АД, ЧСС— частота сердечных сокращений, * — различия достоверны по сравнению с исходными данными (p
Сопоставимость антигипертензивной активности ингибитора АПФ лизиноприла, антагониста рецепторов ангиотензина II эпросартана, антагониста кальция амлодипина и β-адреноблокатора карведилола подтверждается также результатами пробы с изометрической физической нагрузкой (рис. 1). Указанные препараты в целом эффективно снижают реакцию АД, обусловленную статической физической нагрузкой.
Рис. 1. Динамика на фоне терапии максимального АД, зарегистрированного во время проведения изометрической пробы.
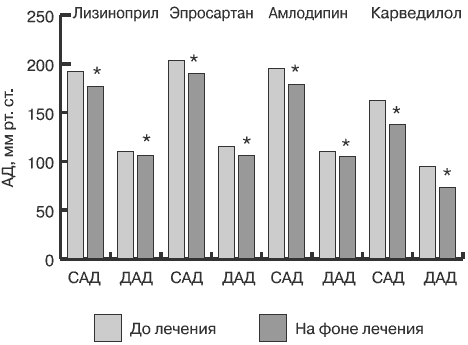
* — различия достоверны по сравнению с исходными данными (p
Вместе с тем характер изменений гемодинамических показателей, регистрируемых во время проведения ВЭМ-пробы, свидетельствует о явных преимуществах β-адреноблокатора карведилола перед другими препаратами с вазодилатирующей активностью в отношении снижения стресс-индуцированной гипертензивной реакции. Карведилол эффективно снижал уровень как систолического АД (САД), так и диастолического АД (ДАД), регистрируемого в условиях данного варианта нагрузочного тестирования (табл. 3).
Таблица 3. Динамика гемодинамических показателей, регистрируемых во время проведения ВЭМ-пробы
| Показатель | Лизиноприл | Эпросартан | Амлодипин | Карведилол | ||||
| до лечения | на фоне лечения | до лечения | на фоне лечения | до лечения | на фоне лечения | до лечения | на фоне лечения | |
| В покое | ||||||||
| САД, мм.рт.ст. | 154,6±23,7 | 120,8±14,4* | 150,1±18,2 | 125,0±9,5* | 159,5±22,2 | 129,7±12,9* | 150,8±11,6 | 129,7±11,3* |
| ДАД, мм.рт.ст. | 93,9±9,6 | 78,5±6,9* | 91,3±15,5 | 76,7±5,4* | 94,2±10,2 | 81,1±6,4* | 105,5±5,3 | 63,3±10,1* |
| ЧСС, уд/мин | 72,85±9,4 | 68,8±9,9 | 65,7±5,6 | 61,3±4,2 | 75,5±9,2 | 72,3±9,5 | 70,7±7,1 | 60,1±7,3* |
| 50 Вт | ||||||||
| САД, мм.рт.ст. | 178,3±13,3* | 155,0±16,4* | 183,0±21,2 | 163,6±20,4* | 181,4±23,2 | 158,6±21,1* | 178,5±15,7 | 155,0±7,1* |
| ДАД,мм.рт.ст. | 105,0±10,0 | 96,7±4,9* | 99,4±5,6 | 85,5±10,8* | 107,1±9,1 | 97,6±8,6* | 97,5±9,5 | 88,0±4,1* |
| ЧСС, уд/мин | 101,2±12,3 | 99,3±14,4 | 101,3±13,5 | 95,3±20,4* | 104,6±11,6 | 100,9±8,8 | 98,0±8,1 | 81,0±2,3* |
| 100 Вт | ||||||||
| САД, мм.рт.ст. | 209,2±18,2 | 195,0±24,7* | 213,0±21,3 | 190,4±21,5* | 200,0±17,1 | 176,7±17,8* | 202,1±4,5 | 177,2±7,6*# |
| ДАД, мм.рт.ст. | 108,3±9,4 | 100,0±8,5* | 100,2±10,8 | 97,3±8,4 | 108,8±9,9 | 102,5±7,1* | 112,0±5,2 | 83,0±2,1*# |
| ЧСС, уд/мин | 123,8±14,6 | 119,8±15,3* | 121,4±13,3 | 121,2±21,5 | 120,2±14,6 | 117,7±9,6 | 117,5±12,3 | 101,3±14,0* |
Примечание: ВЭМ — велоэргометрическая, САД — систолическое АД, ДАД — диастолическое АД, ЧСС - частота сердечных сокращений, * — различия достоверны по сравнению с исходными данными (p
При оценке влияния других вазодилататоров на показатели гемодинамики в условиях ВЭМ-пробы констатирован более выраженный подавляющий эффект в отношении максимального АД при нагрузках средней интенсивности. Так, при мощности нагрузки 50 Вт применение лизиноприла, эпросартана и амлодипина приводило к снижению максимального уровня как САД, так и ДАД. Выраженность эффекта рассматриваемых препаратов на уровне мощности нагрузки 100 Вт оказалась значительно слабее. При этом уменьшился лишь максимальный уровень САД. В то же время снижение ДАД в группах больных, получавших лизиноприл и амлодипин, было выражено весьма умеренно и в среднем не достигало менее 100 мм рт.ст, а на фоне терапии эпросартаном достоверно не изменялось. Тем не менее уже сама возможность подавления стресс-индуцированной гипертензивной реакции с помощью монотерапии, не основанной на использовании β-адреноблокаторов, заслуживала внимания. Пониманию механизма подавления стресс-индуцированной гипертензивной реакции, возникающей в ходе данного варианта нагрузочного тестирования, во многом способствует оценка динамики прироста АД на разных уровнях нагрузки. В рамках настоящего исследования было отмечено, что только применение β-адреноблокатора обеспечивало снижение данного показателя в условиях нарастания интенсивности физической нагрузки динамического типа. На фоне лечения амлодипином прирост АД в аналогичных условиях существенно не изменился, а терапия лизиноприлом и эпросартаном сопровождалась даже стимулированием прироста ДАД при мощности нагрузки 100 Вт (рис. 2).
Рис. 2. Динамика на фоне терапии прироста АД, регистрируемого во время проведения ВЭМ-пробы, при мощности нагрузки 100 Вт
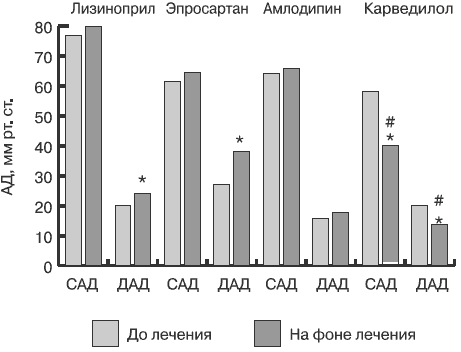
* — различия достоверны по сравнению с исходными данными (p
С учетом изложенного можно сделать вывод, что в основе подавления изученными вазодилататорами, за исключением карведилола, гипертензивной реакции, индуцированной динамической физической нагрузкой, лежит не ограничение роста гемодинамических показателей в условиях возрастания ее мощности, как это наблюдается при использовании β-адреноблокатора, а преимущественное влияние на исходный («предстартовый») уровень АД.
Оптимизирующее влияние терапии на параметры ВРС оказалось также выражено в большей мере при назначении β-адреноблокатора. Карведилол стимулировал увеличение общей мощности спектра, показате ля рNN50 и смещение симпатовагального отношения в сторону преобладания вагусной активности. Резуль таты анализа влияния лизиноприла, эпросартана и амлодипина на показатели ВРС отражали отсутствие ее выраженных нарушений исходно, а также развития неблагоприятной динамики на фоне терапии (табл. 4). Более того, в группах лечения лизиноприлом и эпросартаном отмечен позитивный характер изменений отдельных параметров, в частности SDNN, pNN50, RMSSD и общей мощности спектра в первом случае, и симпатовагального отношения — во втором. У пациентов, получавших амлодипин, выявлены разнонаправленные изменения показателей ВРС. В частности, независимо от проводимого ранее лечения А Г, факторов риска развития сердечно-сосудистых осложнений, а также дозы амлодипина, назначаемого в рамках данного исследования, у ряда пациентов отмечено снижение параметров, характеризующих ВРС, тогда как у других — их повышение. В соответствии с характером изменений показателей ВРС пациенты, получавшие амлодипин, были разделены на 2 подгруппы. В подгруппе 1 терапия амлодипином сопровождалась увеличением SDNN с 24,3±5,1 до 31,6±9,1 мс и общей мощности спектра с 542,6±256,8 до 916,6±637,5 мс2, тогда как в подгруппе 2 наблюдалась обратная динамика указанных параметров, а именно их снижение соответственно с 33,8±12,7 до 24,9±13,1 и с 1344,0±714,6 до 810,9±780,1. Статистически достоверных изменений отношения LF/HF ни в той, ни в другой подгруппе не выявлено.
Таблица 4. Динамика показателей ВРС на фоне проводимой терапии
| Лизиноприл | Эпросартан | Амлодипин | Карведилол | |||||
| ВРС | до лечения | на фоне лечения | до лечения | на фоне лечения | до лечения | на фоне лечения | до лечения | на фоне лечения |
| SDNN, мс | 26,2±9,7 | 36,4±11,7* | 32,4±11,3 | 41,8±12,7 | 29,9±10,2 | 28,1±11,4 | 49,0±44,0 | 41,0,6±25,0 |
| pNN50, % | 1,03±2,9 | 4,9±5,5* | 2,1±0,3 | 5,4±3,5* | 3,2±4,3 | 2,4±3,5 | 2,9±1,1 | 29,3±10,2* |
| RMSSD, мс | 16,0±8,2 | 24,8±11,3* | 40,3±20,7 | 41,1±16,9 | 22,1±11,9 | 18,9±7,8 | 28,0±10,0 | 50,0±50,0 * |
| TP, мс2 | 767,9±532,4 | 1430,0±894,7* | 1576,3±219,0 | 1307,2±123,5 | 773,2±442,4 | 830,2±585,9 | 1024±144,2 | 2018±267,5 |
| LF/НF | 2,0±1,1 | 1,7±1,2 | 2,2±0,76 | 1,8±0,77* | 1,4±0,6 | 1,5± 1,0 | 2,4±0,2 | 1,7±0,09* |
Примечание: ВРС— вариабельность ритма сердца, SDNN — стандартное отклонение от средней длительности всех синусовых интервалов R-R, RMSSD — доля соседних интервалов R-R, различающихся более чем на 50 мс, полученных за весь период записи, RMSSD — среднеквадратичное различие между продолжительностью соседних синусовых интервалов R-R, ТР — общая мощность спектра, LF/ HF — симпатовагальный индекс, * — различия достоверны по сравнению с исходными данными (p
Антигипертензивная эффективность амлодипина по данным клинического измерения АД и данным СМАД была сопоставима в выделенных подгруппах. В то же время продемонстрирована зависимость стресс-индуцированного повышения САД, регистрируемого в ходе про ведения ВЭМ-пробы, от параметров ВРС. Так, снижение максимального САД, а также показателя прироста САД регистрировалось только в той подгруппе, в которой у показателей ВРС была благоприятная динамика (рис. 3).
Рис. 3. Динамика максимального АД и прироста АД на фоне терапии амлодипином во время проведения ВЭМ-пробы при мощности нагрузки 100 Вт.
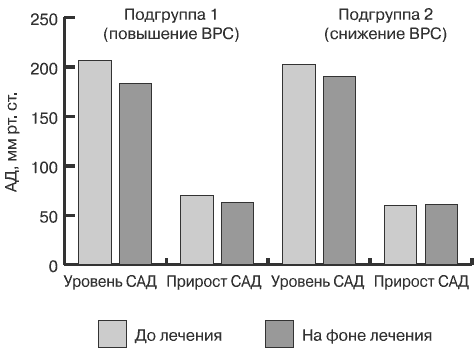
ВРС— вариабельность ритма сердца, ВЭМ — велоэргометрическая, * — различия достоверны по сравнению с исходными данными (p
Потенциальная способность вазодилататоров вызывать ортостатические гипотензивные реакции известна и является существенным фактором, ограничивающим их клиническое использование у пациентов отдельных категорий [10]. Тем не менее в рамках проведенного исследования такого рода эпизоды не отмечены. Реакция АД и ЧСС при использовании лизиноприла, эпросартана и амлодипина была расценена как физиологическая (рис. 4 и 5). Применение карведилола сопровождалось снижением САД в ортостазе, однако подобный эффект был выражен в минимальной степени и не сопровождался субъективными проявлениями.
Рис. 4. Динамика на фоне терапии ЧСС, зарегистрированной во время проведения ортостатической пробы.
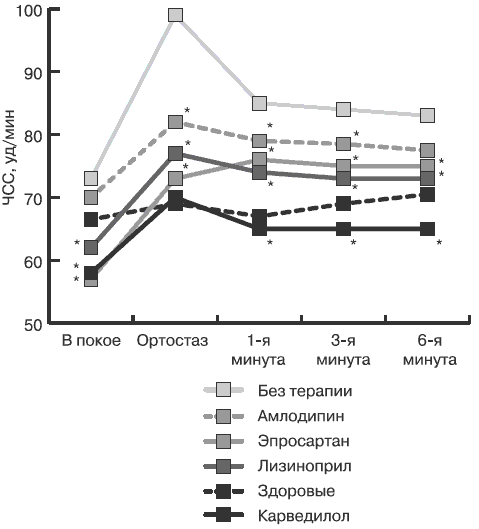
ЧСС— частота сердечных сокращений, * — различия достоверны по сравнению с исходными данными (p
Рис. 5. Динамика на фоне терапии максимального САД, зарегистрированного во время проведения ортостатической пробы.
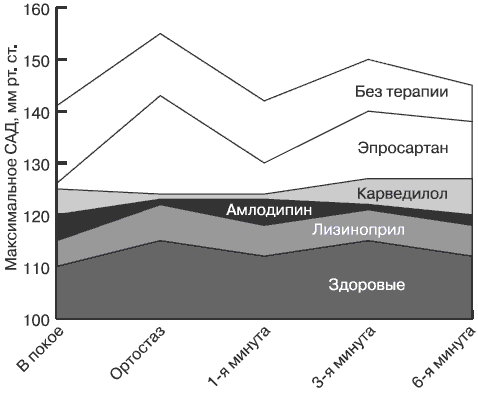
САД — систолическое АД, разница значений показателя на фоне терапии всеми препаратами по сравнению с исходными достоверна (p
Обсуждение
В настоящем исследовании, как по данным клинических измерений АД, так и на основании результатов СМАД, лизиноприл, эпросартан, амлодипин и карведилол примерно в равной мере оказывали антигипертензивный эффект. Исходя из особенностей антигипертензивного действия, ключевое значение в обеспечении которого на фоне терапии ингибитором АПФ лизиноприлом, антагонистом рецепторов ангиотензина II эпросартаном, антагонистом кальция амлодипином, а также β-, α1-адреноблокатором карведилолом отводится снижению сосудистого тонуса, в рамках данного исследования указанные препараты были объединены в общую группу вазодилататоров. При этом во внимание принималось и то, что механизмы индуцируемой ими вазодилатации существенно различаются.
Известно, что в основе наиболее клинически значимых фармакологических эффектов ингибиторов АПФ лежит их способность снижать активность ангиотензин I-превращающего фермента (или кининазы II) и оказывать, таким образом, подавляющее влияние на функционирование ренин-ангиотензиновой системы [11]. Антагонисты рецепторов ангиотензина II также выступают в роли депрессора данного нейрогуморального механизма, вызывая блокаду ангиотензиновых рецепторов 1-го типа, ответственных за вазоконстрикцию [12]. Несмотря на то, что в рамках каждой фарма кологической группы существует широкое разнообразие характеристик ингибиторов АПФ и антагонистов рецепторов ангиотензина II, в гемодинамическом отношении их представители выступают в качестве вазодилататоров смешанного типа [13—15].
В рамках нашего исследования изучался вопрос о существовании клинически значимых преимуществ относительно нового класса нейрогуморальных модуляторов — антагонистов рецепторов ангиотензина II — перед ингибиторами АПФ. Кроме того, в группе антагонистов рецепторов ангиотензина II именно эпросартан рассматривается многими исследователями в качестве, по меньшей мере, препарата выбора при лечении стресс-индуцированной АГ [16,17]. Формированию экспериментальной основы такого рода заключений в значительной мере способствовали работы, выполненные Е.Н. Ohlistein и соавт. [14]. Результаты этих работ продемонстрировали, что снижение симпатического выброса, вызванного раздражением спинного мозга у нормотензивных крыс и предположительно связанного с влиянием на пресинаптические рецепторы ангиотензина I, наблюдается только при введении эпросартана, а при инфузиях вальсартана, ирбесартана и лозартана подобный эффект отсутствует [15]. Таким образом, в известном смысле в настоящем исследовании сравнивалась эффективность различных стратегий медикаментозного подавления активности ренин-ангиотензиновой системы в отношении влияния на стресс-индуцированную реакцию АД в условиях нагрузочных проб.
Результаты нашего исследования продемонстрировали в целом равную эффективность ингибиторов АПФ и антагонистов рецепторов ангиотензина II в отношении ослабления стресс-индуцированной реак ции АД во время физических нагрузок как статическо го, так и динамического типа. Обе стратегии подавле ния активности ренин-ангиотензиновой системы позволяли примерно в одинаковой степени снижать АД на высоте нагрузки при проведении изометрического теста, а также максимальный уровень САД, регистрируемый в ходе ВЭМ-пробы. Вместе с тем, в отличие от β-адреноблокаторов, ни лизиноприл, ни эпросартан не оказывали значимого влияния на уровень максимального ДАД, а также на прирост АД на фоне возрастающей динамической нагрузки.
В рамках настоящего исследования в качестве основного метода характеристики выраженности нейрогуморальной активности использована оценка показателей ВРС, которая лишена целого ряда методических проблем, неизменно возникающих в случае непосредственного определения плазменного уровня катехоламинов [18—20]. Принципиальное значение имеет выявленная в группах терапии ингибитором АПФ и антагонистом рецепторов ангиотензина II ассоциация ослабления стресс-индуцированной гипертензивной реакции, развивающейся во время физической нагрузки динамического типа, с позитивными изменениями параметров ВРС.
Обнаружения подобного рода тенденций трудно было ожидать при лечении антагонистами кальция, которые скорее повышают активность нейрогуморальных систем, чем оказывают на нее подавляющее воздействие [21]. Тем не менее в группе терапии антагонистом кальция амлодипином было также констатировано в целом оптимизирующее воздействие на показатели стресс-тестирования. При этом нельзя не отметить, что, будучи представителем III поколения дигидропиридиновых антагонистов кальция и выступая в гемодинамическом отношении в качестве вазодилататора смешанного типа, амлодипин по целому ряду фармакокинетических и фармакодинамических параметров существенно отличается от других препаратов данной группы [22]. В частности, в отличие от короткодействующих форм нифедипина, амлодипин характеризуется длительным периодом полувыведения, высокой биодоступностью, медленным развитием вазодилатирующего эффекта. Эти особенности в конечном итоге определяют нейрогуморальный профиль амлодипина как нейтральный, сводя к минимуму возможность существенной симпатико-адреналовой активации на фоне терапии данным препаратом [23]. Однако именно поэтому правомерность экстраполяции тенденций, отмеченных при использовании амлодипина, на терапевтические характеристики других антагонистов кальция представляется сомнительной и необоснованной.
Сопоставляя характер изменений показателей стресс-тестирования на фоне применения вазодилататоров разных фармакологических групп, обладающих различным механизмом действия, следует отметить, что констатированная в группах терапии ингибитором АПФ и антагонистом рецепторов ангиотензина II зависимость уменьшения гипертензивной реакции АД от благоприятных изменений симпатовагальных отношений сохраняется и в отношении лечения антагонистом кальция. Ослабление стресс-индуцированного повышения АД во время физической нагрузки дина мического типа на фоне терапии амлодипином отмечено лишь в случаях отчетливой позитивной динамики показателей ВРС.
Таким образом, результаты настоящей работы позволяют дать положительный ответ на вопрос о возможности подавления на фоне терапии вазодилататорами гипертензивной реакции, индуцированной как статической, так и динамической физической нагрузкой, однако в последнем случае это достигается с некоторыми ограничениями и лишь при выполнении ряда условий. Ограничения заключаются в проблематичности влияния на уровень ДАД и прирост АД, а условием положительного эффекта является низкий уровень активности нейрогуморальных, прежде всего симпатико-адреналовой, систем.
Вместе с тем, сопоставляя характер влияния на гипертензивную реакцию, индуцированную динамической физической нагрузкой, разных групп вазодилататоров (что составляло одну из основных задач настоящего исследования), следует обратить внимание на существенные особенности изменения гемодинамических показателей, обусловленные антигипертензивной терапией. Подавление стресс-индуцированного прироста АД в данных условиях можно рассматривать как исключительную прерогативу препаратов, обладающих β-адреноблокирующей активностью. Ослабление же гипертензивной реакции, вызванной динамической физической нагрузкой, под влиянием других антигипертензивных препаратов, если оно достигалось в рамках настоящего исследования, было обусловлено главным образом снижением АД в покое (т.е. снижением “предстартового” АД).
С нашей точки зрения, представляется крайне важным учитывать продемонстрированные в рамках настоящего исследования особенности влияния β-адреноблокаторов и вазодилататоров на стресс-индуцированное повышение АД при их использовании в клинической практике. С учетом явных преимуществ в данном отношении β-адреноблокаторов, их назначение в ситуациях некорригированной стресс-индуцированной АГ, верифицируемой в условиях нагрузочного тестирования, представляется не только обоснованным, но и оптимальным. В то же время дополнительный вазодилатирующий эффект β-адреноблокатора может существенно повышать его эффективность в отношении подавления стресс-индуцированной гипертензивной реакции.
Значительная редукция повышения АД, вызванного физической нагрузкой, может быть достигнута также при использовании ингибиторов АПФ и антагонистов рецепторов ангиотензина II. Однако их возможности в данном отношении существенно уступают таковым β-адреноблокаторов, а при использовании максимальных дозировок нельзя исключить риск развития гипотензивных эпизодов. Тем не менее использование средств, блокирующих ренин-ангиотензиновую систему, может быть обоснованным в ряде случаев стресс-индуцированного повышения преимуществен но САД. В то же время мы считаем, что перспективность применения по данным показаниям антагонистов кальция весьма сомнительна ввиду слабой прогнозируемости их влияния на уровень АД, регистрируемый во время нагрузочного тестирования, отсутствия быстро определяемых предикторов эффективности препаратов данной группы, доступных в условиях повседневной клинической практики. В то же время нельзя исключить, что подобно α1-адреноблокирующему эффекту у карведилола, дополнительное назначение антагонистов кальция, в частности амлодипина, в составе комбинированной терапии с β-адреноблокаторами способно оказать потенцирующее влияние на уровень АД, определяемого как в условиях покоя, так и при проведении нагрузочного тестирования.
Близкие по характеру гемодинамического действия антигипертензивные препараты, как следует из представленных материалов проведенного нами исследования, способны проявлять различную эффективность в отношении подавления гипертензивной реакции, возникающей во время нагрузочного тестирования. Более того, использование одного и того же препарата может сопровождаться различной степенью ее модификации в соответствии с характером изменений симпатовагального баланса.
Выводы
- В дозировках, обеспечивающих сопоставимый антигипертензивный эффект, препараты вазодилатирующего действия — ингибитор ангиотензинпревращающего фермента лизиноприл, антагонист рецепторов ангиотензина II эпросартан, антагонист кальция амлодипин и β-адреноблокатор карведилол (Акридилол®) — в равной мере уменьшают выраженность гипертензивной реакции, регистрируемой во время проведения изометрической нагрузочной пробы.
- Выраженное ослабление стресс-индуцированной гипертензивной реакции, возникающей в условиях динамической физической нагрузки, сопровождающееся значимым снижением как систолического, так и диастолического АД, достигалось только благодаря терапии β-, α1 -адреноблокатором карведилолом.
- Снижение регистрируемого при проведении велоэргометрической пробы максимального систолического АД при использовании других вазодилататоров — ингибитора ангиотензинпревращающего фермента лизиноприла, антагониста рецепторов ангиотензина II эпросартана, и антагониста кальция амлодипина, — ассоциировано с повышением вариабельности сердечного ритма.
- Терапия ингибитором ангиотензинпревращающего фермента лизиноприлом, антагонистом рецепторов ангиотензина II эпросартаном, антагонистом кальция амлодипином и β-адреноблокатором карведилолом характеризуется низким риском развития ортостатических гипотензивных состояний у пациентов, не имеющих их при проведении ортостатической пробы до назначения данных препаратов.
ЛИТЕРАТУРА
1. Henry J.P., Lia J., Meehan W.P. Psychosocial stress and experimental ингибиторов ангиотензинпревращающего фермента. Стhypertension. In:Laragh J.H., Brenner B.M. Hypertension, Pathophysiology, diagnosis, and management. New York:Raven Press, 1995:905—921.
2. Allison T.G., Cordeiro M.A., Miller et al. Prognostic significance of exercise—induced systemic hypertension in healthy subjects. Am J Cardiol 1999;83:371-375.
3. Lima E.G., Spritzer N., Herkenhoff .FL. et al. Noninvasive ambulatory 24-hour blood pressure in patients with high normal blood pressure and exaggerated systolic pressure response to exercise. J Hypertens 1995;26:1121— 1124.
4. Palatini P. Exaggerated blood pressure response to exercise: pathophysiologic mechanisms and clinical relevance. J Sports Med Phys Fitness 1998;38:1:1—9.
5. Шевченко О.П., Праскурничий Е.А., Стресс-индуцированная артериальная гипертония. М: Реафарм 2003;200.
6. Schrader J., Luders S., Dominiak P. Arbeit, Stress und Hypertonie.Hintergrund der STARLET-Studie. Munchen 2001:1—120.
7. Corti R., Binggeli C, Sudano I. et al. The beauty and the beastaspects of the autonomic nervous system. News in PhysiologicalSciences 2000;15:3:125—129.
8. Kjelsen S.E., Mundal R., Sandvik L. et al. A. Blood pressure reading during the physical exercise is prognostic risk factor of vascular death. J Hypertens 2001;19:1343-1348.
9. Праскурничий Е.А., Шевченко О.П., Макарова СВ., Жукова В.А. Антигипертензивная эффективность и влияние на показатели вариабельности ритма сердца β-адреноблокаторов карведилола и метопролола. Кардиология 2005;45:11:17—23.
10. Праскурничий Е.А. Вазодилататоры прямого действия (миотропные). В кн.: Рациональная фармакотерапия сердечно-сосудистых заболеваний. Под ред. Е.И. Чазова, Ю.Н. Беленкова. М: Литтерра 2004:83—87.
11. Беленков Ю.Н., Мареев В.Ю., Агеев Ф.Т. Ингибиторы ангиотензинпревращающего фермента в лечении сердечно-сосудистых заболеваний. М 2002;86.
12. Mimran A., Ribstein J. Angiotensin receptor blockers:pharmacology and clinical significans. J Am Soc Nephrol l999;10:273—277.
13. Корзун А.И., Кириллова М.В. Сравнительная ха рактеристика ингибиторов ангиотензинпревращающего фермента. Ст-Петербург 2003;28.
14. Преображенский Д.В., Сидоренко Б.А., Ива нова Н.А. и др. Вальсартан и другие блокаторы AT1- ангиотензиновых рецепторов: особенности клиниче ской фармакологии и опыт использования при лечении артериальной гипертензии. Артериальная гипертензия 2003;9:4:117—123.
15. Ohlstein E.H., Brooks D.P., Feurstein G.Z., Ruffolo R.R. Inhibitor of sympathetic outflow by the angiotensin II receptor antagonist, eprosartan, but not losartan, valsartan or irbesartan:relationship to differences in prejunctional angiotensin II receptor blockade. Pharmacology 1997;55:244—251.
16. Bottorff M.B., Tenero D.M. Pharmacokinetics or eprosartan in healthy subjects, patients with hypertension, and special populations. Pharmakotherapy 1999;19(4 Pt 2):73S—78S.
17. Blum R.A., Kazierad D.J., Tenero D.M. A review of eprosartan pharmacokinetic and pharmacodinamic drug interaction studies. Pharmakotherapy 1999;19 (4 Pt 2):79S— 85S.
18. Esler M., Jennings G., Korner P. et al. Measurement of total and organ—specific norepinephrine kinetics in humans. Am J Physiol 1984;247:E21—Е28.
19. Pagani M., Lombardi F. , Guzzetti S. et al. Power spectral analysis of heart rate and arterial pressure variabilities as a marker of sympathovagal interaction in man and conscious dog. Circ Res 1986;59:178—193.
20. Schafers R.F., Nurnberger J., Wenzel R.R. et al. Characterization of adrenoceptors mediating cardiovascular and metabolic in vivo effects of amethylnoradrenaline (AMN) in humans. Naunyn— Schmiedeberg’s Arch Pharmacol 1997;356 (Suppl 1):R52
21. Haria M., Wagstaff A.J. Amlodipine:a reappraisal of its pharmacological properties and therapeutic use in cardiovascular disease. Drugs 1995;50:560—586.
22. Burges R.A., Dodd M.G., Gardiner D.G. Pharmacologic profile of amlodipine. Am Heart J 1989;118:1100—1103.
23. Packer M., O’Connor C., Ghali J. et al. Effect of amlodipine on morbidity and mortality in severe chronic heart failure. New Engl J Med 1996;335:1107—1114.
