Свободнорадикальные процессы и их коррекция при шизофрении
СтатьиОпубликовано в журнале:
Психиатрия и психофармакотерапия, Том 15 № 3
С.Б.Болевич1,2, В.Л.Малыгин3, Е.В.Силина1,4, В.А.Орлов1,2
1 ГБОУ ВПО Первый МГМУ им. И.М.Сеченова Минздрава РФ; 2 ГКУЗ Психиатрическая клиническая больница №1 им. Н.А.Алексеева Департамента здравоохранения г. Москвы; 3 ГБОУ ВПО Московский государственный медико-стоматологический университет им. А.И.Евдокимова Минздрава РФ; 4 ОАО Реабилитационный центр для инвалидов «Преодоление» Резюме.
Целью исследования являлось улучшение результатов лечения больных шизофренией на основании оценки и коррекции свободнорадикального дисбаланса. В проспективное комплексное клинико-лабораторное исследование включено 58 мужчин в возрасте от 22 до 64 лет (средний возраст 39,71±10,41 года) с диагнозом шизофрении, установленным в соответствии с Международной классификацией болезней 10-го пересмотра. Выявлено, что при поступлении в стационар у больных шизофренией по сравнению с группой здоровых людей статистически значимо был снижен уровень базального показателя интенсивности хемилюминесценции в 1,99 раза (р<0,001), повышен уровень стимулированного зимозаном показателя интенсивности хемилюминесценции в 3,5 раза (р<0,001), перекисно-липидные маркеры окислительного стресса соответствовали норме. Наиболее выраженные нарушения свободнорадикальных процессов зарегистрированы у больных с непрерывным течением заболевания, а также при выраженной психопатологической симптоматике. 38 больных получали стандартную терапию, 20 пациентам дополнительно был назначен антиоксидант на основе янтарной кислоты мексидол. Назначение антиоксидантной терапии сопровождалось улучшением показателей свободнорадикальных процессов уже к 7-м суткам исследования по сравнению с группой стандартного лечения, а также более быстрым и качественным, опережающим группу сравнения, регрессом психопатологической симптоматики, что привело к сокращению сроков пребывания в стационаре.
Ключевые слова: шизофрения, свободнорадикальные процессы, оксидантный стресс, антиоксиданты.
Free radical processes and their correction in schizophrenia
S.B.Bolevich1,2, V.L.Malygin3, E.V.Silinа1,4, V.A.Orlov1,2
1 I.M.Sechenov First Moscow State Medical University
2 N.A.Alexeev Clinical Psychiatric Hospital №1, Moscow Healthcare Department
3 A.I.Yevdokimov Moscow State Medical Stomatological University
4 Rehabilitation Center “Preodolenie” Summary.
Key words: schizophrenia, free radical processes, oxidative stress, antioxidants.
Введение
Шизофрения – тяжелое хроническое инвалидизирующее заболевание, распространенность которого в мире составляет около 1% [1]. Основная гипотеза этиологии шизофрении заключается в разных комбинациях множества генов, каждый из которых вносит свой небольшой вклад, а также в разнообразии стимулов внешней среды, оказывающих влияние на развитие головного мозга как на ранних, так и на поздних стадиях [2–3]. Несмотря на то что конкретный механизм, лежащий в основе патогенеза шизофрении, остается невыясненным, оксидантный стресс, являющийся следствием нарушения контроля процессов окисления-восстановления, представляет собой привлекательную гипотезу [4–6].
Для количественной оценки антиоксидантной защиты при шизофрении наиболее часто используются ферменты антиоксидантной системы, такие как супероксиддизсмутаза, глутаматпероксидаза и каталаза, а также уровни витаминов Е и С [7–8]. Большинство исследователей констатируют снижение антиоксидантной защиты у пациентов с шизофренией [9–11], однако некоторые авторы сообщают о получении противоположных результатов [12–13]. Полученные расхождения могут быть связаны с разными методиками исследования, различиями в исследованном материале, воздействием нейролептиков, включением в исследование пациентов на различных стадиях и разной тяжести заболевания.
Цель настоящего исследования – улучшение результатов лечения больных шизофренией на основании оценки роли свободнорадикальных процессов (СРП) в возникновении, прогрессировании, течении и исходах заболевания.
Материалы и методы
Проведено проспективное комплексное клинико-лабораторное исследование 58 мужчин в возрасте от 22 до 64 лет (средний возраст составил 39,71±10,41 года) с диагнозом шизофрении, установленным в соответствии с критериями Международной классификации болезней 10-го пересмотра (при наличии в течение более 1 мес хотя бы 1 симптома первого ранга или не менее 2 симптомов второго ранга). Пациенты проходили обследование и лечение в 4-м отделении ГКУЗ Психиатрическая клиническая больница №1 им. Н.А.Алексеева. Длительность заболевания составляла от нескольких недель (первичные пациенты – 3,4%) до 32 лет (повторная госпитализация – 96,6%). Средняя продолжительность заболевания составила 13,86±10,38 года. До настоящей госпитализации пациентам была установлена 1-я группа инвалидности в 19,0% случаев, 2-я группа инвалидности – в 56,9%, 24,1% пациентов инвалидность не имели, причем 6,9% – работающие граждане.
У 62,1% пациентов отмечалось приступообразно-прогредиентное течение заболевания (F20.01), у 34,5% – непрерывное течение (F20.00), в 2 случаях тип не определен (3,4%). Преимущественно галлюцинаторно-параноидный приступ наблюдался у 29,3% больных, преобладание аффективно-бредовой симптоматики – у 70,7%. При поступлении средний балл по шкале PANSS (шкала позитивной и негативной симптоматики) составлял 93,1±16,2, по шкале BPRS (шкала продуктивной симптоматики) – 50,1±8,8, что свидетельствует об остроте заболевания на момент поступления в стационар.
При включении в исследование пациенты были рандомизированы на 2 группы. Группу сравнения составили 38 (65,5%) больных, получавших стандартную терапию. В основную группу вошли 20 (34,5%) больных, получавших антиоксидант на основе янтарной кислоты мексидол в составе стандартной терапии в дозе по 125 мг 3 раза в сутки внутрь ежедневно в течение 20 дней. Стандартная терапия включала в себя нейролептики, транквилизаторы, антидепрессанты, стабилизаторы настроения. Выбор препаратов и доз соответствовал преобладанию клинической симптоматики. При включении в исследование состав обеих групп был однороден (табл. 1).
Таблица 1. Распределение больных исследуемых групп по возрасту, типу течения, длительности заболевания, выраженности клинической симптоматики
| Группа сравнения (n=38) | Основная группа (n=20) | p | Всего (n=58) | |
| Возраст, лет | 38,89±11,48 | 41,25±8,02 | 0,389 | 39,71±10,41 |
| Тип течения шизофрении | ||||
| Приступообразно-прогредиентная | 26 (68,4%) | 10 (50%) | 0,17 | 36 (62,1%) |
| Непрерывно текущая | 10 (26,3%) | 10 (50%) | 0,07 | 20 (34,5%) |
| Не определен | 2 (5,3%) | 0 | 0,3 | 2 (3,4%) |
| Галлюцинаторно-параноидный синдром | 12 (31,6%) | 5 (25%) | 0,6 | 17 (29,3%) |
| Аффективно-бредовый синдром | 26 (68,4%) | 15 (75%) | 0,6 | 41 (70,7%) |
| Госпитализация | ||||
| первичная | 2 (5,3%) | 0 | 0,29 | 2 (3,4%) |
| повторная | 36 (94,7%) | 20 (100%) | 56 (96,6%) | |
| Оценка степени тяжести по шкалам | ||||
| PANSS (общий балл) | 96,1±17,8 | 89,2±10,9 | 0,092 | 93,1±16,2 |
| BPRS | 50,8±9,1 | 48,8±8,2 | 0,682 | 50,1 ±8,8 |
| ≤50 баллов | 22 (57,9%) | 5 (25%) | 0,02 | 27 |
| >50 баллов | 16 (42,1%) | 15 (75%) | 31 | |
Оценка состояния пациента выполнялась в динамике (на 1, 7 и 21-е сутки) на основе комплекса клинических, лабораторных, инструментальных методов исследования: 1) изучения анамнеза и жалоб; 2) клинического и психического состояния больного; 3) стандартизированной оценки психического состояния по шкалам PANSS и BPRS, проводившейся одним исследователем; 4) исследования СРП в плазме крови по показателям генерации активных форм кислорода (АФК) лейкоцитами – базальные (ПИХЛб) и стимулированные зимозаном (ПИХЛс) показатели интенсивности хемилюминесценции лейкоцитов, по показателям антиперекисной активности (АПА) вторичной плазмы, малонового диальдегида (МДА); 5) исследование общего и биохимического анализов крови и мочи.
Хемилюминесцентные показатели генерации АФК лейкоцитами крови исследовали на адаптированном для хемилюминометрии хемилюминометре ЛКБ «Wollac» (Швеция) при стандартной температуре 36,9°С. Определяли уровень ПИХЛб – спонтанной ХЛ в стандартном объеме взвеси лейкоцитов со стандартной их концентрацией (2500 в 1 мкл). После добавления неспецифического активатора (0,1 мл 1% раствора зимозана) определяли ПИХЛс. Рассчитывалась ХЛ лейкоцитов по формуле: ПИХЛ = максимальная ХЛ×106/количество гранулоцитов и моноцитов в исследуемом объеме лейкомассы. ПИХЛб – это интегральный показатель, характеризующий спонтанную ХЛ лейкоцитов без стимуляции, возникающую при поглощении ими микрочастиц, что сопровождается перестройкой окислительного метаболизма лейкоцитов и приводит к образованию АФК. ПИХЛс – стимулированная ХЛ, отражающая присутствие АФК в системе. Методика исследования АПА вторичной плазмы основана на измерении и сопоставлении показателей индуцированной перекисью водорода ХЛ плазмы и ее спонтанной ХЛ. Для определения АПА исследовалась спонтанная и индуцированная ХЛ вторичной плазмы. МДА – вторичный продукт свободнорадикального перекисного окисления липидов – определяли по методике, описанной J.Douest (1983). Исследуемые значения показателей СРП сравнивались с одноименными показателями здоровых людей, доноров.
Статистическая обработка результатов проводилась с применением программ Microsoft Excel и пакета статистического анализа данных SPSS 20.0 по стандартным критериям. Различия считались статистически значимыми при уровне ошибки p<0,05.
Результаты исследования и обсуждение
В ходе исследования выявлена и объективизирована роль СРП в развитии и течении шизофрении уже на 1-е сутки госпитализации. Так, у больных шизофренией при поступлении (включении в исследование) по сравнению с группой здоровых людей отмечалось статистически значимое снижение уровня ПИХЛб в 1,99 раза (р<0,001), повышение ПИХЛс в 3,5 раза (р<0,001). Показатели АПА вторичной плазмы и МДА в группах здоровых доноров и больных шизофренией не обнаруживали статистически значимых различий на 1-е сутки госпитализации (табл. 2). Полученные данные свидетельствуют о важной роли кислородного дисбаланса в головном мозге больных шизофренией при относительно сохранном перекисно-липидной деструкции и высокой защитной антиоксидантной активности.
Таблица 2. Показатели СРП у больных шизофренией при поступлении в стационар в сравнении с нормой
| ПИХЛб, мВ/с×106 L | ПИХЛс, мВ/с×106 L | АПА | МДА, мкМ/л | |
| Норма (n=33) | 63,3±5,0 | 435,8±32,5 | 4,11±0,22 | 2,92±0,17 |
| 62,5 | 469,85 | 3,64 | Ме=2,75 | |
| 41,6/80,3 | 307,5/564,4 | 3,21/4,97 | 2,52/3,70 | |
| Шизофрения (n=58) | 31,78±4,25 | 1524,15±234,76 | 3,84±0,21 | 3,28±0,16 |
| 21,71 | 947,7 | 3,95 | 3,18 | |
| 15,45/36,86 | 780,4/1672,0 | 2,83/4,47 | 2,36/4,02 | |
| p | *р<0,001 | *р<0,001 | р=0,907 | р=0,285 |
*Статистически значимое при p<0,05 отличие показателя по сравнению с нормой.
Выявлена тенденция к более высокому уровню ПИХЛб и ПИХЛс у больных с непрерывным течением шизофрении по сравнению с группой больных с приступообразно-прогредиентным течением. При оценке показателей СРП в зависимости от преобладающего синдрома не было обнаружено статистически значимых различий, также как и при оценке исследуемых показателей в зависимости от уровня тревоги по шкалам BPRS и PANSS, что указывает на отсутствие роли неспецифической активации симпатико-адреналовой системы, связанной со стрессом. В то же время выявлены статистически значимые различия по уровню МДА на момент поступления у больных в зависимости от степени выраженности психопатологической симптоматики, которая оценивалась по шкале PANSS. У больных с выраженной психопатологической симптоматикой и уровнем PANSS более 90 баллов отмечалось снижение уровня МДА в 1,38 раза (р<0,05). Это может быть свидетельством того, что более острые приступы шизофрении часто быстрее разрешаются с выходом в ремиссию, что сопровождается меньшей перекисной деструкцией клеток. Интересно отметить, что при попытке разделения больных по шкале BPRS относительно среднего уровня (до 50 баллов включительно и более 50 баллов) в группе с более высокими значениями уровень МДА в 1,2 раза выше. Корреляционный анализ выраженности симптоматики по шкалам PANSS и BPRS продемонстрировал высокий и статистически значимый уровень корреляции между шкалами (коэффициент корреляции Пирсона 0,86; р<0,001) (табл. 3).
Таблица 3. Показатели СРП у больных шизофренией в зависимости от степени тяжести, типа течения и синдромальной характеристики заболевания
| ПИХЛб, мВ/с×106 L | ПИХЛс, мВ/с×106 L | АПА | МДА, мкМ/л | |
| Тип течения шизофрении | ||||
| Приступообразно-прогредиентная | 36,08±6,15* | 1743,07±347,91* | 3,59±0,22 | 3,32±0,21 |
| 35,84 | 875,9 | 3,89 | 3,14 | |
| 9,91/55,86 | 548,0/2368,0 | 3,39/4,47 | 2,36/4,16 | |
| Непрерывно текущая | 23,67±3,42* | 1110,64±135,86* | 4,41 ±0,46 | 3,32±0,27 |
| 20,39 | 1094,35 | 3,95 | 3,28 | |
| 17,03/23,03 | 947,7/1241,0 | 3,64/6,07 | 2,25/4,02 | |
| Преобладающий синдром | ||||
| Аффективно-бредовый | 34,0±5,67* | 1593,14±316,25* | 3,98±0,26 | 3,42±0,2 |
| 23,83 | 875,9 | 4,03 | 3,28 | |
| 15,45/31,08 | 748,5/1672,0 | 3,11/4,47 | 2,36/4,09 | |
| Галлюцинаторно-параноидный | 26,32±4,61* | 1353,97±242,32* | 3,47±0,32 | 2,94±0,25 |
| 20,39 | 1050,0 | 3,73 | 3,28 | |
| 15,43/32,85 | 947,7/1820,0 | 3,18/3,95 | 2,25/3,28 | |
| Оценка степени тяжести по шкале BPRS | ||||
| BPRS≤50 | 34,34±8,51* | 1576,13±324,66* | 3,73±4,03 | 2,95±0,19 |
| 23,83 | 1346,0 | 4,0 | 2,69 | |
| 9,63/28,46 | 548,0/2331,0 | 2,72/4,47 | 2,25/3,6 | |
| BPRS>50 | 29,77±3,69* | 1482,93±337,91* | 4,19±0,19* | 3,57±0,25* |
| 20,39 | 947,7 | 3,95 | 4,02 | |
| 17,03/42,76 | 875,9/1241,0 | 3,64/4,2 | 2,96/4,23 | |
Полученные данные свидетельствуют о том, что кислородный дисбаланс не связан со степенью тяжести и типом шизофрении, в то время как определяющим является маркер перекисно-липидной деструкции – МДА.
Выявленные изменения свободнорадикального гомеостаза свидетельствуют о целесообразности антиоксидантной терапии больных шизофренией. Для коррекции окислительного стресса мы применяли отечественный оригинальный антиоксидант на основе янтарной кислоты мексидол (2-этил-6-метил-3-гидроксипиридина сукцинат). Мексидол – препарат с поликомпонентным, мультитаргетным механизмом действия, обладающий антиоксидантной, мембранотропной, энергокорригирующей активностью [14–16]. Препарат оказывает влияние на разные звенья СРП в биомембранах и внутри клетки: ингибирует процессы перекисного окисления липидов, активно реагирует с первичными и гидроксильными радикалами пептидов; снижает повышенный при патологии уровень NO в мозге, а также повышает активность антиоксидантных ферментов, в частности супероксиддисмутазы и глутатионпероксидазы [14, 16–18]. Анализ механизма реализации анксиолитического действия мексидола показал, что мексидол не обладает способностью связываться с бензодиазепиновыми и ГАМК-рецепторами, однако обладает способностью усиливать связывание меченого диазепама с бензодиазепиновыми рецепторами. Таким образом, не обладая прямым аффинитетом к бензодиазепиновым и ГАМК-рецепторам, мексидол оказывает на них модифицирующее действие, усиливая их способность к связыванию [14, 15].
Анализ динамики (на 1, 7 и 21-е сутки лечения) маркеров окислительного стресса у больных шизофренией выявил, что в группе стандартной антипсихотической терапии к 21-м суткам отмечалось значимое повышение уровня ПИХЛб в 1,14 раза (p<0,048). В группе, дополнительно получавшей мексидол, также отмечалась значимое повышение ПИХЛб уже к 7-м суткам терапии (р=0,025). В обеих группах в течение всего периода исследования сохранялись значимые отличия ПИХЛб и ПИХЛс по сравнению с нормой, что указывает на выраженный дисбаланс СРП у больных шизофрений на фоне лечения и положительной динамики клинической симптоматики. Это подтверждает участие АФК в патогенезе шизофрении.
Уровень АПА не отличался от нормы в обеих группах на 1,7 и 21-е сутки, однако в группе, получавшей стандартную антипсихотическую терапию, наблюдалось постепенное повышение АПА, которая достигала статистически значимых отличий от исходных показателей к 21-му дню исследования в 1,13 раза (р=0,049) (рис. 1).
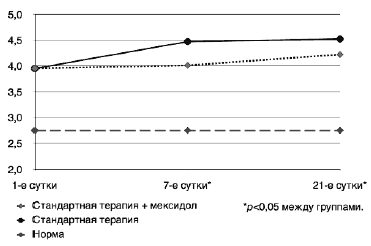
Рис. 1. Динамика уровня АПА.
По уровню МДА на 1-е сутки значимых различий не было выявлено как между группами, так и в группах по сравнению с нормой. В то же время на фоне лечения к 7-м суткам отмечалось значительное снижение уровня МДА в группе, получавшей мексидол, по сравнению с группой стандартного лечения в 1,7 раза (p<0,001). В группе пациентов, получавших мексидол, отмечалась статистически значимая динамика уровня МДА в ходе исследования со снижением показателя в 1,69 раза к 7-му дню лечения (p=0,001) и увеличением концентрации МДА в крови в 1,1 раза с 7-го по 21-й день (p=0,001). При сравнении уровня МДА на 1 и 21-е сутки в группе мексидола также обнаружено статистически значимое снижение уровня МДА более чем в 1,5 раза (р=0,035). К 21-му дню отмечается возвращение уровня МДА к нормальному уровню как в группе, получающей стандартную терапию, так и в группе, дополнительно получавшей мексидол, причем в группе мексидола уровень МДА был недостоверно ниже нормы (рис. 2).
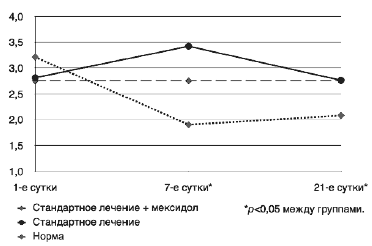
Рис. 2. Динамика уровня МДА.
На фоне лечения в обеих группах отмечалась выраженная положительная динамика по шкалам BPRS и PANSS, что демонстрирует эффективность проводимой терапии. Наиболее выраженная динамика отмечалась по подшкале продуктивной симптоматики PANSS (PANSSпрод). В группе сравнения регресс к 21-му дню по PANSSпрод в среднем составил 14 баллов, в группе антиоксидантной терапии – 18 баллов. К 21-м суткам уровень продуктивной симптоматики составил 10,29±3,21 и 8,77±4,38 балла в группе стандартной терапии и в группе антиоксидантов соответственно (р<0,05). Аналогичная картина зарегистрирована при оценке негативной симптоматики (PANSSнег). В группе сравнения темп регресса был наибольшим в период 1–7-е сутки исследования, в то время как в основной группе отмечалось стойкое кумулирующее снижение негативной симптоматики в среднем на 14 баллов к 21-м суткам (р<0,05). При оценке выраженности общей психопатологической симптоматики по PANSS (PANSSобщ) к 21-м суткам исследования также выявлено достоверное положительное влияние дополнительного назначения сукцината в составе стандартного лечения шизофрении (р<0,05). Динамика выраженности психопатологической симптоматики по шкале BPRS демонстрировала стойкую положительную динамику со снижением в среднем в группе сравнения на 10 баллов к 7-м и на 12 баллов к 21-м суткам, в основной группе – на 12 баллов к 7-м и на 16 баллов к 21м суткам (р<0,05), как это представлено в табл. 4.
Таблица 4. Динамика клинических показателей по результатам оценки по шкалам PANSS и BPRS у больных шизофренией.
| Показатель | 1-е сутки | 7-е сутки | 21-е сутки | |||
| Группа сравнения | Основная группа | Группа сравнения | Основная группа | Группа сравнения | Основная группа | |
| PANSS прод | 25,54±5,43 | 26,33±6,30 | 19,91 ±6,26 | 18,73±4,42 | 10,29±3,21* | 8,07±4,38* |
| PANSS нег | 25,80±2,91 | 27,68±8,53 | 20,37±3,85 | 23,60±7,82 | 15,86±5,67* | 12,29±7,79* |
| PANSS общ | 49,42±3,55 | 51,77±6,93 | 35,54±5,66 | 35,12±8,70 | 22,57±4,53* | 18,46±8,19* |
| BPRS | 50,68±5,95 | 50,99±8,19 | 40,1 ±6,59 | 39,75±9,73 | 38,29±2,14* | 34,38±9,68* |
Таким образом, дополнительное назначение антиоксидантной терапии сопровождалось более быстрым регрессом симптоматики и сокращением пребывания пациентов в стационаре в среднем на 4 дня. Средний койко-день в группе сравнения составил 56,5±4,68 (от 25 до 132 сут, Ме=61 день), а в группе антиоксидантов – 52,1±8,12 (от 12 до 93 сут, Ме=56 дней).
Заключение
Проведенное исследование демонстрирует участие СРП в патогенезе шизофрении. Наиболее выраженные и значимые нарушения СРП зарегистрированы у больных с непрерывным течением заболевания. Полученные данные объективизируют целесообразность антиоксидантной терапии в комплексе лечения данного заболевания. Назначение антиоксиданта мексидола в дозе 125 мг 3 раза в сутки внутрь ежедневно в течение 20 дней сопровождалось улучшением показателей СРП уже к 7-м суткам исследования по сравнению с группой сравнения, а также более быстрым и качественным, опережающим группу сравнения, регрессом психопатологической симптоматики, что привело к сокращению сроков пребывания в стационаре и улучшению результатов лечения.
Литература
- PerКlК J, Suvisaari J, Saarni SI et al. Lifetime prevalence of psychotic and bipolar I disorders in a general population. Arch Gen Psychiatry 2007; 64: 19–28.
- Голимбет В.Е. Молекулярно-генетический подход к клинической и нозологической дифференциации шизоаффективного психоза. Журн. неврологии и психиатрии им. С.С.Корсакова. 2010; 110 (10): 48–52.
- Jaaro-Peled H, Hayashi-Takagi A, Seshadri S et al. Neurodevelopmental mechanisms of schizophrenia: understanding disturbed postnatal brain maturation through neuregulin-1-ErbB4 and DISC. Trends Neurosci 2009; 32: 485–95.
- Наумова А.И. Влияние позитивной и негативной симптоматики больных параноидной шизофренией на показатели, характеризующие окислительный стресс. Всероссийская 70-я итоговая научная студенческая конференция им. Н.И.Пирогова (Томск, 16–18 мая 2011 г.): сб. статей. Под ред. В.В.Новицкого, Л.М.Огородовой. Томск: Изд-во Сиб. гос. мед. ун-та, 2011; с.67–8.
- Matsuzawa D, Hashimoto K. Magnetic resonance spectroscopy study of the antioxidant defense system in schizophrenia. Antioxid Redox Signal 2011; 15 (7): 2057–65.
- Zhang M, Zhao Z, He L et al. A meta-analysis of oxidative stress markers in schizophrenia. Sci China Life Sci 2010; 53: 112–24.
- Колесниченко Е.В., Вильянов В.Б., Захарова Н.Б. и др. Исследование показателей перекисного окисления липидов и Fas-зависимого апоптоза у больных шизофренией. Биологические основы индивидуальной чувствительности к психотропным средствам: материалы международной конференции. М., 2006; с. 40.
- Dadheech G, Mishra S, Gautam S. Oxidative stress, alphatocopherol, ascorbic acid and reduced glutathione status in schizophrenics. Indian J Clin Biochem 2006; 21 (2): 34–8.
- Ben Othmen L, Mechri A, Fendri C et al. Altered antioxidant defense system in clinically stable patients with schizophrenia and their unaffected siblings. Prog Neuropsychopharmacol Biol Psychiatry 2008; 32 (1): 155–9.
- Sivrioglu EY, Kirli S, Sipahioglu D et al. The impact of omega-3 fatty acids, vitamins E and C supplementation on treatment outcome and side effects in schizophrenia patients treated with haloperidol: an open-label pilot study. Prog Neuropsychopharmacol Biol Psychiatry 2007; 31 (7): 1493–9.
- Zhang X, Zhou D, Cao L et al. The effects of Ginkgo biloba extract added to haloperidol on peripheral T cell subsets in drug-free schizophrenia: a double-blind, placebo-controlled trial. Psychopharmacology (Berl) 2006; 188 (1): 12–7.
- Michel TM, Thome J, Martin D et al. Cu, Zn- and Mn superoxide dismutase levels in brains of patients with schizophrenic psychosis. J Neural Transm 2004; 111 (9): 1191–201.
- Rukmini M, D’Souza B, D’Souza V. Superoxide dismutase and catalase activities and their correlation with malondialdehyde in schizophrenic patients. Indian J Clin Biochem 2004; 19 (2): 114–8.
- Воронина Т.А. Мексидол: спектр фармакологических эффектов. Журн. неврологии и психиатрии. 2012; 12: 86–90.
- Воронина Т.А. Мексидол. Основные нейропсихотропные эффекты и механизм действия. Фарматека. 2009; 180 (6): 1–4.
- Щулькин А.В. Влияние мексидола на развитие феномена эксайтотоксичности нейронов in vitro. Журн. неврологии и психиатрии. 2012; 2: 35–9.
- Кузнецов Ю.В., Матюшин И.А., Смирнов Л.Д., Яснецов В.В. Исследование антиокислительной активности новых аналогов этилметилгидроксипиридина сукцината и производных гидроксипиридидобензимидазола. Вестн. новых мед. технологий. 2006; XIII (3): 9–10.
- Bashkatova V, Narkevich V, Vitskova G, Vanin A. The influence of anticonvulsant and antioxidant drugs on nitric oxide level and lipid peroxidation in the rat brain during penthylenetetrazole-induced epileptiform model seizures. Prog Neuropsychopharmacol Biol Psychiatry 2003; 27: 487–92.
Сведения об авторах
Орлов Владимир Алексеевич – аспирант каф. патологии человека фак. послевузовского профессионального образования врачей ГБОУ ВПО Первый МГМУ им. И.М.Сеченова Минздрава РФ, зав. отд-нием ГКУЗ Психиатрическая клиническая больница №1 им. Н.А.Алексеева Департамента здравоохранения г. Москвы.
Силина Екатерина Владимировна – д-р мед. наук, доц. каф. патологии человека фак. послевузовского профессионального образования врачей ГБОУ ВПО Первый МГМУ им. И.М.Сеченова Минздрава РФ, научный консультант РЦ для инвалидов «Преодоление», г. Москва.
Болевич Сергей Бранкович – д-р мед. наук, проф., зав. каф. патологии человека фак. послевузовского профессионального образования врачей ГБОУ ВПО Первый МГМУ им. И.М.Сеченова Минздрава РФ.
Малыгин Владимир Леонидович – д-р мед. наук, проф., зав. каф. психологического консультирования, психокоррекции и психотерапии ГБОУ ВПО Московский государственный медико-стоматологический университет им. А.И.Евдокимова Минздрава РФ.
