Место локальной терапии в лечении остеоартроза
Статьи Статья опубликована в журнале«Медицинский совет», 2011, № 7–8, с. 117–120 Алексеева Л.И.
Остеоартроз является самой распространенной формой поражения суставов и одной из главных причин нетрудоспособности, вызывающей ухудшение качества жизни и значительные финансовые затраты, особенно у пожилых людей.
Учитывая сложные патогенетические механизмы развития остеоартроза, в настоящее время применяется комплексный подход к лечению данной нозологии, в котором симптоматическая терапия, направленная на купирование боли и воспаления, является достаточно важным звеном.
Значительно чаще при остеоартрозе используются аппликации средств, содержащих НПВП. К ним относятся мази, гели, спреи, эмульсии и пластыри. Наиболее часто применяются гели, т.к. их гидрофильная основа обеспечивает более быстрое всасывание активных компонентов препарата в ткани.
При амбулаторном наблюдении пациентов большое внимание уделяется ранней диагностике предартрозных изменений, что дает возможность своевременной консервативной коррекции патологических изменений в суставе. Лечение пациентов направлено на уменьшение боли и воспаления, снижение частоты обострений и поражения новых суставов, улучшение качества жизни, замедление прогрессирования и предотвращение инвалидности. Однако в основном амбулаторные приемы таких пациентов ведут врачи–хирурги, т.к., к сожалению, не во всех поликлиниках и амбулаториях работают специалисты–ревматологи.
В связи с вышеизложенным, по нашему мнению, предлагаемая статья будет интересна хирургам.
Остеоартроз относится к группе заболеваний с очень высокой частотой инвалидизации. Риск утраты трудоспособности у больных гонартрозом сравним с таковым у лиц пожилого возраста с сердечно–сосудистыми заболеваниями. На сегодняшний момент остеоартроз пока неизлечим, но рационально подобранная терапия помогает уменьшить его основные проявления.
Остеоартроз (ОА) – заболевание, возникающее при взаимодействии различных механических и биологических факторов, нарушающих существующее в норме равновесие между процессами деградации и синтеза всех компонентов матрикса суставного хряща.
При этом в патологический процесс вовлекается не только хрящ, но и субхондральная кость, синовиальная мембрана, капсула, связки и периартикулярные мышцы, т.е. все ткани сустава. ОА обычно развивается в пожилом возрасте, у людей старше 65 лет. Для данного заболевания характерно медленное, прогрессирующее течение с постепенным развитием нарушений функций суставов, приводящих к ограничению двигательной активности больного.
При ОА чаще поражаются тазобедренные и коленные суставы, поясничный и шейный отделы позвоночника, а также суставы кистей и стоп.
Основным клиническим симптомом ОА является боль. В начале болезни после значительной физической нагрузки периодически возникают боли механического характера, которые быстро проходят в покое. Однако по мере прогрессирования ОА интенсивность боли увеличивается, она не проходит после отдыха и появляется в ночные часы. Помимо боли также наблюдается утренняя скованность, являющаяся признаком вторичного синовита. При ОА также отмечается небольшая крепитация в пораженном суставе. При прогрессировании заболевания в связи с наличием боли и появлением рефлекторного спазма мышц может возникать ограничение движений в пораженном суставе вплоть до образования сухожильно–мышечных контрактур.
Лекарственная терапия больных ОА должна быть направлена на уменьшение боли, сохранение функции сустава и качества жизни.
Наиболее часто для лечения ОА применяют нестероидные противовоспалительные препараты (НПВП), однако их использование ограничено из–за нежелательных явлений, нередко возникающих со стороны желудочно–кишечного тракта, сердечно–сосудистой системы, особенно у лиц пожилого возраста, имеющих различные сопутствующие заболевания и принимающих другие лекарственные препараты. В связи с этим перспективным является применение локальной противовоспалительной терапии.
Различают следующие методы локальной терапии остеоартроза:
- аппликационные;
- внутрисуставные;
- физиотерапевтические.
Наружные лекарственные средства существуют в виде 3–х форм: твердые (присыпки), жидкие (растворы, рапы) и мягкие (мази, гели, линименты, эмульсии, кремы, пасты, пластыри).
Мазевые основы могут быть липофильными (мази, линименты, пасты), гидрофильными (гели) и липофильно–гидрофильными (эмульсии). Препараты, содержащие в своем составе НПВП, оказывают противовоспалительное действие.
Местные средства в виде мазей, кремов, гелей на основе НПВП назначают при невозможности перорального их приема либо при изолированном суставном поражении, что позволяет избежать системных побочных реакций, особенно у пожилых больных. Локальные формы НПВП могут сочетаться с пероральными, что позволяет уменьшить дозировки последних. Местное применение НПВП эффективно и при заболеваниях мягких тканей опорно–двигательного аппарата. Доказано, что локальные НПВП реже вызывают нежелательные реакции по сравнению с их пероральным приемом.
Достижение высокой концентрации активного вещества в пораженном участке при более низкой его концентрации в плазме крови позволяет значительно снизить развитие системных нежелательных явлений. Основанием для использования локальных НПВП являются исследования на модельных животных и людях, которые показали наличие более низких уровней НПВП в плазме крови при местном применении, составляющих от 1 до 10% концентраций, которые достигаются при их системном приеме.
Вместе с тем для локальных форм НПВП существуют специальные требования. Применяемый препарат должен быть эффективным, не вызывать местных токсических и аллергических реакций, достигать органа–мишени. Концентрация препарата в сыворотке не должна достигать уровня, при котором возникают зависимые от дозы побочные эффекты, а его метаболизм и выведение должны быть такими же, как при системном применении [1]. При местном лечении НПВП необходимо учитывать состояние кожи на участке нанесения препарата. При наличии ран, ссадин, дерматозов, экзем применение этих средств противопоказано.
Степень проникновения препарата зависит от его липофильности и правильного увлажнения рогового слоя эпидермиса, а также от барьерной функции кожных покровов (перепад градиентов рН) [2]. Клинический эффект данных средств определяется концентрацией действующего вещества, оптимальной терапевтической дозой, обеспечивающей анальгетический и противовоспалительный эффект.
Таким образом, количество наносимого препарата зависит от величины сустава:
- на область крупных суставов (тазобедренные, коленные, плечевые) наносится полоска мази или геля длиной от 5 до 10 см (3–4 г);
- на область средних суставов (голеностопные, лучезапястные, локтевые) – от 3 до 5 см (1,5–2 г);
- на область мелких суставов кистей и стоп – 1–2 см (0,5–1 г).
Также важны длительность применения препарата и соблюдение кратности аппликаций. Данные некоторых клинических исследований [3] показали, что минимальным является 4–кратное нанесение локального средства в сутки, а при активном воспалении – до 5–6 раз в сутки. Лучшее всасывание происходит через кожу, имеющую температуру чуть выше физиологической, поэтому для более быстрого поступления препарата, особенно у лиц пожилого возраста со сниженной проницаемостью кожи, рекомендуется в течение 3–5 мин. согреть участок кожи над суставом перед нанесением мази.
Несмотря на довольно большое число исследований эффективности локальной терапии, до сих пор обсуждается вопрос: истинное ли это фармакологическое действие или эффект плацебо?
Результаты мета–анализа 86 исследований, проведенных R.A. Moore и соавт. [4] (более 10 160 больных, НПВП для местного применения сравнивались с плацебо, другими НПВП для местного использования или НПВП для перорального приема), свидетельствуют, что локальные НПВП значимо превосходят плацебо по эффективности. Следует отметить, что этот обзор касался только исследований, в которых боль являлась клиническим исходом при острых (травма мягких тканей, растяжения и вывихи) или хронических заболеваниях (остеоартрит и ревматизм). Было показано, что при острых болях местное лечение эффективнее плацебо уже на 1–й нед., при хронических – через 2 нед. терапии (рис. 1). Нежелательные явления – как местные (3,6%), так и системные (0,5%) – встречались редко и были сопоставимы с плацебо. К аналогичным выводам пришли авторы систематического обзора по локальной терапии хронической боли (2004) [5].
J. Lin и соавт. [6] на основании мета–анализа рандомизированных контролируемых сравнительных исследований локальных НПВП с плацебо или с пероральными НПВП получили иные результаты. Они проанализировали работы по лечению больных с клиническими и рентгенологическими проявлениями ОА. В большинстве из них продолжительность лечения составляла 2 нед., а работы с длительностью терапии более 4 нед. отсутствовали. Мета–анализ показал, что лечебный эффект локальных НПВП был ярко выражен в течение первых 2 нед. их применения, в дальнейшем сохранялся на том же уровне, а через месяц был сопоставим с плацебо.
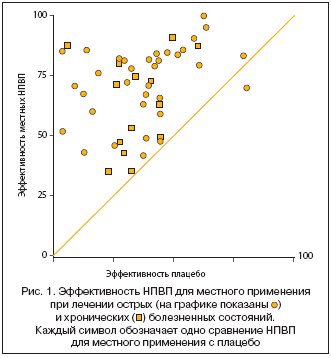
Возможно, эффективность локального НПВП зависит от длительности его применения либо, что более вероятно, от вида используемого препарата (диклофенак, ибупрофен или др.). Авторы мета–анализа сделали вывод, что в настоящее время собрано недостаточно данных о большей эффективности длительного использования локальной терапии. Для того чтобы оценить эффективность локальной терапии, необходимы длительные исследования в течение месяцев (а не недель) и использование для сравнения одного и того же препарата.
В рандомизированных контролируемых исследованиях локальных НПВП была отмечена низкая частота развития системных нежелательных явлений или их полное отсутствие. У 1–2% больных наблюдались местные кожные реакции, обычно ассоциирующиеся с препаратами для местного применения (эритема, зуд, раздражение, ощущение тепла или жжения и контактный дерматит), которые, как правило, не требовали дополнительной терапии и проходили самостоятельно.
В настоящее время имеется большое разнообразие противовоспалительных препаратов с различной концентрацией НПВП.
Нимесулид используется для лечения различных воспалительных заболеваний, болей и лихорадки. После перорального применения у здоровых добровольцев нимесулид (таблетка 100 мг) быстро всасывался и распределялся. Максимальная концентрация (Cmax) препарата составляла от 2,86 до 6,50 мг/л, время до достижения максимальной концентрации (tmax) – 1,22–2,75 ч после применения. Средний период полувыведения варьировался от 1,80 до 4,73 ч. Стабильный уровень концентрации достигался в течение 24–48 ч при ежедневном пероральном или ректальном приеме 2 раза/сут. [7].
Большое количество рандомизированных двойных слепых контролируемых клинических исследований, проведенных на взрослых пациентах, показали, что нимесулид для перорального приема более эффективен, чем плацебо, и как минимум одинаково эффективен по сравнению с другими коммерческими НПВП при лечении боли и воспаления, связанных с ОА, тромбофлебитом, стоматологическими операциями, раком и травмами и т.д.
Основным преимуществом перорального приема нимесулида является его лучшая по сравнению с другими НПВП переносимость. В частности, при применении нимесулида намного реже развивались желудочно–кишечные побочные эффекты, что, вероятно, связано с его селективностью к ЦОГ–2. Слабая кислотность молекулы (рКа 6,5) также может способствовать его относительно хорошей желудочной переносимости в связи с отсутствием расщепления посредством окислительного фосфорилирования. Механизмы действия нимесулида представлены в таблице 1.

Найз гель является новой лекарственной формой нимесулида для местного применения, эффективного при многих воспалительных заболеваниях, в т.ч. мышечно–скелетных заболеваниях, и с благоприятным профилем переносимости по сравнению с другими часто используемыми препаратами.
Противовоспалительная активность местной лекарственной формы нимесулида подтверждена на различных моделях воспаления у животных. Нимесулид гель обладал равной эффективностью с диклофенаком и кетопрофеном.
В исследовании F. Erdogan и соавт. [8], проведенном на 34 добровольцах с болями в коленных суставах, сравнивали концентрацию препарата в синовиальной жидкости, полученной при артроскопии, и в плазме крови при пероральном приеме нимесулида или местном применении геля. Было показано, что при местном нанесении нимесулид проникает трансдермально и присутствует в синовиальной жидкости в концентрации 22,1±10,5 нг/мл. Средняя концентрация нимесулида в плазме крови после местного нанесения составила почти 50% от концентрации нимесулида в синовиальной жидкости (11,8±3,0 нг/мл). В группе перорального приема нимесулида концентрация препарата оказалась в 300 раз выше в плазме крови (3631,9 нг/мл) и в 100 раз выше в синовиальной жидкости (2080,7 нг/мл). Эти результаты подтверждают, что при местном нанесении концентрация препарата в плазме очень мала по сравнению с пероральным введением, что, видимо, объясняет редкость возникновения системных побочных эффектов при местном лечении.
Вторая часть исследования проводилась на 63 больных ОА (51 женщина и 12 мужчин, средний возраст – 54,7±14,0 года). При местном применении геля наблюдалось значительное улучшение всех составляющих индекса WOMAC (Western Ontario and Mc–Master Universities Arthrose), в частности, уменьшение боли, скованности и улучшение функции суставов. Все 63 пациента завершили исследование, серьезных побочных эффектов не было, только один больной сообщил о местном раздражении кожи в месте нанесения геля, что не повлияло на общую удовлетворенность лечением этого пациента.
Таким образом, трансдермальные терапевтические системы являются перспективными средствами для лечения болевого синдрома, особенно при ОА. При их применении поддерживается постоянная концентрация активного вещества в крови между аппликациями и отмечается более низкое содержание препарата в плазме по сравнению с его пероральным приемом, что обусловливает хорошую переносимость и отсутствие системных нежелательных реакций [9,10].
В нашей стране за последние годы были проведены исследования эффективности и переносимости Найз геля. Изучение эффективности геля у больных ОА, проведенное в Туле [В.Н. Сороцкая и соавт.], показало, что через 2 нед. применения геля выраженность боли в коленных суставах снизилась на 21,5%, а тяжесть состояния здоровья уменьшилась на 21,93% относительно этих показателей до лечения. Переносимость проводимой локальной терапии Найз гелем была удовлетворительной (18 больных) и хорошей (12 больных). Следует отметить, что на фоне местного лечения у 9 больных снизилась потребность в пероральном приеме НПВП.
Локальные НПВП обладают эффективностью и при других мышечно–скелетных болях, что подтверждают результаты исследования Р.М. Балабановой и соавт., показавшего достоверное позитивное влияние Найз геля на выраженность боли в комплексной терапии ревматоидного артрита. Были отмечены быстрота и длительность эффекта (время наступления обезболивающего эффекта колебалось от 15 до 30 мин., а длительность – от 30 мин. до 6 ч), противовоспалительное действие препарата и хорошая переносимость. Эффективность Найз геля была продемонстрирована в комплексной терапии синдрома острой люмбалгии [В.Н. Батуев и соавт.] у 83 больных (45 женщин и 38 мужчин, средний возраст – 34,5±3 года).
Таким образом, локальную терапию можно использовать в качестве хорошего дополнительного метода лечения болей не только при ОА, но и при других мышечно–скелетных поражениях. Однако для получения более четких доказательств эффективности такого метода лечения необходимы более многочисленные и длительные наблюдения.
1. Насонова В.А., Муравьев Ю.В., Кузьмина Н.Н. Локальная терапия суставного синдрома кремом Долгит или системное применение нестероидных противовоспалительных препаратов // Терапевтический архив. – 1998. – № 11. – С. 65–66.
2. Хитров Н.А., Цурко В.В., Семочкина Е.Н. Локальная терапия остеоартроза // Лечащий врач. – 2002. – № 03.
3. Насонова В.А., Муравьев Ю.В., Насонов Е.Л., Чичасова Н.В., Цветкова Е.С., Бадокин В.В., Лесняк О.М. Многоцентровая оценка эффективности и переносимости локальной терапии кремом Долгит у больных остеоартрозом // Терапевтический архив. – 1995. – № 6. – С. 48–50.
4. Moore R.A., Tramer M.R., Carroll D., Wiffen P.J., McQuay H.J. Quantitative systematic review of topically applied non–steroidal anti–inflammatory drugs // BMJ. 1998; 316: 333–338.
5. Mason L., Moore R.A., Derry S., Edwards J.E., McQuay H.J. Systematic review of topical for the treatment of chronic pain // BMJ 2004, 328: 991–4.
6. Lin J., Zhang W., Jones A., Doherty M. Efficacy of topical non–steroidal anti–inflammatory drugs in the treatment of osteoarthritis: meta–analysis of randomized controlled trials // BMJ 2004, 329: 324–6.
7. Bernareggi A. Clinical pharmacokinetics of nimesulide // Clin Pharamacokinetic. 1998; 35:247–274.
8. Erdogan F., Erdun H., Gokay N.S. et al. The diffusion jf nimesulide gel synovial fluid: a comparision between administration routes // Internat J Clin Pharmacol&Therapeut, 2006; 44:270–275.
9. Mako S., Stampf G. [Transdermal therapeutic systems]. // Acta Pharm Hung. 2001 Oct; 71 (3): 293–9.
10. Berti J.J., Lipsky J.J. Transcutaneous drug delivery: a practical review // Mayo Clin Proc. 1995 Jun; 70 (6):581–6.
Комментарии
ПРАКТИКА ПЕДИАТРА
