Химиотерапия первой линии с использованием еженедельного введения паклитаксела и карбоплатина при распространенном раке яичников: исследование Фазы I
СтатьиОпубликовано в журнале: Gynecologic Oncology, 85: 321-326 (2002)
Х. Сехули1, Д. Стенгел2, Д. Эллинг3, О. Ортманн4, Й. Бломер1, Х. Рейсс5 и В.
Лихтенеггер1, Исследовательская группа по раку яичников Северо-Германского общества гинекологической онкологии (NOGGO) 1Отделение гинекологии и акушерства, Университетская больница Чарите Вирхов, Берлин, Германия; 2Институт клинической экономики, отдел хирургии травм, Университет Эрнст Мориц Арндта, Графсвальд, Германия; 3Отдел гинекологии и акушерства, Больница Оскар Зиетен, Берлин, Германия; 4Отдел гинекологии и акушерства, Университетская больница, Любек, Германия; 5Отдел медицинской онкологии и гематологии. Университетская больница, Чарите Вирхов, Берлин, Германия Получено 18 октября 2001 г.
Цели.
Монотерапия карбоплатином и паклитакселом при еженедельном введении может безопасно и эффективно использоваться для лечения рака яичников. Мы провели многоцентровое испытание по фазе I с целью определения максимальной переносимой дозы при их еженедельном комбинированном применении.
Методы.
Мы включили в испытание 21 больную с первичным, удаленным хирургически распространенным раком яичников (FIGO III/IV) и средним возрастом 59 лет (интервал от 35 до 79 лет). При фиксированной дозе паклитаксела, составлявшей 100 мг/м2, карбоплатин применяли в дозах, обеспечивающих площадь под кривой равную 2,0 (6 больных), 2,5 (7 больных) и 3,0 (8 больных), соответственно. Схема лечения включала шесть курсов еженедельного введения с последующим двухнедельным перерывом и затем еще шесть курсов. После перерыва в лечении продолжительностью в 28 дней проводили еще три курса.
Результаты.
На первом дозовом уровне токсичности, ограничивающей дозу, обнаружено не было. У трех больных развилась токсичность, ограничивающая дозу (тромбоцитопения, нейтропеническая лихорадка и нейропатия степени 3), при введении карбоплатина с AUC 2,5. Еще у трех больных токсичность, ограничивающая дозу, развилась при максимальной дозе карбоплатина, причем у двух из этих больных отмечалась устойчивая к лечению тромбоцитопения, а еще у одной больной отмечалась нейтропеническая лихорадка, несмотря на профилактическое использование гранулоцитного колониестимулирующего фактора. Алопеция была отмечена у 18 больных. Нейтотоксичность обычно имела легкий или умеренный характер. Значения СА125 нормализовались (<35 ед./мл) у 13 из 19 больных (68%) к концу лечения. У 16 из 19 больных наблюдался 50%-ный ответ на лечение.
Выводы.
Еженедельное введение карбоплатина в комбинации с паклитакселом представляет собой хорошо переносимую схему у больных с первичным распространенным раком яичников. Рекомендованная доза для исследований по фазе II для паклитаксела составляет 100 мг/м2, а доза карбоплатина составляет 2,0 AUC.
Ключевые слова:
новообразования в яичниках, паклитаксел, карбоплатин, максимальная переносимая доза, клинические испытание фазы I; протоколы противоопухолевой комбинированной химиотерапии.
Адрес для переписки: Department of Gynecology and Obstetrics, Charite Virchow University Hospital, Augustenburger Platz 1, 13353 Berlin, Germany. Fax: +49 30 450564904. E-mail: sehouli@aol.com
ВВЕДЕНИЕ
Лечение рака яичников первой линии состоит из агрессивного хирургического вмешательства с последующей адъювантной химиотерапией (1-3). Стандартный подход включает использование комбинаций паклитаксела и препарата платины один раз в три недели (4-7). Предполагается, что платина соединяет соседние основания в тяжах ДНК, что приводит к образованию поперечных сшивок и нарушает репликацию ДНК. Это происходит даже в покоящихся клетках.
Паклитаксел оказывает свой противоопухолевый эффект за счет стабилизации микротрубочек и синхронизации клеток в G2/М фазе клеточного цикла, что увеличивает их чувствительность к цитотоксическим агентам (8). Таким образом, оба препарата действуют синергично по отношению друг к другу в отношении солидных злокачественных опухолей. Доклинические исследования позволили предположить, что продолжительность экспозиции является одним из наиболее важных факторов, обусловливающих гибель клеток (9, 10). Более того, модели ксенотрансплантатов показали наличие антиангиогенного эффекта при вливании паклитаксела в низких дозах (11). Поэтому теоретически является более предпочтительным экспонировать солидные опухоли с большими значениями времени удвоения непрерывно поддерживаемой концентрации цитотоксических препаратов, чтобы повысить шанс воздействия на клетки, которые во время периода лечения проходят через клеточный цикл. Одним из методов для повышения экспозиции химиотерапевтическому препарату является его более частое введение.
Как препараты платины (12, 13), так и паклитаксел (14-20) обладают доказанным противоопухолевым действием в качестве индивидуальных агентов при раке яичников, и их можно использовать при благоприятном профиле токсичности в еженедельной схеме применения (21-23). Эти перспективные результаты побудили нас исследовать комбинацию паклитаксела и карбоплатина, вводимую еженедельно, для химиотерапии первой линии. Многоцентровое испытание по фазе I было проведено для оценки максимальной переносимой дозы (МПД).
БОЛЬНЫЕ И МЕТОДЫ
Схема испытания
Проводившееся испытание представляло собой открытое нерандомизированное многоцентровое испытание по подбору дозы по фазе I. Мы исследовали наращивание дозы карбоплатина и паклитаксела при введении по схеме один раз в неделю. Мы считали, что более частое введение паклитаксела и карбоплатина по сравнению со стандартными схемами приведет к повышению противоопухолевого действия и обеспечит лучший профиль токсичности. Мы ожидали, что в ходе этого испытания токсическим эффектом, ограничивающим дозу, будет миелосупрессия.
Главная задача заключалась в определении максимальной переносимой дозы на недельной схеме. Вторичная задача заключалась в документировании спектра токсических эффектов, как острых, так и кумулятивных, а также в выявлении объективного ответа на проводимое лечение. Подъем дозы осуществлялся в соответствии с модифицированным [24] методом непрерывной переоценки. В настоящем испытании по подбору дозу больные делились на группы их трех человек.
Испытуемых переводили на следующий, более высокий, уровень дозы, только если на протяжении первых шести курсов не проявлялось токсических эффектов, ограничивающих дозу. Если одна из первых трех больных, получавших определенную дозу, обнаруживала токсический эффект, ограничивающий дозу, по крайней мере, три другие больные должны были получать такой же уровень дозы. Если более, чем у двух больных, получавших лечение при соответствующем уровне доз, обнаруживали токсические эффекты, ограничивающие дозу, то считалось, что достигнута МПД.
Повышение дозы у данного конкретного больного не разрешалось.
Исследование выполнялось в соответствии с рекомендациями качественной клинической практики. За контроль данных отвечал независимое мониторирующее учреждение. Для каждого из участвовавших центров требовалось получение разрешения от его совета по рецензированию, а каждая из участвовавших больных давала в письменном виде после информирования свое согласие.
Критерии включения больных и лечения
Больные с гистологически подтвержденным эпителиальным раком яичников на стадии FIGO III или IV включались в настоящее испытание после хирургической операции.
Больные, удовлетворяющие критериям должны были иметь ожидаемую продолжительность жизни, составляющую более трех месяцев по критериям ECOG, функциональный статус не менее 3, данные лабораторных анализов в нормальномдиапазоне, включая скорость гломерулярной фильтрации более 60 мл/мин, значения креатинина сыворотки менее 1,6 мг/мл, значения трансаминаз печени меньшие, чем двукратный уровень нормы, концентрацию билирубина менее 1,5 мг/мл, адекватную функцию костного мозга, соответствующую содержанию нейтрофилов более 1500/мкл, и содержание тромфоцитов более 100000/мкл. Больные, страдающие от вторичных злокачественных заболеваний или от серьезных неконтролируемых сопутствующих соматических или психических заболеваний, исключались из настоящего испытания, как и больные, получавшие другую химиотерапию, иммунотерапию или гормональную терапию.
План лечения
Всем больным перед химиотерапией проводилось хирургическое лечение и в подкожную латеральную вену руки была имплантирована система для вливания.
Паклитаксел вводили путем вливания продолжительностью от одного часа до полутора часов (в 500 мл 5%-ного раствора глюкозы), а карбоплатин в 250 мл 0,9%-ного физиологического раствора в течение 30 минут. За 15 минут до химиотерапии проводили внутривенную премедикацию, включавшую 2 мг клемастина, 50 мг ранитидина, 12 мг дексаметазона, а также антагонист 5-НТ3-рецепторов. Намеченная доза паклитаксела зависела от площади поверхности тела (ППТ). Дозу карбоплатина рассчитывали по формуле Кальверта (25) и выражали как площадь под кривой (AUC, мг/мл . мин). Скорость гломерулярной фильтрации (СГФ) оценивали с помощью уравнения Джеллайфа (26), которое учитывает возраст, пол, вес и креатинин сыворотки у больного.
Мы были главным образом заинтересованы в исследовании комбинаций паклитаксела в дозе 100 мг/м2 с карбоплатином при AUC 2,0 и паклитаксела в дозе 100 мг/м2 с карбоплатином при AUC 3,0. Если МПД достигалась при первом уровне доз, планировалось снижение дозы паклитаксела до 80 мг/м2 при дозе карбоплатина с AUC 2,0. Во время испытания у трех больных развилась токсичность, лимитирующая дозу, при максимальной концентрации карбоплатина. Для определения МПД с большей точностью все советы по рецензированию протокола утвердили поправку, позволявшую оценку промежуточного уровня доз, а именно паклитаксел в дозе 100 мг/м2 и карбоплатин до AUC 2,5. Таким образом, окончательные концентрации карбоплатина, исследовавшиеся в настоящем испытании, составляли 2,0 (уровень (I), 2,5 (уровень II) и 3,0 (уровень III), соответственно. Для каждого из этих трех уровней дозу паклитаксела фиксировали на значении 100 мг/м2.
Первый блок лечения состоял из шести курсов химиотерапии, еженедельно, с последующим 14-дневным перерывом. После этого проводилось еще шесть курсов химиотерапии. После перерыва в лечении продолжительностью в 28 дней проводились дополнительные три курса лечения. Дополнительные курсы проводились лишь в том случае, если у больного отмечался частичный эффект. Схема лечения приведена на Рис. 1.
Определение токсичности Перед каждым курсом химиотерапии снимали ЭКГ, а также брали пробы крови для определения гематологических параметров (гемоглобин, гематокрит, эритроциты, лейкоциты, нейтрофилы, лимфоциты, моноциты, эозинофилы, базофилы и тромбоциты); также проводился биохимический анализ крови (натрий, калий, кальций, креатинин, мочевая кислота, щелочная фосфатаза, СГОТ, СГПТ, общий билирубин и общий белок); эти анализы проводились перед каждым курсом, а также между третьим и пятым днями каждого курса.
Токсичность определяли в соответствии с обычными национальными критериями онкологической токсичности (National Cancer Common Toxicity Criteria) (27).
Регистрировали все документированные эффекты безотносительно к их связи с исследуемым лечением. Для токсических эффектов, ограничивающих дозу, в рамках настоящего исследования по фазе I использовали следующие критерии:
- Абсолютное содержание нейтрофилов (АСН)<0,5 × 109/л более 5 дней,
- Эпизод фебрильной нейтропении с температурой больше 38,2 градуса,
- Гранулоцитопения степени 4 (требующая применения внутривенных антибиотиков и госпитализации),
- Тромбоцитопения степени 4, - Негематологическая токсичность степени ≥3, за исключением алопеции и рвоты (степень 3),
- Отсутствие восстановления нейтрофилов (≥1,5 × 109/л), несмотря на профилактическое использование Г-КСФ (5 мкг/кг веса тела в день подкожно) и/или тромбоцитов (≥100 × 109/л) на 14-ый день,
- Персистирующая негематологическая токсичность (за исключением алопеции и рвоты степени 3) степени ≥2 на 8-ой день в пределах 12 курсов,
- Задержка лечения, превышающая 14 дней.
Не планировалось первичной поддержки гранулоцитным колониестимулирующим фактором (Г-КСФ). Вторичное профилактическое использование Г-КСФ проводилось только в случае тяжелой лейкопении или нейтропенической лихорадки, а также в случае задержки лечения из-за лейкопении или нейтропении. Использование эритропоэтина не разрешалось.
Химиотерапию проводили только если содержание лейкоцитов составляло более 2 × 109/л, а содержание тромбоцитов - более 100 × 109/л.
Ответ на лечение
Ответ на лечение у больных с опухолями, измеримыми в двух направлениях, определялся в соответствии с критериями Международного союза против рака (UICC), и егопроводили путем физического обследования, ультразвука, компьютерной томографии или магнитно-резонансной визуализации перед 7-ым и 13-ым курсом химиотерапии. Если больная реагировала на лечение (частичный или полный ответ), тот же метод исследования применяли повторно для подтверждения. Перед каждым курсом лечения определяли и анализировали уровни СА125 (28). Ответ на лечение у больных при отсутствии измеримой опухоли определялся только путем измерения СА125.
Статистический анализ
Токсичность и процент клинического ответа оценивались описательным способом.
Для оценки вероятности выживания использовался метод жизненных таблиц и метод Каплана-Мейера. Для повышения точности оценки ответа опухолевого маркера в относительно небольшой группе больных использовались скорректированные расчетные процедуры (bootstrapping) для получения 95%-ных доверительных интервалов о средних значениях СА125 перед первым и последним курсом лечения.
Основная идея, лежащая в основе расчетных процедур, заключается в том, что использование множественных проб из фактической выборки больных позволит сделать выводы о распределении значения, представляющего интерес, в соответствующей группе. Сравнения осуществлялись с помощью непараметрического критерия Крускал-Валлиса при двустороннем P<0,05, указывающем на статистическую достоверность. Методы, с помощью которых решалась проблема отсутствующих данных, были определены заранее. Наклоны индивидуальных линий, характеризующих ответ опухолевого маркера, определялись с помощью моделей регрессии (линейной и байесовской) для контроля вероятности и для расчета отсутствующих значений, когда это было необходимо.
РЕЗУЛЬТАТЫ
Характеристики больных
В период с июня 1998 по февраль 1999 г.г. в испытание была включена 21 вновь диагностированная в трех учреждениях Германии больная, из которых 14 лечились в Берлинской университетской больнице Чарите, которая была координирующим центром, а еще 3 и 4 больных – в больнице Оскар-Зитен в Берлине и Университетской больнице в Любеке соответственно. Медианный возраст составлял 59 лет (интервал от 35 до 79 лет). Характеристики всех больных приведены в Таблице 1.
Таблица 1. Характеристики больных
|
Число больных |
21 |
|
Число больных, пригодных для оценки на токсичность |
21 |
|
Число больных, пригодных для оценки на клинический ответ |
4 |
|
Число больных, пригодных для оценки со стороны СА125 |
19 |
|
Медианный возраст, лет (интервал) |
59 (35-79) |
|
Медианная площадь поверхности тела в м2 (интервал) |
1,63 (1,40-2,20) |
|
Функциональный статус ECOG |
|
|
|
|
|
|
|
|
|
|
|
Стадия FIGO |
|
|
|
1 |
|
|
5 |
|
|
10 |
|
|
5 |
|
Степень |
|
|
|
1 |
|
|
10 |
|
|
10 |
|
Гистология |
|
|
|
18 |
|
|
2 |
|
|
1 |
|
Остаточная опухоль после операции |
|
|
|
1 |
|
|
10 |
|
|
10 |
|
Резекция кишечника |
7 |
|
Удаление лимфатических узлов |
|
|
|
14 |
|
|
11 |
|
Отдаленные метастазы |
|
|
|
3 |
|
|
1 |
|
|
1 |
|
Асцит >500 мл |
12 |
У 19 больных значения СА125 были повышены (интервал от 39,7 до 18,053 ед./мл) перед епрвым курсом химиотерапии. Всего было проведено 219 курсов химиотерапии, медианное значение составляет 11 курсов на больного (интервал от 4 до 18). Число больных, получавших лечение при каждом уровне дозы, приведено в Таблице 2.
Таблица 2. Осуществление лечения
|
Уровень |
Доза |
Доза |
Всего курсов |
Больные, |
Задержка |
|
I |
100 |
2,0 |
76 (6) |
4 |
4 |
|
II |
100 |
2,5 |
64 (7) |
3 |
5 |
|
III |
100 |
3,0 |
79 (8) |
2 |
6 |
Токсичность
Все больные оценивались на проявления токсичности. Эпизодов сепсиса или летальных исходов, связанных с проведением химиотерапии, зарегистрировано не было. На уровне I не отмечалось ограничивающей дозу токсичности. МПД достигалась на уровнях II и III. На уровне II ограничивающая дозу токсичность была зарегистрирована у трех из семи больных. У одной больной отмечалась тромбоцитоепния, не восстанавливавшаяся в течение 14 дней, у одной больной отмечалась нейтропеническая лихорадка, и еще у одной больной присутствовала нейропатия степени 3. Ограничивавшая дозу токсичность, заставившая изменить протокол на уровне III, представляла собой два случая тромбоцитопении, которые не нормализовались в пределах 14 дней, и один эпизод нейтропенической лихорадки, несмотря на профилактическое использование Г-КСФ. Лечение было отложено в четырех случаях из-за нейтропении и еще в двух случаях из-за тромбоцитопении и нейропатии. В одном случае задержка лечение была осуществлена по просьбе больной.
Негематологическая токсичность
Наиболее существенные связанные с лечением формы негематологической токсичности приведены в Таблице 3. В настоящем исследовании не обнаружено каких- либо неожиданных эпизодов негематологической токсичности. Побочные эффекты были относительно легкими и редкими. Случаев кардиотоксичности не отмечалось.
Наиболее частым побочным эффектом была алопеция. Нейротоксичность степени 2 наблюдалась у двух больных (1,4% всех курсов). Только у одной больной с сахарным диабетом типа IIb отмечалась нейротоксичность степени 3 (0,5% всех курсов) на 13-ом курсе лечения при дозовом уровне III. Эта больная была снята с испытания.
Нейропатия обычно проявлялась после первого курса лечения. Лишь у четырех больных отмечалась нейропатия перед началом седьмого курса.
Таблица 3. Наиболее тяжелые негематологические токсические эффекты
|
Токсичность |
Степень 1 |
Степень 2 |
Степень 3 |
Степень 4 |
|
Алопеция |
1 |
3 |
13 |
0 |
|
Нейропатия |
13 |
2 |
1 |
0 |
|
Понос |
2 |
4 |
0 |
0 |
Гематологическая токсичность Миелотоксичность, в частности тромбоцитопения и нейтропения, представляли собой главные токсические эффекты, наблюдавшиеся в испытании (Таблица 4).
Гематологические побочные эффекты обычно не были связаны с тяжелыми осложнениями. Для повышения уровня гемоглобина до значения более 9 г/мл в девяти случаях было необходимо переливание крови у шести больных. Только у трех больных требовалось вторичное профилактическое использование Г-КСФ (дни 1 и 5) после четвертого, пятого и шестого курсов химиотерапии, соответственно.
Таблица 4. Наиболее тяжелые гематологические токсические эффекты
|
Токсичность |
Степень 1 курсы (больные) |
Степень 2 курсы (больные) |
Степень 3 курсы (больные) |
Степень 4 курсы (больные) |
|
Анемия |
142 (21)/64,8% |
66 (15)/30,1% |
2 (2)/0,9% |
0 |
|
Лейкопения |
86 (19)/39,22% |
63 (18)/28,8% |
19 (9)/8,7% |
3 (3)/1,4% |
|
Нейтропения |
35 (16)/16,0% |
40 (14)/18,3% |
10 (8)/4,5% |
3 (3)/1,4% |
|
Тромбоцитопения |
40 (14)/18,3% |
8 (8)/3,7% |
3 (3)/1,4% |
1 (1)/0,5% |
Ответ на лечение
Четыре больных могли быть оценены в отношении ответа на лечение в соответствии с критериями UICC; у одной больной отмечался полный ответ. Еще у двух больных имел место частичный ответ, и у одной больной имело место стабильное заболевание. У остальных больных или отсутствовала остаточная определяемая опухоль в послеоперационном периоде, или результаты визуализации органов брюшной полости были отрицательными.
У 13 из 19 больных (68%) с повышенными значениями СА125 наблюдалась нормализация (<35 ед./мл) к концу лечения. Всем больным измерения СА125 проводились перед первым и последним курсом химиотерапии. Информация в отношении динамики СА125 (>85% всех измерений) имелась для десяти историй болезни. В трех случаях, когда отсутствовало 40, 29 и 25% значений, соответственно, были использованы расчетные данные.
Значения СА125 уменьшились со средней величины 162 ед./мл (95%-ный ДИ от 80 до 265 ед./мл) до 11 ед./мл (95%-ный ДИ от 9 до 14 ед./мл, Р=0,0001). По сравнению с концентрациями до лечения опухолевый маркер снизился на 75% у 14 из 19 женщин.
Максимальное снижение составляло 50% еще у двух больных. У двух больных отмечалась быстрая прогрессия заболевания, и они скончались через 2,4 месяца после последнего курса лечения. Во время периода наблюдения (медиана 25 месяцев, интервал от 19 до 28 месяцев) шесть больных скончались от прогрессирующего или рефрактерного заболевания. Медиана средней выживаемости всех больных не была достигнута (интервал от 0 до 30+ месяцев). Вероятность выживания в течение двух лет составляла 74,2%.
ОБСУЖДЕНИЕ
Паклитаксел и карбоплатин, вводимые еженедельно, представляют собой безопасный подход к лечению первой линии при распространенном раке яичников. МПД достигалась при дозе паклитаксела, составлявшей 100 мг/м2, и дозе карбоплатина, составлявшей AUC 2,5. В общем и целом, профиль токсичности этой комбинированной схемы характеризуется лейкопенией и нейропатией. Хотя у 57,1% всех больных эпизодически развивалась лейкопения степени 3 или 4, лишь у 14,3% требовалась профилактика Г-КСФ. Лечение должно было быть приостановлено из-за рефрактерной лейкопении у одной больной (4,8%). Недавно Катсумата и соавт. исследовали еженедельное применение паклитаксела в дозе 80 мг/м2 и карбоплатина при AUC 2,0 у больных с рецидивом рака яичников, которых ранее лечили по схеме, содержащей препарат платины. Наиболее частыми побочными эффектами были лейкопения степени 3 и 4 (61%) и анемия (39%). По аналогии с нашим исследованием, авторы воздерживались от стандартной профилактики с помощью Г-КСФ и не наблюдали тяжелых клинических осложнений (29). Имеются доказательства, что карбоплатин столь же эффективен, как и цисплатин, при обычном лечении, однако имеет благоприятный профиль токсичности (5, 6, 30). Таким образом, карбоплатин может быть лучшим кандидатом для комбинированной химиотерапии в сочетании с паклитакселом при еженедельной схеме введения.
В настоящем испытании нейротоксичность обычно имела легкий или умеренный характер. Только у одной больной развилась нейропатия степени 3, лимитирующая дозу. Распространенность нейропатии степени 2 и 3 у больных, получающих обычную схему паклитаксел/карбоплатин, варьирует от 13 до 30% (5, 30). В рандомизированном испытании монотерапии паклитакселом распространенность нейропатии составляла 29% в группе обычного лечения (200 мг/м2) по сравнению с 11% при еженедельном введении (67 мг/м2) (31). В двух публикациях предполагается, что при еженедельном введении пороговая концентрация паклитаксела для индукции нейропатии составляет 100 мг/м2 (21, 32).
Лишь в немногих исследованиях анализировался эффект различных графиков введения карбоплатина на частоту нейропатии. В рандомизированном испытании Гора и соавт.
нейропатия степени 3 и 4 наблюдалась у 2% больных, получавших препарат при AUC 12,0 (четыре курса), причем при AUC 6,0 (шесть курсов) тяжелой нейротоксичности не наблюдалось (33). Выводы общего характера из этих испытаний монотерапии следует делать с осторожностью, и необходимы дальнейшие исследования профиля токсичности комбинированной схемы при ее еженедельном введении.
Можно спорить по поводу выбранного графика химиотерапии. Мы определенно согласны с тем, что проблема графика введения требует более детального объяснения.
Еженедельное применение позволяет введение более высокой дозы на протяжении более короткого времени. Несмотря на клинический опыт и предпочтения, какие-либо данные, говорящие в пользу использования одной схемы по сравнению с другой, отсутствуют. Поэтому перерывы в лечении были введены на эмпирической основе. С одним перерывом между двумя блоками лечения по шесть курсов 1200 мг/м2 паклитаксела могут быть доставлены в организм за 13 недель, в то время как для введения 1050 мг/м2 паклитаксела в рамках обычной схемы раз в три недели требуется 18 недель (речь идет о шести курсах паклитаксела в дозе 175 мг/м2, как это широко используется в Европе и Канаде). Однако это преимущество происходит за счет несколько меньшей нагрузки карбоплатином. Для обеспечения эквивалентных общих доз при AUC 2,0 еженедельно и AUC 5,0 раз в три недели, экспериментальный подход требует еще трех курсов лечения. В рандомизированном испытании Датской группы по раку яичников удвоение интенсивности дозы карбоплатина не приводило к существенному улучшению выживаемости, когда препарат комбинировали с циклофосфамидом (34). Будущие исследования могут показать, будет ли насыщение дозы за счет дополнительных курсов лечения требоваться для повышения процента выживаемости при использовании комбинаций карбоплатина и паклитаксела.
Один из аргументов в пользу настоящего исследования заключался в том, что сокращение времени, имеющегося у опухоли для рецидива (повышение плотности дозы, более частое введение) может иметь большее воздействие на конечный результат по сравнению с увеличением дозы (35). Шестнадцать из 19 испытуемых, включенных в наше испытание, дали снижение СА125 более, чем на 50%, по отношению к исходному значению. Хотя лишь немногие исследования говорят о воздействии препарата платины и паклитаксела на исход лечения (10, 36-40), большая часть этих данных была получена при ретроспективном анализе. Отсутствуют рандомизированные испытания, говорящие о заметном улучшении выживаемости за счет повышения доз химиотерапевтических агентов (41).
Маркмэн выполнил испытание по фазе II у больных с раком яичников, устойчивым как к платине, так и к паклитакселу (16). Паклитаксел применяли еженедельно в дозе 80 мг/м2 в форме 1-часового вливания. Восемь из 25 больных с измеримыми опухолями дали частичный ответ (32%), а еще у пяти больных наблюдалось снижение уровня СА125 более, чем на 75%. Это говорит в поддержку предположения, что еженедельное применение может не только иметь дополнительный противоопухолевый эффект, но также и преодолевать резистентность к препарату.
В заключение, комбинация паклитаксела и карбоплатина может безопасно и эффективно применяться у больных с распространенным раком яичников по схеме один раз в неделю. Благоприятный профиль токсичности и обнадеживающая противоопухолевая активность, обнаруженная в нашем маломасштабном испытании, дали нам основания продолжить применение комбинации паклитаксела (100 мг/м2) и карбоплатина (AUC 2,0) в многоцентровом испытании по фазе II. Результаты этого идущего испытания помогут прояснить потенциальные преимущества данной схемы лечения по сравнению с другими обычными режимами.
Авторы признательны О. Бухвейтсу, О. Камара, Дж. Дари, Э. Кейл, Г. Мораку, А.
Нугент. Ж. Оскей, Й. Рике и А.Шонборну за помощь в сборе данных. Мы благодарим весь участвовавший сестринский персонал и больных. Без их энтузиазма и поддержки проведение этой работы оказалось бы невозможным.
Литература
1. Berek JS, Bertelsen K, du Bois A, and coauthors. Advanced epithelial ovarian cancer: 1998 consensus statement. Ann. Oncol 1999; 10:87-92.
2. Lichtenegger W, Sehouli J, Buchmann E, and coauthors. Operative results after primary and secondary debulking-operations in advanced ovarian cancer. J Obstet Gyn Res 1998;24:447 – 51.
3. Sehouli J, Lichtenegger W, Hieronimus-Reichel A, and coauthors. Dose dense therapy with weekly taxol carboplatin as first line treatment in advanced ovarian cancer [Abstract].
Proc Am Soc Clin Oncol 2000;19:1613.
4. McGuire WP, Hoskins WJ, Brady MF, and coauthors. Cyclophosphamide and cisplatin compared with paclitaxel and cisplatin in patients with stage III and IV ovarian cancer. N Engl J Med 1996;334:1 – 6.
5. Ozols RF, Bundy BN, Fowler J, and coauthors. Randomized phase III study of cisplatin/paclitaxel versus carboplatin/paclitaxel in optimal stage III epithelial ovarian cancer (GOG 158) [Abstract]. Proc Am Soc Clin Oncol 1999;18:1373.
6. Du Bois A, Lueck HJ, Meier W, and coauthors. Cisplatin/paclitaxel versus carboplatin/paclitaxel in ovarian cancer: update of an Arbeitsgemeinschaft Gynakologische Onkologie (AGO) study group trial [Abstract]. Proc Am Soc Clin Oncol 1999;19:1374.
7. Piccart MJ, Bertelsen K, James K, and coauthors. Randomized intergroup trial of cisplatin – paclitaxel versus cisplatin – cyclophosphamide in women with advanced epithelial ovarian cancer: three-year results. J Natl Cancer Inst 2000;92:699 – 708.
8. Schiff PB, Horwitz SB. Taxol stabilizes microtubules in mouse fibroblasts. Proc Natl Acad Sci USA 1980;77:1561 – 5.
9. Belotti D, Vergani V, Drudis T, and coauthors. The microtubule-affecting drug paclitaxel has antiangiogenic activity. Clin Cancer Res 1996;2:1843 – 9.
10. Liebmann JE, Cook JA, Lipschultz C, and coauthors. Cytotoxic studies of paclitaxel (taxol) in human tumour cell lines. Br J Cancer 1993;68: 1104 – 9.
11. Lopes NM, Adams, EG, Pitts TW, and coauthors. Cell kinetics and cell cycle effects of taxol on human and hamster ovarian cell lines. Cancer Chemother Pharmacol 1993;32:235 – 42.
12. Bolis G, Favalli G, Danese S, and coauthors. Weekly cisplatin given for 2 months versus cisplatin plus cyclophosphamide given for 5 months after cytoreductive surgery for advanced ovarian cancer. J Clin Oncol 1997;15: 1938 – 44.
13. Frasci G, Comella A, Parziale, A, and coauthors. Cisplatin – paclitaxel weekly schedule in advanced ovarian cancer. Ann Oncol 1993;8:291 – 3.
14. Fennelly D, Aghajanian C, Shapiro F, and coauthors. Phase I and phar-macologic study of paclitaxel administered weekly in patients with re-lapsed ovarian cancer. J Clin Oncol 1997;5;187 – 92.
15. Fennelly D, Shapiro F, Aghajanian C, and coauthors. Application of 3 dose-intensive paclitaxel utilizing a weekly one-hour infusion schedule: efficacy and feasibility in patients with recurrent ovarian cancer [Abstract]. European Society for Medical Oncology (ESMO) Congress, 1996.
16. Markman M, Baker EM, Hall B, and coauthors. Phase II trial of weekly single agent paclitaxel in platinum and paclitaxel-refractory ovarian cancer [Abstract]. Proc Am Soc Clin Oncol 2000;19:1567.
17. Markman M. Weekly paclitaxel in the management of ovarian cancer. Semin Oncol 2000;27:37 – 40.
18. Markman M, Kulp B, Peterson G, and coauthors. Weekly carboplatin as a strategy to prevent severe treatment-related emesis. Gynecol Oncol 2000; 78;265.
19. Grothey A, Burghardt F, Bremer A, and coauthors. Phase I/II trial of weekly applications of taxol in chemoresistant breast and ovarian cancer [Abstract]. Ann Hematol 1996;73:273.
20. Loffler TM, Freund W, Lipke J, and coauthors. Schedule- and dose- 4 intensified paclitaxel as weekly 1 hour infusion in pretreated solid tu-mours: results of a phase I/II trial. Semin Oncol 1996;23:32 – 4.
21. Seidman AD, Hudis CA, Albanel J, and coauthors. Dose-dense therapy 4 with weekly 1 hour paclitaxel infusions in the treatment of metastatic breast cancer. J Clin Onсol 1998;16:3353 – 61.
22. Abu-Rustum NR, Aghajanian C, Barakat RR, and coauthors. Salvage weekly paclitaxel in recurrent ovarian cancer. Semin Oncol 1997;24:62 – 7.
23. Gianni AM, Piccart MJ. Optimising chemotherapy dose density and dose intensity. New strategies to improve outcomes in adjuvant therapy for breast cancer. Eur J Cancer 2000;36:1 – 3.
24. Faries D. Practical modifications of the continual reassessment method for phase I cancer clinical trials. J Biopharm Stat 1994;4:147 – 64.
25. Calvert AH, Newell DR, Gumbrell LA, and coauthors. Carboplatin dosage: prospective evaluation of a simple formula based on renal function. J Clin Oncol 1989;7:1748 – 56.
26. Jelliffe RW. Creatinine clearance: bedside estimate. Ann Intern Med 1973;79:604 – 5.
27. National Cancer Institute common toxicity criteria. In: Perry MC, editor. The Chemotherapy Source Book. Baltimore: Williams & Wilkins, 1990: 1133 – 40.
28. Rustin GJ, Nelstrop AE, McClean P, and coauthors. Defining response of ovarian carcinoma to initial chemotherapy according to serum CA 125. J Clin Oncol 1996;14:1545 – 51.
29. Katsumata N, Watanabe T, Mukai H, and coauthors. A phase II trial of weekly paclitaxel/carboplatin as salvage chemotherapy in patients with relapsed ovarian cancer [Abstract]. Proc Am Soc Clin Oncol 2001;19:865.
30. Markman M, Kennedy A, Webster K, and coauthors. Neurotoxicity associated with a regimen of carboplatin (AUC 5-6) and paclitaxel (175 mg/m' over 3 h) employed in the treatment of gynecologic malignancies. J Cancer Res Clin Oncol 2001;127:55 – 8.
31. Andersson H, Boman K, Ridderheim M, and coauthors. An updated analysis of a randomized study of single agent paclitaxel given weekly versus every 3 weeks to patients with ovarian cancer treated with prior platinum therapy [Abstract]. Proc Am Soc Clin Oncol 2000;19:380a.
32. Breier S, Lebedinsky C, Ayiviri C, and coauthors. Long term weekly paclitaxel (P) in metastatic breast cancer. A Phase II trial in pretreated patients [Abstract]. Proc Am Soc Clin Oncol 1998;17:740.
33. Gore M, Mainwaring P, A’Hern R, and coauthors. Randomized trial of dose-intensity with single-agent carboplatin in patients with epithelial ovarian cancer. London Gynaecological Oncology Group. J Clin Oncol 1998;16:2426 – 34.
34. Jakobsen A, Bertelsen K, Andersen JE, and coauthors. Dose effect study of carboplatin in ovarian cancer: a Danish Overian Cancer Group study. J Clin Oncol 1997;15:193 – 8.
35. Norton L. Evolving concepts in the systemic drug therapy of breast cancer. Semin Oncol 1997;24:S10-3 – S10-10.
36. Eisenhauer EA, ten Bokkel Huinink WW, Swenerton KD, and coauthors. European – Canadian randomized trial of paclitaxel in relapsed ovarian cancer: high-dose versus lowdose and long versus short infusion. J Clin Oncol 1994;12:2654 – 66.
37. Levin L, Hryniuk WM. Dose intensity analysis of chemotherapy regimens in ovarian carcinoma. J Clin Oncol 1987;5:756 – 67.
38. Ngan HY, Choo YC, Cheung M, and coauthors. A randomized study of high-dose versus low-dose cis-platinum combined with cyclophosphamide in the treatment of advanced ovarian cancer. Hong Kong Ovarian Carcinoma Study Group. Chemotherapy 1989;35:221- 7.
39. Torri V, Korn EL, Simon R. Dose intensity analysis in advanced ovarian cancer patients. Br J Cancer 1993;67:190 – 7.
40. Scotto V, Sbiroli C. Weekly cis-platinum as third line chemotherapy in advanced ovarian carcinoma. Phase II study. Eur J Gynaecol Oncol 1991;12: 51 – 3.
41. McGuire WP, Hoskins WJ, Brady MF, and coauthors. Assessment of dose-intensive therapy in suboptimally debulked ovarian cancer: a Gynecologic Oncology Group study. J Clin Oncol 1995;13:1589 – 99.
Рис. 1. Профиль 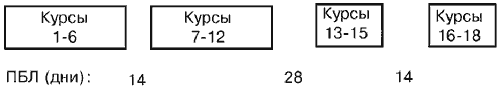
испытания. ПБЛ = период без лечения
Комментарии
ПРАКТИКА ПЕДИАТРА
