Результаты двухлетнего применения кеппры для лечения эпилепсии у взрослых
СтатьиОпубликовано в журнале:
Журнал неврологии и психиатрии, 7, 2006
В.А. Карлов, П.Н. Власов
Кафедра нервных болезней лечебного факультета Московского государственного медико-стоматологического университета Анализируется эффективность кеппры (леветирацетам) в составе комплексной терапии у 87 больных парциальной труднокурабельной эпилепсией и в 17 случаях при идиопатической генерализованной эпилепсии у взрослых. В 25,3% удалось добиться медикаментозной ремиссии эпилепсии на период свыше 12 мес. Эффективность терапии по показателю снижения частоты припадков более 75% достигнута в 12,6% наблюдений; более 50% — в 43,7% случаев. Отсутствие эффекта и недостаточная эффективность отмечены только в 18,4% наблюдений. Применение кеппры в составе комбинированной терапии указывает на стойкость терапевтического эффекта, который практически не снижался через 12 и 24 мес наблюдения. Выявлена хорошая переносимость препарата. Отмена из-за побочных явлений имела место в 5 случаях (4,8%). Полученные результаты свидетельствуют о высокой перспективности применения кеппры в эпилептологии и, в частности, при фармакорезистентной эпилепсии.
Ключевые слова: фармакорезистентная эпилепсия, леветирацетам (кеппра), эффективность, побочные проявления.
The results of the two-year experience of using keppra in therapy of adult patients with epilepsy
V.A. Karlov, P.N. Vlasov
Keppra (levetiracetam) was used as a part of the complex therapy in 87 patients with partial epilepsy and in 17 patients with adult idiopathic generalized epilepsy. Most of the cases were pharmacoresistant. Remission was observed in 25.3% of patients for the period over 12 months. Therapeutic efficacy by a decrease of seizures frequency by 75% and more has been reached in 12.6% of cases; by 50% and more — in 43.7%. The absence of drug effect and insufficient efficacy were detected only in 18.4% of cases. The therapeutic effect was stable and did not decrease after 12 and 24 months. The drug was well tolerated and was withdrawn in 5 cases (4.8%) because of side effects. The results obtained hold promise for using keppra in epileptology, in particular in treatment of pharmacoresistant epilepsy.
Key words: pharmacoresistant epilepsy, levetiracetam (keppra), efficacy, side effects.
Кеппра, или леветирацетам, является одним из последних антиэпилептических препаратов (АЭП). Он был введен в российскую клиническую практику в 2003 г. В известной степени свойства его можно считать уникальными: он высокоэффективен в отношении разных видов эпилептических припадков, хорошо переносится больными, в отличие от других АЭП у него близок к идеальному фармакокинетический профиль [18]. Это дает основание рассчитывать на эффективность кеппры в случаях, когда терапевтические возможности других АЭП исчерпаны. Положительные результаты применения кеппры в качестве препарата дополнительной терапии при фармакорезистентной эпилепсии отмечались ранее как нами [1], так и другими исследователями [2]. Однако эти публикации основаны на наблюдении больных на протяжении от 3 до 12 мес.
Цель настоящего исследования состояла в оценке эффективности кеппры в течение более длительного периода — 2 лет.
Материал и методы
Наблюдали 104 больных 19—52 лет (средний возраст 25 лет) — 87 с парциальной эпилепсией (ПЭ) и 17 с идиопатической генерализованной (ИГЭ).
Все больные ПЭ получали препарат не менее года, а 29 — более года, причем из них 25 — два года. Из 17 пациентов с ИГЭ 15 лечились на протяжении 12 мес и 2 — два года.
В группе ПЭ преобладали (77%) резистентные к лечению (труднокурабельные) случаи [1]. К остальным 23% пациентов понятие фармакорезистентности применимо формально, так как в этих случаях ранее было апробировано не более двух схем терапии, эффективность которых при максимально переносимой суточной дозе оказалась недостаточной. В части наблюдений с исходной монотерапией кеппру назначали в качестве дополнительного АЭП (в этой подгруппе были в основном больные студенты, при лечении которых мы должны были учитывать отсутствие негативного влияния этого препарата на когнитивные функции).
В группе ПЭ абсолютно преобладали женщины — 63 (72,4%); соответственно мужчин было 24 (27,6%). Ведущий эпилептический очаг локализовался в височной доле у 51 (58,6%), в лобной у 23 (26,4%) пациентов. Теменно-затылочная локализации эпилептического фокуса выявлена в 3 (3,4%) наблюдениях. У 10 (11,5%) больных идентификация эпилептического фокуса оказалась невозможной из-за недостаточной информативности (противоречивости) результатов электроэнцефалографии и нейровизуализационных методик либо их неполного применения при клинической полиморфности припадков.
Из фокальных эпилепсий симптоматические формы составили 37,9%, вероятно симптоматические — 62,1%. Структурные изменения вещества головного мозга включали корковую дисплазию, рубцово-атрофические изменения, единичные и множественные кисты, гиппокампальный склероз.
По длительности заболевания абсолютно преобладали случаи с его течением более 10 лет (59,8%). Наиболее часто регистрировалось сочетание парциальных и вторично-генерализованных эпилептических припадков (64,4%). Парциальные припадки без вторичной генерализации встречались значительно реже (14,9%), при этом частота их, как правило, была высокой. Мономорфные вторично-генерализованные припадки наблюдались в 17,2% случаев. У 3 (3,4%) пациентов регистрировались мономорфные гипермоторные припадки сна. Соответствующие данные более полно приведены в табл. 1.
Таблица 1. Клиническая характеристика ПЭ
| Показатель | Kоличество наблюдений | |
|---|---|---|
| абс. | % | |
| Длительность заболевания, годы: до 5 5—10 более 10 |
19 16 52 |
21,8 18,4 59,8 |
| Характер припадков: парциальные без вторичной генерализации вторично-генерализованные сочетание парциальных и генерализованных гипермоторные припадки сна |
13 15 56 3 |
14,9 17,2 64,4 3,4 |
| Средняя частота припадков в месяц: простые, сложные парциальные и их сочетание сочетание парциальных и генерализованных |
До десятков |
Не менее 4 |
Таблица 2. Фоновая терапия (до назначения кеппры) больных труднокурабельной ПЭ
| Число препаратов | Kоличество наблюдений | |
|---|---|---|
| абс. | % | |
| Один | 20 | 23,0 |
| Два энзиминдуцирующих | 19 | 21,8 |
| Два: индуктор+неиндуктор | 25 | 28,7 |
| Два неиндуктора (депакин+ламиктал) | 8 | 9,2 |
| Три | 15 | 17,2 |
Как видно из табл. 2, в подавляющем большинстве случаев ранее терапия проводилась двумя препаратами в различном сочетании, как с индукторами микросомальных ферментов печени — карбамазепином, фенитоином и фенобарбиталом/бензоналом, так и с неиндукторами — вальпроевой кислотой, ламотриджином, топираматом и бензодиазепинами, что составило в сумме 59,7%. Исходная (базовая) монотерапия проводилась у 23% больных, как правило, в случаях плохой переносимости применявшегося фонового АЭП либо недостаточном эффекте его субмаксимальных суточных доз. Три исходных АЭП получали 17,2% больных. Длительность приема фоновых АЭП до назначения кеппры составила не менее 3 мес. Суточные дозы и концентрации базовых АЭП во всех наблюдениях были достаточными.
Таким образом, подавляющее большинство наблюдений ПЭ было представлено труднокурабельной височной эпилепсией с полиморфными припадками высокой частоты при длительности заболевания более 10 лет.
Что касается ИГЭ, то кеппра применялась при разных формах заболевания (табл. 3). Ее назначали в случаях недостаточной эффективности ранее назначенных препаратов, либо при их плохой переносимости. В подавляющем большинстве случаев исходная терапия проводилась с использованием одного препарата, и только в одном наблюдении юношеской абсансной эпилепсии использовались два препарата (вальпроевая кислота и этосуксимид).
Таблица 3. Распределение больных ИГЭ (n=17) по формам заболевания
| Форма эпилепсии | Kоличество больных | |
|---|---|---|
| абс. | % | |
| Юношеская миоклоническая | 8 | 47,1 |
| Юношеская абсансная | 4 | 23,5 |
| С генерализованными судорожными припадками пробуждения | 5 | 29,4 |
В случаях ПЭ и ИГЭ первоначальная доза кеппры составила 1000 мг/сут при двукратном приеме. У 2 пациентов при ПЭ эффективная терапевтическая доза составила 500 мг/сут. При недостаточной эффективности суточную дозу препарата доводили до 2000 мг, а в отдельных случаях до 3000 мг. Увеличение дозы на 500 мг проводили еженедельно в зависимости от переносимости. При этом дозы базовых АЭП не меняли.
Эффективность лечения оценивали по уменьшению числа припадков: полное их прекращение — ремиссия, улучшение — при снижении на 75% и на 50%.
До и в процессе лечения проводилось электроэнцефалографическое обследование больных и оценивалось качество их жизни по 5-балльной аналоговой шкале [1]. Поскольку основную группу больных составляли женщины, оценивали также влияние препарата на менструальную функцию.
Результаты
Как уже указывалось, в группе ПЭ более года кеппрой лечились 29 больных. При этом к концу второго года ее продолжали принимать 25 (86,2%) пациентов. В последней подгруппе ремиссия была достигнута у 8 (32%) больных; улучшение на 75% было отмечено у 3 (12%); улучшение на 50% — у 13 (52%), недостаточный эффект — у 1 (4%) пациента.
Таблица 4. Эффективность кеппры в качестве дополнительного АЭП через 12 мес при ПЭ (n=87)
| Вид припадков | Ремиссия | Уменьшение частоты припадков | Отсутствие эффекта и недостаточный эффект |
|
|---|---|---|---|---|
| более чем на 75% | более чем на 50% | |||
| Парциальные без вторичной генерализации | 3 | 2 | 6 | 3 |
| Вторично-генерализованные мономорфные | 4 | 4 | 3 | 5 |
| Сочетание парциальных и вторично-генерализованных | 15 | 5 | 27 | 7 |
| Гипермоторные припадки сна | 2 | 1 | ||
| Всего больных: абс. % |
22 25,3 |
11 12,6 |
38 43,7 |
16 18,4 |
Таблица 5. Зависимость эффекта кеппры от суточной дозы
| Доза, мг/сут Ремиссия | Ремиссия | Уменьшение частоты припадков | Отсутствие эффекта и недостаточный эффект |
|
|---|---|---|---|---|
| более чем на 75% | более чем на 50% | |||
| 1000 и ниже | 17 | 4 | 23 | 9 |
| 1250—1750 | 3 | 5 | 14 | 5 |
| 2000 и выше | 2 | 2 | 1 | 2 |
| Всего больных: абс. % |
22 25,3 |
11 12,6 |
38 43,7 |
16 18,4 |
Эффективность терапии через 12 мес при разных видах припадков отражена в табл. 4 и в зависимости от доз препарата — в табл. 5. Из этих данных видно, что полного купирования припадков на период более 12 мес удалось добиться в 25,3% наблюдений. При этом более чем у 3/4 больных ремиссия была достигнута уже при суточной дозе кеппры 1000 мг. В данной подгруппе преобладали криптогенные формы ПЭ с височной локализацией эпилептического очага. Ремиссия была достигнута в случае фармакорезистентной эпилепсии на фоне грубых структурных изменений височной доли (как последствие герпетического менингоэнцефалита) с полиморфными припадками. Приводим это наблюдение.
Больная Т., 31 года. По специальности врач-лаборант, инвалид II группы.
В возрасте 25 лет перенесла генерализованную герпетическую инфекцию с герпетическим менингоэнцефалитом. Начало заболевания было острым с повышения температуры до 38°С и герпетическими высыпаниями (Herpes labialis, Herpes genitalis). На 7-е сутки развилась серия вторично-генерализованных эпилептических припадков, после которых больная впала в кому. На фоне проведения патогенетической и симптоматической терапии состояние стало улучшаться: к концу 3-х суток стала приходить в сознание, однако в неврологическом статусе наряду с грубыми мнестическими нарушениями выявлялся левосторонний пирамидный и атактический синдромы.
Раннее развитие без особенностей. Из перенесенных заболеваний в анамнезе — вирусный гепатит А в возрасте 6 лет и острый панкреатит в 12 лет.
К эпилептологу больная обратилась через 6 мес после стационарного лечения, когда, несмотря на прием депакина хроно 2000 мг/сут и фенобарбитала 150 мг на ночь, ежемесячно регистрировалось до 2—3 вторично-генерализованных эпилептических припадков исключительно во сне со склонностью к серийному течению. Ранее для терапии использовался карбамазепин, переносимость и эффективность которого были низкими — больная практически постоянно спала, а эпилептические припадки продолжались.
В неврологическом статусе при первом обращении определялись симптомы левосторонней пирамидной недостаточности, выраженные симптомы вегетативной дистонии парасимпатической направленности, астенический синдром.
Инструментальные обследования: МРТ — киста правой височной доли (3×2 см), гипоплазия мозолистого тела. ЭЭГ — на фоне диффузных изменений регистрируется региональное замедление по правому полушарию, преимущественно в височно-центрально-лобных отведениях без тенденции к генерализации (рис. 1).
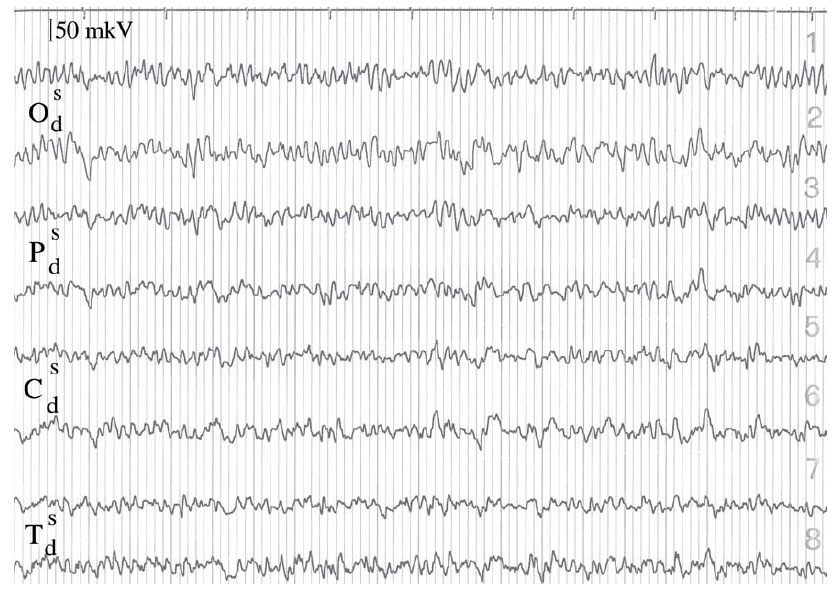
Рис. 1. ЭЭГ больной Т. в возрасте 25 лет (первые 10 с постгипервентиляционного периода).
На фоне диффузных изменений выявляется региональная эпилептиформная активность в виде замедления ритмов в правом полушарии, преимущественно в височно-центрально-лобных отведениях, без тенденции к генерализации.
С учетом того, что припадки регистрировались исключительно во сне, высоких концентраций вальпроевой кислоты в крови, фенобарбитал был заменен дифенином (впоследствии фенитоином). Ремиссии припадков в течение 4 мес удалось добиться при сочетании депакина 1500 мг/сут и фенитоина 450 мг/сут. Однако на фоне рецидива герпетической инфекции (Herpes labialis) вновь развилась серия из 5 генерализованных эпилептических припадков во сне. Клинически сразу появились признаки выраженной передозировки АЭП, несмотря на то что ранее больная удовлетворительно их переносила. Припадки стали регистрироваться и в состоянии бодрствования. Появились простые парциальные приступы в виде ощущения давления в области корня носа и состояния «уже виденного». Сложные парциальные припадки длительностью до десятков секунд иногда сопровождались автоматизированными движениями рук.
Ввиду неэффективности комбинированной терапии был введен ламиктал с постепенным повышением суточной дозы до 375 мг. На протяжении трех лет терапии было опробовано несколько схем комбинированной терапии (депакин+ ламиктал+фенитоин; ламиктал+фенитоин+клоназепам). Частота припадков несколько стабилизировалась, однако они продолжали регистрироваться практически ежемесячно. Обычно больная плохо переносила увеличение дозы АЭП — появлялись различные побочные эффекты. В частности, регистрировались тромбоцитопения, выраженная сонливость, явления периферической полиневропатии, периодически в крови повышалась концентрация ряда ферментов (АЛТ, АСТ, ГГТ). При лечении ламикталом в дозах 375 мг/сут в сочетании с фенитоином 300 мг/сут развились симптомы полиневропатии, потребовавшие госпитализации пациентки.
После появления кеппры она была назначена дополнительно к ламикталу (375 мг/сут) и фенитоину (300 мг/сут) по схеме, начиная с 1000 мг/сут с увеличением дозы по 500 мг в неделю до 2000 мг/сут. Побочных явлений отмечено не было. Начиная с назначения исходной дозы кеппры 1000 мг/сут частота припадков существенно снизилась, а с дозы 2000 мг/сут они полностью прекратились. К концу второго года наблюдения больная получает ламиктал 200 мг/сут и кеппру 2000 мг/сут. На обзорной ЭЭГ эпилептических форм активности не выявлено (рис 2).
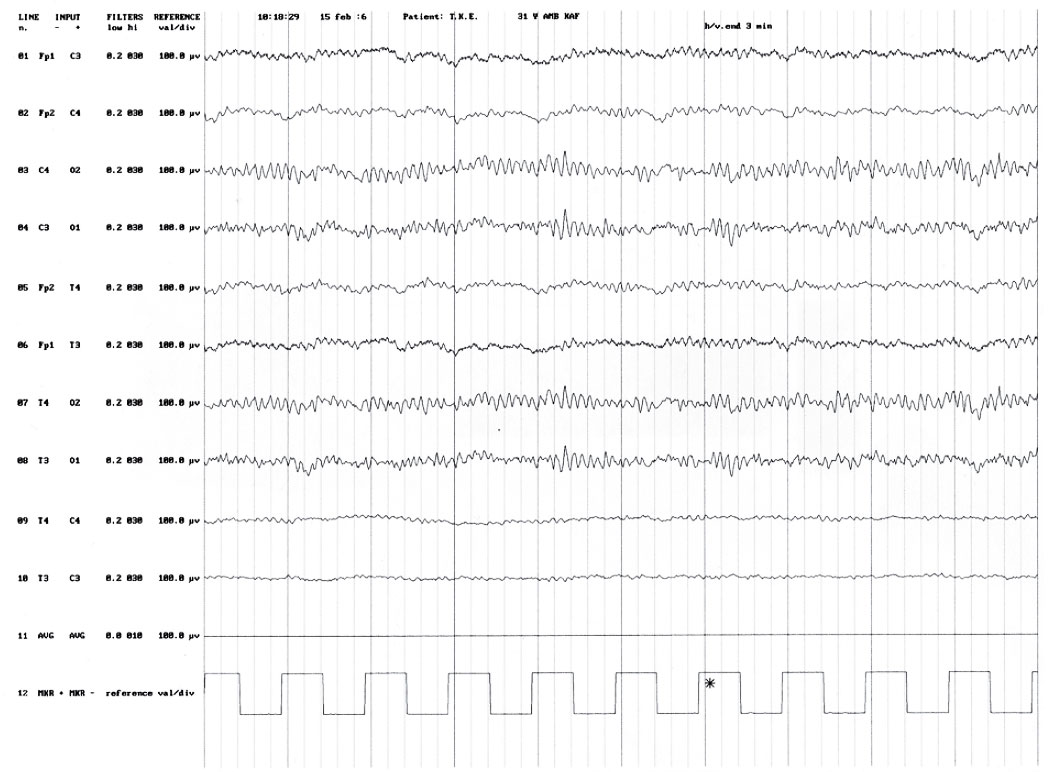
Рис. 2. ЭЭГ той же больной в возрасте 31 года — через 2 года после достижения медикаментозной ремиссии.
Особенностью наблюдения является в определенной степени выраженная недостаточность функции иммунной системы, вероятно, обусловившая развитие в детстве острого панкреатита и вирусного гепатита, а затем и герпетической инфекции с последующей эпилепсией. У пациентки была низкая толерантность к АЭП, проявлявшаяся уже на ранних этапах их назначения в виде непереносимости либо появления побочных реакций. Назначение кеппры в качестве добавочного препарата больная хорошо перенесла, несмотря на то что суточная доза обоих фоновых АЭП была максимально переносимой. Этот препарат в описанном случае оказался высокоэффективным.
Практически во всех наших наблюдениях, где эффективность терапии была достаточно выраженной (сокращение числа припадков более чем на 75%), изначальный эффект достигался уже при суточной дозе 1000 мг. Однако большее количество пациентов получали 1250—1750 мг кеппры в сутки. В тех случаях, когда была достигнута медикаментозная ремиссия, исходное соотношение парциальных и вторично-генерализованных припадков было сходным.
Основную подгруппу — 38 (43,7%) больных составили пациенты с урежением эпилептических припадков более чем на 50%. В ней также преобладали больные с сочетанием парциальных и вторично-генерализованных эпилептических припадков.
Эффективность кеппры при ПЭ оказалась недостаточной всего в 16 (18,4%) наблюдениях. Из них в 5 препарат был отменен из-за побочных явлений: первый случай характеризовался головокружением, тошнотой, головной болью и тремором [1], второй — ажитацией, третий — галлюцинозом, четвертый — несколькими проявлениями в виде атаксии, нистагма, дизартрии. Все труднопереносимые побочные явления регистрировались уже при суточной дозе 500—1000 мг, из них 2 больных самостоятельно перестали принимать препарат после нескольких его приемов. В одном наблюдении при грубом структурном дефекте височной доли головного мозга отмечено парадоксальное учащение парциальных и вторично-генерализованных припадков, потребовавшее отмены кеппры. Из других преходящих побочных эффектов отмечались седация, общая слабость, снижение настроения, эмоциональная неустойчивость. Эти явления проходили достаточно быстро на этапе титрования дозы. В 11 (из 16) наблюдений комбинированной терапии, где эффективность лечения оказалась недостаточной, в течение 1—3 мес назначались суточные дозы до 1000 мг (к сожалению, препарат до сих пор не входит в льготный список, и мы не могли далее повышать дозу кеппры из-за материального положения пациентов).
В группе ИГЭ кеппру в качестве монотерапии на протяжении 2 лет получали две пациентки. В обоих случаях была достигнута медикаментозная ремиссия. При юношеской миоклонической эпилепсии комбинированная терапия кеппрой в сочетании с вальпроевой кислотой позволила добиться медикаментозной ремиссии у 6 (75%) из 8 больных; в одном наблюдении (12,5%) частота припадков понизилась более чем на 75% и еще в одном — более чем на 50%. В случаях абсансной эпилепсии у 3 (75%) больных удалось добиться медикаментозной ремиссии; в одном случае частота припадков понизилась более чем на 75%. При ИГЭ с генерализованными судорожными припадками у 4 (80%) больных была достигнута медикаментозная ремиссия, в одном случае эффективность комбинированной терапии была недостаточной — урежение припадков менее чем на 50%. Из группы больных, у которых удалось достичь медикаментозной ремиссии 4 из 13 в последующем были переведены на монотерапию кеппрой, в оставшихся 9 случаях коррекция терапии проводится до настоящего времени. Во всех наблюдениях с ИГЭ пациенты продолжают получать кеппру.
На ЭЭГ после применения кеппры при ПЭ и ИГЭ выявлено понижение индекса пароксизмальной активности. В большинстве наблюдений при ПЭ отмечалась тенденция к замещению генерализованной эпилептиформной активности фокальной.
Согласно данным 5-балльной аналоговой шкалы, практически во всех случаях (исключение составили наблюдения, где кеппра оказалась недостаточно эффективной) отмечено повышение качества жизни. Важен тот факт, что положительный клинический эффект в отдельных случаях достигался даже при недостаточной эффективности препарата в отношении припадков.
Обсуждение
Кеппра (леветирацетам) оказалась высокоэффективным АЭП при медикаментозно резистентной эпилепсии при применении в качестве дополнительного препарата к базовым АЭП с различным механизмом действия (как с ферментиндуцирующими АЭП, так и с неиндукторами). Медикаментозная ремиссия на период свыше 12 мес достигнута в 25,3% наблюдений, урежение припадков более чем на 75% — в 12,6%, более чем на 50% — у 43,7% пациентов. Недостаточная эффективность комбинированной терапии отмечена всего в 18,4% наблюдений. Все больные ранее без успеха лечились различными комбинациями АЭП, в том числе такими препаратами последней генерации, как топирамат, тиагабин и габапентин. Данные литературы [10] свидетельствуют об идеальном соотношении для кеппры показателей эффективности/ переносимости в сравнении с окскарбазепином, зонисамидом, габапентином, топираматом и тиагабином. По этим данным, эффективность и переносимость топирамата, зонисамида, окскарбазепина и тиагабина была меньшей, чем у кеппры, а габапентин и ламотриджин оказались в группе с меньшей эффективностью, но лучшей переносимостью по отношению к кеппре.
Показатели эффективности кеппры за 6-месячный период наблюдения, отраженные нами в предыдущей публикации [1], вполне сопоставимы с результатами применения комбинированной терапии в течение 12 и 24 мес (рис. 3). По нашему мнению, это не может быть объяснено малой выборкой и коротким сроком приема АЭП и, вероятно, отражает истинную антиэпилептическую активность препарата. Несколько более высокий процент случаев отсутствия клинического улучшения у больных ПЭ по сравнению с предыдущей публикацией может быть обусловлен широким назначением кеппры в случаях симптоматической ПЭ с грубыми структурными поражениями головного мозга. Напротив, лучшие результаты комбинированной терапии через 24 мес наблюдения объясняются «отсевом» тех больных, у которых терапия оказалась неэффективной.
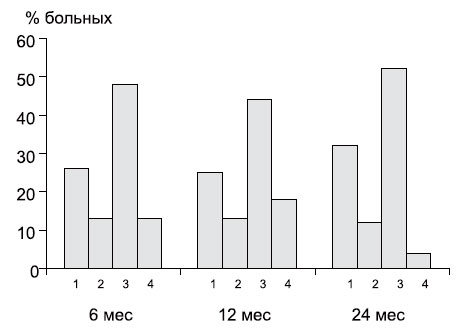
Рис. 3. Эффективность комбинированной терапии кеппрой при ПЭ через 6, 12 и 24 мес наблюдения.
1 — ремиссия; 2 — уменьшение частоты припадков более чем на 75%; 3 — более чем на 50%; 4 — отсутствие эффекта.
Очень высоким оказался процент больных, которые лечились два года (86,2%), что связано как с хорошей переносимостью, так и с эффективностью препарата. На достаточно высокую эффективность кеппры в качестве дополнительного средства терапии труднокурабельной ПЭ обращают внимание и другие авторы [16]. При этом обычно суточная доза препарата достигает 3000 мг. В нашем случае клиническая ремиссия либо урежение припадков часто достигались уже при суточной дозе 1000 мг.
Факт хорошей переносимости кеппры в комплексной терапии труднокурабельной ПЭ согласуется с данными других исследователей [13]. Только в 5 наших случаях кеппра была отменена. Из них у 1 больного причиной было учащение эпилептических припадков, а 2 больных после начала терапии сами прекратили ее прием по причине ажитации и галлюциноза. Это дает нам основание подчеркнуть необходимость осторожного применения кеппры у пациентов с психическими нарушениями в анамнезе, на что обращают внимание и другие авторы [7, 14].
Возможность широкого применения кеппры в качестве добавочного препарата обусловлена также тем, что при его назначении феномен парадоксального учащения эпилептических припадков наблюдается крайне редко — не чаще, чем при использовании плацебо [11]. В нашем исследовании парадоксальное учащение эпилептических припадков зарегистрировано всего в одном случае (0,9%), хотя по данным литературы [9] процент учащения припадков может достигать 23,2 (правда, это касается детей и подростков).
Недостаточная эффективность кеппры, выявленная нами у 11 (12,6%) больных ПЭ — незначительная величина. Она ниже показателей, приводимых в других публикациях [5]. В данной подгруппе больных преобладали суточные дозы до 1000 мг, что не позволяло оценить истинный потенциал препарата.
Учитывая то обстоятельство, что препарат не метаболизируется в печени и 2/3 его выделяется в неизмененном виде, его можно без особых опасений назначать в качестве дополнительного АЭП. Это достаточно четко проиллюстрировано приводимым клиническим наблюдением.
Важным показателем эффективности терапии кеппрой явилось повышение качества жизни больных, вероятно, в связи с нормотимическим и ноотропным действием препарата и положительным влиянием его на когнитивные функции [1].
В рамках настоящего исследования было проанализировано влияние препарата на менструальную функцию: ни в одном из наблюдений изменений менструального цикла зарегистрировано не было, что свидетельствует об отсутствии влияния кеппры на обмен женских половых гормонов. Поэтому препарат может оцениваться как весьма перспективный для использования у больных эпилепсией женщин при лечении катамениальной эпилепсии, а также при сопутствующей эпилепсии акушерско-гинекологической патологии в пери- и постменопаузальном периоде. В связи с этим важно отметить, что не выявлено тератогенных свойств кеппры при ее применении в режиме монотерапии [4, 17]. В отношении грудного вскармливания следует учитывать низкую способность (около 10%) кеппры связываться с белками крови. Поэтому она должна поступать с молоком матери ребенку.
Что касается ИГЭ, то эффективность кеппры в этих случаях в наших наблюдениях достигала 75—80% вне зависимости от формы эпилепсии. При этом около 25% больных (4 из 13) после достижения ремиссии оказалось возможным перевести на монотерапию кеппрой, а двое непрерывно получали препарат на протяжении 2 лет.
Ранее эффективность кеппры при ИГЭ была показана и при монотерапии [6, 8]. Мы также располагаем более чем 10 наблюдениями эффективности препарата в качестве монотерапии при ПЭ и ИГЭ, и этот материал продолжает накапливаться. К сказанному следует добавить, что имеются публикации об успешном переводе больных с поли- на монотерапию кеппрой [16], а также о возможности назначения препарата при впервые диагностированной ПЭ [3] и ИГЭ [8].
Резюмируя результаты проведенного исследования можно констатировать высокую эффективность кеппры в отношении фармакорезистентных форм ПЭ и ИГЭ в качестве дополнительного АЭП. Крайне важным оказался тот факт, что у большинства больных препарат действовал уже в дозе 1000 мг. Это подтверждает высказываемое в литературе мнение, что если АЭП оказывается эффективным, то его действие проявляется уже при невысоких и средних терапевтических дозах [11, 15]. Положительный клинический эффект коррелировал с улучшением характеристик ЭЭГ и показателей качества жизни больных. Переносимость препарата в большинстве наблюдений была очень хорошей. В единичных случаях препарат был отменен из-за побочных явлений, одно из которых заключалось в парадоксальном учащении припадков. Преходящие побочные эффекты относились к ЦНС и самостоятельно купировались, обычно на этапе титрования. Препарат не влиял на репродуктивную функцию женщин. Высокая эффективность при использовании в составе комплексной терапии свидетельствует о перспективности применения кеппры при разных формах эпилепсии. По своим клиническим (эффективность, переносимость), фармакокинетическим и фармакодинамическим характеристикам этот препарат приближается к «идеальному» АЭП.
Литература
- Карлов В.А., Власов П.Н. Эффективность кеппры в составе комплексной терапии при фармакорезистентной эпилепсии у взрослых. Журн невропатол и психиат 2005; 105: 7: 38—44.
- Мухин К.Ю., Пилия С.В., Чадаев В.А. и др. Кеппра в лечении эпилепсии: эффективность и переносимость. Журн невропатол и психиат 2005; 105: 1: 49—51.
- Alsaadi T.M., Thieman C. Levetiracetam monotherapy for newly diagnosed epilepsy patients. Seizure 2003; 12: 154—156.
- Berg K., Samren E.B., Oppen A.C. et al. Levetiracetam use and pregnancy outcome. Reprod Toxicol 2005; 20: 175—178.
- Betts T., Yarrow H., Greenhill L., Barrett M. Clinical experience of marketed Levetiracetam in an epilepsy clinic — a one year follow up study. Seizure 2003; 12: 136—140.
- Bonaventura C., Fattouch J., Mari F. et al. Clinical experience with levetiracetam in idiopathic generalized epilepsy according to different syndrome subtypes. Epileptic Disord 2005; 7: 3: 231—235.
- Brodie M.J., French J.A. Role of levetiracetam in the treatment of epilepsy. Epileptic Disord 2003; 5: Suppl 1: 65—72.
- Cohen J. Levetiracetam monotherapy for primary generalised epilepsy. Seizure 2003; 12: 150—153.
- Coppola G., Mangano S., Tortorella G. et al. Levetiracetam during 1-year follow-up in children, adolescents, and young adults with refractory epilepsy. Epilepsy Res 2004; 59: 35—42.
- Eng C.O., Arrigo C., Rijckevorsel K., French J.A. Meta-analysis and indirect comparisons of Levetiracetam with other second-generation antiepileptic drugs in partial epilepsy. Clin Neuropharmacol 2005; 28: 72—78.
- French J., Edrich P., Cramer J.A. A systematic review of the safety profile of levetiracetam: a new antiepileptic drug. Epilepsy Res 2001; 47: 77—90.
- French J., Nicola S., Arrigo C. Fast and sustained efficacy of levetiracetam during titration and the first 3 months of treatment in refractory epilepsy. Epilepsia 2005; 46: 8: 1304—1307.
- Harden C. Safety profile of levetiracetam. Epilepsia 2001; 42: Suppl 4: 36—39.
- Kossoff E.H., Bergey G.K., Freeman J.M. et al. Levetiracetam psychosis in children with epilepsy. Epilepsia 2001; 42: 1611—1613.
- Kwan P., Brodie M. Early identification of refractory epilepsy. N Engl J Med 2000; 342: 314—319.
- Mohanraj R., Parker P.G., Stephen L.J., Brodie M.J. Levetiracetam in refractory epilepsy: a prospective observational study. Seizure 2005; 14: 23—27.
- Morrow J.I., Russell A., Gutherie E. et al. Malformation risks of antiepileptic drugs in pregnancy: a prospective study from the UK epilepsy and pregnancy register. J Neurol Neurosurg Psychiat published online 12 sep 2005; doi:10.1136/jnnp.2005.0742203.
- Perucca E., Johannessen S.I. The ideal pharmacokinetic properties of an antiepileptic drug: how close does levetiracetam come? Epileptic Disord 2003; 5: Suppl 1: 17—26.
