Анти-В клеточная терапия синдрома и болезни Шёгрена
СтатьиОпубликовано в журнале:
«Научно-практическая ревматология» 2008, приложение к № 1, С. 34-39
Васильев В.И., Логвиненко О.А., Кокосадзе Н.В.*, Насонов ЕЛ.
ГУ Институт ревматологии РАМН, Российский онкологический научный центр РАМН*, Москва
Болезнь Шёгрена (БШ) - распространенное системное заболевание неизвестной этиологии, характерной чертой которого является хронический аутоиммунный процесс в секретирующих эпителиальных железах с развитием паренхиматозного сиалоаденита с ксеростомией и сухого конъюнктивита/кера-токонъюнктивита. Синдром Шёгрена (СШ) - лимфоидная инфильтрация слюнных и слёзных желёз, развивающееся у 5-25% больных с системными заболеваниями соединительной ткани, чаще ревматоидным артритом (РА), реже системной красной волчанкой (СКВ) и другими аутоиммунными заболеваниями [1]. В-клеточная гиперактивность (слайд-1) лежит в основе патогенетических механизмов развития БШ/СШ и проявляется лимфоидной инфильтрацией как секретирующих эпителиальных желёз, так других органов и тканей, образованием аутоантител (РФ,АНФ,Ro/La) и криоглобулинов с моноклональным РФ в составе, а также развитием у 5-16% больных преимущественно В-клеточных лимфом [1-5]. Частота развития неходжкинских лимфом (НХЛ) при БШ в 44-50 раз выше, чем в общей популяции [3]; превалируют экстранодальные лимфомы MАLT-типа, развивающиеся в слюнных железах [4,5]. В общем НХЛ составляют только 2-5% неоплазм слюнных желёз, но 50% MALT-лимфом слюнных желёз развиваются из лимфоэпителиальных поражений при БШ/CШ[6]. Генерализованный криоглобулинемический васкулит, НХЛ, аутоиммунные панцитопении являются основными причинами смерти больных БШ (частота 37,7%, 34,5% и 6,6%, соответственно) [2,3,4,7]. В настоящее время отсутствуют чётко доказанные, эффективные принципы терапии некоторых состояний (MALT-лимфом, генерализованных васкулитов и аутоиммунных панцитопений), развивающихся у больных БШ/СШ, что стимулирует исследователей к использованию новых подходов в лечении у данной категории больных.
Слайд 1.
Предпосылки для использования ритуксимаба при болезни Шёгрена.
В-клеточная гиперреактивность лежит в основе патогенетических механизмов развития БШ/СШ и проявляется лимфоидной инфильтрацией как секретирующих эпителиальных желёз, так и других органов и тканей, образованием аутоантител (РФ.АНФ. Ro/La) и криоглобулинов с моноклональным РФ в составе, а также развитием у 5-16% больных преимущественно В-клеточных неходжкинских лимфом (НХЛ). Генерализованный криоглобулинемический васкулит, НХЛ, аутоиммунные панцитопении являются основными причинами смерти больных БШ( частота 37,7%, 34,5% и 6,6% соответственно).
Ритуксимаб - химерное анти-СD20 моноклональное антитело, которое связывается с антигеном СD20 на поверхности В-клеток, в настоящее время активно используется в лечении В-клеточных лимфом [8]. Он считается одним из самых перспективных препаратов в лечении различных аутоиммунных заболеваний, таких как БШ, СКВ, РА и криоглобулинемический васкулит [9,10]. Гипотеза о том, что В-клетки играют ключевую роль в патогенезе БШ базируется на cледующих доказательствах (слайд 1,2) значительно меньшее количество В-клеток с фенотипом CD19+/CD27+/IgD+ в периферической крови больных БШ, по сравнению со здоровыми лицами или больными РА; более высокое содержание активированных В-клеток в крови больных БШ, чем у здоровых лиц или больных РА; СD19+,CD20+ и CD27+ В-клетки в значительном количестве выявляются в биоптатах околоушных слюнных желёз, причём активированные В-клетки составляют 10-20% клеточного инфильтрата на ранних стадиях и 50-70% на поздних стадиях заболевания [11,12]. Основываясь на вышеизложенном, нами проведено исследование по эффективности и безопасности использования препарата ритуксимаб в терапии осложненных форм болезни и синдрома Шёгрена.
Слайд 2. Гипотеза о ключевой роли В-клеток в патогенезе болезни Шёгрена
- Значительно меньшее количество В-клеток с фенотипом CD19+/CD27+/lgD+ в периферической крови больных БШ по сравнению со здоровыми лицами или больными ревматоидным артритом.
- Более высокое содержание активированных В-клеток в крови больных БШ, чем у здоровых лиц или больных ревматоидным артритом.
- CD19+, CD20+, CD27+ В-клетки в значительном количестве выявляются в биоптатах околоушных слюнных желёз, причём активированные В-клетки составляют 10-20% клеточного инфильтрата на ранних стадиях и 50-70% на выраженных и поздних стадиях заболевания.
Материалы и методы.
Проведена оценка эффективности и переносимости препарата Рт в лечении осложненных форм БШ/СШ (слайд 3,4). Медиана возраста до начала лечения составила 55 лет (размах 48-57лет), медиана длительности течения заболевания была 10 лет (размах 7-20 лет). Всем больным перед введением ритуксимаба в стандартной дозе 375мг/м2 проводилась пульстерапия (ПТ метилпреднизолоном 500мг внутривенно капельно), на следующий день после введения ритуксимаба проводилась комбинированная ПТ (500мг метилпреднизолона + 1,0г циклофосфана внутривенно капельно). Отдельные больные получали монотерапию ритуксимабом, стандартные режимы полихимиотерапии или другие иммуносупрессивные препараты. Диагноз НХЛ ставился согласно классификации ВОЗ [13,14]. Больные обследовались полностью до и после окончания терапии, рестадирование НХЛ проведено через 2 месяца после окончания терапии. Клеточный мониторинг субпопуляций Т и В-лимфоцитов в периферической крови проводился до, через неделю после 2-й инфузии, через неделю, 3 и 6 месяцев после последнего введения ритуксимаба.
Слайд 3,4.
| Клинические проявления | Наличие лимфомы | Кол-во инфузий | Ассоциированная терапия | Результат лечения | |
| 1-БШ | Интерстициальный пневмонит Генерализованная лимфаденопатия |
В-ККЛ. IV ст | 6 | СНОР | Полная ремиссия |
| 2-БШ | Пурпура Канальцевый ацидоз Интерстициальный пневмонит Регионарная лимфаденопатия |
Маргинальной зоны лимфоузлов, II А ст. | 6 | СОР | Полная ремиссия |
| 3-БШ | Увеличение ОУЖ Интерстициальный пневмонит |
MALT- лимфома II Е | 4 | - | Частичная ремиссия |
| 4-БШ | Пурпура Выпотной серозит Гломерулонефрит с нефротическим синдромом Полинейропатия Артриты |
- | 5 | КПТ | Летальный исход |
| 5-БШ | Пурпура Гломерулонефрит Полинейропатия |
- | 2 | КПТ | Полная ремиссия |
| 6-БШ | Увеличение ОУЖ Регионарная лимфаденопатия |
MALT- лимфома II Е | 5 | КПТ | Полная ремиссия |
| 7-БШ | Увеличение ОУЖ Инфильтрат в мягких тканях лица Регионарная лимфаденопатия |
MALT- лимфома III ст | 6 | Лейкеран 6 мг/л | Полная ремиссия |
| 8-БШ | Увеличение ОУЖ | MALT- лимфома I Е ст. | 4 | КПТ | Полная ремиссия |
| 9-БШ | Увеличение ОУЖ Интерстициальный пневмонит Фотодерматоз Аутоиммунный тиреоидит |
MALT- лимфома I Е ст. | 4 | КПТ | Полная ремиссия |
| 10-БШ | Увеличение ОУЖ | MALT- лимфома I Е ст. | 6 | Алкеран 10 мг/л | Полная ремиссия |
| 11-БШ | Пурпура Язвенно-некротический васкулит Полимиелорадикулоневрит Панцитопения Генерализованная лимфаденопатия |
- | 4 | КПТ | Полная ремиссия |
| 12-БШ | Артриты Генерализованная лимфаденопатия |
Фолликулярная лимфома | 6 | СНОР | Частичная ремиссия |
| 13--БШ | Артриты | - | 5 | ПТ+Лейкеран 2 мг/л | Полная ремиссия |
Результаты.
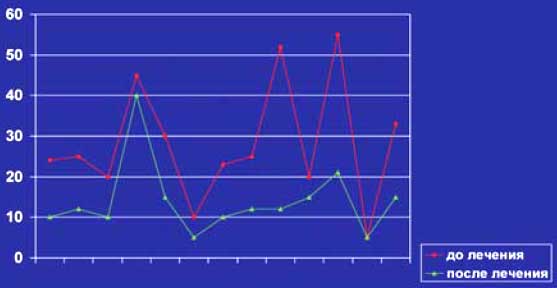
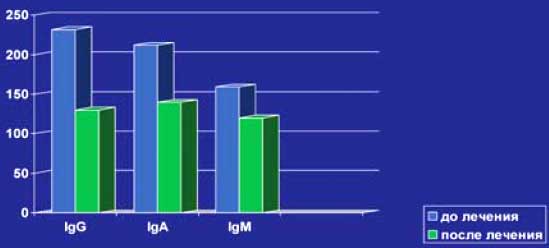
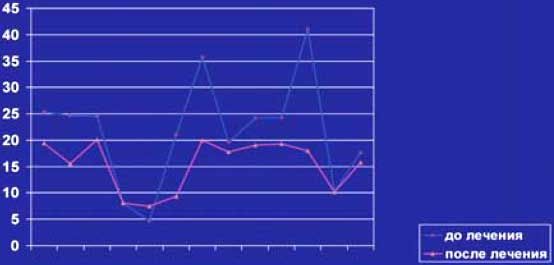
У 7 из 9(78%) больных достигнута полная ремиссия лимфомы, у 2 больных наблюдалась частичная ремиссия. У 5 из 6(83%) больных Рт оказал положительное влияние на системные проявления. Одна больная БШ с генерализованным криоглобулинемическим васкулитом оказалась рефрактерной к проводимой терапии Рт+КПТ и погибла в стационаре от некупируемого отёка легких. Субъективное улучшение стоматологических и офтальмологических проявлений заболевания наблюдалось у 12 из 13(92%), тогда как объективное улучшение подтверждено только у 6 из 13(46%) больных. Динамика лабораторных проявлений до и после терапии в настоящем исследовании представлена на слайдах № 5-8. У всех 7(100%) больных со значительным увеличением ОУЖ наблюдалась нормализация размеров слюнных желёз и внутрижелезистых лимфоузлов. Рестадирование лимфомы через 2 месяца после окончания курсов терапии Рт+КПТ с повторным иммуноморфологическим исследованием биоптата околоушных слюнных желёз показало полное отсутствие опухолевого субстрата у больной (слайды 9-12). Рецидивы криоглобулинемической пурпуры не наблюдались у 2(100%) больных, также как перестал обнаруживаться моноклональный IgMk в крови после окончания лечения (слайд 8). Деплеция CD19+ клеток достигнута после второй инфузии Рт у 12 из 13 больных и сохранялась в течение 3-6 месяцев после завершения исследования. Статистически достоверно снижались уровни СОЭ (р=0,002), медиана уровней IgG, IgA, IgM иммуноглобулинов (р=0,05-0,002). У 7 больных перестал определяться IgM РФ (54%), тогда как у 6(46%) пациентов титры его значительно снизились.
Слайд 5. Динамика уровня СОЭ, мм/ч
Слайд 6. Динамика среднего уровня иммуноглобулинов, МЕ/мл
Слайд 7. Динамика уровня гамма-глобулинов.%
Слайд 8. Динамика криоглобулинемии и моноклональной секреции иммуноглобулинов
| Криоглобулины | Моноклональные Ig | ||
| До лечения | после | До лечения | после |
| отр | отр | отр | отр |
| отр | отр | отр | отр |
| отр | отр | отр | отр |
| 4+ | 4+ | отр | - |
| 4+ | отр | Mk+BJk | отр |
| 2+ | отр | отр | отр |
| 4+ | отр | отр | отр |
| отр | отр | отр | отр |
| 4+ | отр | Mk | отр |
| отр | отр | Gk+BJk | Gk+BJk |
| 4+ | отр | отр | отр |
| отр | отр | отр | отр |
| отр | отр | отр | отр |
Слайд 9.
5 курсов с интервалом в 14 дней:
1-ый день метипред 500 мг + Мабтера 500 мг,
2-ой день метипред 500 мг + циклофосфан 1000 мг
 |
 |
Слайд 10. Морфологическая картина околоушной слюнной железы ДО и ПОСЛЕ лечения
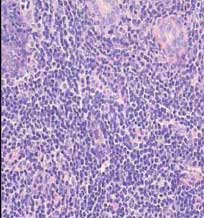 |
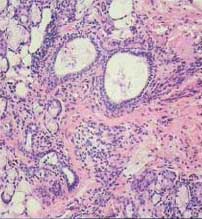 |
Слайд 11. Иммуногистохимическая и молекулярная картина околоушной слюнной железы
| до лечения | после лечения | |
| В-клетки CD20+ | 85% | 25% |
| Т клетки CD3+ | 15% | 75% |
| IgM ппазматич клетки | 25% | 2% |
| Ki-67 пролиферативная активность. | 25% | 0 |
| к/λ соотношение | 3 | 1 |
| Моноклональность тяжелых цепей Ig (ПЦР) | есть | нет |
Слайд 12. Динамика показателей
| до лечения | после лечения | |
| CD19+ | 6,1% | 0,2% |
| Криоглобулины | есть | нет |
| РФ | 1/160 | нет |
| АНФ | 1/320 | 1/160 |
| Сиалометрия, мл | 0,5 | 3 |
| Тест Ширмера, мм | 3 | 8 |
Побочных проявлений при проведении терапии Рт не наблюдалось.
Динамическое наблюдение продолжено за 11 больными с медианой наблюдения 8,5 месяцев. Одна больная погибла от псевдомембранозного колита на фоне необоснованного и длительного применения антибиотиков. Обострения заболевания не наблюдалось. У больной с частичной ремиссией MALT-лимфомы ОУЖ после монотерапии ритуксимабом развился рецидив лимфомы через месяц после окончания терапии. У больной с генерализованным криоглобулинемическим васкулитом через 7 месяцев после проведения 2-х инфузий вновь появились рецидивы пурпуры, в крови стал определяться IgMk. Обе больные повторно пролечены Рт в сочетании с КПТ с хорошим результатом.
Обсуждение.
В табл.1 представлены литературные данные по применению ритуксимаба у больных БШ. Начиная с первого сообщения Shih W.J.[15] до 2005 года описывались единичные больные БШ с лимфомами, получавшими Рт в виде монотерапии или в сочетании с полихимиотерапией, с положительными результатами у всех больных. Некоторые исследователи отмечали положительное воздействие на железистые и внежелезистые проявления БШ [16,17,18, 19,20,21]. Монотерапия ритуксимабом эффективна у 40-50% больных БШ с MALT-лимфомами I-IIE стадии и у 80-100% больных не только с индолентными, но и высокоагрессивными диффузными В-крупноклеточными лимфомами (ДВККЛ) в комбинации с различными цитотоксиче-скими препаратами [22-25]. Использование комбинации RСНОР (ритуксимаб, циклофосфан, доксирубицин, винкристин, преднизолон) увеличила в три раза выживаемость больных БШ с ДВККЛ, по сравнению с использованием только курсов СНОР (100% против 18-36%) [2,26].
Таблица 1. Эффективность терапии ритуксимабом.
| Количество больных | Показания для терапии Рт | Эффективность при НХЛ | Эффективность при системных проявлениях | Влияние Рт на субъективные проявления БШ | Влияние на объективные проявления БШ | Побочные эффекты | |
| Shih. 2002 (15) | 1 | HXJI | + | НО | + | + | - |
| Somer. 2003 (16) | 1 | НХЛ | + | О | + | + | - |
| Vjulgarelis 2004 (17) |
4 | НХЛ 4/4 | + 4/4(100%) |
3/3(100%) | НО | - | 2/4(50%) 2 ИР |
| Homer. 2004 (18) | 1 | НХЛ | + | О | + | - | НО |
| Ramos-Casals, 2004 (19) | 2 | НХЛ 2/2 | + 2/2 (100%) |
О | НО | - | НО |
| Pijpe. 2005 (20) | 1 | НХЛ | + | О | + | + | - |
| Gottenberg, 2005 (28) | 6 | НХЛ 2/6 | 1/2(50%) | О | 3/6(50%) | 0/2 | 2/6 (33%), 1-ИР, 1-СР |
| Pijpc. 2005 (23) | 15 | НХЛ 7/15 | 3/7(43%) | О | + 10/14(70%) |
2/7 с НХЛ(28%) 10/15(66%) |
6/14(43%) 2-ИР, 3-СР |
| Ring, 2005 (21) | 1 | Канальцевый ацидоз | - | О | + | + | - |
| Voulgarelis. 2006 (26) | 6 | НХЛ 6/6 | 6/6(100%) | 3/6(50%) | - | - | 2/6(33%) |
| Devauchelle-Pensec, 2007 (24) | 16 | Железистые поражения 15/16 | - | 1/1(100%) | + | - | 4/16(24,8%) 3-ИР, 1-СР |
| Seror, 2007 (22) | 16 | Системные проявления 11/16 НХЛ 5/16 |
4/5 (80%) | 9/11(82%) | 5/16(36%) | 2/16(18%) | 3/16( 19,8%) 2-И Р, 1-СР |
| Васильев, 2006 (27) | 1 | Криоваскулит, панцитопения | - | 1/1(100%) | + | + | - |
| Настоящее исследование | 13 | Системные проявления 4/13, НХЛ 9/13 | 7/9(78%) | 5/6(83%) | 12/13(92%) | 6/13(46%) | - |
"+" -положительное влияние Рт на НХЛ, железистые и внежелезистые проявления БШ. "-" отсутствие НХЛ; побочных эффектов, влияния на железистые и внежелезистые проявления заболевания. НО- не оценивались. О-отсутствие системных проявлений заболевания. ИР- инфузионные реакции, СР-сывороточные реакции с обнаружением антихимерных антител.
Несмотря на высокую частоту субъективных улучшений состояния слюнных/слёзных желёз у 36-92% больных БШ [22,23,28], объективное увеличение саливации и лакримации наблюдается только у 18-46% больных с незначительной длительностью заболевания и наличием остаточной саливации [23,27]. Только в последних двух исследованиях оценено влияние терапии ритуксимабом на внежелезистые проявления заболевания
Частота положительной оценки колеблется от 50-100%, следует отметить, что в этих исследованиях использовалась комбинация его с различными цитотоксическими препаратами, КПТ и полихимиотерапией, и только у одного больного использовалась монотерапия с хорошим эффектом относительно легочных проявлений заболевания [22,24,27]. Во всех опубликованных исследованиях чётко показана эффективность ритуксимаба у больных с криоглобулинемической пурпурой, гломерулонефритом, альвеолитом, стойким синовитом и стабилизация или улучшение неврологических проявлений, связанных с васкулитом [17,19,22,26,27]. Описаны отдельные случаи криоглобулинемических васкулитов рефрактерных к ритуксимабу [22,24]. Как правило, такая рефрактерность была связана с отсутствием полной деплеции CD19+ клеток в периферической крови [24], как и в настоящем исследовании, или наличием недиагностированной лимфомы до начала терапии [22]. Монотерапия ритуксимабом статистически не влияла на снижение каких-либо показателей воспалительной и иммунологической активности, за исключением достоверного снижения IgM РФ и IgA РФ у больных с БШ [23]. При использовании его в комбинации с КПТ, различными цитостатиками и полиохимиотерапией, статистически достоверно снижаются уровни у-глобулинов, IgG, РФ, Р-2 микроглобулина [22,26,27], а в настоящем исследовании также достоверно снижались уровни СОЭ, IgA/ IgM, IgM РФ и переставали определяться криоглобулины у всех 8(100%) больных. В 2 случаях исчезла следовая секреция IgMk. Применение ритуксимаба позволяет снизить фоновые дозы принимаемого преднизолона [22]. Инфузионные реакции, связанные с введением препарата описывались у 30% больных в первых исследованиях [18,28] и практически не наблюдаются при введении препарата со скоростью не превышающей 100 мг. в час [24]. Сывороточные реакции с обнаружением антихимерных антител описывались ранее у 30-43% больных, получавших препарат без премедикации гормональными препаратами [23,24]. При использовании 100 мг метилпреднизолона в качестве премедикации минимальные клинические проявления сывороточных реакций наблюдались у 6% больных и гриппоподобные проявления у 12% больных при первой инфузии [22]. При использовании 500 мг метилпреднизолона для премедикации в нашем исследовании каких-либо побочных реакций мы не наблюдали.
В заключении следует отметить, что ритуксима эффективен при лечении железистых проявлений с ранней стадией БШ/CШ и сохранившейся остаточной секрецией секретирующих эпителиальных желёз, а также внежелезистых (криоглобулинемическая пурпура, гломерулонефрит, полинейропатия, интерстициальные поражения легких, стойкий синовит, аутоиммунная панцитопения) проявлений заболевания. Монотерапия менее эффективна по сравнению с комбинированной терапией с антилимфопролиферативными препаратами, КПТ и полихимиотерапией в лечении НХЛ и системных проявлений БШ/CШ. Терапия хорошо переносится с минимальным количеством побочных эффектов при правильной премедикации и медленной инфузии препарата.
Дальнейшие контролируемые исследования необходимы, чтобы подтвердить эффективность Рт при лечении различных форм БШ/СШ.
ЛИТЕРАТУРА
1. Васильев В.И., Симонова М.В., Сафонова Т.Н. Болезнь Шёгрена. В кн. Насонова В.А., Бунчук Н.В. (ред.), Ревматические болезни, М., Медицина; 1997, 196-210.
2. Васильев В.И., Пробатова Н.А., Тупицын Н.Н. и др. Лимфопролифера-тивные заболевания при болезни Шёгрена. Онкогематология 2007; 3 : 16-26.
3. Kassan S.S., Thomas T.L., Mout-sopoulos H.M., et al. Increased risk of lymphoma in sicca syndrome. Ann. Intern. Med .1978, 89: 888-892.
4. Voulgarelis M., Dafni U.G., Isenberg D.A., et al. Malignant lymphoma in primary Sj?gren's syndrome. A multicenter, retrospective, clinical study by the European Concerted Action on Sjgren's syndrome. Arthritis Rheum.1999; 42: 1765-1772.
5. Васильев В.И., Пробатова Н.А., Тупицин Н.Н. и др. MALT-лимфомы при болезни Шёгрена. Тер.Арх. 2006; 1, 45-49.
6. Harris N.L Lymphoid proliferations of the salivary glands. Am.J.Clin.Pathol. 1999; 111(Suppl.1) : 94-103.
7. Васильев В.И. Болезнь Шёгрена: клинико-лабораторные, иммуноморфо-логические проявления и прогноз. Дис. док.мед.наук - Москва, 2007.
8. Поддубная И.В. Лечение индолентных неходжкинских лимфом. Практическая Онкология. 2004; 5(3): 203-208.
9. Насонов Е.Л., Соловьев С.К. Перспективы применения моноклональных антител к В-лимфоцитам (Ритуксимаб) при воспалительных ревматических заболеваниях. Научно-практическая ревматология. 2007; 1: 4-8.
10. Silverman G.J., Weisman S. Rituximab therapy and autoimmune disorders. Arthr.Rheum. 2003; 48(6): 1484-1491.
11. Cohen S.B. B-cell depletion for rheumatic disease: where are we? Med.Gen.Med. 2005 ; 7(2):1-13.
12. Родионова Е.Б., Васильев В.И., Прокопенко В.Д., Логвиненко О.А. Антигенпредставляющие клетки лимфо-гистиоцитарного инфильтрата при болезни Шёгрена. Научно-практическая ревматология. 2006; 3 : 16-20.
13. Harris N., Jaffe E., Diebold J et al. The World Health Organization classification of neoplastic diseases of the hematopoetic and lymphoid tissues: report of the clinical advisory committee Meeting, Airlie House, Virginia, November, 1997. Ann.Oncol..1999; 10 : 1419-1432.
14. Carbone P.P., Kaplan H.S., Musshoff K. et al. Report on the Committee on Hodgkin 's Desease Studing Classification. Cancer Res.1971; 31 : 1860-1861.
15. Shih W.J., Ghesani N., Hongming Z. et al. F-18 FDG positron emission tomography demonstrates resolution of non-Hodgkin's lymphoma of parotid gland in a patient with Sjogren's syndrome: before and after anti-CD20 antibody rituximab therapy. Clin. Nucl.Med.2002; 27: 142-143.
16. Somer B.G., Tsai D.E., Downs L et.al. Improvement in Sjogren's syndrome following therapy with rituximab for marginal zone lymphoma. Arthr.Rheum.2003; 49(3) : 394-398.
17. Voulgarelis M., Giannouli S., Anagnostou D., Tzioufas A.G. Combined therapy with rituximab plus cyclophosphamide/doxorubicin/vincristine/prednisone [CHOP] for Sjogren's syndrome-associated B-cell aggressive non-Hodgkin's lymphomas. Rheumatology [Oxford].2004; 43: 1050- 1053.
18. Harner R.S.,Jockson L.W., Drabick J.J. Normalization of anticardiolipin antibodies following rituximab therapy for marginal zone lymphoma in a patient with Sjogren's syndrome. Rheumatology [Oxford].2004; 43 : 1309-1310.
19. Ramos-Casals M., Lopez-Guillermo A., Brito-Zeron P. et al. Treatment of B-cell lymphoma with rituximab in two patients with Sjogren's syndrome associated with hepatitis C virus infection. Lupus.2004; 13: 969-971.
20. Pijpe J., Imhoff G.W., Vissink A. et al. Changes in salivary gland immunohistology and function after rituximab monotherapy in a patient with Sjogren's syndrome and associated MALT lymphoma. Ann.Rhtum.Dis. 2005; 64: 958-960.
21. Ring T, Kallenbach M., Praetorius J. et al. Successful treatment of a patient with primary Sjogren's syndrome with Rituximab. Clin.Rheumatol.2006; 25 : 891-894.
22. Serror R., Sordet C, Guillevin L Et al. Tolerance and efficacy of rituximab and changes in serum B cell biomarkers in patients with systemic complications of primary Sjogren's syndrome. Ann.Rheum.Dis. 2007; 66(3) : 351-358.
23. Pijpe P., van Imhoff G.W., Spijkervet F.K., et al. Rituximab treatment in patients with Sjogren's syndrome: an open-label phase II study. Arthritis Rheum. 2005, 52 (9), 2740-2750.
24. Deyauchelle-Pensec V., Pennec Y, Morvan J. et al. Improvement of Sjogren's sendrome after two infusions of Rituximab (Anti-CD20). Arthr.Rheum.2007; 57(2) : 310-317.
25. Cavalli F., Isaacson P.G., Gascoyne R.D., Zucca E. MALT Lymphas. Hematology. 2001; 241-258
26. Voulgarelis M., Giannjuli S., Tzioufas A.G., Moutsopoulos H.M. Long term remission of Sjogren's syndrome associated aggressive B cell non-Hodgkin's lymphomas following combined B cell depletion therapy and CHOP (cyclophosphamide, doxorubicin, vincristine, prednisone). Ann. Rheum. Dis. 2006; 65 : 1033-1037.
27. Васильев В.И., Соловьев С.К., Логвиненко О.А., Насонов Е.Л. Успешное применение Ритуксимаба при "катастрофическом" течении системной красной волчанки с синдромом Шёгрена. Научно- практическая ревматология.2006; 3 : 33- 37.
28. Gottenberg J.E., Guillevin L, Lam- botte O. Et al. Tolerance and short term efficacy of rituximab in 43 patients with systemic autoimmune diseases. Ann. Rheum.Dis.2005; 64: 913-920
Комментарии
ПРАКТИКА ПЕДИАТРА
