Новые возможности лечения диабетической периферической невропатии
СтатьиОпубликовано в журнале:
«Фарматека», 201, №3, с. 58-63
Е.Ю. Комелягина, М.Б. Анциферов
Эндокринологический диспансер Департамента здравоохранения, Москва
Диабетическая периферическая невропатия (ДПН) относится к числу частых и прогностически важных осложнений сахарного диабета. Своевременное лечение ДПН относится к числу чрезвычайно важных задач современной диабетологии. Представ- лены данные о факторах риска, прогнозе, патогенезе, клинической картине и принципах диагностики ДПН. Подчеркивается, что лечебно-профилактические мероприятия при ДПН должны начинаться как можно раньше и проводиться на фоне компенсации углеводного обмена. Рассматриваются современные возможности лечения ДПН с использованием патогенетической и симптоматической терапии. Приводятся клинические данные, подтверждающие эффективность применения при ДПН препарата Актовегин.
Ключевые слова: сахарный диабет, диабетическая периферическая невропатия, Актовегин
Диабетическая периферическая невропатия (ДПН) характеризуется наличием симптомов и/или признаков нарушения функции периферических нервов у больных сахарным диабетом (СД) после исключения других причин [1]. Поражения нервной системы при СД встречаются достаточно часто, при этом их проявления довольно разнообразны. Кроме ДПН при СД встречаются быстрообратимые, фокальные и мультифокальные невропатии (табл. 1).
Таблица 1. Классификация невропатий [2]
| Быстрообратимые невропатии | Невропатия на фоне гипергликемии |
| Постоянно существующие симметричные полиневропатии | Дистальная соматическая сенсорная/моторная полиневропатия с преимущественным поражением волокон большого сечения. Автономная невропатия. Невропатия с поражением волокон малого сечения |
| Фокальные/мультифокальные невропатии | Черепные (краниальные) невропатии. Торакоабдоминальные радикулопатии. Фокальные невропатии конечностей. Проксимальные невропатии. Компрессионные невропатии |
В клинической практике чаще всего приходится сталкиваться с сенсорно-моторной периферической полиневропатией. В среднем частота ДПН при СД составляет 20–30 %, или 2 % новых случаев, в год [3]. Недавно получены данные о том, что ДПН встречается в 13 % случаев среди больных с нарушением толерантности к глюкозе и в 11,3 % – при повышенном уровне глюкозы плазмы натощак [4]. Эти данные говорят о том, что ДПН не только является одним из самых распространенных осложнений СД, но и может развиваться гораздо раньше клинической манифестации этого заболевания. В 16–26 % случаев ДПН сопровождается болевым синдромом [5, 6]. Невропатическая боль существенно снижает качество жизни больных, в основном за счет нарушения сна [7]. Кроме того, ДПН является прогностически значимым фактором риска развития язвенных дефектов стоп (невропатическая форма синдрома диабетической стопы – СДС) и нейроостеоартропатии (стопа Шарко). Поэтому своевременное лечение ДПН относится к числу чрезвычайно важных задач современной диабетологии.
Факторы риска
Многочисленными исследованиями доказано влияние гипергликемии и длительности СД на развитие ДПН. Риск ДПН повышается на 10–15 % на каждый ммоль подъема уровня гликемии натощак [8]. Распространенность ДПН возрастает с 14 % при длительности СД менее 5 лет до 44 % при длительности заболевания более 30 лет [9]. Выявлена взаимосвязь между ДПН и висцеральным ожирением, а также ДПН и ростом. Нельзя исключить влияние на вероятность развития ДПН таких факторов, как артериальная гипертензия, возраст, курение, недостаточность инсулина, дислипидемия [3].
Прогноз
Имеющиеся в настоящее время данные позволяют предположить, что снижение скорости проведения импульса по нервному волокну и ухудшение вибрационной чувствительности могут рассматриваться как предикторы смертности у больных СД [10, 11]. В случае наличия невропатических язвенных дефектов риск смерти также значительно возрастает. В частности, если у больных СД без язвенных дефектов смертность составляет 5 человек на 100 больных в год, то в случае их наличия данный показатель возрастает до 12 человек на 100 больных [12].
Патофизиология и патогенез
Патогенез ДПН является сложным и многофакторным. Безусловно ключевая роль в ее развитии принадлежит хронической гипергликемии, которая является пусковым механизмом каскада биохимических реакций, приводящих к дегенерации и демиелинизации нервного волокна. В предыдущие годы теории патогенеза ДПН подразделялись на метаболическую и сосудистую. В настоящее время они объединены и рассматриваются как отдельные компоненты одного процесса.
Выделено шесть патофизиологических механизмов ДПН [13]:
- Активация полиолового пути обмена глюкозы, который приводит к аккумуляции сорбитола и фруктозы, истощению миоинозитола, снижению активности Na+/K+-АТФазы.
- Нарушение метаболизма жирных кислот и простагландинов, что является причиной повреждения мембран нервных окончаний, микрососудистых и гемореологических нарушений.
- Эндоневральная ишемия с последующим возникновением гипоксии, образованием свободных радикалов (окислительный стресс), повышением активности протеинкиназы С.
- Дефицит нейротрофов, приводящих к пониженной экспрессии и истощению фактора роста нервов, нейротрофи-на-3, инсулиноподобного фактора роста, а также нарушению аксонального транспорта.
- Аккумуляция конечных продуктов неферментного гликирования в белковых структурах нервов и сосудов.
- Иммунологические и воспалительные изменения с наличием антител к различным структурам автономной нервной системы.
Клинические проявления
Клинические проявления ДПН во многом зависят от стадии процесса. Термин “гипергликемическая невропатия” применяется для описания сенсорных проявлений невропатии у больных с плохим уровнем компенсации СД. Эти проявления обратимы и перестают беспокоить пациента после нормализации гликемии. В отсутствие адекватного лечения СД процесс принимает хроническое, прогрессирующее течение. Предполагается, что длинные аксоны более уязвимы к повреждению при СД. Это подтверждается наличием корреляционной связи между ДПН и ростом, а также тем, что в типичных случаях клинические симптомы возникают в дистальных отделах конечностей (стопы, кисти) [13]. Симптомы (жалобы) можно условно разделить на “позитивные”, к которым относятся боль, жжение, парестезии, и “негативные”, например онемение.
На ранних стадиях ДПН преобладает достаточно яркая клиническая симптоматика. Больных беспокоят жалобы на жжение, боли стреляющего характера, покалывания, парестезии и т. д. Характерны гиперестезия, аллодиния – ощущение боли от прикосновения предметов, которые в норме не вызывают боль (например, одежда, постельное белье и т. д.). В физиологических условиях боль является защитной реакцией организма на повреждение тканей. При нарушении их целостности высвобождаются биологически активные вещества, такие как гистамин и простагландины, активизирующие болевые рецепторы (ноцицепторы). При ДПН механизм возникновения боли другой. В генезе болевых ощущений участвуют прямая активация ноцицептивных рецепторов, активная аксональная дегенерация, атрофия аксона и т. д. [14]. Кроме того, болевые ощущения могут возникать вследствие эктопической генерации импульсов при регенерации аксона в волокнах мелкого сечения [15, 16]. С подобным феноменом можно столкнуться при улучшении показателей гликемии после назначения инсулинотерапии.
На более поздних стадиях, напротив, симптомы проявляются менее ярко. Преобладает “негативная” симптоматика с объективными признаками нарушения чувствительности. При этом существует риск развития невропатической формы СДС, в более редких случаях – нейроостеоартропатии (стопа Шарко). Следует обратить внимание на тот факт, что в 10–18 % случаев пациенты впервые узнают, что больны СД, когда оказываются в отделениях гнойной хирургии с осложненными формами СДС (!).
Диагностика
ДПН необходимо выявлять как можно раньше с целью назначения необходимых лечебно-профилактических мероприятий. В Международном согласительном документе по стандартизации методов диагностики диабетической невропатии рекомендованы следующие подходы [17]:
- клиническое обследование;
- проведение морфологического анализа;
- электрофизиологические исследования, включая электромиографию;
- количественные сенсорные тесты;
- оценка состояния автономной нервной системы.
Клиническое обследование необходимо проводить каждому больному СД для выявления признаков ДПН, а в случае наличия симптомов невропатии следует осуществлять дифференциальную диагностику с другой патологией.
В план обследования входят:
- подробный и тщательный сбор анамнеза;
- неврологический осмотр с исследованием сенсорной функции (оценка разных видов чувствительности: болевой, тактильной, вибрационной), рефлексов, автономной функции (вариабельность сердечного ритма, ортопроба).
При проведении клинического обследования рекомендуется оценивать степень тяжести как имеющейся симптоматики, так и неврологического дефицита. Выраженность симптомов определяется при помощи шкал, основанных на количественной оценке признаков ДПН. Например, при использовании невропатического симптоматического счета (НСС) заполняется опросник, в котором каждому симптому присваивается определенный балл в зависимости от наличия и интенсивности признака. Общая сумма баллов характеризует степень выраженности симптомов. Соответственно, чем больше баллов, тем более яркую клиническую симптоматику имеет ДПН. В общем симптоматическом счете (ОСС) учитываются интенсивность и частота появления жалобы за последние 24 часа (табл. 2).
Таблица 2. Общий симптоматический счет
| Жалоба | Интенсивность | Частота | ||||
| Отсутствует (0) | Слабая (1) | Средняя (2) | Сильная (3) | Иногда (0) | Часто (0,33) | Постоянно (0,66) |
| Стреляющая боль | ||||||
| Жжение | ||||||
| Онемение | ||||||
| Покалывания | ||||||
Степень тяжести неврологического дефицита определяется также при помощи ряда шкал, количественно оценивающих имеющиеся расстройства: Нейропатический дисфункциональный счет (шкала НДС), Шкала невропатических нарушений нижних конечностей (ШНН-НК). В качестве примера в табл. 3 приведена ШНН-НК, предполагающая оценку мышечной силы, рефлексов и нарушений различных видов чувствительности.
Таблица 3. Шкала ШНН-НК
| Оценка (0–4 балла) | Итого | ||
| Мышечная слабость | Справа | Слева | |
| Сгибание бедра | |||
| Разгибание бедра | |||
| Сгибание колена | |||
| Разгибание колена | |||
| Тыльное сгибание стопы | |||
| Подошвенное сгибание стопы | |||
| Разгибание 1 пальца | |||
| Сгибание 1 пальца | |||
| Суммарная оценка мышечной слабости | |||
| Рефлексы | Оценка (0–2 балла) | ||
| Справа | Слева | ||
| Коленный | |||
| Ахиллов | |||
| Суммарная оценка рефлексов | |||
| Чувствительность | Оценка (0–2 балла) | ||
| Справа | Слева | ||
| Прикосновение | |||
| Укол | |||
| Вибрация | |||
| Положение сустава | |||
| Суммарная оценка чувствительности | |||
В отличие от клинического осмотра морфологический анализ не относится к рутинным методам и включает биопсию кожи либо икроножного нерва. Биопсия большеберцового нерва выполняется в основном в научно-исследовательских целях. Этот метод имеет ограничения, т. к. инвазивен и может привести к осложнениям [17]. Более распространенным методом является биопсия кожи (3 мм – “punch”-биопсия), используемая для исследования волокон небольшого сечения, включая немиелинизированные интраэпидермальные нервные волокна (ИНВ). Этот метод позволяет рассчитать линейную плотность ИНВ и считается наиболее информативным в диагностике сенсорной невропатии с вовлечением волокон малого сечения [18].
Электрофизиологические исследования (ЭФИ) или исследования проводимости импульса по нервному волокну позволяют изучить возможности проведения электрического импульса по различным типам нервных волокон. Сенсорные и моторные нервные волокна обладают разными свойствами, по-разному отвечают на электростимуляцию. Эти ответы записываются, измеряются и количественно оцениваются. ЭФИ позволяют выявлять невропатию на ранних стадиях – до возникновения клинических проявлений, а также этиологию, распределение и тяжесть повреждения периферического нерва [19].
Лечение
Лечебно-профилактические мероприятия при ДПН должны начинаться как можно раньше. Необходимо отметить, что основным методом профилактики и лечения ДПН является компенсация углеводного обмена. Одно из обоснований этого – результаты, полученные в ряде крупнейших проспективных исследований. Так, в исследовании DCCT (Diabetic Control and Complication Trial, 1993) через 5 лет в группе больных, получавших традиционную инсулинотерапию, ДПН развилась в 9,6 % случаев, среди пациентов, находящихся на интенсифицированном режиме инсулинотерапии с лучшим контролем гликемии, – лишь в 2,8 % [20]. В исследовании Stockholm в группе больных, находящихся на интенсифицированной терапии, отмечено улучшение клинической симптоматики и скорости проведения импульса по нервному волокну [13]. В настоящее время показанием к назначению медикаментозной терапии является наличие у пациента болевой формы ДПН (острой или хронической).
Лекарственные средства для лечения ДПН представлены двумя основными классами препаратов:
- имеющими патогенетическую направленность действия;
- оказывающими симптоматическое воздействие.
Средства патогенетической терапии влияют на основные механизмы развития ДПН. К их числу относятся ингибиторы альдозоредуктазы, γ-линоленовая кислота; антиоксиданты (α-липоевая кислота – АЛК), миоинозитол, факторы роста нерва, ингибиторы неферментного гликирования структурных компонентов нервного волокна (аминогуанидин), вазодилататоры. В настоящее время подавляющее большинство препаратов этой группы находится на различных стадиях клинических испытаний. Эффективность и безопасность подтверждены только для препаратов АЛК.
Целью симптоматической терапии является купирование болевой симптоматики. В данном аспекте в качестве стандартной терапии могут использоваться: трициклические антидепрессанты (амитриптиллин, имипрамин, кломипрамин, дулоксетин), противосудорожные средства (габапентин, прегабалин, карбамазепин), анальгетики (трамадол), средства местного воздействия (Капсикам, капсаицин) [21, 22].
Таким образом, в арсенале врачей есть несколько классов препаратов для купирования болевой симптоматики при ДПН. В табл. 4 представлена схема выбора препарата для лечения болевой формы ДПН в зависимости от сопутствующих заболеваний (табл. 4).
Таблица 4. Дифференцированный подход к выбору препарата для лечения болевой формы ДПН [13]
| Сопутствующие заболевания или состояния |
Дулоксетин | Прегабалин | ТА | Опиоиды | АЛК *** |
| Депрессия | + * | Н * | + | Н | Н |
| Ожирение | Н | НЖ | НЖ | Н | Н |
| Генерализованное тревожное расстройство |
+ | + | НД | НД | НД |
| Нарушение сна | + | + | + | НЖ * | НД |
| ИБС | Н | Н | НЖ | Н | Н |
| Автономная невропатия | НД | НД | НЖ | НЖ | + |
| Печеночная недостаточность | НЖ | Н | ** | ** | Н |
| Почечная недостаточность | НЖ | Индивидуальный подбор дозировки | ** | ** | Н |
Примечание. + – прием препарата возможен; НЖ – прием препарата нежелателен; Н – прием препарата не оказывает влияния на данное состояние; НД – нет данных; ТА – трициклические антидепрессанты.
* нарушение дыхания во время сна.
** зависит от индивидуальной ситуации.
*** при приеме препаратов АЛК возможно незначительное снижение уровня гликемии.
В недавно проведенном в Великобритании исследовании показано, что пациенты с СД предъявляют врачам жалобы на болевые ощущения в 96 % случаев, однако только в 65 % случаев для снятия боли назначается медикаментозная терапия. Предпочтение отдается антидепрессантам – 43,5 % назначений, противосудорожные препараты выписываются в 17,4 % случаев, опиаты – в 39,0 %. Однако в течение 5 лет болевые ощущения сохранялись в 77 % случаев [5]. По более оптимистичным данным, при монотерапии положительного клинического эффекта удается достичь не более чем в 40–60 % случаев [23]. Не стоит забывать, что большинство средств симптоматической терапии имеют центральный механизм действия с выраженными побочными эффектами и не замедляют прогрессирования ДПН [24]. В связи с этим представляет интерес препарат Актовегин (Никомед, Австрия), доказавший свою эффективность и безопасность при лечении ДПН.
Спектр действия препарата достаточно широк и базируется на неспецифической стимуляции клеточного метаболизма. В результате усиливается захват клетками кислорода и глюкозы. Кроме того, Актовегин влияет на процессы окисления, сдвигая окислительно-восстановительный потенциал в сторону увеличения количества окисленных продуктов. Под его воздействием повышается содержание энергетически насыщенных субстанций, таких как АТФ и креатинфосфат. Хорошо известен инсулиноподобный эффект препарата, который, по мнению экспертов, может быть связан с наличием в его составе как инозитолфосфатолигосахаридов, так и отдельной физиологической субстанции, ответственной за данный эффект [13].
Благодаря указанным свойствам Актовегин применяется в неврологии при лечении нарушений мозгового кровообращения, энцефалопатий различного генеза и т. д. [25]. Те же свойства препарата легли в основу гипотезы о его положительном влиянии на течение ДПН. Актовегин способен предотвращать повреждение и гибель клеток вследствие гипоксии, что в условиях сниженного эндоневрального кровотока при ДПН имеет важное значение. В последних исследованиях т УИГО установлено, что Актовегин увеличивает количество нейронов, аксональную длину, число нейрональных синаптических связей и подавляет апоптоз. Данные свойства зависят от дозы препарата [13].
Впервые эффект Актовегина на течение ДПН был оценен в 1987 г. в плацебо-контролируемом исследовании с участием 70 пациентов. Было показано, что под воздействием Актовегина повышается скорость проводимости импульса по нерву, снижается интенсивность алло-динии, улучшается субъективное состояние больных [26].
В 2008 г. закончилось многоцентровое рандомизированное плацебо-контролируемое исследование по оценке эффективности и безопасности Актовегина при лечении больных СД типа 2 с ДПН. В нем приняли участие 567 пациентов, из них 281 больной получал препарат, а 286 – плацебо. Курс лечения состоял из внутривенных капельных вливаний 20 %-ного раствора Актовегина 1 раз в стуки в течение 20 дней, после чего прием препарата продолжался в виде таблеток по 1800 мг/сут (600 мг 3 раза в день) в течение 140 дней. В исследование включались пациенты в возрасте 18–65 лет без признаков нарушения магистрального кровотока нижних конечностей, с уровнем гликированного гемоглобина 120 ммоль/л [27]).
Оценка эффективности лечения проводилась по изменению показателей ОСС и вибрационной чувствительности (первичные конечные точки). Кроме того, анализировались динамика ШНН-НК и воздействие курса лечения на качество жизни пациентов (вторичные конечные точки). Результаты статистического анализа показали достоверное уменьшение показателей ОСС в группе пациентов, получавших Актовегин, по сравнению с группой плацебо (рис. 1). Кроме того, в группе Актовегина наблюдалась четкая тенденция к снижению порога вибрационной чувствительности (p = 0,08; рис.2). При анализе воздействия Актовегина на ШНН-НК выявлено достоверно улучшение сенсорной составляющей (p = 0,004); влияния на моторный компонент не отмечалось (p = 0,731). Так же достоверно улучшилась ментальная составляющая качества жизни (p = 0,02).
Рис. 1. Динамика показателей ОСС в группе больных, получавших Актовегин, по сравнению с группой пациентов, получавших плацебо.
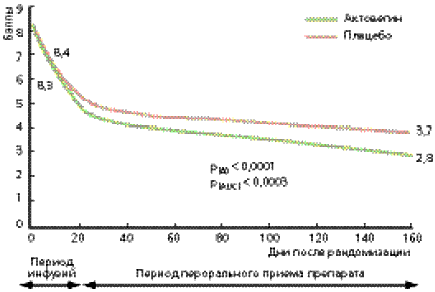
Рис. 2. Динамика показателей вибрационной чувствительности в группе больных, получавших Актовегин, по сравнению с группой пациентов, получавших плацебо.
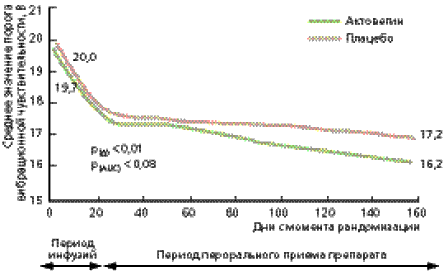
Таким образом, в проведенном исследовании выявлено положительное влияние Актовегина на динамику неврологических симптомов (снижение интенсивности боли, парестезии, онемения) и неврологический дефицит (улучшение показателей вибрационной чувствительности и сенсорного компонента ШНН-НК). С учетом того, что нарушение вибрационной чувствительности является независимым фактором риска развития СДС, данный эффект препарата имеет важное клиническое значение [27].
В заключение хотелось бы отметить, что эффект фармакотерапии ДПН во многом зависит от уровня компенсации углеводного обмен. При этом нельзя забывать о профилактических немедикаментозных мероприятиях, направленных на предотвращение возникновения язвенных дефектов стоп и ампутаций нижних конечностей. А это прежде всего обучение пациентов и членов их семей правилам ухода за ногами и поведения при появлении повреждений.
ЛИТЕРАТУРА
1. International guidelines on the out-patient management of diabetic peripheral neu-ropathy, 1996.
2. Sima AAF , Thomas PK, Ishii D, et al. Diabetic neuropathies. Diabetologia 1997;40:74-7.
3. Shaw JE, Zimmet PZ, Gries FA, et al. Epidemiology of Diabetic Neuropathy. In: Gries FA, Cameron NE, Low PA, Ziegler D (Eds.). Textbook of diabetic neuropathy. 2003;64-82.
4. Ziegler D, Rathmann W, et al. Prevalence of Polyneuropathy in Prediabetes and Diabetes is Associated with Abdominal Obesity and Macroangiopathy. The MONICA/KORA Augsburg Surveys S2 and S3. Diabetes Care 2008;31:464-69.
5. Daosi C, Bendow SJ, Woodward A, et al. The natural history of chronic painful peripheral neuropathy in a community diabetes population. DiabetMed 2006;23:1021-24.
6. Davies M, Brophy S, Williams R, et al . The prevalence, severity, and impact of painful diabetic peripheral neuropathy in type 2 diabetes. Diabetes Care 2006;29:1518-22.
7. Galer BS, Gianas A, Jensen M P. Painful diabetic neuropathy: epidemiology, pain description, and quality of life. Diabetes Res Clin Pract 2000;47:123-28.
8. Partanen J, Niskanen L, et al. Natural history of peripheral neuropathy in patients in patients with non-insulin-dependent diabetes mellitus. N Engl J Med 1995;333:89-94.
9. Cabezas-Cerrato J. The prevalence of clinical diabetic polyneuropathy in Spain: a study in primary care and hospital clinic groups. Neuropathy Spanish Study Group of the Spanish Diabetic Society (SDS). Diabetologia 1998;41:1263-69.
10. Forsblom CM, Sane T, et al. Risk factors for mortality in type II (non-insulin-dependent) diabetes: evidence of a role for neuropathy and a protective effect of HLA-DR. Diabetologia 1998;41:1253-62.
11. Navarro X, Kennedy WR, et al. Neuropathy and mortality in diabetes: influence of pancreas transplantation. Muscle Nerve 1996; 19:1009-16.
12. Boyko EJ, Ahroni JH, et al. Increased mortality associated with diabetic foot ulcers. Diabetic Med 1996;13:967-72.
13. Циглер Дан. Диабетическая периферическая нейропатия: клинические проявления, диагностика и лечение. М., 2009.
14. Thomas PK. Mechanisms of neuropathic pain. In: Textbook of Diabetic Neuropathy, Thieme 2002;208.
15. BROWN MJ, MARTIN JR. PAINFUL DIABETIC NEUROPATHY: A MORPHOMETRIC STUDY . ARCH NEUROL 1976;33:164-71.
16. Asbury AK, Fields HL. Pain due to peripheral nerve damage: an hypothesis. Neurology 1984;34:1587-90.
17. Proceedings of a consensus development conference on standardized measures in diabetic neuropathy. Diabetes Care 1992;15(8): 1080-1107.
18. Lauria G, Cornblath DR , Johansson O, et al . European Federation of Neurological Societies. EFNS guidelines on the use of skin biopsy in the diagnosis of peripheral neuropathy . Eur J Neurol 2005;12:747-58.
19. Bril V. Electrophysiologic testing. In: Textbook of Diabetic Neuropathy , Thieme 2002;177-84.
20. The Diabetes Control and Complication Trial Research Group. The effect of intensive diabetes therapy on the development and progression of diabetic neuropathy . Ann Intern Med 1995;122:561-68.
21. Spruce MC, Potter DV , et al. The pathogenesis and management of painful diabetic neuropathy: a review. Diabetic Med 2003;20(2):88-99.
22. Ziegler D. Treatment of neuropathic pain. In: Textbook of Diabetic Neuropathy , Thieme 2002;211-24.
23. Dworkin RH, O’Connor AB, et al. Pharmacologic management of neuropathic pain: eviden-ce-based recommendations. Pain 2007; 132:237-51.
24. Boulton AJM, Vinik AI, et al. Diabetic neuropathies: a statement by the American Diabetes Association. Diabetes Care 2005;28:956-62.
25. Машковский М.Д. Лекарственные средства. Пособие для врачей. М., 2005.724.
26. Jensen W, Beck E. Treatment of the diabetic polyneuropathy. A controlled double blind study . Med Welt 1987;38:838-41.
27. Zigler D, Movsesyan L. et al. Treatment of Symptomatic Polyneuropathy With Actovegin in Type 2 Diabetic Patients. Diabetes Care 2009;32(8):1479-84.
