 bionorica.ru
bionorica.ru

Лекарственный растительный препарат для лечения и профилактики воспалительных заболеваний почек и мочевых путей, а также мочекаменной болезни, у взрослых и детей с 1 года
canephron.ru
Растительный препарат Канефрон Н в лечении и профилактике инфекций мочевых путей
СтатьиОпубликовано в журнале:
«Врачебное сословие», 2005, № 4-5, с. 1-4
Т. С. Перепанова, П. Л. Хазан
НИИ урологии МЗ РФ, Москва
Инфекции мочевых путей (ИМП) - термин, охватывающий широкий круг заболеваний, при которых имеется микробная колонизация в моче - свыше 104 колоний микроорганизмов в 1 мл мочи и/или микробная инвазия с развитием инфекционного процесса в какой-либо части мочеполового тракта от наружного отверстия уретры до коркового вещества почек. В зависимости от преимущественного инфекционного поражения какого-либо органа выделяют пиелонефрит, цистит, простатит, уретрит и др.. (1). Однако если какая-либо часть или участок мочеполовой системы инфицированы, всегда есть риск инвазии бактерий для всей мочеполовой системы.
Различают неосложненные и осложненные инфекции верхних или нижних мочевых путей. К неосложненным инфекциям мочевых путей относят острые циститы, пиелонефриты и уретриты у больных, чаще женщин, при отсутствии каких-либо нарушений к оттоку мочи из почек или из мочевого пузыря и структурных изменений в почках или мочевыводящих путях, а также у пациентов без серьезных сопутствующих заболеваний. Это обычный острый восходящий цистит или пиелонефрит без нарушения оттока мочи у относительно здоровых женщин с нарушениями мочеиспускания, наличием примесей, гноя в моче, иногда сопровождающийся примесью крови в моче, субфебрильной температурой тела и болями в боку (2). Этот вид инфекции хорошо поддается химиотерапии и эти пациенты первично, как правило, обращаются к врачу - терапевту. Острый неосложненный бактериальный цистит в 80% случаев вызывается E.coli и в 15 % другими возбудителями: St. saprophyticus, Enterococcus faecalis, Klebsiella spp, Proteus spp. (3). В большинстве случаев острый цистит представляет поверхностные инфекции слизистой мочевого пузыря, легко поддающиеся терапии антимикробными препаратами (4). В то же время, несмотря на легкость купирования острого цистита, несмотря на анатомически нормальные мочевые пути, цистит очень часто рецидивирует.
Осложненные ИМП (ОИМП) возникают на фоне анатомических нарушений, обструкции мочевыводящих путей (камни, стриктуры, опухоли, кисты, фистулы, доброкачественная гиперплазия предстательной железы), а также на фоне функциональных нарушений: нейрогенный мочевой пузырь, везикоуретеральный рефлюкс. Инородные тела - катетеры, стенты, дренажи, камни приводят к формированию биопленки (biofilm) из различных микроорганизмов на их поверхностях и развитию «катетер-ассоциированной ИМП», «биофильм-инфекции». Метаболические, гормональные нарушения (сахарный диабет, хроническая почечная недостаточность, мочекаменная болезнь, постменопауза), иммунодефицитные состояния могут сопровождаться осложненной ИМП. Полирезистентные госпитальные штаммы возбудителей мочевой инфекции, грибковая ИМП, и ИМП у мужчин также относятся к осложненной мочевой инфекции.
Возбудителями ОИМП являются многочисленные резистентные микроорганизмы семейства Enterobacteriaceae: E.coli, Klebsiella pneumonia, Citrobacter spp, Enterobacter spp, Staphylococcus spp, Enterococcus faecalis, Proteus mirabilis, а также синегнойная палочка. В ситуациях частой возвратной инфекции нижних мочевых путей, рецидива заболевания, когда вновь выделяется первоначальный патогенный возбудитель необходимо урологическое обследование на предмет выявления аномалий развития или выявления сопутствующих заболеваний, соответствующая их коррекция и подбор адекватного антибиотика.
Эффективное лечение ОИМП возможно только лишь при условии восстановления нормальной уродинамики и коррекции осложняющих факторов и сопутствующих заболеваний. ОИМП характеризуется частыми обострениями заболевания, где необходимо дифференцировать реактивацию существующего очага инфекции от реинфекции (новый возбудитель).
Целью лечения ОИМП является профилактика уросепсиса, рецидива заболевания, предупреждение развития осложнений и повреждения паренхимы почек.
Различают 3 тактики антимикробного лечения ИМП:
- эрадикационная - 2 - 4 недели, целью является эрадикация возбудителя, купирование симптомов ИМП и предотвращение осложнений;
- профилактическая - 6 месяцев, в низкой дозе (например ципрофлоксацин по 100 мг 1 раз в сутки), цель - предупреждение рецидивов;
- супрессивная - месяцы и годы, терапевтическая доза снижается до поддерживающей.
Из предлагаемых антибактериальных препаратов для лечения ОИМП рекомендуются фторхинолоны, защищенные бета-лактамы, цефалоспорины, аминогликозиды, комбинации антибиотиков. Однако длительная непрерывная антибактериальная терапия приводит к дисбиозу кишечника, влагалища, аллергизации организма и селекции резистентных штаммов микроорганизмов.
Персистенция бактерий в мочевых путях представляет одну их наиболее трудных задач успешного лечения ИМП. Достаточно известны и доказанны «катетер-ассоциированная ИМП», «биофильм-инфекция», «инфекция инородного тела». Отсутствие защитных противоинфекционных механизмов на искусственных материалах (катетеры, дренажи, камни, протезы и т.д.) обьясняют адгезию микроорганизмов к их поверхностям, формирование биопленки и таким образом существование возбудителей (бактерионосительство) в организме человека. Чаще всего после удаления инородных тел из мочевых путей бактериурия исчезает. Однако, наибольший интерес с клинической точки зрения, представляет персистенция микроорганизмов в слизистой оболочке мочевых путей без наличия или после удаления катетеров, инородных тел. Так называемый рецидивирующий или персистирующий бактериальный цистит (свыше 3-х обострений в год) наблюдается у 25-40% женщин после однократного эпизода острого цистита.
Персистенция - стратегия выживания патогенных и условно-патогенных микроорганизмов в организме хозяина (5). Взаимоотношения «паразит-хозяин» лежат в основе персистенции микроорганизмов, однако в обычных условиях далеко не всегда вызывают болезнь. Паразитирующие патогены для выживания должны совершенствовать свои тактические приемы, уклоняясь от таких факторов защиты хозяина, как-то: воспалительная реакция, фагоцитоз, выработка антител. Многие бактерии способны выживать в слабореактивных организмах (которые не реагируют на возбудитель), что позволяет им свободно размножаться. При изменении условий существования комменсалы (условно-патогенные) бактерии приобретают высокоспециализированные функции и начинают причинять вред хозяину (кишечная палочка, стафилококки, клебсиеллы, протей, бактериоды). Варьирующими признаками паразита является вирулентность и антигенность, а хозяина - иммунокомпетентность. Микроорганизмы способны «предвидеть события» и включать регуляторные системы изменчивости и самоорганизации (общебиологический принцип опережающего отражения). Многие виды бактерий способны паразитировать внутриклеточно, проявляя тропность к различным клеткам хазяина - факультативный паразитизм. Для кишечной палочки например, возможно паразитирование в клетках эпителия и макрофагов, что рассматривается как «непрофессиональный фагоцитоз». Ферментативная активность микроорганизмов обеспечивает проникновение их в клетку или межклеточное пространство. Необходимым условием персистенции являются определенные биологические свойства микроорганизма и дефектность защиты хозяина, что обусловливает бактерионосительство и хронизацию воспалительного процесса. Длительное персистирование микроорганизмов в организме хозяина является одной из загадок и нерешенных проблем в инфектологии. Для выживания в организме хозяина бактерии либо уклоняются от факторов защиты, либо подавляют эти факторы, что обусловливает две соответствующие формы клинического проявления персистирования - бессимптомное и манифестное, которые могут переходить друг в друга. Снижая вирулентность или изолируясь в очагах локального иммунодефицита бактерии могут уклоняться от факторов защиты человека. Подавление же факторов защиты хозяина идет за счет повышения вирулентных свойств бактерий или в результате диссеминации в иммунокомпрометированном организме. Высокая приспосабливаемость микроорганизмов к постоянно меняющимся условиям существования особенно проявляется при антибиотикотерапии - обесцениваются целые классы антибиотиков за счет селекции резистентных штаммов микроорганизмов (6,7).
Лечение персистирующей или хронической ИМП и эффективная санация от бактерионосительства представляют большую проблему. Часто внутриклеточная концентрация антибиотиков недостаточна для создания бактерицидных концентраций, поэтому антибактериальная терапия неэффективна. Однако выяснено, что малые концентрации антибиотиков вызывают существенные изменения в морфологии и биохимии бактерий. Суббактериостатические концентрации (1/4МПК) пенициллина, гентамицина, ванкомицина и др. вызывают резкое подавление адгезии стрептококков разных видов к слизистой оболочке (8). Известно подавляющее действие фитотерапевтических препаратов на персистенции уропатогенов (9). Выяснено, что на разные возбудители: E.coli, Klebsiella spp., Proteus mirabilis ингибирующее действие различается (по маркерам персистенции микроорганизмов: антилизоцимная активность и антиинтерферроновая активность). В частности, есть сведения об эффективности ряда лекарственных трав: ромашки, фиалки, мать и мачехи, зверобоя и др..
Для лечения и профилактики персистирующей бактериальной инфекции нижних мочевых путей мы провели клиническое исследование растительного препарата Канефрон®Н (Bionorica AG, Германия).
Канефрон®Н — комбинированный фитопрепарат. В его состав входят золототысячник (herba Centaurii), обладающий диуретическим и антибактериальным действиями; любисток (radix Levistici), с его диуретическим, спазмолитическим, а также антибактериальными эффектами, и розмарин (folia Rosmarini), который, кроме указанных, обладает также и противовоспалительным эффектом. В траве золототысячника присутствуют алкалоиды, флавоноидные соединения, горькие гликозиды, феноловые кислоты. В составе любистока имеются эфирные масла, фенолкарбоновые кислоты, фталиды. Розмарин содержит розмариновую кислоту, эфирные масла и флавоноиды.
Входящие в состав препарата компоненты оказывают выраженное антисептическое, спазмолитическое, противовоспалительное действие на мочеполовой тракт, уменьшают проницаемость капилляров почек, обладают диуретическим эффектом, улучшают функцию почек, потенцируют эффект антибактериальной терапии
Материал и методы
В НИИ Урологии М3 РФ в 2004 году проведены клинические испытания препарата «Канефрон®Н», компании «Bionorica AG», у пациентов с хроническим рецидивирующим бактериальным циститом и хроническим простатитом. В группу женщин с хроническим рецидивирующим бактериальным циститом включены также больные с интерстициальным циститом (по результатам гистологического исследования), с так называемой «цисталгией» - с выраженным болевым синдромом и больные с уретральным синдромом.
Изучались безопасность, переносимость и эффективность лекарственного средства Канефрон®Н, для приема внутрь, его влияние на выраженность бактериурии, особенно у женщин с персистирующей инфекцией нижних мочевых путей; диуретический эффект, что имеет большое значение для «самопромывания организма» и длительности безрецидивного периода.
Дизайн клинического исследования - открытое постмаркетинговое исследование, IV фаза.
Данные исследования, были сведены в электронную базу, после чего обрабатывались с помощью пакета статистических программ «Статистика». Оценивали эффективность, безопасность, развитие побочных эффектов и переносимость препаратов. Различия по количественным показателям оценивались с помощью непараметрического критерия Вилкоксона. В качестве критерия статистической значимости различий принималась вероятность ошибки pВ исследование включено 27 пациентов, из них 11 с хронической персистирующей инфекцией нижних мочевых путей, 9 пациенток с интерстициальным циститом, 2 пациента с простатитом, 2 пациентки с уретральным синдромом и 3 с цисталгиями (рис.1).
Рис. 1 Структура заболеваемости
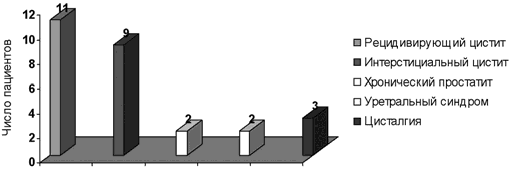
Контрольная группа состояла из 70 пациенток с хроническим циститом, не получавших лечение препаратом Канефрон®Н. Им проводилась стандартная антибактериальная терапия при обострениях (фторхинолоны по 3-5 дней или фосфомицин трометамол 3 г однократно), клюквенный морс.
Отбор пациентов производился в поликлиническом отделении НИИ Урологии МЗ РФ, с разъяснением хода предстоящего исследования. Пациенты подписывали информированное согласие.
Клинические, клинико-лабораторные, биохимические исследования включали: врачебный осмотр урологом с обязательным влагалищным или ректальным исследованием. Общеклинический анализ крови и мочи, микроскопическое исследование мазков из уретры, влагалища и шейки матки, бактериологическое исследование мочи и кала (по показаниям), ПЦР на заболевания передающиеся половым путем (микоплазмы, вирус простого герпеса, хламидии). Больным проводили уродинамическое исследование и они также вели дневник мочеиспусканий в течение 3-х месяцев.
Демографическая характеристика группы наблюдения (Канефрон®Н): 27 пациентов, из них 25 женщин и 2-е мужчин. Возраст пациентов от 18 до 67 лет. Средний возраст составил 42,59 года.
Контрольная группа состояла из 70 пациенток женского пола, возраст в группе варьировал от 18 до 78 лет, средний возраст составил 43,16 года.
Пациенты получали Канефрон®Н в дозе: 50 капель 3 раза в день или 2 драже 3 раза в день, в течение трех месяцев.
16 пациентов получали лечение Канефроном®Н в виде монотерапии, а 11 пациентов в сочетании с антибиотиками - фосфомицин трометамол (Монурал), по 3 г 1 раз в сутки. Ни один из пациентов из исследования исключен не был.
Результаты
Средний объем диуреза в группе наблюдения составил 1,59 л до лечения Канефроном®Н и 1,86 л после лечения; в контрольной группе 1,6 и 1,64 л. соответственно. Различия статистически достоверны, p®Н диурез после лечения увеличился: 0,27 л против - 0,04 л в контрольной группе. (см. табл.№1)
Таблица № 1. Результаты лечения больных ИМП
| Группа Канефрона (N=27) | Контрольная группа (N=70) | ||||
| До лечения | Через 3 мес. | До лечения | Через 3 мес. | p | |
| Диурез (л) | 1,59 | 1,86 | 1,60 | 1,64 | < 0.05 |
| Бактериурия (%) | 46 | 14 | 41 | 38 | < 0.05 |
| Безрецидивный период (мес.) | 1,46 | 3,15 | 1,65 | 2,31 | < 0.05 |
Бактериурия была выявлена у 46% пациентов из группы наблюдения до лечения и лишь у 14% после лечения. У пациентов из контрольной группы, бактериурия имелась у 41 % пациентов до лечения и у 38% через 3 месяца после лечения. Различия статистически достоверны, pВ группе пациентов получавшей лечение Канефроном®Н статистически достоверно снизился процент бактериурии после лечения, разница составила 32%, а в контрольной группе лишь 3%.
Безрецидивный период в группе, получавшей лечение Канефроном®Н до лечения составлял 1,46 месяца, а после лечения 3,15 месяца. В контрольной группе исходный интервал составил 1,65 месяца, а через три месяца наблюдения - 2,31 месяца. Различия статистически достоверны, p®Н средний интервал между обострениями увеличился на 1,69 месяца, а в контрольной группе - только на 0,66 месяца.
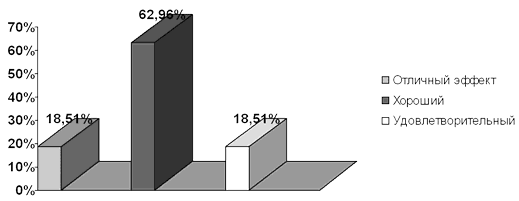
Всего проведено 27 стандартных курсов лечения Канефроном®Н. 5 пациенток (18,51%) отмечали отличный клинический эффект, 17 (62,96%) - хороший клинический эффект, а в 5 случаях (18,51%), клинический эффект был удовлетворительным (рис. 2). Все пациенты отметили снижение симптоматики, уменьшение болей в области мочевого пузыря, исчезновение резей, связанных с мочеиспусканием, а также увеличение интервалов между обострениями заболеваний, при этом сами обострения протекали в более легкой форме, чем до лечения Канефроном®Н.
Рис. 2 Эффективность лечения Канефроном®Н
Препарат показал хорошую безопасность и переносимость у всех пациентов, побочных эффектов, аллергических реакций за время наблюдения отмечено не было.
Заключение
Таким образом, при лечении персистирующей бактериальной инфекции нижних мочевых путей, являющейся одной из сложных задач в урологической практике, растительный препарат Канефрон®Н является эффективным и безопасным средством. Он значительно улучшает диурез, что является одним из ключевых моментов при лечении больных с мочевой инфекцией (антиадгезивное действие, «самопромывание организма»). Снижение бактериурии способствует снижению персистенции микроорганизмов в мочевых путях, что приводит к увеличению безрецидивного периода. Удобство применения (пероральная форма) обеспечивает комплаентность и улучшает качество жизни больных с урологической инфекцией.
Список литературы
1. Дунаевский Л.И., Арсеньев Р.В. Урология амбулаторного врача.- М.,1974, с. 89 -105
2. Calvin M. Kunin. Urinary Tract Infections. Detection, Prevention and Management. Fifth Edition. Williams and Wilkins, 1997, 419s.
3. Кремлинг Х., Лутвайер В., Хайнтц Р. Гинекологическая урология и нефрология.- М., 1985.- 506 с.
4. Практическое руководство по инфекционным болезням / под ред. Риза Р.Е., Дугласа Р.Г. Бостон / Торонто, 1983, с.738.
5. Бухарин О.В. «Персистенция патогенных бактерий». М., Медицина, 1999г., 368с.
6. Bhardi S., Nackman N.,Nicaud J.M.,Holland I.B.Escherihia coli hemolysin may damage target cell membranes by generating transmembrane pores // Infect. Immun. 1986,V.52, p.63-69.
7. Чахава О.В., Горская Е.М. Носительство патогенных микроорганизмов как фаза резервации возбудителя в межэпидемическом периоде // Журн.микробиол.1984, №9, с.9-16
8. Навашин СМ. Некоторые аспекты химиотерапии бактериальных инфекций // Журн.микробиологии, 1984, №7,с.37-45.
9. Челпаченко О.Е. Экспериментальное обоснование рациональной терапии пиелонефрита у детей под контролем маркеров персистенции возбудителя // Автореферат дис….канд. мед. наук Челябинск,1993г. 23с.
