Новый препарат для лечения гриппа и острых респираторных вирусных инфекций
Статьи Опубликовано в журнале:
« Инфекционные болезни » , 2011, т.9, №4. М.П.Костинов
Научно-исследовательский институт вакцин и сывороток им. И.И.Мечникова РАМН, Москва
В многоцентровом двойном слепом плацебо-контролируемом, рандомизированном клиническом исследовании оценивалась эффективность и безопасность препарата Эргоферон. В клиническом исследовании, которое проводили в 8 медицинских центрах РФ, приняли участие пациенты в возрасте от 18 до 60 лет с температурой тела >37,8°C, имеющие как минимум один катаральный симптом (кашель, ринит, боль в горле) и один симптом интоксикации (озноб/потливость, недомогание, слабость, головная боль) в период сезонной заболеваемости, обратившиеся к врачу в течение 48 часов с момента появления первых симптомов острой респираторной вирусной инфекции. Полученные результаты свидетельствуют о безопасности и эффективности изученного препарата в лечении острой респираторной вирусной инфекции у взрослых пациентов, применение которого обеспечивает эффективную противовирусную защиту, сокращает длительность лихорадочного периода и способствует более быстрому купированию основных клинических симптомов острой респираторной вирусной инфекции.
Ключевые слова: грипп, острая респираторная вирусная инфекция, гамма-интерферон человека, гистамин, CD4, противовирусная защита, комбинированный препарат, клиническое исследование, Эргоферон
Острые респираторные вирусные инфекции (ОРВИ) в настоящее время остаются самыми распространенными инфекционными заболеваниями в развитых странах.
По статистике, в среднем за год взрослый болеет ОРВИ не реже 2–3 раз, ребенок, в зависимости от возраста, от 4 до 10 раз. В процессе развития вирусное заболевание может осложняться бактериальной инфекцией, что связано, прежде всего, с развитием относительного или абсолютного иммунодефицита [1, 2]. У части больных течение ОРВИ сопровождается развитием астеновегетативной симптоматики. Бактериальные осложнения, требующие назначения антибиотикотерапии, астенический «хвост» после перенесенного заболевания и другие последствия ОРВИ приводят к снижению качества жизни (трудоспособности, физического и социального функционирования) и увеличению дней нетрудоспособности. Положительный результат лечения обычно достигается при раннем использовании этиотропных препаратов, начиная с первых суток манифестации заболевания [3, 4]. В соответствии с клиническими рекомендациями для лечения ОРВИ назначаются лекарственные средства различных групп, включая химиопрепараты, иммуноглобулины, интерфероны и их индукторы [3–5], обладающие не только эффективностью в отношении респираторных вирусов, но и целым спектром побочных (нежелательных) явлений. В связи с этим актуальным остается вопрос об эффективных и одновременно безопасных лекарственных средствах для лечения ОРВИ.
Эргоферон (РУ №ЛСР-007362/10-290710) – новый комбинированный препарат, созданный на основе аффинно очищенных антител к гамма-интерферону человека (анти- ИФН-γ), гистамину (анти-Н) и CD4 (анти-CD4). Значение ИФН-γ и анти-ИФН-γ в противовирусном ответе хорошо изучено [5–10]. Экспериментально доказано, что анти-ИФН-γ повышают экспрессию ИФН-γ, ИФН-α/β, а также рлейкинов (ИЛ-2, -4, -10 и др.), улучшают лиганд-сопряженных с ними интерецепторное взаимодействие ИФН, восстанавливают цитокиновый статус; нормализуют концентрацию и функциональную активность естественных антител к ИФН-γ [11–13]. В течение 2003–2010 гг. накоплен большой опыт по применению анти-ИФН-γ для лечения и профилактики гриппа и ОРВИ у взрослых и детей [7, 10, 14, 15].
Второй компонент Эргоферона – анти-Н – оказывает положительное влияние на опосредованные Н1-рецепторами процессы воспаления: уменьшает эозинофилов и агрегацию тромбоцитов, способствует сокращению длительности и выраженности воспалительных изменений слизистых оболочек респираторного тракта проницаемость сосудов, подавляет высвобождение гистамина из тучных клеток и базофилов, продукцию лейкотриенов, синтез молекул адгезии, снижает хемотаксис, в том числе ринорею и заложенность носа, кашель и чихание [11, 16]. Анти-CD4 – третий компонент Эргоферона, который регулирует активность CD4-рецептора. Известно, что CD4-клетки, в том числе антиген-презентирующие (макрофаги, дендритные клетки) и Т-хелперы (Th1 и Th2), играют ключевую роль в противовирусном иммунном ответе [1, 6, 17–19]. В эксперименте показано, что модулирующее влияние анти-CD4 на CD4-клетки системы иммунитета сопровождается повышением их функциональной активности, нормализацией соотношения CD4/CD8 и субпопуляционного состава (СD3, CD4, CD8, CD16, CD20), усилением противовирусной эффективности компонентов, входящих в состав Эргоферона, в том числе анти-ИФН-γ, формированием адекватного противовирусного ответа [11, 13, 16].
Экспериментально доказанная эффективность анти- ИФН-γ + анти-CD4 + анти-Н при гриппе и ОРВИ, а также безопасность нового противовирусного препарата были продемонстрированы в ходе многоцентрового двойного слепого плацебо-контролируемого, рандомизированного клинического исследования (КИ) в параллельных группах у взрослых пациентов. Известно, что маркером виремии в остром периоде ОРВИ, сопровождающемся общеинтоксикационным синдромом и симптомами поражения дыхательных путей, является повышенная температура тела, а критерием противовирусной эффективности лекарственного средства – ее снижение/нормализация. В качестве первичного критерия эффективности Эргоферона в данном КИ оценивалась доля пациентов с нормализацией температуры тела (≤37,0°С) на 1–5-е сутки лечения в сравнении с плацебо-терапией. Вторичными критериями эффективности были выраженность и продолжительность клинических проявлений ОРВИ (температуры тела, проявлений интоксикации, катаральных симптомов), динамика частоты приемов жаропонижающих препаратов на 2–5-й дни лечения, а также удельный вес пациентов, у которых отмечено ухудшение течения заболевания (развитие осложнений, требующих назначения антибиотиков или госпитализации).
Пациенты и методы
В КИ, которое проводили в 8 медицинских центрах РФ, включались пациенты в возрасте от 18 до 60 лет с температурой тела >37,8°C, имеющие как минимум один катаральный симптом (кашель, ринит, боль в горле) и один симптом интоксикации (озноб/потливость, недомогание, слабость, головная боль) в период сезонной заболеваемости, обратившиеся к врачу в течение 48 ч с момента появления первых симптомов ОРВИ.
После подписания информированного согласия на этапе скрининга пациентам проводилось начальное обследование (сбор анамнеза, оценка витальных функций, физикальное и лабораторное обследования), регистрировалась сопутствующая терапия. Пациент не включался в КИ при подозрении/ /наличии инвазивной бактериальной инфекции или тяжелого заболевания, требующего назначения антибактериальных препаратов (включая сульфаниламиды), обострении или декомпенсации хронических заболеваний, поливалентной аллергии в анамнезе, беременности, кормлении грудью.
Разрешался прием симптоматических препаратов, исходя из принятых стандартов лечения ОРВИ, включая жаропонижающие (при повышении температуры тела выше 38°С), отхаркивающие средства, муколитики, витамины, сосудосуживающие капли в нос, при необходимости проводилась дезинтоксикационная терапия. После включения в КИ пациент рандомизировался в группу приема Эргоферона либо плацебо. Эргоферон/плацебо назначались по схеме: в первые сутки лечения – 8 таблеток (в первые 2 ч по 1 таблетке каждые 30 мин, затем, в оставшееся время, еще 3 раза через равные промежутки), со 2-х по 5-е сутки препарат принимали 3 раза в день. В процессе лечения пациенты наносили врачу (либо врач пациенту) 3 визита (1-й, 3-й и 7-й дни), в ходе которых измерялась аксиллярная температура, регистрировались симптомы ОРВИ и сопутствующая терапия, оценивалась безопасность лечения. Для оценки эффективности терапии по первичному критерию учитывали значения утренней и вечерней температуры тела пациента в течение каждого из пяти дней лечения. Если пациент ис- пользовал разрешенные к применению в ходе исследования жаропонижающие препараты вследствие сохранения у него гипертермии (>37°С), принимали во внимание значения ак- силлярной температуры до приема антипиретика. Степень выраженности симптомов интоксикации и катаральных симптомов оценивалась врачом в ходе визитов в баллах (симптом отсутствует – 0 баллов; слабо выражен – 1 балл; средне выражен – 2 балла; ярко выражен – 3 балла). В общей сложности пациент наблюдался в течение 7 сут (5 сут – лечение и 2 сут – наблюдение).
В исследование было включено 87 амбулаторных пациентов. Из 5 пациентов были исключены исследователями по формальным критериям. В процессе обработки данных из анализа были исключены еще 7 пациентов в связи с отсутствием полных клинических данных. Таким образом, в окончательный анализ вошли данные 75 участников исследования, в том числе 38 – группы Эргоферона и 37 – группы плацебо.
Статистическая обработка данных проводилась с помощью статистического пакета SAS-9.2. Использовались методы параметрической (для непрерывных и интервальных переменных) и непараметрической (частотный анализ по категориальным переменным) статистики.
Результаты исследования и их обсуждение
Анализ температурной реакции у пациентов с длительностью течения ОРВИ не более 48 ч показал, что эффективность Эргоферона проявлялась, начиная с первых суток лечения (рис. 1), что подтверждалось превалированием пациентов с нормализацией температуры тела в группе активного препарата к вечеру первого дня наблюдения (13 против 8% в группе плацебо). К вечеру вторых суток терапии почти половина исходно лихорадящих больных группы Эргоферона имели нормальную температуру тела (45 против 32% в группе плацебо), к исходу третьего дня лечения удельный вес пациентов с нормальной температурой достиг 68% (против 49% в группе плацебо), а на утро четвертого дня от начала болезни почти все пациенты (92%), получавшие Эргоферон, не имели повышенной температуры (против 70% больных группы плацебо; р 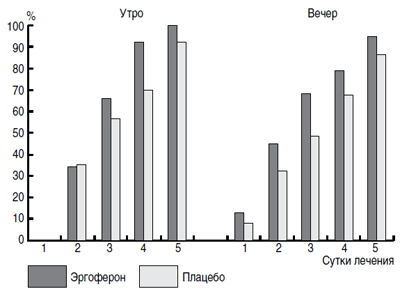
Рис. 1. Число пациентов с нормализацией температуры
на протяжении первых пяти дней заболевания.
Сравнение долей пациентов двух групп по утренним и вечерним измерениям температуры в каждый из пяти дней лечения по критерию Кохрана–Мантеля–Хензеля (Cochran–Mantel–Haenszel) выявило значимое различие между группами Эргоферона и плацебо на всем временном отрезке, включающем по пять пар измерений (F(1) = 11,018; р = 0,0009).
В подвыборке пациентов с манифестацией заболевания не более 24 ч эффективность Эргоферона имела более существенно выраженные различия с группой плацебо. К вечеру вторых суток терапии разница в числе пациентов с нормальными значениями температуры тела между группами активного препарата и плацебо достигала 15% (47 против 32% соответственно), а на утро четвертого дня – уже 23% (91 против 68% соответственно; р = 0,036). Через 4 сут приема Эргоферона (на утро пятого дня лечения) все участники исследования имели нормальную температуру тела.
Анализ результатов исследования по вторичным критериям подтвердил эффективность препарата, что выражалось в более низкой частоте приема жаропонижающих средств в течение 1–5 сут от начала терапии. Как видно из рис. 2, в первые сутки лечения Эргофероном менее половины участников (47%) использовали антипиретики с целью облегчения выраженности симптомов ОРВИ (против 65% в группе плацебо); на вторые сутки лечения их доля снизилась до 21% (против 27% в группе плацебо), на третьи – до 11% (против 19% в группе плацебо). Начиная с четвертого дня лечения ни один пациент группы активного препарата не пользовался жаропонижающими средствами (против 14% группы плацебо; p 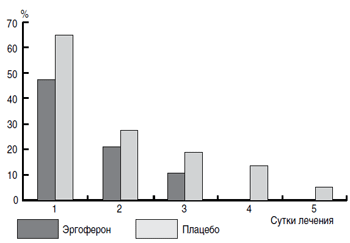
Рис. 2. Число пациентов, принимавших жаропонижающие средства
на протяжении первых пяти дней заболевания.
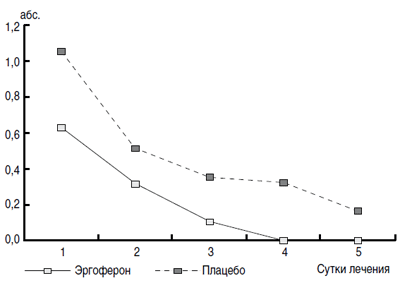
Рис. 3. Динамика средней частоты ежедневных приемов жаропонижающих
на протяжении первых 5 дней заболевания.
Анализ других вторичных критериев эффективности позволил продемонстрировать влияние Эргоферона на такие симптомы ОРВИ, как слабость, недомогание, чихание, заложенность и выделения из носа. Уже на третий день терапии доля пациентов без явлений астении в группе Эргоферона была больше, чем в группе плацебо (12 против 3%), к 7-му дню наблюдения разница составила 20% (79 и 59% соответственно). К третьему дню лечения бόльший процент пациентов группы Эргоферона не отмечал повышенной сонливости (59 против 47%). Катаральные симптомы со стороны верхних дыхательных путей (в том числе выделения из носа и чихание) к 7-му дню наблюдения полностью купировались также у бόльшего процента больных группы Эргоферона (87 и 71% соответственно).
Превосходство Эргоферона по влиянию на симптомы интоксикации и катаральные проявления ОРВИ было получено при оценке выраженности изучаемых клинических признаков в баллах на 1-й, 3-й и 7-й дни заболевания. Например, такие симптомы как слабость (2,0 ± 0,83 баллов), недомогание (2,0 ± 0,83 баллов) и заложенность носа (1,7 ± 0,99 баллов) уже к концу первого дня лечения Эргофероном были выражены значительно меньше, чем при использовании плацебо (2,3 ± 0,63; 2,3 ± 0,72 и 2,0 ± 1,02 баллов соответственно). На третий день лечения эффективность Эргоферона в отношении данных симптомов сохранялась. Кроме того, к третьему дню у больных, получавших Эргоферон, существенно уменьшалась сонливость (с 1,1 ± 1,07 до 0,5 ± 0,71 баллов против 1,1 ± 1,05 до 0,7 ± 0,73 баллов в группе плацебо).
Наконец, анализ результатов лечения и наблюдения показал, что в группе Эргоферона не зарегистрировано ни одного случая ухудшения течения заболевания, в том числе ни у одного пациента не отмечено развития осложнений, требующих назначения антибиотиков или госпитализации. То есть все больные, получавшие терапию Эргофероном, заканчивали участие в исследовании выздоровлением от ОРВИ либо значительным улучшением. В то же время в группе плацебо у двух больных зафиксировано развитие бактериальных осложнений, что привело к необходимости назначения им антибактериальных препаратов.
В анализ безопасности были включены данные всех пациентов, скринированных в исследование. В течение изучаемого периода лечения не было выявлено ни одного нежелательного явления, имеющего достоверную связь с приемом исследуемого препарата. Частота всех нежелательных явлений при лечении Эргофероном в течение 5 дней у пациентов с ОРВИ не отличалась от частоты нежелательных явлений при использовании плацебо. Эргоферон не оказывал отрицательного влияния на физикальные, включая витальные показатели. Мониторинг лабораторных показателей (анализа крови и мочи, биохимических маркеров) показал, что применение Эргоферона по лечебной схеме в течение 5 дней не приводило к каким-либо значимым отклонениям от нормальных значений.
Таким образом, на основании результатов исследования можно сделать вывод – препарат эффективен и безопасен в лечении ОРВИ у взрослых пациентов. Прием Эргоферона у пациентов с давностью заболевания не более двух суток значимо быстрее приводил к нормализации повышенной температуры тела по сравнению с приемом плацебо. Лечение Эргофероном, начатое в течение 24 ч от дебюта ОРВИ, более существенно сокращало длительность лихорадки, чем терапия, начатая в течение первых 48 часов. Эффект лечения Эргофероном проявлялся с первых суток приема препарата, а к исходу трех суток лечения подавляющее большинство больных ОРВИ имели нормальную температуру тела.
В течение пяти дней использования Эргоферона пациенты реже применяли жаропонижающие препараты с целью облегчения выраженности симптомов ОРВИ, начиная с первого дня лечения. Кроме того, эффективность терапии Эргофероном проявлялась купированием основных катаральных и общеинтоксикационных проявлений ОРВИ в более короткие сроки у большего процента больных, чем в группе плацебо.
Отчетливый клинический эффект препарата отмечен в отношении астенических проявлений (слабость, недомогание, сонливость) и симптомов со стороны верхних дыхательных путей (заложенность и выделения из носа, чихание). Лечение Эргофероном предупреждало развитие бактериальных осложнений, требующих применения антибиотиков.
Описанные эффекты терапии обусловлены влиянием препарата на основные звенья противовирусной резистентности и иммунного ответа, а также на гистаминоопосредованный компонент воспалительного процесса дыхательных путей у пациентов с ОРВИ [10, 11, 13, 16].
Анти-ИФН-γ проявляет противовирусную активность за счет индукции эндогенных ИФН и увеличения количества связей ИФН-γ с клеточными рецепторами, а также их числа [10, 12]. Анти-CD4 повышают функциональную активность CD4-клеток, что приводит к нескольким эффектам: оказывает модулирующее влияние на презентацию антигена, сокращает время клиренса вируса, которое зависит, в том числе, от активности CD4-эффекторов [7, 10, 17], способствует формированию адекватного противовирусного клеточного ответа [6, 16]. Анти-Н уменьшают выраженность экссудативной стадии воспаления слизистых оболочек респираторного тракта (ринореи, назальной обструкции, чихания). Таким образом, три компонента Эргоферона обеспечивают эффективную противовирусную защиту, что реализуется в уменьшении длительности лихорадочного периода и более быстром купировании основных клинических симптомов ОРВИ.
В ходе исследования была показана безопасность применения Эргоферона у пациентов с ОРВИ по лечебной схеме в течение пяти дней. В группе Эргоферона не было зарегистрировано нежелательных явлений, связанных с исследуемой терапией; препарат не оказывал отрицательного влияния на показатели общего и биохимического анализов крови и клинического анализа мочи; не было получено данных о взаимодействии Эргоферона с другими препаратами, принимавшимися пациентами в ходе исследования в качестве сопутствующей терапии.
Таким образом, Эргоферон – новый эффективный и безопасный препарат для этиопатогенетической терапии ОРВИ.
Для корреспонденции:
Костинов Михаил Петрович, доктор медицинских наук, профессор, заведующий лабораторией вакцинопрофилактики и иммунотерапии аллергических заболеваний Научно-исследовательского института вакцин и сывороток им. И.И.Мечникова РАМН Литература 1. Новиков Д.К., Новиков П.Д. Клиническая иммунопатология. Руководство. М.: Мед. лит., 2009; 464.
Адрес: 105064, Москва, Малый Казенный переулок, 5а.
2. Nathanson N. Viral Pathogenesis and Immunity. Lippincott Williams & Wilkins. 2002; 220.
3. Ершов Ф. Рациональная фармакотерапия гриппа и ОРВИ. Фармацевтический вестник 2003; 39.
4. Antiviral Agents for the Treatment and Chemoprophylaxis of Influenza Recommendations of the Advisory Committee on Immunization Practices (ACIP). Morbidity and Mortality Weekly Report. 2011; 60(1).
5. Ершов Ф.И., Киселев О.И. Интерфероны и их индукторы. М.: Гэотар-Медиа, 2005; 356.
6. Новиков Д.К. Противовирусный иммунитет. Иммунопатология, аллергология, инфектология 2002; 1: 5–15.
7. Baccam P., Beauchemin C., Macken C.A., et al. Kinetics of influenza A virus infection in humans. J Virol. 2006; 80: 7590–9.
8. Ellis T.N., Beaman B.L. Interferon-gamma activation of polymorphonuclear neutrophil function. Immunology 2004; 112: 2–12.
9. Pestka S., Krause C.D., Walter M.R. Interferons, interferon-like cytokines, and their receptors. Immunol. Rew. 2004; 202: 2896–920.
10. Tarasov S., Dugina Y., Sergeeva S., Epstein O. Oral antibody to interferon gamma in ultra low doses: clinical efficacy and interferon stimulation in patients with upper respiratory viral infections. Fundamental & Clinical Pharmacology 2008; 22 (Suppl. 2): 37.
11. Эпштейн О.И. Сверхмалые дозы (история одного исследования). М.: Издательство РАМН, 2008; 336.
12. Эпштейн О.И., Дугина Ю.Л., Качанова М.В. и др. Противовирусная активность сверхмалых доз антител к гамма-интерферону. Вестник Международной Академии Наук (Русская Секция) 2008; 2: 20–3.
13. Эпштейн О.И., Штарк М.Б., Дыгай А.М. и др. Фармакология сверхмалых доз антител к эндогенным регуляторам функций. Монография. М.: Издательство РАМН, 2005.
14. Martyushev-Poklad A.V., Uchaikin V.F., Drinevsky V.P., et al. A novel anti-interferon gamma antibody therapeutic: clinical benefits in paediatric viral upper respiratory tract infections. Book of abstracts of the 4th world congress of the world society for pediatric infectious diseases-WSPID. Warsaw, Poland. 2005; 178.
15. Sergeeva S.A., Martyushev-Poklad A.V., Petrov V.I., et al. Anaferon, oral antiinterferon gamma antibodies for treatment and prophylaxic of viral infections. Clinical and Experimental Pharmacology and Psychology 2004; 31 (Suppl. 1): 114.
16. Эпштейн О.И., Дыгай А.М., Шерстобоев Е.Ю. и др. Экспериментальное исследование фармакологических эффектов сверхмалых доз антител к эндогенным регуляторам функций. Бюл. экспер. биол. 2008; Приложение №2: 82–8.
17. Ha Youn Lee et al. Simulation and Prediction of the Adaptive Immune Response to Influenza A Virus Infection. J of Virology 2009; 7151–65.
18. Ingulli E., Funatake C., Jacovetty E.L., Zanetti M. Cutting edge: antigen presentation to CD8 T cells after influenza A virus infection. J Immunol. 2009; 182: 29–33.
19. Smith C.M., Wilson N.S., Waithman J., et al. Cognate CD4 T cell licensing of dendritic cells in CD8 T cell immunity. Nat. Immunol. 2004; 5: 1143–8.
