Состояние энергетического метаболизма и его коррекция у детей с гиперактивным мочевым пузырем
СтатьиОпубликовано в журнале: «Практика педиатра» Октябрь, 2014.
С.Л. Морозов, Е.И. Шабельникова, В.В. Длин,
Обособленное структурное подразделение «Научно-исследовательский клинический институт педиатрии» ГБОУ ВПО РНИМУ им. Н.И. Пирогова, г. Москва
Ключевые слова: нейрогенная дисфункция мочевого пузыря, ферменты клеточного энергообмена, энерготропная терапия, Элькар
Keywords: neurogenic dysfunction of urinary bladder, enzymes of cellular energy metabolism, energotropic therapy, Elkar
В настоящее время все более значимое положение занимает учение о полисистемных нарушениях клеточного энергообмена (митохондриальная патология). Ключевая область этого раздела медицины – наследственные синдромы, в основе которых лежат мутации генов, ответственных за митохондриальные белки (синдромы Кернса – Сейра, MELAS, MERRF, Пирсона, Барта и др.) [1].
Однако класс состояний, характеризующихся митохондриальной недостаточностью, отнюдь не ограничивается этими «первичными» митохондриальными заболеваниями. Громадное количество болезней включает в себя нарушения клеточного энергообмена в качестве «вторичных» звеньев патогенеза. Среди них: синдром хронического утомления, кардиомиопатии, гликогенозы, болезни соединительной ткани, рахит, тубулопатии, гипопаратиреоз, функциональные нарушения мочеиспускания [2].
Для практической медицины особое значение имеет изучение указанных нарушений в связи с наличием достаточно эффективных возможностей терапевтической коррекции. Однако при этом следует принять во внимание, что спектр патологических нарушений клеточного энергообмена чрезвычайно велик (повреждения различных звеньев цикла Кребса, дыхательной цепи, бета-окисления и др.) [3].
Нейрогенная дисфункция мочевого пузыря по-прежнему остается актуальной проблемой. У детей она обусловлена высокой социальной значимостью, приводящей к выраженному ограничению психической и физической активности пациента, затрудняющей его социальную адаптацию в обществе, что приводит к проблемам в общении со сверстниками, отставанию в учебе, конфликтным ситуациям в семье [4–6]. Распространенность нейрогенной дисфункции мочевого пузыря среди детского населения составляет в среднем 10–30%, что обусловливает не только научный, но и медико-социальный характер данной проблемы [7–10]. Нейрогенная дисфункция мочевого пузыря способствует развитию и поддержанию вторичных изменений мочевой системы, в частности может вызывать серьезные и необратимые повреждения почек и мочевого пузыря [8–11].
Ранняя диагностика и эффективная своевременная терапия нейрогенной дисфункции мочевого пузыря позволяет снизить риск повреждения верхних и нижних мочевых путей [11].
Проблема причин возникновения нейрогенных дисфункций мочевого пузыря еще далека от окончательного решения. Патогенез заболевания имеет полиэтиологический характер и в большой мере связан с дисфункцией вегетативной регуляции. Однако в последнее время все больше внимания уделяется нарушению биоэнергетики детрузора и ее связи с холинергическими системами организма [12].
Одним из основных нейромедиаторов вегетативной нервной системы является ацетилхолин. В последнее время появились данные о существовании ацетилхолина в крови, который не связан с синапсами и играет большую роль в обеспечении общей устойчивости организма [12]. В работах K. Tracey (США) [13] и K. Kawashima (Япония) [14] показано ключевое стимулирующее действие ацетилхолина, образующегося внутри тканей, а не в синапсах, на общую устойчивость организма. Было обнаружено присутствие ацетилхолина во многих не нейрональных клетках и тканях – иммунных клетках, клетках дыхательного эпителия и эндотелия сосудов, половых органах, мочевого пузыря и других [14]. Показано регуляторное действие внутриклеточного ацетилхолина на функции и биохимические превращения в клетках. Таким образом, возникло представление, что соматические клетки обладают холинергической системой, которая участвует в их функции, а холинергическая дисфункция связана с патологическими сдвигами в органах [13].
В работах Кондрашовой М.Н. и соавт. (2009) показано, что реципрокное влияние симпатического и парасимпатического отделов вегетативной нервной системы имеет в митохондриях соответствующих представителей, а именно такие ферменты, как сукцинатдегидрогеназа и альфа-кетоглутаратдегидрогеназа [15]. Эти ферменты и их субстраты, сукцинат и альфа-кетоглутарат, являются уникальными метаболическими парами, которые связывают митохондрии с симпатической и парасимпатической нервной системой через своих посредников – адреналин/норадреналин и ацетилхолин [15– 16]. В частности, в экспериментальных работах на животных Кондрашовой М.Н. и соавт. показана взаимосвязь уровня сукцинатдегидрогеназы и состояния холинергических систем организма. Так, при низких уровнях сукцинатдегидрогеназы преобладала активность парасимпатической нервной системы, основным медиатором которой является ацетилхолин.
Целью работы было определить состояние энергетического обмена у детей с ГАМП в зависимости от тяжести заболевания и установить в динамике состояние митохондриальных маркеров энергетического метаболизма после проведенной энерготропной терапии.
Клиническая характеристика групп и методы обследования.
Было обследовано 35 детей с ГАМП (25 девочек – 72% и 10 мальчиков – 28%) в возрасте от 5 до 14 лет (средний возраст 8 ± 2 лет). Диагноз ГАМП ставился на основании данных анамнеза, клинической картины заболевания. Для оценки степени выраженности нарушений мочеиспускания использовалась квалиметрическая таблица Е.Л. Вишневского, в которой перечислены основные симптомы ГАМП, оцененные в баллах. Дети с клиническими проявлениями ГАМП были разделены на три группы в зависимости от тяжести нарушений мочеиспускания. Первая группа включала 13 (37%) детей с легкой степенью нарушений мочеиспускания (менее 20 баллов), вторая группа – 14 (40%) детей со средней степенью нарушения мочеиспускания (от 30 до 20 баллов) и третья группа – 8 детей (23%) с выраженным нарушением мочеиспускания (от 30 до 40 баллов). Всем больным проводилась функциональная оценка состояния нижних мочевых путей на уродинамической установке (Medtronic DUET, США). По данным уродинамического обследования оценивались: цистометрический объем мочевого пузыря, внутрипузырное давление покоя, порог чувствительности мочевого пузыря, детрузорное пороговое давление потери мочи.
Для диагностики митохондриальной недостаточности у детей с ГАМП проводилось определение активности дегидрогеназ лимфоцитов: СДГ, альфа-ГФДГ, ЛДГ по методу A.G. Averson Pears в модификации Р.П. Нарцисова с последующей визуальной и компьютерной морфометрией. Ферментативная активность оценивалась в условных единицах, соответствующих среднему числу гранул формазана, являющимся продуктом цитохимических реакций. У детей с ГАМП до приема терапии исследовалась исходная оценка уровня цитохимических ферментов, далее в течение 3 месяцев дети получали терапию L-карнитином (препарат Элькар®, ООО «ПИК-ФАРМА») в дозировке 30–50 мг/кг/сут, с последующей оценкой уровня ферментов в динамике. Кроме того, оценивался уровень активности ферментов через 3 месяца после окончания терапии.
Результаты. При оценке исходного уровня ферментов клеточного энергообмена у детей с гиперактивным мочевым пузырем (1-я точка) уровень СДГ варьировал от 10 до 22 усл. ед. (17,4 ± 2,01, норма 18–23) и был снижен у 63% обследуемых, причем достоверно более выраженное снижение уровня СДГ отмечалось у детей из II и III групп больных (табл. 1).
Таблица 1
Уровень активности ферментов биоэнергетического обмена (у. е.) лимфоцитов периферической крови в зависимости от тяжести проявления ГАМП (M±m)
| Показатели / Группы | СДГ | альфа-ГФДГ | ЛДГ |
|---|---|---|---|
| I (n = 13) | 20,69 ± 3,05* | 11,05 ± 2,34 | 17,37 ± 5,56 |
| II (n = 14 ) | 17,76 ± 1,72* | 10,69 ± 2,06 | 14,38 ± 3,78 |
| III (n = 8 ) | 14,14 ± 1,97* | 9,0 ± 3,78 | 15,02 ± 1,97 |
Примечание: P I–II = 0,007; P I–III = 0,0002; P II–III = 0,0002; * – достоверная разница р
Уровень альфа-ГФДГ варьировал от 7 до 15 усл. ед. (10,1 ± 2,1, норма 11–14) и был снижен у 57% обследуемых и достоверно не зависел от тяжести проявления ГАМП. Снижения уровня ЛДГ у больных с ГАМП не отмечалось, и ее уровень составил 15,1 ± 4,1 (норма 10–17) усл. ед.
Все дети с гиперактивным мочевым пузырем получали в течение 3 месяцев терапию Элькаром в дозировке 30–50 мг/кг/сут, с последующей оценкой уровня активности ферментов в динамике (2-я точка). Кроме того, оценивались показатели активности ферментов через три месяца после окончания терапии (3-я точка). В динамике через 3 месяца терапии L-карнитином уровень СДГ в лимфоцитах крови был достоверно выше исходного уровня (Р = 0,00012) и составлял 20,9 ± 1,13 усл. ед. (рис. 1).
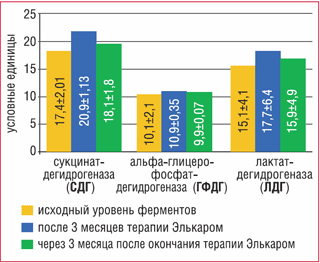
Рисунок 1. Динамика показателей активности ферментов биоэнергетического обмена у детей с ГАМП (достоверные различия указаны в тексте)
Значительное увеличение уровня СДГ наблюдалось у всех больных, и у 92% пациентов его уровень находился в пределах нормы. Кроме того, на фоне терапии отмечалось достоверное увеличение (р = 0,004) уровня альфа-ГФДГ, который составлял 10,9 ± 0,35 усл. ед. (рис. 1).
Через 3 месяца после отмены терапии уровень СДГ достоверно снижался (р = 0,0006), но был выше исходных значений. Динамика уровней альфа-ГФДГ и ЛДГ была менее значимой, а через 3 месяца после отмены терапии их уровень соответствовал исходному (рис. 1).
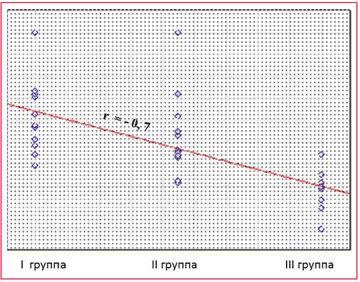
Рисунок 2. Корреляционная взаимосвязь уровня СДГ от тяжести проявления ГАМП
При оценке показателей активности ферментов клеточного энергообмена установлена обратная корреляционная взаимосвязь уровня СДГ (r = –0,7; pСледовательно, у большинства детей с ГАМП выявляются нарушения энергетического метаболизма, преимущественно в виде снижения уровня СДГ и альфа-ГФДГ, что обосновывает более широкое применение энерготроп-ных препаратов. При оценке клинических результатов у детей с гиперактивным мочевым пузырем применение Элькара в качестве монотерапии в дозировке 30–50 мг/кг/сут показало высокую эффективность.
У детей I группы полностью купировались клинические признаки ГАМП, эффект от терапии сохранялся на всем периоде наблюдения за детьми. Во второй группе у 70% детей симптомы ГАМП полностью исчезали, при этом у 30% детей наблюдался частичный эффект в виде снижения количества эпизодов недержания мочи в ночное и дневное время, уменьшение выраженности императивных позывов на мочеиспускания. В третьей группе уменьшение клинических признаков ГАМП отмечалось у 40% детей, тогда как у 60% клинического эффекта не отмечалось или он был незначительный. Применение энерготропных препаратов при нарушениях мочеиспускания у детей показало свою эффективность в ряде исследований [17]. Одним из основных энерготропных препаратов, применяемых при нарушениях мочеиспускания, является Элькар®, представляющий собой L-стереоизомер карнитина, который оптимально подходит для коррекции процессов биоэнергетического обмена. Учитывая, что за последнее десятилетие значимую роль в патогенезе многих заболеваний приобрели нарушения клеточного энергообмена, то такая терапия вполне оправдана. Показана ее эффективность при различных патологических состояниях и заболеваниях детского возраста, в том числе и при нарушениях мочеиспускания у детей [2].
Выводы.
Таким образом, у большинства детей с ГАМП выявляются нарушения энергетического метаболизма преимущественно в виде снижения уровня СДГ и альфа-ГФДГ.
Показано, что уровень активности ферментов биоэнергетического обмена нормализуется после проводимого лечения, однако спустя 3 месяца после окончания терапии снижается, при этом не достигая исходного уровня ферментов. Снижение уровня активности данных ферментов через 3 месяца после окончания терапии обосновывает назначение повторных курсов препаратов L-карнитина. В результате проведенного исследования установлена сильная обратная корреляционная зависимость тяжести ГАМП от уровня СДГ. Корреляционной связи уровней альфа-ГФДГ и ЛДГ с тяжестью ГАМП не выявлено.
Установлено, что применение препаратов L-карнитина (Элькара) показано для детей со средней и легкой степенью нарушения мочеиспускания в качестве монотерапии в дозировке 30-50 мг/кг/сут и в составе комплексной терапии у детей с тяжелой степенью расстройств мочеиспускания.
Список литературы находится в редакции.

