Роль антиоксидантов в коррекции психовегетативных, астенических и когнитивных нарушений
СтатьиОпубликовано в журнале:
Трудный Пациент №4, ТОМ 9, 2011
С.Н.Дума, Ю.И.Рагино
НИИ терапии СО РАМН, Москва
Наиболее частым механизмом патогенеза многих заболеваний ЦНС является ишемически-гипоксическое поражение головного мозга (ГМ), которое включает несколько механизмов: поражение клеток, вызванное свободными радикалами, оксидативный стресс, эксайтотоксичность, некроз и/или апоптоз клеток, воспаление и иммунная патология, секвестрация молекул, гибель клетки. Это поражение является важным звеном патогенеза многих болезней и патологических состояний: инсультов, ишемически-гипоксической энцефалопатии (в условиях глобальной гипоперфузии и гипоксии, например остановка сердечной деятельности и дыхания и др.), хронической церебральной ишемии (дисциркуляторной энцефалопатии – ДЭ), метаболических нарушений, токсических поражений ЦНС и др. Актуальность антиоксидантного эффекта для ГМ заключается в том, что он уязвим для свободных радикалов: это объясняется тем, что мозг потребляет до 50% вдыхаемого кислорода, из 10 млрд митохондрий, находящихся в тканях нашего организма, половина приходится на ГМ, для него характерно тотальное доминирование аэробного механизма энергопродукции, мозг богат полиненасыщенными жирными кислотами, поэтому возникает сверхактивация перекисного окисления в ответ на любое повреждающее воздействие. В норме активация перекисного окисления сопровождается активацией антиоксидантной системы, но сам ГМ бедно представлен ею. По мере прогрессирования цереброваскулярной недостаточности усиливается дисбаланс прооксидантной и антиоксидантной систем [11], а именно нервные клетки наиболее чувствительны и одновременно наиболее расположены к индукции свободно радикальных реакций [13]. Оксидантный стресс является одним из важнейших звеньев патогенеза ишемически-гипоксических поражений ГМ, в первую очередь хронической церебральной ишемии (ДЭ). Анаэробный гликолиз, запускаемый при гипоксии, вызывает окисление сукцината: это срочный компенсаторный путь с менее эффективной энергопродукцией (выработка 2 молекул АТФ против 32 при аэробном дыхании), т.е. «обреченный» путь – он «захлопывается» при истощении запасов гликогена, именно он запускает выработку избытка свободных радикалов (СР), перекисное окисление липидов (ПОЛ). Последствия хронической ишемии и сопутствующего ей оксидантного стресса определяются компенсаторными реакциями ГМ, которые направлены на восстановление гомеостаза вследствие ишемии, и являются частным проявлением адаптации [13]. Наиболее ярко отражают состояние компенсаторных процессов нейропсихологические, вегетативные и психопатологические показатели, характеризующие функциональное состояние ГМ [2]. Многочисленные результаты изучения роли оксидантного стресса при ишемии мозга дают основания для практического использования восполнения недостаточности антиоксидантных систем организма препаратами антиоксидантами [8]. В нашем сравнительном исследовании были использованы два современных антиоксидантных препарата (нейрокс и мексидол, МНН: этилметилгидроксипиридина сукцинат). Основным препаратом исследования был препарат нейрокс (Сотекс Фармфирма, Россия), обладающий антиоксидантными, мембраностабилизирующими эффектами, способствующий активации энергетического метаболизма в митохондриях и улучшающий выживаемость клеток в условиях гипоксии.
Цель нашего исследования – оценить эффективность влияния антиоксидантного препарата нейрокс на психовегетативные, астенические и когнитивные нарушения у пациентов с ДЭ 1 и 2 стадии.
Материалы и методы
В открытое сравнительное контролируемое исследование продолжительностью 15 дней были включены 60 пациентов обоего пола с подтвержденным диагнозом ДЭ 1–2 ст. в возрасте от 45 до 68 лет. Включенные в исследование пациенты случайным методом были разделены на 2 группы : 1-я (основная) группа (препарат Нейрокс): 30 человек (7 мужчин и 23 женщины) с ДЭ 1–2 ст., средний возраст 52,5 лет; 2-я (контрольная) группа (препарат Мексидол): 30 человек (4 мужчины и 26 женщин) с ДЭ 1–2 ст., средний возраст 51,5 лет. Статистически значимых различий между группами по полу и возрасту не было. От всех пациентов было получено информированное согласие на участие в исследовании. Диагноз ДЭ 1–2 ст. был выставлен в соответствии с «Классификацией сосудистых поражений головного и спинного мозга», разработанной НИИ неврологии РАМН (Е.В.Шмидт, Г.А. Максудов, В.М. Коган, 1985 г.). По международной классификации болезней 10 пересмотра (МКБ-10), заболевание рассматриваемых больных квалифицируется как « Другие уточненные поражения сосудов мозга с гипертензией» (рубрика I 67.8). Подтверждение или установление диагноза проводилось по результатам стандартизированного клинического неврологического обследования, а также анализа лабораторных данных (общий анализ мочи и крови, биохимическое исследование, проведенное за 3 мес от начала исследования) и инструментальных исследований (УЗДСГ сонных артерий и МРТ головного мозга), представленных в амбулаторной карте пациентов. Согласно «Классификации сосудистых поражений головного и спинного мозга» (Е.В.Шмидт, Г.А.Максудов, В.М.Коган, 1985 г.) клинически ДЭ 1 ст. проявляется субъективными церебральными жалобами (головная боль, шум, несистемное головокружение и т.д.), невротическими жалобами (раздражительная слабость, эмоциональная неустойчивость на фоне тревожно-депрессивных черт). При специальном обследовании выявляются легкие когнитивные нарушения (ЛКН) нейродинамического типа: замедление и инертность интеллектуальной деятельности, истощаемость, колебания внимания, уменьшение объема оперативной памяти. В неврологическом статусе – микроочаговая симптоматика (анизорефлексия, недостаточность конвергенции, негрубые рефлексы орального автоматизма, снижение устойчивости при выполнении координационных проб и т.д.). При ДЭ 2 ст. при некотором уменьшении выраженности субъективных жалоб усугубляются эмоциональные и познавательные расстройства. Когнитивные нарушения достигают стадии умеренных нарушений (УКН). На этой стадии, кроме нейродинамических расстройств, появляются дизрегуляторные (снижается контроль, способность планировать, выявляются нарушения выполнения заданий, уже не ограниченных рамками времени и т. д). В неврологическом статусе могут выявляться легкие экстрапирамидные нарушения, неполный псевдобульбарный синдром, дисфункция отдельных ЧМН (чаще 7 и 12 пары по центральному типу) и др.
Задачи исследования:
- Оценка влияния препарата на окислительно-антиоксидантный потенциал липопротеинов низкой плотности, на психовегетативную симптоматику (тревога, вегетативные расстройства), астению у пациентов основной (нейрокс внутримышечно 5,0 мл/50 мг №15) и контрольной групп (мексидол внутримышечно 5,0 мл/50 мг №15).
- Оценка влияния препарата на когнитивные нарушения нейродинамического типа (внимание, изменение объема оперативной памяти, скорость концентрации и т.д.) у пациентов основной и контрольной групп.
- Определение скорости наступления клинических эффектов у пациентов в обеих группах, сравнительная оценка отдельных преимуществ препаратов и оценка их переносимости.
Критериями исключения из исследования являлось:
- лечение препаратами, влияющими на функции ЦНС в течение 4-х недель до начала исследования;
- нестабильные сопутствующие заболевания, требующие лечения изменяющимися дозировками лекарств;
- проявление депрессии, присутствующей или в анамнезе, по оценке исследователя (шкала депрессии Гамильтона >7 баллов);
- наличие признаков хронического алкоголизма, лекарственной и наркотической зависимости.
- Изучение когнитивных функций: таблицы Шульте (норма 40–50 с) – исследование скорости обработки информации, концентрации внимания. Тест Векслера (символьно-цифровое сочетание) – исследование скорости обработки информации, зрительно-моторной координации и избирательного внимания (норма 40 с и более, от 40–35 с соответствует ЛКН; меньше 35 с соответствует УКН, 30 и меньше – деменция).
- Психовегетативные и астенические расстройства:
- Шкала Гамильтона для оценки тревоги (HAМ-Ф). Критерии оценки: показатели 6 баллов и меньше норма; 7–13 баллов могут быть тревожные расстройства; 14–20 баллов – тревога, 21–28 баллов – симптоматическая тревога; более 29 баллов – выраженная тревога.
- Шкала субъективной оценки астении (MFI-20), показатели астении оценивались по 5 субшкалам (в каждой субшкале норма до 12 баллов): общая астения, физическая астения, снижение активности, снижение мотивации, психическая астения.
- Шкалы вегетативных нарушений: опросник для выявления признаков вегетативных нарушений (заполняется пациентом), норма до 15 баллов, сумма более 15 говорит о высокой вероятности наличия синдрома вегетативной дисфункции (А.М.Вейн, 1998 г.); схема исследования для выявления признаков вегетативных нарушений (заполняется врачом) (А.М.Вейн, 1998 г.); норма до 25 баллов, сумма более 25 баллов свидетельствует о высокой вероятности наличия синдрома вегетативной дисфункции.
- Оценка эффективности лечения проводилась по следующим шкалам:
- Шкала глобального клинического воздейст-вия – улучшение (CGI-I) после лечения (оценка субъективного мнения врача-исследователя) по градациям: очень хорошее улучшение, хорошее улучшение, минимальные улучшения, нет изменений, минимальное ухудшение.
- Шкала общего впечатления пациента после окончания лечения по градациям: сильно улучшилось с момента исследования, улучшилось с момента начала исследования, улучшилось незначительно с момента начала исследования, мало изменилось с момента начала исследования.
- Регистрация побочных эффектов в обеих группах.
Статистическая обработка данных используемых тестов и шкал проводилась при помощи компьютерной программы SPSS, версия 11.5. Для обработки данных использовались непараметрические критерии Уилкоксона–Манна–Уитни. При сравнении вариационных рядов учитывались достоверные различия (рχ2-Пирсона. Статистическая обработка биохимических результатов выполнена на компьютере типа Pentium в статистической программе SPSS (версия 11.5). Использовались методы вариационной статистики с применением парного и независимого t-критерия Стьюдента, корреляционного анализа. Критерием достоверности считали уровень p
Результаты и обсуждение
Сравнительное исследование влияния препаратов нейрокс и мексидол на окислительно-антиоксидантный потенциал липопротеинов низкой плотности у пациентов основной и контрольной групп. При исследовании влияния указанных препаратов на параметры окислительных процессов нами был сделан акцент на оценку прооксидантно-антиоксидантного потенциала частиц ЛНП и, в частности, содержания в них продуктов ПОЛ и жирорастворимых антиоксидантов, а также устойчивости ЛНП к индуцированному катализаторами окислению.
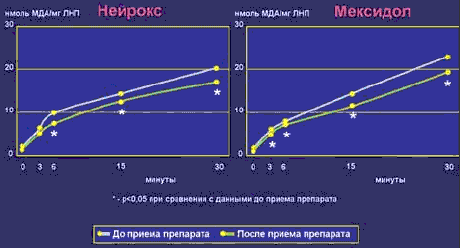
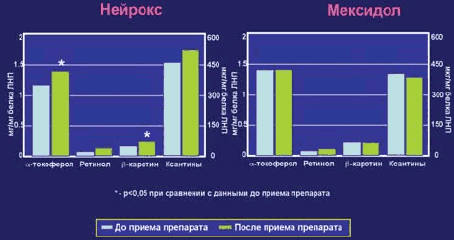
Выявлено, что после инъекций препарата Нейрокс у пациентов повысилась резистентность ЛНП к окислению (табл. 1): количество продуктов ПОЛ в ЛНП после 6-, 15- и 30-й мин их инкубации с катализаторами окисления снизилось на 16, 13 и 13% соответственно. Одновременно у пациентов этой же группы после приема нейрокса в ЛНП повысилось содержание α-токоферола и β-каротина на 17 и 16% соответственно (табл. 2).
| Показатели | Исходный уровень продуктов ПОЛ в ЛНП | Резистентность ЛНП к окислению катализатором | |||
| 3 мин | 6 мин | 15 мин | 30 мин | ||
| До исследования | 1,1±0,1 | 6,0±0,6 | 9,6±0,9 | 13,9±1,0 | 20,0±1,1 |
| После исследования | 0,9±0,1 | 5,2±0,6 | 8,1±0,7* | 12,1±0,9* | 17,3±0,9* |
| Примечание. * – p | |||||
| Показатели | α-Токоферол, мг/мг белка ЛНП | Ретинол, мг/мг белка ЛНП | β-Каротин, мкг/мг белка ЛНП | Ксантины, мкг/мг белка ЛНП |
| До исследования | 1,2±0,06 | 0,03±0,00 | 56,6±3,8 | 457,0±31,5 |
| После исследования | 1,4±0,07* | 0,06±0,01 | 65,5±6,2* | 472,8±40,9 |
| Примечание. * – p | ||||
В другой группе отмечено, что после введения препарата мексидол у пациентов также повысилась резистентность ЛНП к окислению (табл. 3): количество продуктов ПОЛ в ЛНП после 3-, 6-, 15- и 30-й мин их инкубации с катализаторами окисления снизилось на 12, 9, 13 и 13% соответственно. Однако каких либо изменений в содержании эндогенных липофильных антиоксидантов в ЛНП после приема мексидола зарегистрировано не было (табл. 4).
| Показатели | Исходный уровень продуктов ПОЛ в ЛНП | Резистентность ЛНП к окислению катализатором | |||
| 3 мин | 6 мин | 15 мин | 30 мин | ||
| До исследования | 2,1±0,2 | 5,7±0,4 | 8,0±0,5 | 13,5±0,7 | 22,5±0,9 |
| После исследования | 2,0±0,2 | 5,0±0,3* | 7,3±0,4* | 11,7±0,6* | 19,6±0,8* |
| Примечание. * – p | |||||
| Показатели | α-Токоферол, мг/мг белка ЛНП | Ретинол, мг/мг белка ЛНП | β-Каротин, мкг/мг белка ЛНП | Ксантины, мкг/мг белка ЛНП |
| До исследования | 1,4±0,1 | 0,04±0,00 | 59,1±3,3 | 377,9±36,9 |
| После исследования | 1,4±0,1 | 0,05±0,00 | 59,7±3,9 | 366,4±40,2 |
| Примечание. * – p | ||||
Сравнительная оценка влияния препаратов основной и контрольной групп по исследуемым биохимическим параметрам наглядно представлена на рис. 1 и рис. 2.
| Рис. 1. Влияние препаратов нейрокс и мексидол на уровень продуктов ПОЛ в ЛНП и их резистентность к окислению |
 |
| Рис. 2. Влияние препаратов нейрокс и мексидол на антиоксидантный потенциал и ЛНП |
 |
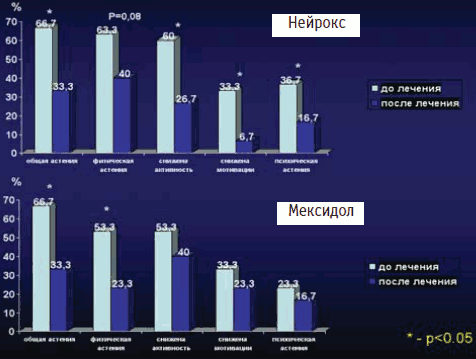
Результаты по сравнительному исследованию влияния препаратов основной группы (нейрокс) и контрольной группы (мексидол) на астеническую симптоматику пациентов. Астения – психопатологическое состояние, характеризующееся слабостью, повышенной утомляемостью, эмоциональной лабильностью, нарушениями сна. Повышенная утомляемость – одна из распространенных жалоб у пациентов с ДЭ 1–2 ст. Общеизвестно, что астенические симптомы мало подвержены спонтанному обратному развитию, что, как правило, всегда определяет необходимость проведения соответствующей терапии. Существуют разные подходы к их терапии. За рубежом распространен подход, подразумевающий использование самых разных препаратов – от кортикостероидов до иммуномодуляторов, витаминов и антидепрессантов. В отечественной психофармакологии наиболее часто используются препараты группы ноотропов, использование психостимуляторов ограничено из-за рисков, связанных с их использованием (злоупотребление, синдром отмены) [1]. Поэтому наличие у антиоксидантов антиастенического эффекта является весьма важным качеством, так как они лишены нежелательных рисков психоропных препаратов и при этом обладают дополнительным широким спектром терапевтического действия (ноотропным, вегетостабилизирующим, антигипоксантным и т.д.). В нашем исследовании проводилась оценка динамики показателей по пяти субшкалам астенического синдрома (шкала MFI-20) (рис. 3). В 2 исследуемых группах доля пациентов с общей астенией составила 66,7%. Анализ субшкал астении показал близкие показатели распространенности астении на начало исследования: так по показателям физической астении (в основной группе – 63,3%, в контрольной – 53,9%); сниженной активности (соответственно 60 и 53,3%); сниженной мотивации (33,3% в обеих группах); только по показателям психической астении больший процент был в основной группе (35,7 против 23,3% в контрольной группе). На конец исследования была отмечена положительная динамика в обеих группах, статистически достоверные (p
| Рис. 3. Динамика субшкал VFI дл и после лечения препаратами нейрокс и мексидол |
 |
Результаты по сравнительному исследованию влияния препаратов основной группы (Нейрокс) и контрольной группы (Мексидол) на психовегетативную симптоматику и когнитивные нарушения у пациентов. С середины 90-х годов международные эксперты обсуждают концепцию васкулярной депрессии. Предполагается, что хроническая ишемия ГМ приводит к дисфункции стриопалидарных-кортикальных путей и нарушению обмена нейротрансмиттеров, учавствующих в регуляции настроения. При ДЭ 1 ст. соматические симптомы (общая слабость, головная боль, утомляемость, головокружение, нарушения сна) часто маскируют такие эмоциональные нарушения как лабильность, раздражительность, нервозность. Отличительной чертой сосудистых эмоционально-аффективных расстройств является их сочетание с когнитивными жалобами. Вместе с тем, аффективные расстройства, связанные с ДЭ 1–2 ст., плохо поддаются лечению антидепрессантами и другими психотропными препаратами. В литературе активно обсуждаются тактики сочетанного использования психотропной и сосудисто-метаболической терапии, а также терапии, направленной на гипоксически-ишемический патогенез хронической ишемии мозга. В практике невролога часто встречаются психогенные астении, сочетающиеся с вегетативной дисфункцией. У подобных пациентов часто диагностируют психовегетативный синдром (ПВС). Спецификой вегетативной составляющей ПВС является то, что актуальные жалобы драматизируются пациентом при отсутствии объективных признаков соматического заболевания или заболевание не может объяснить всего спектра и интенсивности жалоб; активный расспрос позволяет дополнительно выявить жалобы на нарушения в других сферах (полисистемность вегетативных расстройств); вегетативные жалобы сопряжены с нарушениями сна, раздражительностью по отношению к привычным жизненным ситуациям, чувством постоянной усталости, нарушением внимания, изменениями аппетита, нейроэндокринными расстройствами. Появление и усугубление жалоб связано с динамикой актуальной психогенной ситуации, а под влиянием психофармакологических средств происходит редукция жалоб. Вместе с тем важно отметить, что в классификации важнейших транквилизаторов в рубрике новые анксиолитики, в подгруппе мембранные модуляторы ГАМК А-бензодиазепинового рецепторного комплекса находятся препараты антиоксиданты: мексидол и др. [6].
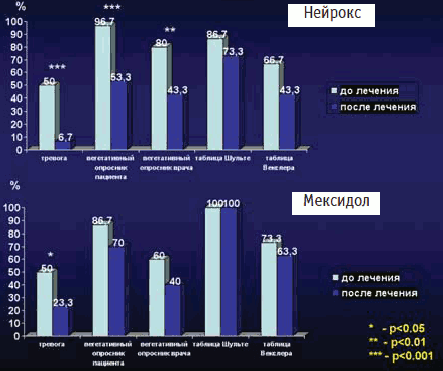
В нашем исследовании оценка показателей тревоги (шкала HAМ-Ф) представлена на рис 4 (1 столбец). Тревожные расстройства были наиболее широко представленной симптоматикой в обеих исследуемых группах на начало исследования и составляли в основной группе – 83,3%, а в контрольной группе – 93,3%. На 15-й день терапии хорошую противотревожную динамику показали: основная группа – тревожная симптоматика отмечена у 66,7% пациентов (снизилась на 16,8% за 15 дней терапии), а в контрольной группе доля пациентов с тревожной симптоматикой снизилась до 70% (снизилась на 23,3%, p
| Рис. 4. Динамика психовегетативных и когнитивных показателей до и после лечения |
 |
| Рис. 5. Представленность тревожных расстройств и их динамика на фоне лечения |
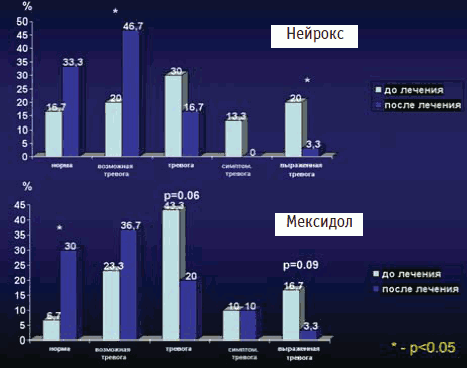 |
В основной группе наилучшую динамику на конец лечения отметили в подгруппе «симптоматическая тревога» (с 13,3 до 0% на конец исследования и в подгруппе «выраженная тревога» с 20 до 3,3%; в подгруппе «тревога» с 30% до 16,7%). Хотя статистически достоверная динамика была выявлена только в категории «выраженная тревога» и «возможная тревога» (p
Отличительной чертой сосудистых эмоционально-аффективных расстройств является их сочетание с когнитивными жалобами. У препаратов антиоксидантов имеется широко признанный ноотропный эффект. Они улучшают процессы обучения и памяти – за счет стабилизации мембран, образования взаимосвязанных мембранных комплексов нейронов, вызывая активацию синаптических процессов и улучшение когнитивных функций, согласно синапсомембранной организации памяти. Оценка динамики когнитивных расстройств представлена на рис. 4 в 4-м столбце (таблицы Шульте) и 5-м столбце (тест Векслера). Проводилась оценка когнитивных функций только нейродинамического типа в связи с краткосрочностью исследования – 15 дней. В обеих группах были широко представлены подобные нарушения: так по скорости заполнения таблиц Шульте (исследование скорости обработки информации, концентрации внимания) в основной группе на начало исследования не укладывались в нужный норматив времени 86,7% пациентов, в контрольной группе норматив смогли выполнить в 100%. Оценка на конец исследования: в основной группе отметилась положительная динамика (положительная дельта по времени выполнения теста составила 5,7 с), но не была статистически достоверной. В контрольной группе динамика не выявлена, хотя также выявлена положительная дельта в 4.4 с. Оценка динамики выполнения теста Векслера (символьно-цифровое сочетание) – исследование скорости обработки информации, зрительно-моторной координации и избирательного внимания показала: в основной группе не укладывались в требуемый норматив 66,7% пациентов. На конец исследования их доля в основной группе составила 43,3%, и хотя просматривается положительная динамика (положительная дельта в 6,9 дополнительных знаков за 1 мин) статистической достоверности не получено. В контрольной группе динамика показателей составила 73,3 и 63,3% соответственно, также просматривается положительная динамика (дельта в 4,2 знака), но статистически достоверной динамики не получено. Положительная динамика, выявленная при выполнении данных тестов, позволяет предположить получение статистически достоверных положительных результатов при более длительном приеме препаратов.
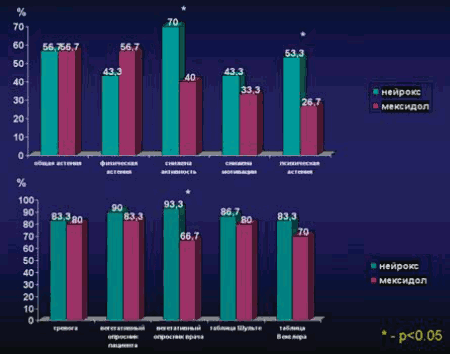
Влияние терапии препаратов на улучшение исследуемых показателей, сравнительная оценка. На рис. 6 отражена сравнительная оценка доли пациентов, у которых улучшились исследуемые показатели после терапии препаратами нейрокс и мексидол. Так, по астеническим субшкалам отмечается преимущество основной группы (по показателям сниженной активности и психической астении) – получена статистическая достоверность (p
| Рис. 6. Сравнительный анализ влияния терапии препаратами нейрокс и мексидол на улучшение исследуемых показателей |
 |
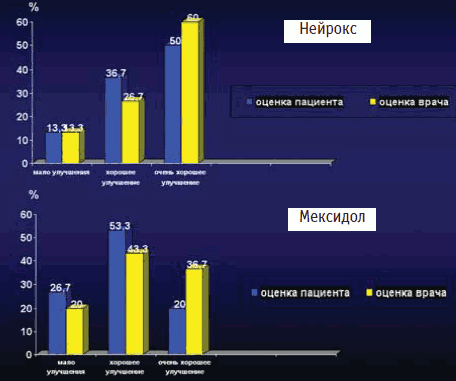
Оценка эффективности лечения проводилась с использованием шкал глобального клинического воздействия – улучшение (CGI-I) после лечения по оценкам субъективного мнения врача-исследователя и пациента. Оценка субъективного мнения врача-исследователя после лечения распределилась следующим образом: очень хорошее улучшение: основная группа – 60%, контрольная группа – 36,7%; хорошее улучшение: основная группа – 26,7%, контрольная группа – 43,3%; минимальные улучшения: основная группа – 13,3%, контрольная группа – 20%; нет изменений: основная группа – 0%, контрольная группа – 0%; минимальное ухудшение: основная группа – 0%, контрольная группа – 0% (рис. 7). Оценка по шкале общего впечатления пациента после окончания лечения: очень хорошее улучшение от начала исследования: основная группа – 50%, контрольная группа – 20%; хорошее улучшение: основная группа – 36,7%, контрольная группа – 53,3%; улучшилось незначительно от начала исследования: основная группа – 13%, контрольная группа – 26,7%; мало изменилось от начала исследования: основная группа – 0%, контрольная группа – 0% (см. рис. 7).
| Рис. 7. Оценка эффективности лечения препаратами нейрокс и мексидол |
 |
Регистрация побочных эффектов: в обеих группах зарегистрировано по 1 случаю незначительных побочных эффектов. В основной группе 1 пациентка предъявила жалобу на слабо выраженную сонливость и несистемное головокружение на начальном этапе терапии (первые 2 инъекции). В контрольной группе 1 пациентка отметила тошноту и легкое головокружение при введении первых инъекций. Исследование закончили все пациенты, из-за нежелательных побочных реакций отмены препаратов не было. Пациенты обеих групп отмечали появление болезненных уплотнений в ягодицах к концу терапии. Постинъекционных абсцессов зарегистрировано не было.
Выводы
- Выявлено положительное влияние препаратов двух исследуемых групп на окислительный потенциал ЛНП, а именно – уменьшение предрасположенности к окислительным процессам ЛНП in vivo под влиянием обоих препаратов. Выявлен дополнительный эффект препарата основной группы (нейрокс) на антиоксидантный потенциал ЛНП, а именно – повышение содержания в ЛНП липофильных антиоксидантов α-токоферола и β-каротина, что более положительно характеризует препарат основной группы (нейрокс) в отношении антиоксидантных свойств.
- В основной группе (нейрокс) отмечен более выраженный противоастенический эффект по 4 субшкалам: общей астении, сниженной активности, сниженной мотивации и психической астении (p
- Выявлено положительное влияние препаратов двух исследуемых групп на тревожную симптоматику (статистически достоверное в контрольной группе, p
- Выявлено положительное влияние препаратов обеих групп на вегетативную симптоматику. Статистически достоверная динамика отмечена только в основной группе (нейрокс) как по мнению врача (p
- Выявлено незначительное положительное влияние препаратов обеих групп на когнитивную симптоматику нейродинамического типа. Подобные результаты с учетом наличия положительной тенденции к концу лечения можно объяснить краткосрочностью исследования (15 дней).
- Сравнительная оценка двух препаратов выявила преимущества (p
Литература
1. Аведисова А.С., Ястребов Д.В. Оценка диагностики и терапии астенических расстройств по результатам анкетирования врачей общей практики. Журн неврол и психат 2010; 110: 2: 56–60.
2. Антипенко Е.А.,Густов А.В. Антиоксидантная терапия при дисциркуляторной энцефалопатии. Журн неврол и психиат. 2010; 110: 7 :53–55.
3. Арцимович Н.Г., Галушина Т.С.Синдром хронической усталости. М.: Научный мир, 2001.
4. Вейн А.М., Вознесенская Т.Г., Голубев В.Л., Дюкова Г.М. Депрессия в неврологической практике. М.: МИА, 2007; 208.
5. Вознесенская Т.Г., Фокина Н.М., Яхно Н.Н. Лечение астенических расстройств у пациентов с психовегетативным синдромом (результаты многоцентрового исследования эффективности и переносимости ладастена). Журн неврол и психиат. 2010; 110: 5: 17–26.
6. Воронина Т. А., Середенин С. Б. Перспективы поиска анксиолитиков. Эксперим. и клин. фармакология. 2002; 65: 5: 4–17.
7. Гусев Е.И.,Скворцова В.И. Ишемия головного мозга. М.: Медицина, 2000.
8. Камчатнов П.Р., Михайлова Н.А., Жданова С.В. Коррекция свободнорадикального окисления у больных с расстройствами мозгового кровообращения. Трудный пациент. 2010; 8: 6–7: 26–30.
9. Путилина М.В. Астенические синдромы при хронической ишемии мозга и их коррекция. Cons.Med. 2010; 12: 9: 48–50.
10. Сафарова Т.П. Клинико-фармакологическое обоснование дифференцированной психофармакотерапии больных с астеническим синдромом: автореф.дис…кан. мед.наук. М.: 1997; 23.
11. Clemens J.A. Cerebral ischemia gene activation,neuronal injury, and the protective role of antioxidants. Free Radic Biol Med. 2000; 28: 10: 1526–1531.
12. Kontos H.Oxygen Radical in Cerebral ischemia: The2001Willis ture. Stroke. 2001; 32: 2712–2716.
13. Pasker L.L., Prilipco Y., CyistenY.Free radicalisin the brain. Berlin,1992; 120.
