Цереброваскулярная болезнь и инсульт в настоящее время становятся основной социально-медицинской проблемой неврологии. На сегодняшний день около 9 млн человек страдают цереброваскулярными заболеваниями. В последние годы в нашей стране отмечается увеличение частоты острых нарушений мозгового кровообращения. Ежегодно в мире церебральный инсульт переносят около 6 млн человек, а в России - более 450 тыс., т. е. каждые 1,5 мин. у кого-то из россиян впервые развивается это заболевание. В Москве количество острых инсультов составляет от 100 до 120 в сутки, столь же высокая заболеваемость инсультом, в пересчете на количество населения, отмечена и в других крупных мегаполисах нашей страны.
В структуре общей смертности населения в мире инсульт занимает 2-е место, уступая лишь кардиальной патологии, и составляет 4,7 млн человек в год. Ранняя 30-дневная летальность после инсульта составляет 35%, в течение года умирает около 50% больных, т. е. каждый второй заболевший. Показатели смертности от цереброваскулярных заболеваний за последние 15 лет повысились на 18% и достигли сегодня 280 человек на 100 тыс. населения.
Инсульт и тяжелые цереброваскулярные заболевания являются в настоящее время основной причиной инвалидизации населения. Менее 20% выживших после церебрального инсульта больных могут вернуться к прежней работе. Помимо этого, стоимость расходов на социальную реабилитацию и длительное восстановительное лечение одного больного с инсультом составляет от 55 до 73 тыс. долларов в год.
Среди всех видов инсульта преобладают ишемические поражения мозга. В России, как и в странах Европы и Америки, ишемические инсульты составляют 70-85% случаев, кровоизлияния в мозг - 20-25% случаев, нетравматические субарахноидальные кровоизлияния - 5% случаев.
В основе патоморфологических нарушений у больных с ишемическими инсультами лежат многообразные патогенетические факторы, такие как атеросклероз, гипертоническая болезнь, их сочетание, кардиальная патология, изменения состояния позвоночника с компрессией вертебральных артерий, гормональные расстройства, ведущие к изменениям свертывающей системы крови, другие виды нарушений системы гемостаза и физико-химических свойств крови, срывы церебральной ауторегуляции, что приводит к формированию ишемических очагов. Тяжесть церебральной ишемии определяется как размерами и локализацией ее зон, так и вторичными постишемическими дисрегуляторными расстройствами, прежде всего прогрессирующим постишемическим отеком, дестабилизацией церебральной ауторегуляции.
Патогенез поражения церебральных структур при сосудистых ишемических поражениях головного мозга, несмотря на фоновое многообразие причин, их вызывающих, всегда однотипен и заключается в последовательном нарастании комплекса патобиохимических расстройств, обусловленных снижением уровня кислорода артериальной крови (гипоксемией), с одной стороны, и токсическим воздействием интермедиатов недоокисленного кислорода (оксидантным стрессом), с другой стороны (Е. И. Гусев, В. И. Скворцова, 2000):
апоптоз-клеточная смерть. В результате острого нарушения регионарной церебральной перфузии и системного кровотока, микроциркуляции, а также снижения уровня кислорода артериальной крови происходит деструкция клеточных мембран нейронов и глиальных элементов, а также изменение структур мембран эндотелиоцитов, выстилающих капиллярное русло, с изменением ширины их просвета за счет нарушения внутриклеточного ионного гомеостаза.
Результатом этих гипоксическо-ишемических расстройств является развитие первичной и прогрессирование вторичной церебральной ишемии, формирование лакунарных инфарктов и увеличение зон ишемии.
В то же время даже в условиях ишемии и гипоксии церебральные структуры при участии ряда саморегулирующих систем, поддерживающих баланс энергозатратных и энергопродуцирующих процессов, осуществляют поддержание энергетического гомеостаза. Реализованный в клетках, в том числе и в нейронах, принцип сопряжения окисления и фосфорилирования, в ходе которого на мембранах создается электрический потенциал, активно преобразует химическую энергию в электрическую и осмотическую. Но в полном объеме и с полной энергетической отдачей этот механизм может работать только в условиях адекватного кислородного баланса организма. Кислород для любой клетки, особенно для нейрона и популяций нейронов, является ведущим энергоакцептором в дыхательной митохондриальной цепи. Связываясь с атомом железа цитохромоксидазы, молекула кислорода подвергается четырехэлектронному восстановлению и превращается в воду. В условиях нарушения энергообразующих процессов дисбаланс энергетического метаболизма может негативно сказаться на клетке и даже привести ее к гибели. Главной причиной негативных последствий даже кратковременной ишемии и гипоксии является образование при неполном восстановлении кислорода высокореакционных, а потому токсичных свободных радикалов или продуктов, их генерирующих. В условиях неполного восстановления кислорода возникает относительная доступность и легкость образования свободных радикалов.
В настоящее время известно большое число веществ со свойствами свободных радикалов, играющих разнообразные роли в обменных процессах в тканях. Свободные радикалы представляют собой группу разнообразных по природе веществ, характеризующихся одним общим признаком - наличием в одном из атомов неспаренного электрона. Такое состояние вещества является неустойчивым, и свободные радикалы стремятся превратиться в стабильные продукты путем спаривания свободного электрона.
В процессе функционирования биологических объектов из групп радикалов вырабатываются вещества, обладающие антиоксидантным действием, которые получили название стабильных радикалов. Стабильные радикалы, появляющиеся в биологических объектах, правильнее было бы назвать условно стабильными.
Они не способны отрывать атомы водорода от большинства молекул, входящих в состав клетки. Но они могут совершать эту операцию с особыми молекулами, имеющими слабо связанные атомы водорода. Этот класс химических соединений получил название антиоксидантов, поскольку механизм их действия основан на торможении свободнорадикальных процессов в тканях. В отличие от нестабильных свободных радикалов, оказывающих повреждающее действие на клетки, стабильные свободные радикалы тормозят развитие деструктивных процессов, замедляют старение и гибель клеток.
Жизнеспособность клеток, попавших в зону ишемии при церебральном инсульте, определяется целым рядом факторов, ведущим из которых является степень нарушения энергосинтеза и энергопотребления, от которых напрямую зависит функциональная и морфологическая целостность мембранных структур. Терапевтические стратегии, позволяющие снизить энергозатраты и уменьшить выраженность оксидантного стресса, являются в настоящее время одним из наиболее разрабатываемых методов первичной и вторичной нейропротекции постишемических системных и локальных церебральных расстройств.
Эти стратегии опираются прежде всего на активизацию в условиях гипоксии и ишемии собственных антиоксидантных ресурсов организма.
Существующая в организме физиологическая антиоксидантная система представляет собой совокупную иерархию защитных механизмов клеток, тканей, органов и систем, направленных на сохранение и поддержание в пределах нормы реакций организма, в том числе в условиях ишемии и стресса. Она включает систему внутриклеточных антиокислительных ферментных систем, противодействующих окислительному стрессу и обезвреживающих активные формы кислорода.
К антиоксидантным внутриклеточным ферментам относятся, прежде всего, супероксиддисмутаза (восстанавливает кислород до перекиси водорода), каталаза (восстанавливает перекись водорода до воды).
Однако перекисное окисление липидов в фосфолипидных структурах биологических мембран плохо устраняется системой супероксиддисмутаза-каталаза. Детоксикация в этих структурах осуществляется, главным образом, ферментами системы глутатиона, прежде всего глутатионредуктазой, глутатионпероксидазой и глутатионтрансферазой. Наряду с антиоксидантными ферментами к числу высокомолекулярных антиоксидантов следует отнести также сывороточный альбумин, гаптоглобин, трансферрин, ферритин, связывающие высокоактивные ионы, но слабо проникающие через мембраны.
Активность свободных радикалов ограничивается антиоксидантами, которые разрывают цепи молекул при реакциях свободнорадикального окисления и разрушают молекулы перекисей. К числу ферментных антиоксидантов относятся супероксиддисмутаза, глутатионпероксидаза, каталаза, находящиеся в клеточных структурах. Неферментные антиоксиданты - витамины Е, К, С, убихиноны, триптофан, фенилаланин, церулоплазмин, трансферрин, гаптоглобин, глюкоза, каротиноиды, флавоноиды - блокируют активность свободных радикалов в крови. Изменения структуры и функции субстратов, на которые действуют свободные радикалы, зависят, в конечном счете, от соотношения активности свободных радикалов и антиоксидантов.
Контроль свободнорадикального окисления в головном мозге осуществляется также некоторыми нейропептидами.
Так, введение АКТГ вызывает длительное снижение продуктов перекисного окисления липидов в мозге и крови и активирует супероксидперехватывающие системы головного мозга. Основные механизмы действия антиоксидантов основаны на стимуляции естественных ферментных систем.
Известные к настоящему моменту биологические и химически синтезированные антиоксиданты подразделяются на жирорастворимые и водорастворимые. Жирорастворимые антиоксиданты локализуются там, где расположены субстраты -мишени атаки свободных радикалов и пероксидов, наиболее уязвимые для процессов перекисного окисления биологические структуры. К числу таких структур относятся прежде всего биологические мембраны, липопротеины крови, а наиболее адекватными мишенями в них являются ненасыщенные жирные кислоты. Среди жирорастворимых антиоксидантов наиболее известен альфа-токоферол, который, взаимодействуя с гидроксильным радикалом ОН, оказывает подавляющее влияние на синглентный кислород.
Среди водорастворимых антиоксидантов наиболее известны глутатион и аскорбиновая кислота, играющая наиболее важную роль в антиоксидантной защите структур мозга.
Наиболее адекватным синергистом и практически повсеместным спутником аскорбиновой кислоты является система физиологически активных фенольных соединений. В значительных количествах они встречаются во всех живых организмах, составляя 1-2% биомассы и более и выполняя разнообразные биологические функции.
Наибольшим разнообразием химических свойств и биологической активности отличаются фенольные соединения с двумя и более гидроксильными группами в бензольном ядре.
Эти классы фенольных соединений в физиологических условиях образуют буферную окислительно-восстановительную систему.
Широко известные препараты со свойствами антигипоксантов в настоящее время применяются в клинической практике. К препаратам с таким действием относится аскорбиновая кислота, церулоплазмин, витамин Е, каротин, убихинон, эмоксипин. Все эти препараты применяются, в том числе для лечения больных с нарушениями мозгового кровообращения, достаточно давно, но обладают недостаточно выраженной антиоксидантной фармакокинетикой.
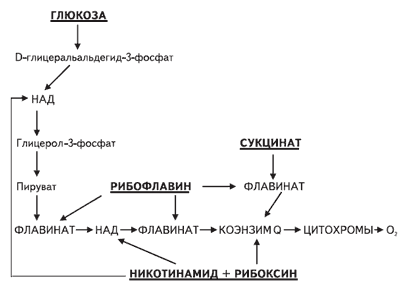
В настоящее время на фармакологическом рынке появилось большое количество препаратов-антиоксидантов, применяемых с целью уменьшения выраженности ишемических повреждений при инсульте. В последние годы широко изучается действие янтарной кислоты, ее солей и эфиров, представляющих собой универсальные внутриклеточные метаболиты. Янтарная кислота, содержащаяся в тканях и органах, является продуктом пятой реакции и субстратом шестой реакции цикла трикарбоновых кислот. Выполняя каталитическую функцию по отношению к циклу Кребса, янтарная кислота снижает в крови концентрацию других продуктов данного цикла - лактата, пирувата и цитрата, накапливающихся на ранних стадиях гипоксии. Феномен быстрого окисления янтарной кислоты сукцинатдегидрогеназой, сопровождающийся АТР - зависимым восстановлением пула пиримидиновых динуклеотидов, получил название "монополизации дыхательной цепи", биологическое значение которой заключается в быстром ресинтезе АТР. В нервной ткани функционирует Y-аминобутиратный шунт (цикл Робертса), в ходе которого янтарная кислота образуется из Y-аминомасляной кислоты через промежуточную стадию янтарного альдегида. В условиях окислительного стресса образование янтарной кислоты возможно также в реакции окислительного дезаминирования а-кетоглутаровой кислоты в печени. Антиоксидантное действие янтарной кислоты обусловлено ее влиянием на транспорт медиаторных аминокислот, а также увеличением содержания в мозге Y-аминомасляной кислоты за счет шунта Робертса. Янтарная кислота в организме в целом нормализует содержание гистамина и серотонина и повышает микроциркуляцию в органах и тканях, прежде всего в мозге, не оказывая влияния на артериальное давление и показатели работы сердца. Противоишемический эффект янтарной кислоты связан не только с активацией сукцинатдегидрогеназного окисления, но и с восстановлением активности ключевого окислительно-восстановительного фермента дыхательной митохондриальной цепи - цитохромоксидазы.
Следующим шагом в области фармакокинетики антиоксидантов было создание цитофлавина - комплексного препарата, содержащего янтарную кислоту (10%), рибоксин (2%), никотинамид (1%), рибофлавина мононуклеотид натрия (0,2%).
Комплексный состав препарата позволяет полностью использовать механизмы антигипоксического действия всех его составляющих. Метаболический антигипоксант цитофлавин представляет собой сбалансированный комплекс из двух метаболитов (янтарная кислота, рибоксин) и двух коферментов витаминов - рибофлавина мононуклеотида (витамин В2) и никотинамида (витамин РР).
В условиях гипоксии при резком снижении активности НАД-зависимых ферментов цикла Кребса остро встает необходимость активации альтернативных НАД метаболических потоков, и прежде всего окисляющего янтарную кислоту сукцинатдегидрогеназного шунта. Для активации сукцинатдегидрогеназы, которая по своей структуре является железосернистым флавопротеином, используют кофермент витаминов - рибофлавин мононуклеотид (витамин В2).
Рис. 1. Схема действия цитофлавина
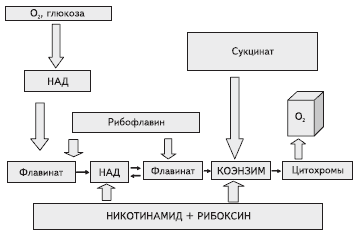
У рибофлавина установлено прямое антигипоксическое действие, связанное с увеличением активности флавинредуктаз и восстановлением уровня макроэргов - АТР и креатинфосфата, и антиоксидантные свойства, обусловленные восстановлением окисленного глутатиона.
Рибофлавин также стимулирует утилизацию янтарной кислоты, активируя систему митохондриального транспорта дикарбоновых кислот цикла Кребса через глицерофосфатный "челночный" механизм, а янтарная кислота повышает трансмембранный потенциал, стимулируя транспорт рибофлавина через мембраны.
Необходимо отметить, что при гипоксии для восстановления дыхательной цепи митохондрий необходима активация всех звеньев, как флавинат-, так и никотинамид-адениндинуклеотид (НАД)-зависимых. Введение одного из фрагментов НАД - никотинамида активирует НАД-зависимые ферменты клеток, в том числе антиоксидантные системы убихиноновых оксиредуктаз, защищающие мембраны клеток от разрушения радикальными частицами.
Никотинамид также является селективным ингибитором образующегося при ишемии фермента поли-АЭР-рибозилсинтетазы, приводящего к дисфункции внутриклеточных белков и последующему апоптозу клеток.
Антиоксидантное действие инозина реализуется целым рядом взаимосвязанных метаболических путей: 1) активацией синтеза НАД в митохондриях из никотинамида, где рибоксин выступает в качестве донора рибозы; 2) стимуляцией анаэробного гликолиза с образованием лактата и НАД+; 3) ингибированием фермента ксантаноксидазы и подавлением радикальных процессов.
Янтарная кислота также обладает антиоксидантным действием, дезактивируя пероксидазы в митохондриях, усиливает активность НАД-зависимых ферментов, а рибофлавин и никотинамид усиливают фармакологическую активность янтарной кислоты.
Таким образом, антигипоксическая и антиоксидантная активность цитофлавина, определяющая фармакологические свойства и лечебную эффективность композиции, сводится к взаимопотенциирующиму действию янтарной кислоты, рибоксина, рибофлавина и никотинамида.
Рис. 2. Пути метаболической стимуляции дыхания и цикла окислительного фосфорилирования в митохондриях клеток янтарной кислотой, рибоксином, рибофлавином и никотинамидом
Оглавление