Гипокальциемии у детей. Клиническое наблюдение
Статьи

ЖУРНАЛ "ПРАКТИКА ПЕДИАТРА"
Опубликовано в журнале:
«ПРАКТИКА ПЕДИАТРА»; сентябрь-октябрь; 2018; стр. 32-42.
Е.В. Тозлиян, к.м.н., педиатр-эндокринолог, генетик, ОСП «НИКИ педиатрии им. академика Ю.Е. Вельтищева» ФГБОУ ВО РНИМУ имени Н.И. Пирогова МЗ РФ, г. Москва
Ключевые слова: дети, гипокальциемия, витамин D
Keywords: children, hypocalcemia, vitamin D
В детском возрасте (особенно на первом году жизни) заболевания (или состояния), связанные с нарушением фосфорно-кальциевого обмена, встречаются довольно часто.
В раннем возрасте это обусловлено чрезвычайно высокими темпами развития ребенка: за первые 12 месяцев жизни масса тела увеличивается в среднем в 3 раза, длина - в 1,5. Такое интенсивное увеличение размеров тела очень часто сопровождается абсолютным или относительным дефицитом кальция и фосфора в организме. К нарушению гомеостаза кальция и фосфора в организме приводят разнообразные факторы: ускорение процессов роста и развития, вызывающее повышенную потребность организма в минералах; недостаточное поступление кальция и фосфатов с пищей; нарушение всасывания кальция и фосфатов в кишечнике, а также избыточное выведение минералов с мочой; уменьшение концентрации кальция и фосфатов в организме вследствие нарушения кислотно-щелочного баланса, дисбаланса витаминов и минеральных веществ по ряду причин; дефицит витамина D вследствие воздействия внешних и внутренних (наследственных) факторов; снижение двигательной активности и опорной нагрузки организма; нарушение гормонального фона вследствие нарушения оптимального соотношения остеотропных гормонов; нарушение всасывания минеральных веществ через стенки кишечника; дефекты метаболизма фосфора и кальция из крови в ткани костного скелета; избыточное выведение минералов через органы выделительной системы.
Физиология фосфорнокальциевого обмена
Ионы кальция регулируют ряд важнейших физиологических и биохимических процессов, в частности, нейромышечное возбуждение, свертывание крови, поддержание целостности мембран и транспорт через мембраны, многие ферментативные реакции, внутриклеточное функционирование гормонов и нейромедиаторов (рис. 1).
Рис. 1. Роль кальция в организме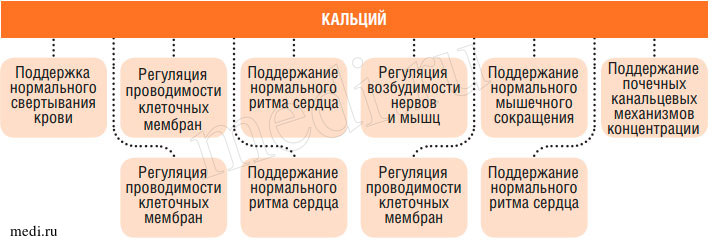
В сыворотке крови кальций в трех формах:
- в комплексе с органическими и неорганическими кислотами (цитратом, фосфатом, сульфатом, карбонатом) - 6%,
- в связанной с белками - альбумином (депо кальция) - 48%,
- ионизированной (несвязанной) форме - 46%.
Роль фосфора в организме не менее важная.
- 80% фосфора - в скелете.
- 20% - в составе клеточных мембран, АТФ, внутриклеточных сигнальных протеинов, РНК, ядерной и митохондриальной ДНК.
Фосфор выполняет важную роль в транспорте кислорода, энергетическом обмене, обеспечении целостности скелета, мышечной сократимости. Концентрации кальция и фосфора во внеклеточной жидкости взаимосвязаны: любые изменения внеклеточной концентрации одного из ионов приводят к обратному изменению концентрации другого.
Также нельзя забывать о роли магния в организме:
- 65% магния - в скелете,
- 34% - во внутриклеточном пространстве,
- 0,3-1% - во внеклеточном пространстве.
В сыворотке крови:
- 80% - ионизированная форма магния,
- 20% - связанная с белками форма магния.
Магний выполняет важную роль в построении ряда энзимов, кофактор биохимических реакций, в активации секреции паратгормона, в костном метаболизме и обмене кальция, мышечной сократимости.
Нормальное протекание всех жизненно важных процессов в организме обеспечивается за счет поддержания концентрации кальция в плазме крови в очень узких пределах, контролируемых паратгормоном (гормон околощитовидных желез), кальцитонином (гормон С-клеток (парафолликулярных) щитовидной железы) - основными регуляторами фосфорно-кальциевого обмена (рис. 2), а также метаболитами витамина D (действие активного метаболита витамина D - 1,25-диоксикальциферола (кальцитриола) -в организме аналогично действию других стероидных гормонов: это гормоноподобный витамин). Мишенями этих гормонов являются костная ткань, почки, тонкая кишка.
Продукция паратгормона околощитовидными железами усиливается при наличии гипокальциемии и особенно при снижении в плазме и внеклеточной жидкости концентрации ионизированного кальция. Действие паратгормона на почки проявляется увеличением реабсорбции кальция и магния. Одновременно снижается реабсорбция фосфора, что приводит к гиперфосфатурии и гипофосфатемии. Считается также, что паратгормон повышает способность образования в почках кальцитриола, усиливая тем самым абсорбцию кальция в кишечнике. В костной ткани под влиянием паратгормона кальций костных апатитов переходит в растворимую форму, благодаря чему происходит его мобилизация и выход в кровь, сопровождающаяся развитием остеомаляции и даже остеопороза. Таким образом, паратгормон является основным кальций сберегающим гормоном. Он осуществляет быструю регуляцию гомеостаза кальция, постоянная регуляция - функция витамина D и его метаболитов. Образование паратгормона стимулируется гипокальциемией, при высоком уровне кальция в крови его продукция уменьшается (рис. 3, 4).
Рис. 2. Регуляция фосфорно-кальциевого обмена (анатомическое расположение щитовидной и околощитовидных желез)
Рис. 3. Регуляция фосфорно-кальциевого обмена (эффекты паратиреоидного гормона)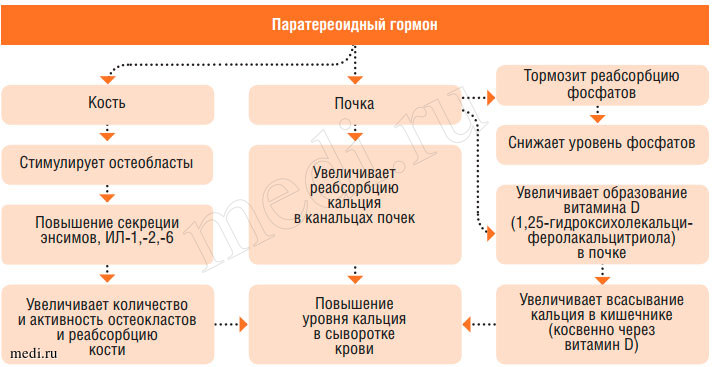
Рис. 4. Регуляция фосфорно-кальциевого обмена (эффекты паратиреоидного гормона)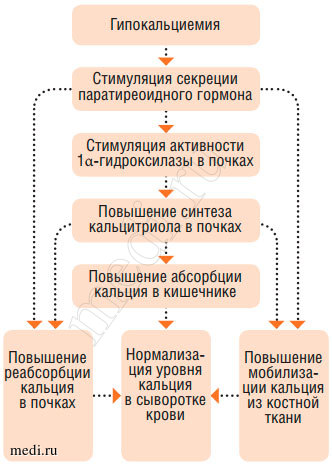
Важным регулятором кальциевого обмена является кальцитонин (КТ) - гормон, вырабатываемый С-клетками парафолликулярного аппарата щитовидной железы. По действию на гомеостаз кальция он является антагонистом паратгормона. Его секреция усиливается при повышении уровня кальция в крови и уменьшается при понижении. Диета с большим количеством кальция в пище также стимулирует секрецию КТ. Этот эффект опосредуется глюкагоном, который таким образом является биохимическим активатором выработки КТ. Кальцитонин защищает организм от гиперкальциемических состояний, снижает количество и активность остеокластов, уменьшая резорбцию костей, усиливает отложение кальция в кости, предотвращая развитие остеомаляции и остеопороза. Предполагается возможность ингибирующего влияния КТ на образование в почках кальцитриола (рис. 5).
Рис. 5. Регуляция фосфорно-кальциевого обмена (эффекты кальцитонина)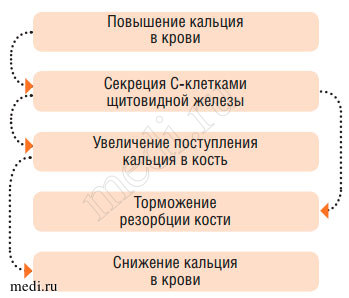
Одним из основных регуляторов фосфорно-кальциевого обмена, наряду с паратгормоном и кальцитонином, является витамин D. Под названием «витамин D» понимают группу веществ (около 10), содержащихся в продуктах растительного и животного происхождения, обладающих влиянием на фосфорно-кальциевый обмен. Наиболее активными из них являются эргокальциферол (витамин D2) и холе-кальциферол (витамин D3). Эргокальциферол в небольших количествах содержится в растительном масле, ростках пшеницы; холекальциферол - в рыбьем жире, молоке, сливочном масле, яйцах. Физиологическая суточная потребность в витамине D величина достаточно стабильная и составляет 400-500 МЕ. В период беременности и грудного вскармливания она возрастает в 1,5 (максимум в 2) раза.
Нормальное обеспечение организма витамином D связано не только с поступлением его с пищей, но и с образованием в коже под влиянием УФ-лучей с длиной волны 280-310 ммк. При этом из эргостерола (предшественник витамина D2) образуется эргокальциферол, а из 7-дегидрохолестерола (предшественник витамина D3) - холекальциферол (рис. 6).
Рис. 6. Метаболизм витамина D3 в организме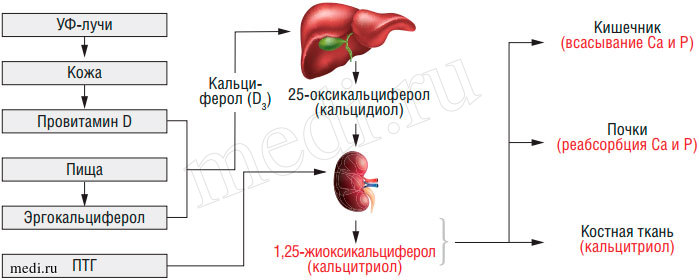
При достаточной инсоляции (по некоторым данным достаточно 10-минутного облучения кистей рук) в коже синтезируется необходимое организму количество витамина D. При недостаточной естественной инсоляции: климатогеографические особенности, условия проживания (сельская местность или промышленный город), бытовые факторы, время года и др., - недостающее количество витамина D должно поступать с пищей или в виде лекарственных препаратов. У беременных женщин витамин D откладывается в виде депо в плаценте, что обеспечивает новорожденного некоторое время после рождения антирахитическими веществами.
Витамины D2 и D3 обладают очень малой биологической активностью. Физиологическое действие на органы-мишени (кишечник, кости, почки) осуществляется их метаболитами, образующимися в печени и почках в результате ферментативного гидроксилирования. В печени под влиянием гидроксилазы образуется 25-гидроксихолекальциферол 25(OH) D3-кальцидиерол. В почках в результате еще одного гидроксилирования синтезируется дигидроксихолекальциферол (1,25-(OH)2D3-кальцитриол), являющийся наиболее активным метаболитом витамина D. Содержание 25(OH)D3 в крови в норме колеблется от 10 до 30 нг/мл (по данным некоторых авторов до 100 нг/мл). Избыток его накапливается в мышечной и жировой тканях. Содержание витамина D в женском грудном молоке составляет 2,0-4,0 мг на 100 мл. Данных по содержанию 25(OH)D3 в молоке в доступной нам литературе не имеется. Кроме этих двух основных метаболитов в организме синтезируются другие соединения витамина D3 - 24,25(OH)2D3, 25,26(OH)2D3, 21,25(OH)2D3 - действие которых изучено недостаточно.
Основная физиологическая функция витамина D (его активных метаболитов) в организме - регуляция и поддержание на необходимом уровне фосфорно-кальциевого гомеостаза организма. Это обеспечивается путем влияния на всасывание кальция в кишечнике, отложение его солей в костях (минерализация костей) и реабсорбцию кальция и фосфора в почечных канальцах.
Механизм всасывания кальция в кишечнике связан с синтезом энтероцитами кальций-связывающего белка (СаСБ), одна молекула которого транспортирует 4 атома кальция. Синтез СаСБ индуцируется кальцитриолом через генетический аппарат клеток, т. е. по механизму действия 1,25(OH)2D3 аналогичен гормонам. В условиях гипокальциемии витамин D временно увеличивает резорбцию костной ткани, усиливает всасывание кальция в кишечнике и реабсорбцию его в почках, повышая тем самым уровень кальция в крови. При нормокальциемии он активирует деятельность остеобластов, снижает резорбцию кости и ее кортикальную порозность. В последние годы показано, что клетки многих органов имеют рецепторы к кальцитриолу (активному метаболиту витамина D), который тем самым участвует в универсальной регуляции ферментных внутриклеточных систем. Активация соответствующих рецепторов через аденилатциклазу и цАМФ мобилизует кальций и его связь с белком-кальмодулином, что способствует передаче сигнала и усиливает функцию клетки, и соответственно, всего органа.
Витамин D стимулирует реакцию пируват-цитрат в цикле Кребса, обладает иммуномодулирующим действием, регулирует уровень секреции тиреотропного гормона гипофиза, прямо или опосредованно (через кальциемию) влияет на выработку инсулина поджелудочной железой (рис. 7).
Рис. 7. Эффекты активного метаболита витамина D (кальцитриола) в организме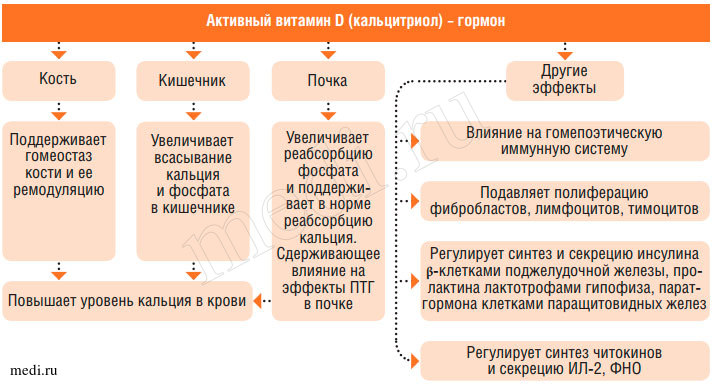
На гомеостаз кальция и фосфора, кроме трех вышеописанных (витамин D, паратгормон, кальцитонин), оказывает влияние множество других факторов:
- другие гормоны: глюкокортикоиды, гормон роста, тиреоидные гормоны, глюка-гон, половые гормоны;
- факторы: ПТГ-подобный пептид, цитокины, тромбоцитарный фактор роста, инсулиноподобные факторы роста и др.
Клинические проявления
У детей нарушение фосфорно-кальциевого обмена чаще всего сопровождается гипокальциемией в различных ее проявлениях. Гипокальциемия - это снижение уровня общего кальция в сыворотке крови < 2 ммоль/л, ионизированного кальция < 1,03 ммоль/л. Клинические проявления гипокальциемии у детей следующие.
1. Симптомы повышенной нервно-мышечной возбудимости:
- парестезии вокруг рта, в пальцах;
- тетания в виде спазма отдельных групп мышц, чаще мимических («рыбий рот») и метакарпальных («рука акушера»);
- судороги (простая или генерализованная тетания).
2. Повышение активности симпатоадреналовой системы: тахикардия, потливость, бледность кожи.
3. Нарушение ритма сердца, удлинение интервала QT.
4. Неврологические симптомы (при длительной гипокальциемии отложение кальция в базальных ганглиях).
5. Проявление со стороны кожи и зубов: сухость кожи, шелушение, ломкие ногти, нарушение образования зубной эмали, плохой рост зубов, дефекты в корнях зубов.
6. Проявление со стороны глаз: катаракта.
7. Проявления со стороны кишечника: синдром мальабсорбции.
Классификация гипокальциемии у детей
I. Гипокальциемия у детей младшего возраста:
1. Неонатальная гипокальциемия:
a) Ранняя неонатальная гипокальциемия:
- физиологическая послеродовая гипокальциемия,
- патологическая гипокальциемия,
- первичная гипомагниемия.
b) Поздняя неонатальная гипокальциемия:
- врожденный гипопаратиреоз,
- преходящий гипопаратиреоз.
2. Избыточное потребление фосфора.
3. Почечная недостаточность.
4. Дефицит или нарушение метаболизма витамина D.
II. Гипокальциемия у детей старшего возраста:
1. Гипопаратиреоз:
- врожденный гипопаратиреоз,
- врожденный гипопаратиреоз в составе наследственных синдромов (синдром Ди Джорджи, синдром Кенни-Кафея, синдром Кеари, синдром Бакарат),
- врожденный изолированный гипопаратиреоз,
- приобретенный гипопаратиреоз (повреждения околощитовидных желез),
- послеоперационный гипопаратиреоз (транзиторный; постоянный),
- аутоиммунный полигландулярный синдром 1-го типа,
- гемосидероз,
- синдром Вильсона-Коновалова.
2. Псевдогипопаратиреоз (тип 1а, 1b, 1с, II).
3. Заболевания и состояния, сопровождающиеся гипокальциемией:
- гиповитаминоз D;
- диарея;
- гипопротеинемия вследствие потери альбумина с мочой, со стулом или в результате нарушения синтеза в печени;
- при остром панкреатите;
- при острой клеточной деструкции при терапии опухолей;
- почечной недостаточности;
- ятрогенная - медикаментозная (глюкокортикостероиды, мочегонные, противосудорожные препараты и т. д.).
Основные методы лечения
Лечение нарушений фосфорно-кальциевого обмена сводится к коррекции процессов обмена, восполнению недостатка витамина D, купированию клинических проявлений и восстановлению нарушенных функций внутренних органов организма. К числу обязательных лечебных мероприятий относят употребление препаратов, содержащих витамин D, а также регулярный прием солнечных и воздушных ванн (ежедневные прогулки в течение двух-трех часов). В качестве дополнительных методов лечения нарушений фосфорно-кальциевого обмена используют следующие: специальные диеты; витаминотерапию, заключающуюся в приеме препаратов, содержащих витамины группы В, витамина А, С, Е; водные процедуры и массаж. При отсутствии должного эффекта от предпринятого лечения пациент подлежит госпитализации для более глубокого обследования.
Профилактические мероприятия при беременности
Профилактика нарушений фосфорнокальциевого обмена проводится еще на стадии вынашивания плода и заключается в следующем: подбор правильного рациона питания, исключающего дефицит наиболее важных витаминов и минеральных веществ; полный отказ от вредных привычек, вызывающих интоксикацию организма (алкоголь, курение, наркотические средства); предотвращение возможного контакта с токсическими веществами (химикаты, пестициды, опасные лекарственные средства); достаточная физическая активность, включающая ежедневные прогулки на воздухе в течение нескольких часов; соблюдение оптимального режима дня с достаточным периодом на отдых; профилактический прием витамина D при наличии показаний.
Профилактические мероприятия для детей
Профилактика нарушения фосфорнокальциевого обмена на первом году жизни ребенка заключается в соблюдении следующих мероприятий: грудное вскармливание; своевременное и правильное введение прикорма; достаточные прогулки на свежем воздухе, обязательные водные процедуры, гимнастика и массаж; по возможности свободное пеленание ребенка с первых дней жизни. Кроме того, в качестве мер профилактики и лечения нарушений фосфорно-кальциевого обмена рекомендуется дополнительный прием витамина D.
Клиническое наблюдение
Девочка Д., 8,5 лет (фото 1-3) поступила в НИКИ Педиатрии с диагнозом: «Дегенеративное заболевание нервной системы? Симптоматическая эпилепсия. Вторичное удлинение интервала QT. Метаболическая энцефалопатия».
Фото 1. Особенности фенотипа
Фото 2. Особенности фенотипа (комплекс микроаномалий развития)
Фото 3. Особенности фенотипа (брахифалангия, сандалевидная щель)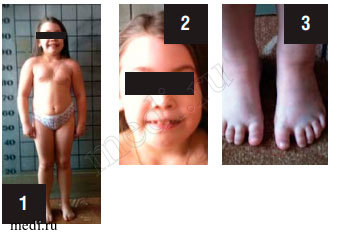
Жалобы при поступлении на периодическое нарушение походки, мышечную слабость, частые падения при ходьбе, периодические дистонические атаки.
Анамнез семейный: родители русские, не состоящие в кровном родстве и не имеющие профессиональных вредностей. Нечеткие указания на имевшиеся у матери периодические изменения походки в возрасте 5 лет.
Анамнез жизни: перинатальный анамнез не отягощен. Родилась от 2-й беременности, протекавшей без особенностей. При рождении вес 3210 г, длина 54 см, оценка по Апгар 9/10 баллов. Достоверных данных о раннем периоде развития нет. Ребенок воспитывается бабушкой с возраста 1 года 10 месяцев. Со слов бабушки, на момент передачи ей ребенка отмечались изменения походки, периодические эпизоды резкого повышения мышечного тонуса, моторная неловкость. Раннее психомоторное и речевое развитие по возрасту.
Анамнез заболевания: дебют приступов с 1,5 лет, приступы тонико-клонические с поворотом головы, длительностью до 2 мин, частотой до 4 в месяц. Получала Депакин - хроно (43 мг/кг/сут) - отмечалось снижение частоты приступов до 2 раз в месяц. При присоединении к терапии Финлепсина-ретард - ремиссия в течение 2 месяцев. При присоединении к терапии Конвулекса - ремиссия в течение 4 лет. В возрасте 6 лет выявлено удлинение интервала QT. Выставлен диагноз: «Миотония Беккера? Симптоматическая парциальная эпилепсия». С диагностической целью девочке была проведена инцизионная биопсия мышечной ткани, выставлен диагноз: «Митохондриальная энцефаломиопатия. Синдром альтернирующей гемиплегии». При проведении МРТ головного мозга выявлен единичный очаг повышения МР-сигнала в левой теменной доле, при проведении в последующем МРТ головного мозга в динамике - отмечалась отрицательная динамика в виде появления очагов изменения МР-сигнала в базальных ядрах.
При анализе амбулаторной карты ребенка и документации по месту жительства исследование кальция и фосфора проводилось однократно, в возрасте 2 лет, отмечалась гипокальциемия, но по данному поводу дообследование не проводилось!
Учитывая неопределенность диагноза по месту жительства, ребенок направлен в Москву, в НИКИ Педиатрии с целью уточнения диагноза.
В возрасте 8 лет в НИКИ Педиатрии впервые ребенок консультирован эндокринологом по поводу задержки роста, судорожных пароксизмов. Было обращено внимание на биохимический анализ крови, где отмечалась выраженная гипокальциемия, гиперфосфатемия. Назначено дообследование.
Данные объективного исследования:
- Соматический статус.
Физическое развитие низкое, гармоничное. Sds роста соответствует -2,2 отклонениям от нормы (норма -2+2). Особенности фенотипа: комплекс МАР (круглое лицо, короткая шея, антимонголоидный разрез глазных щелей, широкое переносье, высокий лоб, брахидактилия), ониходистрофия ногтей на руках, гиперплазия десен (фото 2,3). По внутренним органам - без особенностей. Половое развитие - Tanner I (по возрасту).
- Неврологический статус.
Психоневрологическое состояние: состояние
ребенка по основному заболеванию тяжелое. Сознание ясное. Обращенную речь понимает. Инструкции выполняет. Общемозговые и менингеальные симптомы отсутствуют. Форма черепа обычная. Звук при перкуссии черепа обычный.
- ЧМН.
Запахи чувствует. Видит: артифакия, помутнение прозрачных сред глаза. Точки ветвей V нерва при пальпации безболезненны. Корнеальный рефлекс живой. Конъюнктивный рефлекс живой. Жевание не нарушено. Глазные щели D = S; носогубные складки асимметричны. Оскал симметричный. Вкусоощущение с передних 2/3 языка не нарушено. Слух не нарушен. Нистагм отсутствует. Глотание не нарушено. Небный рефлекс живой, небная занавеска не провисает. Uvula по средней линии. Голова по средней линии, повороты головы, поднятие плеч в полном объеме. Язык по средней линии, фибрилляции на языке отсутствуют.
- Двигательно-рефлекторная сфера.
У девочки имеются тяжелые двигательные нарушения: отмечается изменение походки по типу атактической, напряженность мышц (очень плотные на ощупь), деформация стоп (подтягивает большой палец), периодически «скованность» движений рук и ног (то справа, то слева, по типу гемиплегии с дистонической установкой руки и ноги), в эти моменты девочка не может ходить по несколько часов, миотонические реакции, применяет миопатические приемы. Пассивные и активные движения несколько ограничены за счет формирования контрактур в голеностопных суставах. Мышечная сила сохранна. Тонус мышц дистоничен, повышен. Сухожильные рефлексы не вызываются. Брюшные рефлексы - вызываются. В позе Ромберга - не стоит. Координаторные пробы не выполняет. Гиперкинезы отсутствуют. Патологические рефлексы (Бабинского, Россолимо) отрицательные. Функции тазовых органов не нарушены. Трофические расстройства не выявлены. Психоречевое развитие -отставание психоречевого развития.
Данные лабораторных и функциональных исследований:
- клинический анализ крови и мочи - норма.
- гликемический профиль - норма.
- биохимический анализ крови - общий кальций 1,2 (норма 2,02-2,6 ммоль/л), кальций ионизированный - 0,48 (норма 1,13-1,32 ммоль/л), фосфор неорганический - 3,98 (норма 0,86-1,56 ммоль/л), остальные показатели в пределах нормы.
- Тиреоидный профиль, кортизол крови -норма.
- Паратиреоидный гормон - 0 (норма 1265 пг/мл), СТГ - 7 нг/мл (норма 7-10), соматомедин-С - 250 нг/мл (норма 88-360).
- УЗИ внутренних органов - реактивные изменения сосудов, протоков печени. Невыраженные диффузные изменения паренхимы печени. Увеличение желчного пузыря. Содержимое в желудке натощак. Диффузные изменения поджелудочной железы. Недостаточно четкая дифференцировка паренхимы почек.
- ЭКГ - миграция суправентрикулярного водителя ритмана фоне незначительной тахиаритмии, ЧСС = 98-109 уд./мин. Вертикальное положение ЭОС. Синдром ранней реполяризации желудочков. ЭКГ-признаки гипокальциемии. Вторичное удлинение интервала QT. QTc = 458-448 мс, (N < 440 мс).
- МРТ мышц: МРТ мышц бедра: МР-сигнал на Т1 импульсной последовательности и STIR не изменен. МРТ мышц голени: МР-сигнал на Т1 импульсной последовательности и STIR не изменен.
- МРТ головного мозга: Полушария большого мозга симметричны. В подкорковых ядрах (хвостатые, лентикулярные, полушарий мозжечка) выявляются зоны диффузного умеренно повышенного МР сигнала на Т2ВИ, Т1ВИ (возможно, вследствие отложения кальция). Изменений МР-сигнала в стволе головного мозга не выявлено. Боковые желудочки не расширены, симметричны. Третий, четвертый желудочки нормальных размеров и формы. Борозды больших полушарий и мозжечка не расширены. Срединные структуры не смещены. Гипофиз не изменен. Краниовертебральный переход без особенностей. ЗАКЛЮЧЕНИЕ: МР-картина поражения подкорковых ядер и ядер мозжечка. Для выявляения кальцификатов в выявленных зонах рекомендовано РКТ.
- РКТ: Проведено КТ головного мозга. Определяются множественные кальцинаты в ядрах мозжечка в стволе в подкорковых ядрах субкортикальных отделах больших полушарий. Желудочки мозга симметричны, не расширены. Субарахноидальное пространство не расширено. ЗАКЛЮЧЕНИЕ: Множественные кальцинаты.
- Рентген кистей рук: Форма и структура костей не изменена. Взаимоотношения в суставах не нарушены. Суставные поверхности конгруентны. Костный возраст: 6-6,5 лет. К.О. 0,81 (норма 1 ± 0,2) Д.О. -1,5 (норма 0±1). Индекс Барнета-Нордена 25% (в норме не менее 43%). ЗАКЛЮЧЕНИЕ: Отставание костного возраста. Остеопороз.
- ЭНМГ, ЭМГ: Полученные данные могут указывать на аксональный и мышечный характер поражения, по-видимому, вторичного генеза. Обращает на себя внимание регистрация спонтанной активности в виде миотонических разрядов увеличенной амплитуды, что не исключает наличие миотонического расстройства у пациента. Консультации специалистов:
- Консультация окулиста: артифакия (после удаления вторичной катаракты).
- Консультация эндокринолога: гипопаратиреоз (АПС I типа? Синдром Ди Джорджи?).
- Консультация психиатра: смешанные расстройства поведения и эмоций.
- Консультация дерматолога: ониходистрофия. Рекомендовано: Микроскопическое исследование + посев с ногтя 1-го пальца левой кисти (КВД по м/ж), мазок со слизистой языка на флору.
Учитывая фенотип ребенка, данные анамнеза, результаты дополнительных исследований (гипокальциемия, гиперфосфатемия, крайне низкий уровень паратиреоидного гормона крови), кальцинаты в веществе головного мозга, наличие катаракты, поставлен диагноз: «Гипокальциемия. Гипопаратиреоз. Артифакия (состояние после удаления вторичной катаракты). Ониходистрофия. Судорожный синдром. Вторичное удлинение интервала QT. АПС I типа (Аутоиммунный полигландулярный синдром 1-го типа)? Синдром Ди Джорджи?» Рекомендовано проведение ДНК-диагностики (поиск мутаций в гене AIRE), цитогентическое исследование (с целью исключения синдрома Ди Джорджи).
- Цитогенетическое исследование - патологических изменений не выявлено.
ДНК-диагностика - молекулярно-генетическое исследование гена AIRE - выявлены две мутации T16[T,M] и R257[R,*]. Заключение: диагноз «Аутоиммунный полигландулярный синдром 1-го типа» подтвержден на основании обнаружения высокого титра антител к интерферонам-омега и выявлении 2 мутаций в гене AIRE.
Лечение: ребенку рекомендована пожизненная терапия: активный метаболит витамина D - альфакальцидол - в дозе 2 мкг/сут; кальций 2000 мг/сут; постепенная отмена противосудорожной терапии под контролем ЭЭГ и наблюдение невролога-эпилептолога; занятия с логопедом-дефектологом и психологом; контроль показателей фосфорно-кальциевого обмена.
Таким образом, представленное клиническое наблюдение демонстрирует сложности дифференциально-диагностического поиска, важность своевременного исследования простых биохимических параметров (при эпилепсии обязателен неоднократный скрининг показателей фосфорно-кальциевого обмена), исходы поздней диагностики генетически детерминированного заболевания, необходимость интегрировать отдельные признаки в общий фенотип того или иного патологического состояния для целенаправленной своевременной диагностики отдельных форм наследственных заболеваний. Своевременная диагностика, уточнение генеза каждого синдрома особенно важны, так как позволяют найти оптимальный подход к лечению этих состояний, профилактике возможных осложнений (вплоть до инвалидности ребенка); предупреждению повторного возникновения наследственных болезней в пораженных семьях (медико-генетическое консультирование). Это диктует необходимость врачам различных специальностей четко ориентироваться в потоке наследственно обусловленной патологии.
Список литературы
1. Баранов А.А., Щеплягина Л.А., Баканов М.И. Маркеры костного метаболизма в критические периоды роста и развития детей и подростков // Тез. докл. XVIII съезда физиологического общества им. И.П. Павлова. Казань, 2001. С. 657.
2. Баранов А.А., Щеплягина Л.А., Баканов М.И. Возрастные особенности изменений биохимических маркеров костного ремоделирования у детей// Российский педиатрический журнал. 2002. № 3. С. 7-12.
3. Голованова Н.Ю., Лыскина Г. А. НАЗВАНИЕ?// Вестник педиатрической фармакологии и нутрициологии. 2004. Т. 1. № 1. С. 60-63.
4. Грушицкая Г.П., Чумакова О.В., Яцык Г.В. Кальций-креатининовый коэффициент - один из маркеров кальциевого метаболизма у новорожденных детей // Мат. II конф. с межд. участием «Проблемы остеопороза в травматологии и ортопедии». М., 2003. С. 160-161.
5. Дедов И.И., Григорян О.Л., Чернова Т.О. Костная денситометрия в диагностике и мониторинге остеопатии // Остеопороз и остеопатии. 2000. № 3. С. 16-19.
6. Дедов И.П., Рожинская Л.Я., Марова Е.И. Остеопороз. Патогенез, диагностика, принципы профилактики и лечения: Руководство для врачей. М., 2002. 60 с.
7. Дедов И.И., Петеркова В.А. Детская эндокринология: Руководство для врачей. М., 2006. 595 с.
8. Зоткин Е.Г., Мазуров В.И. Роль кальция и витамина Д в глобальной профилактике и лечении остеопороза и остеопоретических переломов // Русский медицинский журнал. 2004. № 12. С. 31-36.
9. Клинические рекомендации. Остеопороз. Диагностика, профилактика и лечение / Л.И. Беневоленской и др. М.: ГЭОТАР-Медиа, 2005. С. 176.
10. Коровина Н.А., Захарова И.Н., Чебуркин А.В. Нарушения фосфорно-кальциевого обмена у детей. Проблемы и решения // Руководство для врачей. М., 2005. 67 с.
11. Котова С.М., Карлова Н.А., Максимцева И.М. Формирование скелета у детей и подростков в норме и патологии. СПб.: Питер, 2002. 44 с.
12. Крутикова Н.Ю., Щеплягина Л.А., Козлова Л.В. Особенности костного метаболизма новорожденных детей // Российский педиатрический журнал. 2006. № 3. С. 16-21.
13. Кузнецова Г.В., Чумакова О.В., Щеплягина Л.А. Факторы риска снижения минеральной плотности костной ткани у детей // Вопросы современной педиатрии. 2004. № 3. С. 97-100.
14. Лепарский Е.А. Ранняя диагностика реальный путь профилактики остеопороза // Медицина. Качество жизни. 2006. Т. 16. № 5. С. 58-62.
15. Моисеева Т.Ю. Минерализация костной ткани растущего организма: Автореф. дис. Д-ра мед. наук. М., 2004. 24 с.
16. Новиков П.В. Рахит и наследственные рахитоподобные заболевания у детей: диагностика, лечение, профилактика. М: Триада-х, 2006. 336с.
17. Коровина Н.А. и др. Остеопороз у детей. М.: МЗиСР РФ, 2005. 40 с.
18. Рожинская Л.Я., Родионова С.С. Роль активных метаболитов витамина в патогенезе и лечении метаболических остеопатии: Методическое пособие для врачей / Под ред. Е.И. Марова. М., 1997. 38с.
19. Рожинская Л.Я. Основные принципы и перспективы профилактики и лечения остеопороза // Остеопороз и остеопатии. 1998. № 1. С. 43-45.
20. Шилин Д.Е. Молоко и как источник кальция в питании современных детей и подростков // Педиатрия. Журнал им. Сперанского Г.Н. 2006. № 2. С. 21-27.
21. Щеплягина Л.А., Чирина Е.В., Римарчук Г.В. Эффективность комбинированного препарата кальция и витамина ДЗ у детей со снижением костной плотности // Вопросы практической педиатрии. 2009. Т. 4. № 4. С. 20-24.
22. Boonen S. et al. Treatment with alendronate plus calcium, alendronat alone, or calcium alore for postmenopausal low bone mineral density // Curr Med Res Opin. 2007. Jun. № 23 (6). P. 1341-1349.
23. Brown J.P., Josse R.G. Clinical practice guidelines for the diagnosis and management of osteoporosis in Canada // CMAJ. 2002. 167 (10 suppl.). P. l-34.
24. Carrie Fassler A.L., Bongiorur LP. Osteoporosis as pediatric problem // Pediatr.Clin. North Am. 1995. Vol. 43. №.4. P. 811-824.
25. Cassidy J.T. Osteopenia and osteoporosis in children // Clin.Exp.Rheumatol. 1999. Vol. 17. № 2. P. 245250.103. (1993) Consensus development conference; diagnosis, prophylaxis,and treatment of osteoporosis // At. J. Med. 1994. P. 646-650.
26. Dequeker J. et al. Transplantation osteoporosis and corticosteroid-induced osteoporosis in autoimmune diseases: experience with alfa-calcidol // Z. Rheumatol. 2000. Vol. 59. № 7. P. 1126-1145.
27. Fricke O., Tutlewski B., Schwahn B., Schoenau E. Speed of sound: relation to geometric characteristics of bone in children, adolescents, and adults // J Pediatr. 2005. P. 146.
28. Hartman C., Brik et al.Bone quantitave ultrasound and nutritional status in severeli handcapped institutionalized children and adolescents // Clin. Nutr. 2004. Vol. 23. P. 89-98.
29. Janz K.F., Burns T.L., Torner J.C. Physical Activity and Bone Measures in Young Children: The Iowa Bone Development Study // Pediatrics. 2001. June. Vol. 107 (6). P. 1387-1393.
30. Lorenc R.S. Pediatric aspect of osteoporosis // Pediatr. Pol. 1996. Vol. 71. № 2. P. 83-92.
31. Steelman J., Zeitler P. Treatment of symptomatic pediatric osteoporosis with cyclic single - day intravenous pamidronate influsions // J. Pediatr. 2003. Vol. 142. № 4. P. 417-423.
32. Woo J.-T., Kawatani M., Kato M. Reveromycin A, an agent for osteoporosis, inhibits bone resorption by inducing apoptosis specifically in osteoclasts // Proc. Natl. Acad. Sci. USA. 2006. Vol. 103. № 12. P. 4729-4734.
Комментарии
ПРАКТИКА ПЕДИАТРА
