Синдром обструктивного апноэ сна и ожирение у детей: точки соприкосновения
СтатьиОпубликовано в журнале:
Практика педиатра, сентябрь-октябрь, 2017
А.Д. Прохорова1, Б.М. Блохин1,2, д.м.н., профессор, М.Г. Полуэктов3, к.м.н., доцент, В.М. Делягин4, д.м.н., профессор
1 Кафедра поликлинической и неотложной педиатрии ФГБОУ ВПО «РНИМУ им. Н.И. Пирогова» Минздрава России.
2 ФГБУ «Детский медицинский центр» Управления делами Президента РФ.
3 ФГБОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России.
4 ФГБУ «ФНКЦ ДГОИ им. Дмитрия Рогачева» Минздрава России.
Ключевые слова: сон, ожирение у детей, синдром обструктивного апноэ сна у детей
Keywords: sleep, obesity in children, obstructive sleep apnea syndrome in children
Одной из глобальных проблем современности является неуклонный рост распространенности ожирения. Особую обеспокоенность вызывает рост ожирения в детском возрасте. Так, по данным Всемирной организации здравоохранения, 41 млн детей в возрасте до 5 лет страдают избыточным весом или ожирением. Большая часть населения планеты проживает в странах, где от последствий избыточного веса и ожирения умирает больше людей, чем от последствий аномально низкой массы тела [1]. Хорошо известно, что избыточный вес и ожирение у детей и подростков, а также сопутствующие им заболевания, представляют серьезную угрозу состоянию здоровья ребенка. В литературе широко описаны заболевания, сопутствующие ожирению: сердечно-сосудистые, эндокринологические, неврологические, легочные, ортопедические, патология желудочно-кишечного тракта и психосоциальная патологии [2].
Одной из недостаточно изученных у детей патологией, связанной с ожирением, является синдром обструктивного апноэ сна (СОАС), который входит в раздел нарушений дыхания во сне [3]. Известно, что у взрослого населения ожирение – наиболее значимый фактор, предрасполагающий к развитию обструкции дыхательных путей [4]. В детской популяции 60% детей с ожирением имеют осложнение в виде СОАС [5].
Необходимо отметить, что имеются данные о взаимосвязи между продолжительностью и качеством сна и риском развития ожирения [6] (рис. 1).

Рис. 1. Взаимосвязь СОАС и ожирения
Таким образом, нарушения сна, в частности СОАС, и ожирение являются взаимодополняющими проблемами и требуют комплексного подхода к их решению (таблица).
Точки соприкосновения СОАС и ожирения
| Показатель | Ожирение | СОАС |
| 1. Сердечно-сосудистая патология | ||
| гиперлипидемия | + | |
| повышенный уровень кровяного давления | + | + |
| сосудистая дистония | + | + |
| ранний коронарный и аортальный атеросклероз | + | |
| расширение и дисфункция левого желудочка и предсердия | + | + |
| 2. Эндокринная патология | ||
| метаболический синдром | + | + |
| гиперинсулинемия | + | + |
| инсулинорезистентность | + | + |
| предиабет | + | + |
| сахарный диабет 2-го типа | + | + |
| 3. Психосоциальная патология | ||
| психологическое расстройство по поводу собственного внешнего вида | + | |
| низкая самооценка | + | + |
| нарушенная социализация | + | + |
| виктимизация | + | |
| депрессивные симптомы | + | + |
| беспорядочное питание | + | + |
| тревожность | + | + |
Основные угрожающие последствия СОАС у детей связаны с нейробиологическими, сердечно-сосудистыми, эндокринными и метаболическими нарушениями. Синдром обструктивного апноэ во сне проявляется у детей длительной регулярной или приходящей полной обструкцией верхних дыхательных путей, что приводит к периодической гипоксемии, гиперкапнии с последующим пробуждением и фрагментации сна [7, 8]. Это клиническое нарушение, характеризующееся частыми остановками дыхания во время сна, обычно они сопровождаются громким храпом. СОАС в детском возрасте может появиться в любое время, но пик встречаемости приходится на период от 2 до 6 лет, что совпадает с максимальным разрастанием небных миндалин, которые перекрывают дыхательные пути на уровне глотки [9]. Помимо гипертрофии небных миндалин, СОАС могут вызывать структурные аномалии верхних дыхательных путей, возникшие в результате снижения тонуса мышечной стенки ВДП или дискоординации работы дыхательной мускулатуры и потока воздуха, а также наличие ожирения.
Выделяют дневные и ночные клинические симптомы СОАС. Основным ночным симптомом СОАС является храп. Помимо этого, у ребенка отмечается дыхание ртом, усиление дыхания при физической нагрузке или затруднение дыхания во сне, появление эпизодов обструкции, усиленное потоотделение во сне, беспокойство и частые ночные пробуждения, непривычная поза во сне и жалобы родителей на дыхание ребенка ночью [10, 11]. К дневным симптомам СОАС относятся: увеличение потребности в дневном сне, гиперактивное поведение, трудности в обучении и когнитивные нарушения [12, 13].
Диагностическим критерием СОАС у детей считается индекс апноэ-гипопноэ (ИАГ) > 5 в час сна (по данным полисонмографии) и присутствие симптомов чрезмерной дневной сонливости [14]. СОАС, по разным данным, охватывает 2–3% детей [15]. Однако у детей, страдающих ожирением, его распространенность достигает 59% [16]. У детей с СОАС и ожирением значительно увеличивается риск кардиоваскулярной патологии. По данным клинических исследований, СОАС связан с такими факторами риска развития сердечнососудистых заболеваний, как эндотелиальная дисфункция, артериальная гипертензия, аритмии и сердечная недостаточность [17–20].
Ключом к пониманию гемодинамических реакций на синдром обструктивного апноэ сна является концепция так называемого «дайвинг-рефлекса». Он состоит в следующем: апноэ вызывает гипоксемию, которая стимулирует парасимпатическую активность и приводит к брадикардии; повышенная периферическая симпатическая активность сужает периферические сосуды и повышает артериальную резистентность. Типичный эпизод обструкции во сне может приводить к брадикардии (или даже к кратковременной остановке синусового узла) и постепенно увеличивать периферическую симпатическую нейронную активность. Когда обструкция купируется, симпатическая нейронная активность достигает своего максимума, что резко увеличивает кровяное давление и сердечный ритм, это увеличение совпадает с компенсаторным гиперпноэ [21–23] (рис. 2, 3).
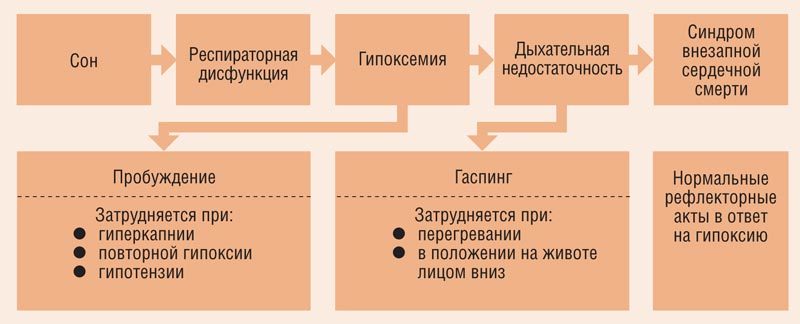
Рис. 2. Нарушение дыхательных функций (Adrian Walker, 1996)
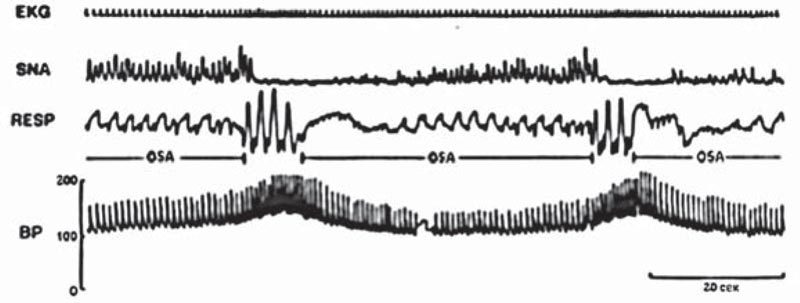
Рис. 3. Записи во время сна у пациентов с СОАС
Эпизоды обструкции верхних дыхательных путей во время сна у пациентов с СОАС вызывают увеличение внутригрудного давления, выброс адреналина и вторичную дисфункцию эндотелия. Также одну из ключевых ролей играет возникновение оксидантного стресса на фоне эпизодов гипоксии. Ожирение и СОАС являются заболеваниями, сопровождающимися системным воспалением [24–26]. В крови у детей с СОАС обнаружено повышение провоспалительных цитокинов, таких как интерлейкин-6, а также С-реактивный белок [27]. Однако многие из этих факторов также тесно связаны с ожирением, поэтому исследования направлены на выявление того, являются ли такие ассоциации независимыми от ожирения. В поддержку независимого влияния СОАС представлены данные когортного исследования здоровых подростков, которые демонстрируют прогрессирующее повышение уровней СРБ, что указывает на то, что даже умеренные проявления СОАС при отсутствии сопутствующей патологии могут приводить к повышению воспалительных маркеров [28].
Другим механизмом развития сердечнососудистых осложнений является повышение тонуса симпатической нервной системы. Исследования показали наличие существенных изменений симпатического тонуса у детей с СОАС [29]. Острая симпатическая активация, связанная с апноэ во время сна, и устойчивое повышение симпатической активности при пробуждении играет критически важную роль в генерации сердечных аритмий у пациентов с синдромом удлиненного интервала QT [30]. В исследованиях была подтверждена связь между СОАС и развитием аритмии [31]. Наиболее распространенными аритмиями во время сна являются неосложненная желудочковая тахикардия, пауза/остановка синусового узла, атриовентрикулярная блокада второй степени и преждевременное сокращение желудочков (ПВХ > 2 уд./ мин) [32, 33].
Продолжают изучаться патофизиологические связи между фибрилляцией предсердий и апноэ во сне. Вероятно, фибрилляция предсердий при СОАС связана с наличием ожирения, расширением предсердий, гипертонией и вегетативным дисбалансом. В ряде работ сообщалось об увеличении размера предсердий среди пациентов с СОАС [34, 35]. СОАС приводит к изменениям активности сердечных ганглиозных сплетений, что, по-видимому, влияет на период рефрактерности предсердий [36].
Еще одним угрожающим последствием СОАС у детей с ожирением является повышенный риск развития внезапной сердечной смерти. Так, в некоторых работах было продемонстрировано, что у детей с частыми проявлениями СОАС значительно повышался риск внезапной сердечной смерти по сравнению с контрольной группой [37]. В когорте детей с ожирением итак повышен риск развития вышеперечисленных заболеваний, СОАС же вносит дополнительный вклад в развитие данных патологий, замыкая «порочный круг». Именно поэтому оценка наличия эпизодов обструкции во сне является обязательным звеном в ведении пациентов с морбидным ожирением.
Имеются данные, свидетельствующие о том, что ночные пробуждения связаны с изменениями активности гипоталамо-гипофизарно-надпочечниковой системы и увеличением пульсирующего выброса кортизола [38]. Повышенный уровень кортизола связан с многочисленными неблагоприятными последствиями, такими как метаболический синдром, диабет, гипертония, депрессия и бессонница [39]. В некоторых популяционных исследованиях отмечено, что распространенность метаболического синдрома среди детей составляет 3,3% у детей без ожирения, 11,9% у детей с избыточной массой тела, а у детей с ожирением 29,2% [40].
Известно также, что повышенные уровни кортизола вызывают снижение секреции гормона роста [41]. В литературе описано, что у детей с обструкцией верхних дыхательных путей обнаруживаются дефекты роста из-за снижения секреции гормона роста. Секреция данного гормона восстанавливается после аденотозиллэлектомии [42].
Данные различных исследований свидетельствуют о том, что как СОАС, так и ожирение приводят к значительному снижению качества жизни детей, особенно когда имеет место наличие обеих патологий [43, 44]. Качество жизни улучшается после лечения СОАС [43].
Известно, что у детей, страдающих ожирением, в 1,8 раза чаще, чем у детей с нормальным весом, отмечается низкая само-оценка [45]. Многие исследования показали наличие четкой ассоциации между СОАС и синдромом дефицита внимания с гиперактивностью, и другими поведенческими нарушениями [46– 49]. Механизм возникновения этих симптомов заключается в нарушении сна и возникновении эпизодов гипоксии. Это приводит к нарушению таких функции префронтальных областей коры головного мозга, как рабочая память, поведенческий контроль, анализ, организация, саморегуляция [50, 51].
Практикующие врачи, к сожалению, не всегда уделяют должное внимание обследованию детей на предмет выявления у них СОАС. Однако важно помнить, что диагностика СОАС у детей основана на клиническом обследовании и полисомнографии [52]. Клиническое обследование необходимо для более точной интерпретации полисомнографических данных, выявления сопутствующей и основной патологии и исключения причин нарушения дыхания, не связанных с обструктивным апноэ сна. При клиническом обследовании пациентов с СОАС возможно обнаружение следующих симптомов: ретрогнатия, арочное нёбо, гипертрофия небных миндалин.
Американская академия педиатрии рекомендует полисомнографию в качестве диагностического теста для детей с подозрением на СОАС [53]. Полисомнография представляет собой синхронную запись различных физиологических параметров во время сна. Протокол исследования с целью диагностики нарушений сна включает проведение электроэнцефалограммы, электроокулограммы, электромиограммы, электрокардиограммы, оценку респираторной активности, показателей насыщения крови кислородом, артериального давления, частоты сердечных сокращений, двигательной активности грудной клетки и передней брюшной стенки, ортоназального потока воздуха, шума дыхания, положения тела в постели и движения конечностей во сне [54].
Методы лечения СОАС у детей включают: аденостонзилотомию, применение назальной маски для создания положительного давления в дыхательных путях во время сна (CPAP-терапия), ротовых аппликаторов, назначение противовоспалительных препаратов. Аденостонзиллотомия назначается в 83% случаев и является первоочередным методом лечения у детей, страдающих СОАС. В послеоперационном периоде необходимо клиническое наблюдение, так как в 15–20% выявляются остаточные явления [55]. Риск развития послеоперационных осложнений выше у детей младше 3 лет, детей страдающих СОАС, ожирением и другой сопутствующей патологией [56]. Соответственно, необходимо проводить повторные исследования сна в ночное время после аденотонзиллотомии.
CPAP-терапия применима у детей с хроническим СОАС после проведенной аденотонзилотомии или с противопоказаниями к хирургическому лечению [57]. CPAP-терапия – полностью безопасный метод лечения, но требует времени для привыкания и обучения родителей.
Представленные результаты исследований в области ожирения и синдрома обструктивного апноэ сна демонстрируют взаимодополняющее влияние этих двух состояний. Это обуславливает необходимость мультидисциплинарного подхода к проблеме ожирения и нарушениям сна у детей. Практикующим врачам необходимо сформировать комплексный подход к обследованию и терапии пациентов с ожирением, включающий обязательное проведение полисонмографического исследования как золотого стандарта диагностики СОАС. Это позволит эффективно выявлять пациентов с тяжелыми формами нарушения дыхания во сне, своевременно назначать им адекватную CPAP-терапию, предотвратить внезапную сердечную смерть. Кроме такого, успешное лечение ожирения и сопутствующих ему состояний невозможно без своевременной и полноценной коррекции обструктивных состояний во сне.
Список литературы:
4. Вейн А.М., Елигулашвили Т.С., Полуэктов М.Г. Синдром апноэ во сне. М.: Эйдос-Медиа, 2002.
5. Indra Narang and Joseph L. Mathew. Childhood Obesity and Obstructive Sleep Apnea // Journal of Nutrition and Metabolism. Vol. 2012. Article ID 134202. 8 p.6. Guillaume M, Lapidus L, Bjorntorp P, Lambert A. Physical activity, obesity, and cardiovascular risk factors in children: The Belgian Luxembourg Child Study II. Obes Res 1997; 5: 549–556.7. Schechter M.S. Section on Pediatric Pulmonology. Technical report: Diagnosis and management of OSAS // Pediatrics. 2002. Vol. 109. P. 69.8. Rosen CL. Clinical features of obstructive sleep apnea hypoventilation syndrome in otherwise healthy children // Pediatr. Pulmonol. 1999. Vol. 27. Р. 403–9.9. Jeans W.D., Fernando D.C., Maw A.R., Leighton B.C. A longitudinal study of the growth of the nasopharynx and its contents in normal children // Br. J. Radiol. 1981. Vol. 54. P. 117–21.10. J.L Carol , McColley S.A, Marcus C.L., Curtis S., Loughlin G.M. Inability of clinical history to distinguish primary snoring from obstructive sleep apnea syndrome in children // Chest. 1995. Vol. 108. Р. 610-8.11. Guilleminault C., Korobkin R., Winkle R. A review of 50 children with obstructive sleep apnea syndrome // Lung. 1981. Vol. 159. P. 275–87.12. Mindel J.A., J.A.Owens. A Clinical guide to Pediatric Sleep: Diagnosis and Management of Sleep Problems; 2nd ed. Philadelphia, USA: LIPPICOTT WILLIAMS &WILKINS, 2010.
13. Mindell J.A., L.S. Telofski, B. Wiegand, E.S. Kurtz. A Nightly Bedtime Routine: Impact on Sleep in Young Children and Maternal Mood // Sleep. 2009. Vol. 32, № 5. Р. 599–606.
14. Jambhekar S, Carroll JL. Diagnosis of pediatric obstructive sleep disordered breathing: Beyond the gold standard // Expert Rev Respir Med. 2008; 2:791–809/15. Marcus CL. Sleep-disordered breathing in children // Am J Respir Crit Care Med. 2001; 164: 16–30.16. Verhulst SL, Van Gaal L, De Backer W. et al. The prevalence, anatomical correlates and treatment ofsleep-disordered breathing in obese children and adolescents // Sleep Med Rev 2008; 12: 339–346.17. Gozal D, Kheirandish-Gozal L. Childhood obesity and sleep: relatives, partners, or both? // Ann NY Acad Sci. 2012; 1264: 135–141.
18. Bhattacharjee R, Kheirandish-Gozal L, Pillar G, Gozal D. Cardiovascular omplications of obstructive sleep apnea syndrome: evidence from children // Prog Cardiovasc Dis. 2009; 51: 416–433.
19. Kheirandish-Gozal L, Bhattacharjee R, Gozal D. Autonomic alterations and endothelial dysfunction in pediatric obstructive sleep apnea // Sleep Med. 2010; 11: 714–720.
20. Bhattacharjee R, Kim J, Alotaibi WH, Kheirandish-Gozal L, Capdevila OS, Gozal D. Endothelial dysfunction in children without hypertension: potential contributions of obesity and obstructive sleep apnea // Chest. 2012; 141: 682–691.
21. Somers VK, Dyken ME, Clary MP, Abboud FM. Sympathetic neural mechanisms in obstructive sleep apnea // J Clin Invest 1995; 96(4): 1897–904.
22. Somers VK, Dyken ME, Mark AL, Abboud FM. Parasympathetic hyperresponsiveness and bradyarrhythmias during apnoea in hypertension // Clin Auton Res. 1992; 2(3): 171–6.
23. Sabharwal R, Zhang Z, Lu Y, Abboud FM, Russo AF, Chapleau MW. Receptor activity-modifying protein 1 increases baroreflex sensitivity and attenuates angiotensin-induced hypertension // Hypertension 2010; 55(3): 627–35.
24. Zaldivar F, McMurray RG, Nemet D, Galassetti P, Mills PJ, Cooper DM. Body fat and circulating leukocytes in children // J Obes (Lond) 2006; 30: 906–911.
25. Cindik N, Baskin E, Agras PI et al. Effect of obesity on inflammatory markers and renal functions // Acta Paediatr 2005; 94: 1732–1737.
26. Gozal D, Kheirandish L. Oxidant stress and inflammation in the snoring child: confluent pathways to upper airway pathogenesis and end-organ morbidity // Sleep Med Rev.2006;10: 83–96.
27. Gozal D, Serpero LD, Sans Capdevila O, Kheirandish-Gozal L. Systemic inflammation in non-obese children with obstructive sleep apnea // Sleep Med 2008; 9: 254–9.
28. Larkin EK, Rosen CL, Kirchner HL et al. Variation of C-reactive protein levels in adolescents: association with sleep-disordered breathing and sleep duration // Circulation. 2005; 111: 1978–84.
29. O’Brien L. M., Gozal D. (2005). Autonomic dysfunction in children with sleep-disordered breathing. Sleep 28, 747–752, O’Brien L. M., Gozal D. (2005). Autonomic dysfunction in children with sleep-disordered breathing. Sleep 28, 747–752, O’Brien L. M., Gozal D. (2005). Autonomic dysfunction in children with sleep-disordered breathing. Sleep 28, 747–752.
30. Antzelevitch C. Sympathetic modulation of the long QT syndrome // Eur Heart J. 2002; 23:1246.
31. Gula LJ, Krahn AD, Skanes A, Ferguson KA, George C, Yee R, et al. Heart rate variability in obstructive sleep apnea: A prospective study and frequency domain analysis // Ann Noninvasive Electrocardiol. 2003; 8: 144–9.
32. Hoffstein V, Mateika S. Cardiac arrhythmias, snoring and sleep apnea // Chest. 1994; 106: 466–71.
33. Koehler U, Schafer H. Is obstructive sleep apnea (OSA) a risk factor for myocardial infarction and cardiac arrhythmias in patients with coronary heart disease (CHD) // Sleep. 1996; 19: 283–6.
34. Orban M, Bruce CJ, Pressman GS et al. Dynamic changes of left ventricular performance and left atrial volume induced by the Mueller maneuver in healthy young adults and implications for obstructive sleep apnea, atrial fibrillation, and heart failure // J Cardiol. 2008; 102(11): 1557–61.
35. Otto ME, Belohlavek M, Khandheria B et al. Comparison of right and left ventricular function in obese and nonobese men // J Cardiol 2004; 93(12): 1569–72.
36. Hou Y, Scherlag BJ, Lin Jet al. Ganglionated plexi modulate extrinsic cardiac autonomic nerve input: effects on sinus rate, atrioventricular conduction, refractoriness, and inducibility of atrial fibrillation // J Am Coll Cardiol 2007; 50(1): 61–8.
37. Kahn A, Groswasser J, Rebuffat E et al. Sleep and cardiorespiratory characteristics of infant victims of sudden death: a prospective case–control study // Sleep.1992; 15: 287–292.
38. Spth-Schwalbe E, Gofferje M, Kern W, Born J, Fehm HL. Sleep disruption alters nocturnal ACTH and cortisol secretory patterns // Biol Psychiatry. 1991. 29: 575–584
39. Buckley TM, Schatzberg AF. On the interactions of the hypothalamic-pituitary-adrenal (HPA) axis and sleep: normal HPA axis activity and circadian rhythm, exemplary sleep disorders // J Clin Endocrinol Metab. 2005, 90: 3106–3114
40. Friend A, Craig L, Turner S. The prevalence of metabolic syndrome in children: a systematic review of the literature // Metab Syndr Relat Disord. 2013; 11(2): 71–80.
41. Giustina A, Veldhuis JD. Pathophysiology of the neuroregulation of growth hormone secretion in experimental animals and the human // Endocr Rev. 1998. 19: 717–797
42. Peltomki T. The effect of mode of breathing on craniofacial growth–revisited // Eur J Orthod. 2007. 29: 426–42943. Franco RA Jr, Rosenfeld RM, Rao M. First place–resident clinical science award 1999: quality of life for children with obstructive sleep apnea // Otolaryngol Head Neck Surg. 2000; 123: 9–16113115.
44. Friedlander SL, Larkin EK, Rosen CL, Palermo TM, Redline S. Decreased quality of life associated with obesity in school-aged children // Arch Pediatr Adolesc Med. 2003; 157: 1206–1211.
45. Chervin RD, Dillon JE, Bassetti C, Ganoczy DA, Pituch KJ. Symptoms of sleep disorders, inattention, and hyperactivity in children // Sleep. 1997; 20: 1185–92.46. Small L, Aplasca A. Child obesity and mental health: a complex interaction // Child Adolesc Psychiatr Clin N Am 2016; 25(2): 269–82.
47. Owens J, Spirito A, Marcotte A, McGuinn M, Berkelhammer L. Neuropsychological and behavioral correlates of obstructive sleep apnea syndrome in children: A preliminary study // Sleep Breath. 2000; 4: 67–78.
48. Chervin RD, Archbold KH, Dillon JE et al. Inattention, hyperactivity, and symptoms of sleep-disordered breathing // Pediatrics 2002; 109: 449–56.
49. Gottlieb DJ, Vezina RM, Chase C et al. Symptoms of sleep-disordered breathing in 5-year-old children are associated with sleepiness and problem behaviors // Pediatrics. 2003; 112: 870.
50. Chervin RD, Dillon JE, Bassetti C, Ganoczy DA, Pituch KJ. Symptoms of sleep disorders, inattention, and hyperactivity in children // Sleep. 1997; 20: 1185–92.
51. Beebe DW, Gozal D. Obstructive sleep apnea and the prefrontal cortex: towards a comprehensive model linking nocturnal upper airway obstruction to daytime cognitive and behavioral deficits // J Sleep Res 2002; 11: 1–16.
52. Leach J., Olson J., Hermann J., Manning S. Polysomnographic and clinical findings in children with obstructive sleep apnea // Arch. Otolaryngol. Head Neck Surg. 1992. Vol. 118. Р. 741–4.
53. American Academy of Pediatrics. Clinical practice guideline: diagnosis and management of childhood obstructive sleep apnea syndrome // Pediatrics. 2002; 109(4): 704–712.
54. Iber C, ed. The AASM Manual for the Scoring of Sleep and Associated Events: Rules, Terminology and Technical Specification. American Academy of Sleep Medicine; 2007. Ref Type: Serial (Book, Monograph).
55. Brietzke S.E., Katz E.S., Roberson D.W. Can history and physical examination reliably diagnose pediatric obstructive sleep apnea/hypopnea syndrome? A systematic review of the literature // Otolaryngol. Head Neck Surg. 2004. Vol. 131. Р. 827–32.
56. Sanders J.C., King M.A., Mitchell R.B., Kelly J.P. Perioperative complications of adenotonsillectomy in children with obstructive sleep apnea syndrome // Anesth. Analg. 2006. Vol. 103. Р. 1115–21.
57. Massa F, Gonsalez S, Laverty A, Wallis C, Lane R. The use of nasal continuous positive airway pressure to treat obstructive sleep apnoea // Arch Dis Child. 2002; 87: 438–443.


