Клинический случай целиакии, осложненной динамической кишечной непроходимостью
СтатьиЮ.А. Дмитриева1, 2, канд. мед. наук, И.Д. Майкова2, канд. мед. наук, Е.В. Скоробогатова1, 2, канд. мед. наук, Ж.В. Полякова2, М.А. Меньшикова2, И.Н. Захарова1, д-р мед. наук, профессор
1 ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России, г. Москва
2 ГБУЗ «Детская городская клиническая больница им. З.А. Башляевой Департамента здравоохранения города Москвы»
Резюме. Целиакия представляет собой хроническое иммуноопосредованное заболевание, развивающееся в любом возрасте на фоне регулярного употребления в пищу глютенсодержащих продуктов. Симптомы заболевания крайне разнообразны. У детей раннего возраста в клинической картине, как правило, доминируют гастроинтестинальные проявления. Своевременная диагностика и назначение безглютеновой диеты приводит к быстрому купированию симптомов и улучшению состояния пациентов. Несвоевременная диагностика глютеновой энтеропатии может приводить к развитию серьезных осложнений, одним из которых является динамическая кишечная непроходимость.
Ключевые слова: целиакия, глютен, дети, мальабсорбция, кишечная непроходимость, инвагинация, энтероколит, кишечная недостаточность, атрофическая энтеропатия, тканевая трансглутаминаза
Summary. Celiac disease is a chronic immune-mediated disease that develops at any age against the background of regular consumption of gluten-containing foods. The symptoms of the disease are extremely diverse. In young children, the clinical picture is usually dominated by gastrointestinal manifestations. Timely diagnosis and administration of a gluten-free diet leads to rapid relief of symptoms and improvement in the condition of patients. Untimely diagnosis of gluten enteropathy can lead to the development of serious complications, one of which is dynamic intestinal obstruction.
Keywords: celiac disease, gluten, children, malabsorption, intestinal obstruction, invagination, enterocolitis, intestinal insufficiency, atrophic enteropathy, tissue transglutaminase
Для цитирования: Клинический случай целиакии, осложненной динамической кишечной непроходимостью / Ю.А. Дмитриева [и др.] // Практика педиатра. 2024. № 4. С. 37-39.
For citation: A clinical case of celiac disease complicated by dynamic intestinal obstruction / Yu.A. Dmitrieva [et al.] // Pediatrician's practice. 2024;(4): 37-39. (in Russ.)
В настоящее время целиакия рассматривается как иммуноопосредованное системное генетически детерминированное заболевание, возникающее при употреблении глютена, характеризующееся развитием атрофической энтеропатии, появлением в сыворотке крови специфических антител и наличием большой комбинации глютен-зависимых клинических проявлений [1, 2].
В раннем возрасте целиакия чаще характеризуется наличием гастроинтестинальных симптомов, при этом наиболее яркая клиническая картина заболевания отмечается у детей первых лет жизни. Заболевание обычно начинается после введения в питание ребенка глютенсодержащих продуктов. Первые признаки синдрома мальабсорбции возникают, как правило, через 8-12 недель, хотя продолжительность латентного периода может быть различной и зависит от ряда сопутствующих факторов [3]. Клинические симптомы целиакии появляются в большинстве случаев постепенно. Дети становятся раздражительными, капризными, вялыми. На эти проявления родители обычно не обращают внимания и часто связывают их с прорезыванием зубов. По мере прогрессии заболевания в клинической картине могут присутствовать снижение аппетита, нарушение темпов физического и психомоторного развития, снижение двигательной активности ребенка. Типичным клиническим проявлением целиакии у детей раннего возраста, как правило, является обильный пенистый, жирный, зловонный стул, полифекалия. Формируется характерный внешний вид больного: на фоне дефицита массы тела, истончения подкожно-жирового слоя, снижения мышечного тонуса обращает на себя внимание значительно увеличенный в размере живот. Иногда дети жалуются на боли в животе, которые чаще имеют непостоянный, тупой характер и локализуются преимущественно в околопупочной области. В тяжелых случаях может отмечаться утрата ранее приобретенных навыков и умений. Диагностика целиакии в таких случаях обычно не представляет сложностей, а своевременное назначение безглютеновой диеты довольно быстро приводит к исчезновению клинических симптомов и нормализации темпов физического и нервно-психического развития ребенка [4]. Несмотря на столь характерные проявления синдрома мальабсорбции, доминирующие в клинической картине целиакии у детей раннего возраста, даже в случае типичного дебюта заболевания диагноз часто выставляется с запозданием, что может привести к формированию серьезных, жизнеугрожающих осложнений заболеваний. Мы представляем демонстрацию подобного клинического случая.
Девочка 1 года 11 мес поступила в ДГКБ им. З.А. Башляевой по экстренным показаниям с жалобами на вялость, повышение температуры, учащенный разжиженный стул. С учетом особенностей клинической картины была госпитализирована в инфекционное отделение.
При сборе анамнеза стало известно, что ребенок от первой беременности, протекавшей с угрозой прерывания в первом триместре, срочных самостоятельных родов. Вес при рождении 3550 г, длина тела 54 см. С рождения находилась на грудном вскармливании в течение месяца, в последующем была переведена на искусственное вскармливание в связи с развитием мастита у матери. Проводилась повторная смена смесей ввиду наличия у ребенка минимальных пищеварительных дисфункций (вздутие живота, склонность к запорам). Продукты прикорма введены в рацион с 6 месяцев, глютенсодержащие продукты в виде детского печенья, мультизлаковой каши с 10 мес). С 11 мес отмечено замедление темпов прибавки в весе (менее 200 г в мес). В возрасте 1 года вес ребенка составил 9325 г. С года в клинической картине увеличение живота в объеме (расценивалось как конституциональные особенности ребенка), нестабильные темпы прибавки в весе, регулярный, но пестрый стул, девочка стала плаксивой, капризной (расценивалось как синдром прорезывания зубов), стала часто показывать на животик. В возрасте 1 года 7 мес появился учащенный разжиженный стул при отсутствии иных симптомов инфекционного процесса; проводилась терапия пробиотиками, сорбентами, регуляторами моторики кишечника с временным эффектом. В 1 год 9 мес с жалобами на сохранение вялости, потерю в весе и интенсивные боли в животе девочка была госпитализирована в хирургическое отделение стационара. Особенности клинической картины позволили предположить наличие у ребенка кишечной непроходимости. По данным рентгенологического исследования брюшной полости, определены множественные уровни жидкости, расширение петель кишечника в эпигастральной области. Последующее выполнение рентген-контрастного исследования не выявило нарушения прохождения бария по кишечнику, ввиду чего клиническая ситуация была расценена как функциональные нарушения желудочно-кишечного тракта. С рекомендациями симптоматической терапии ребенок был выписан домой. Спустя сутки после выписки в связи с повторным ухудшением состояния (гипорексия, сохраняющиеся боли в животе, многократный жидкий стул, повышение температуры тела до фебрильных цифр) бригадой скорой медицинской помощи доставлена в ДГКБ им. З.А. Башляевой.
Состояние ребенка на момент поступления в стационар расценено как тяжелое. Тяжесть состояния была обусловлена выраженным интоксикационным синдромом, диареей с формированием симптомов дегидратации. Параметры физического развития (рост 81 см (SDS - 1,59), вес 8450 г, ИМТ 12,88 кг/м2 (SDS - 2,9)) соответствовали наличию у девочки острой белково-энергетической недостаточности умеренной степени. По результатам первичного лабораторного обследования в клиническом анализе крови определен умеренно выраженный нейтрофильный лейкоцитоз (WBC 12,7 х 109). В биохимическом анализе крови отмечено снижение концентрации общего белка до 55,4 г/л (n = 58-74), умеренная трансаминаземия АЛТ 52,3 ед/л (n < 31), АСТ 56,1 ед/л (n < 37), повышение гамма-глутамилтранспептидазы 50,5 ед/л (n = 5-32) С-реактивного белка 19,1 мг/л (n = 0-5). По данным КЩС, зафиксирован декомпенсированный метаболический ацидоз (рН 7,32 ВЕ -8,8). По результатам рентгенологического исследования продолжали определяться множественные горизонтальные уровни жидкости, скопление бария в проекции тонкой кишки, дистальных отделов толстой кишки (рис. 1).
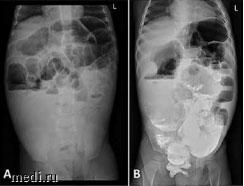 Рис. 1. Рентгенограмма брюшной полости пациентки при первой (А) и второй (В) госпитализации
Рис. 1. Рентгенограмма брюшной полости пациентки при первой (А) и второй (В) госпитализации
Эхографически визуализировалось расширение петель кишечника с ослаблением перистальтики, выраженный метеоризм, в мезогастрии слева определялось «мишенеподобное образование», соответствующее формированию тонко-тонкокишечного инвагината. Дополнительно обращали на себя внимание результаты копрологического исследования, выявившие наличие выраженной смешанной стеатореи. По тяжести состояния к концу первых суток госпитализации ребенок был переведен в отделение реанимации и интенсивной терапии, где находился под наблюдением педиатра и хирурга. Показаний к экстренному оперативному вмешательству определено не было, при динамическом эхографическом контроле инвагинат не определялся. Проводилась антибактериальная (метронидазол, защищенные цефалоспорины III поколения) и инфузионная терапия, на фоне чего у ребенка упорно сохранялись проявления кишечной недостаточности (вздутие живота, учащенный разжиженный стул), низкая толерантность к энтеральному питанию, несмотря на перевод на вскармливание полуэлементной смесью. Данное обстоятельство потребовало проведения частичного парентерального питания. На 8 сутки лечения на фоне сохранения диарейного синдрома в гемограмме определено появление анемии (HGB 103 г/л, RBC 3,65 х 1012), тромбоцитопении (124 х 109), нарастание нейтрофилёза со сдвигом лейкоцитарной формулы до юных форм (WBC 6,4 х 109, миелоциты 2%, метамиелоциты 1%, палочкоядерные 16%, сегментоядерные 52%), отмечено повышение концентрации островоспалительных маркеров в крови (прокальцитонин 3,32 нг/мл (n = 0-0,5), С-реактивный белок 74,7 мг/л (n = 0-7)), формирование коагуляционных нарушений, соответствующих развитию синдрома диссеминированного внутрисосудистого свертывания. При микробиологическом исследовании кала определялся активный рост представителей условно-патогенной флоры (Enterobacter cloacae, Klebsiella pneumoniae). Klebsiella pneumoniae была также выделена при посеве крови пациентки. По данным дополнительных инструментальных исследований, на данном этапе наблюдения диагностирована двусторонняя полисегментарная пневмония. Указанные клинико-лабораторные данные свидетельствовали в пользу формирования генерализованной бактериальной инфекции, наиболее вероятно, как следствие бактериальной транслокации из кишечника у ребенка с динамической кишечной непроходимостью в дебюте заболевания и длительным сохранением кишечной недостаточности. Перевод пациентки на полное парентеральное питание, ротация антибактериальной терапии (назначение карбапенемов, ванкомицина), внутривенное введение иммуноглобулинов, активная посиндромная терапия позволили стабилизировать состояние пациентки и купировать островоспалительные проявления. Принимая во внимание анамнестические данные и тяжесть поражения кишечника в условиях реанимационного отделения, выполнен серологический скрининг на целиакию, по результатам которого выявлено значимое повышение концентрации специфических аутоантител к тканевой трансглутаминазе IgA до 172 ед/мл (n = 0-10). После стабилизации состояния ребенка выполнено эндоскопическое исследования с забором биоптатов слизистой двенадцатиперстной кишки. По данным гистологического исследования, определена картина атрофической энтеропатии с межэпителиальным лимфоцитозом в стадии Marsh 3C (рис. 2), что позволило окончательно верифицировать диагноз целиакии.
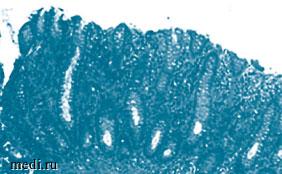 Рис. 2. Атрофическая энтеропатия с межэпителиальным лимфоцитозом в биоптатах нисходящего отдела двенадцатиперстной кишки
Рис. 2. Атрофическая энтеропатия с межэпителиальным лимфоцитозом в биоптатах нисходящего отдела двенадцатиперстной кишки
После купирования эпизода генерализованной бактериальной инфекции обращало на себя внимание длительное сохранение проявлений кишечной недостаточности (увеличение энтеральной нагрузки сопровождалось эпизодами беспокойства, субфебрилитета, невозможностью эффективного наращивания объема питания), что, с учетом тяжести энтеропатии, определенной по результатам гистологического исследования, определило необходимость проведения курса гормональной терапии (преднизолон из расчета 1 мг/кг/с в течение двух недель с последующей отменой). На фоне гормональной терапии была достигнута четкая положительная динамика в состоянии ребенка, толерантность к энтеральному питанию была постепенно восстановлена, при дальнейшем расширении рациона в рамках строгой безглютеновой диеты диарейный синдром не рецидивировал, достигнута стабильная прибавка в весе.
Данный клинический пример демонстрирует недостаточную настороженность педиатров первичного звена к начальным классическим проявлениям синдрома мальабсорбции в дебюте целиакии. Отсутствие своевременного диагноза и продолжение употребление глютена ребенком позволило развиться динамической кишечной непроходимости, транзиторной инвагинации, что в последующем стало фоном для формирования энтероколита, ассоциированного с активацией условно-патогенной флоры кишечника, и транслокации бактериальной флоры в системный кровоток. Купирование проявлений кишечной недостаточности стало возможным только на фоне комбинированной антибактериальной терапии и проведения курса гормональной терапии, при том, что в случае диагностики целиакии на стадии начальных проявлений, безглютеновая диета позволила максимально быстро устранить симптомы заболевания и предотвратить развитие жизнеугрожающих осложнений.
Литература
1. Целиакия у детей: проект клинических рекомендаций / Е.А. Рославцева [и др.] // Экспериментальная и клиническая гастроэнтерология. 2021. № 188 (4). С. 199-227.
2. European Society for Pediatric Gastroenterology, Hepatology, and Nutrition Guidelines for the Diagnosis of Coeliac Disease / S. Husby [et al.] // Journal of Pediatric Gastroenterology and Nutrition. 2012. Vol. 54, No. 1. P 136-160.
3. Целиакия: клинические особенности / И.Н. Захарова [и др.] // Педиатрия. Consilium Medicum. 2014. № 3. С. 62-67.
4. Захарова И.Н., Дмитриева Ю.А. Ошибки ведения пациентов с целиакией (на основании анализа Всероссийского консенсуса по диагностике и лечению целиакии у детей и взрослых) // Педиатрия. Consilium Medicum. 2016. № 2. С. 86-90.

