Низкоактивное воспаление в кишечнике как основа функциональных нарушений пищеварения первого года жизни
СтатьиИ.В. Бережная1, канд. мед. наук, О.В. Кузнецова2, канд. мед. наук, Д.К. Дмитриева1, И.Н. Захарова1, д-р мед. наук, профессор
1 ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России, г. Москва
2 ФГБОУ ВО «Ивановский государственный медицинский университет» Минздрава России, кафедра педиатрии и неонатологии, г. Иваново
Резюме. В статье рассмотрены механизмы этиопатогенеза функциональных заболеваний ЖКТ первого года жизни. Младенческие колики встречаются у детей достаточно часто как явление чрезмерного плача, носящего до конца не изученный и мучительный характер. Несмотря на частое возникновение колик, в настоящее время нет единого согласия в отношении определения, патогенеза или оптимальной стратегии лечения младенческих колик. Это состояние описывается как многофакторный синдром. Рассматриваются разные факторы, которые могут способствовать патофизиологии детских колик: нейрогенные, желудочнокишечные, микробные и психосоциальные. В последнее время активное обсуждение посвящено влиянию дисбиотических нарушений и феномена активации локального воспалительного ответа у пациентов с функциональными нарушениями пищеварения (ФНП), который описан как «lowgrade inflammation» (низкоактивное воспаление). В связи с чем влияние этих механизмов на возникновение младенческих колик и поиск терапевтической мишени восстановления барьерной функции слизистой оболочки кишки у пациентов представляет огромный интерес. В экспериментальных и клинических исследованиях установлена возможность биоактивных компонентов детских формул (например, пребиотической смеси scGOS/lcFOS 9:1) снижать интенсивность ФНП благодаря модуляции микробиоты, улучшению пищеварительных биомаркеров и воздействию на иммунный ответ. Рассмотрен аспект возможности влияния пребиотического компонента смеси на видовое и количественное разнообразие микробиоты в кишечнике младенца с целью снижения дисбиотических последствий и восстановлению кишечного барьера.
Ключевые слова: низкоактивное воспаление, младенческие колики, дисбиоз, пребиотические олигосахариды scGOS/lcFOS 9:1
Summary. The article considers the leading mechanisms of etiopathogenesis of functional gastrointestinal disorders (FGIDs) of the first year of life. Infantile colic is quite common in children as a phenomenon of excessive crying, which is mysterious and excruciating. Despite the frequent occurrence of colic, there is currently no agreement on the definition of pathogenesis or the optimal treatment strategy for infant colic. This condition is described as multifactor syndrome. Various factors that may contribute to the pathophysiology of childhood colic are considered: neurogenic, gastrointestinal, microbial and psychosocial. Recently, an active discussion has been devoted to the influence of dysbiotic disorders and the phenomenon of activation of local inflammatory response in patients with FGIDs, which is described as «lowgrade inflammation» (lowactive inflammation). In this regard, the effect of these mechanisms on the occurrence of infantile colic and the search for a therapeutic target to restore the barrier function of the mucous membrane in patients is of great interest. In experimental and clinical studies, the possibility of bioactive components of children’s formulas (for example, a prebiotic mixture of scGOS/lcFOS 9:1) to reduce the intensity of FGIDs by modulating microbiota, improving digestive biomarkers and effects on immune response. The aspect of the possible influence of the prebiotic component of the mixture on the process of normalization of microbiota in the intestine of the infant to reduce the dysbiotic effects is considered.
Keywords: low-active inflammation, infant colic, dysbiosis, prebiotic oligosaccharides scGOS/lcFOS 9:1
Для цитирования: Низкоактивное воспаление в кишечнике как основа функциональных нарушений пищеварения первого года жизни / И.В. Бережная, О.В. Кузнецова, Д.К. Дмитриева, И.Н. Захарова // Практика педиатра. 2024. № 2. С. 24-30.
For citation: Lowactivity inflammation in the intestine as the basis of functional digestive disorders of the first year of life / I.V. Berezhnaya, O.V. Kuznetsova, D.K. Dmitrieva, I.N. Zakharova // Pediatrician’s practice. 2024;(2):24-30. (in Russ.)
Роль микробиоты кишечника для формирования здоровья ребенка
Многочисленные исследования показали, что микробиота кишечника на раннем этапе жизни ребенка играет решающую роль в состоянии его здоровья и развития в будущем [1]. Растущее количество научных данных указывает на присутствие бактерий в плаценте, пуповине и околоплодных водах при здоровой доношенной беременности [2]. В исследованиях показано, что 63% бактериальной микробиоты младенцев соответствует микробиоте кишечника их матерей, при этом оказалось, что вирусных сообществ не более 15% [3]. Транслокация или вертикальная передача бактериальной микробиоты - это один из основных путей влияния микробов матери на младенца [4].
Бактериальная колонизация расширяется после рождения ребенка и зависит от способа родоразрешения, вскармливания, применения лекарственных препаратов и т. д. [5].
Микробный резервуар матери играет ключевую роль в процессе развития детского микробиома [6] (рис. 1). В связи с этим многие исследования направлены на изучение становления микробиома и отдельных ниш микробиоты именно в контексте «мать - ребенок» [7].
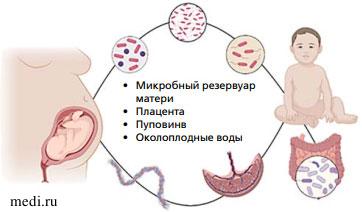 Рис. 1. Внутриутробное формирование микробиома «мать - ребенок»
Рис. 1. Внутриутробное формирование микробиома «мать - ребенок» С помощью генетического секвенирования было обнаружено уникальное, разнообразное и специфическое микробное сообщество в амниотической жидкости, грудном молоке, меконии [8]. Изучение микробиоты матери и сопоставление с микробиотой кишечника младенца показало частичное совпадение даже в возрасте 6 лет, что подтверждает сохранение материнской микробиоты как своей. Исследования о наследовании микробиоты кишечника выявили множество микробов, численность которых генетически связана с хозяином (генотип хозяина) [9, 10]. Так, исследования пар монозиготных и дизиготных близнецов в возрасте от 0 до 6 лет показали идентичность бактериального состава кишечника у монозиготных близнецов и значительные отличия у дизиготных [11].
Функции микробиоты
Эксперты во всех странах мира на основании исследований последних десятилетий пришли к выводу, что кишечная микробиота является по сути «виртуальным эндокринным органом». Среди основных функций кишечной микробиоты преимущественно выделяют четыре: защитная, метаболическая, иммунная и генетическая [12].
Защитная функция заключается в обеспечении колонизационной резистентности по отношению к патогенам [13].
Метаболический эффект кишечной микробиоты дает ей возможность выйти далеко за пределы ЖКТ и влиять на функцию других органов и систем, помимо прямого воздействия на слизистую оболочку кишечника и энтеральную нервную систему. Выработка многочисленных химических веществ гормональной природы (метаболиты триптофана и гистамин, ү-аминомасляная кислота и др.), короткоцепочечных жирных кислот, биологически активных сигнальных молекул оказывает прямое и опосредованное влияние на иммунный ответ [14, 15].
Иммунная функция реализуется за счет постоянного взаимодействия с «ассоциированной с кишечником лимфоидной тканью (GALT - gut-associated lymphoid tissue)» [15-17].
Факторы, которые могут обеспечить «здоровый» состав микробиоты, - это физиологичное течение беременности, естественное родоразрешение, раннее прикладывание к груди, кратковременность пребывания в роддоме, грудное вскармливание, полноценное разнообразное питание ребенка, рациональная антибиотикотерапия и др. А лучшее понимание микробиоты кишечника, ее метаболитов и ее взаимодействия с хозяином может быть использовано для разработки новых диагностических и терапевтических подходов [18].
Младенческие колики - наиболее стрессовый вариант минимальных пищеварительных дисфункций у ребенка, напрямую зависящий от стабильности формирования микробиоты кишечника и дисбиоза [19].
Поиск маркера, характерного только для группы детей с коликами, позволил выявить особенности микробиоты и ее метаболической активности, по сравнению со здоровыми. Исследования показали, что у детей, страдающих коликами, имеет место относительное увеличение количества Н2-продуцирующих бактерий, по сравнению с группой без колик. У них идентифицировано несколько таксонов, которые в значительной степени связаны с коликами: Acinetobacter, Lactobacillus iners, Clostridium, Lactobacillus и Klebsiella [20]. Также фенотип колик положительно коррелирует с повышенным содержанием Serratia, Vibrio и Pseudomonas в кишечнике [21, 22], а уровень бифидобактерий в среднем ниже в 30 раз, чем у детей без колик [23]. Кроме того, была обнаружена связь колик у младенцев на искусственном вскармливании и уровнем Escherichia coli в кишечнике, чем больше колиформных бактерий, тем ярче окрашены приступы беспокойства [24]. Что было подтверждено в работе F. Turroni с соавторами (2020), которые отмечают увеличение численности потенциально патогенных грамотрицательных бактерий -Escherichia и Klebsiella в образцах фекалий у младенцев с коликами [1].
В исследование S. Kozhakhmetov c соавторами проанализированы не только количественный состав, но и метаболическая активность микробиоты фекалий у младенцев с коликами и здоровых. Исследование включало две группы младенцев с коликами по 15 человек из двух лечебных учреждений, и группу здоровых младенцев (21 ребенок). Группы с коликами и контрольная группа были рождены вагинально и находились исключительно на грудном вскармливании. Образцы кала у детей собирались в течение времени с 1-го дня до 12 месяцев [19]. В группах детей с коликами было выявлено относительное обеднение пула Bifidobacterium и обогащение Bacteroides Clostridiales. Исследование метаболических путей показало, что в группах без колик превалировали пути биосинтеза аминокислот, в то время как в группах с коликами микробита фекалий обладала метаболическими путями гликолиза, которые коррелировали с таксоном Bacteroides и усиливали воспаление. Современная стратегия использования пробиотиков в терапии младенческих колик показывает, что введение пробиотика матери на 28 неделе беременности и младенцу после рождения приводит к восстановлению уровня бифидо- и лактобактерий и клиническому уменьшению интенсивности периодов беспокойства, а также лабораторному уменьшению маркеров воспаления [25].
Установлено, что лактобациллы или молочнокислые бактерии оказывают благотворное влияние на функцию эпителия, слизистый барьер и перистальтику желудочно-кишечного тракта (ЖКТ) [26]. Bifidobacterium spp. и Lactobacillus способствуют правильному функционированию иммунной системы кишечника [27], помимо прочих эффектов еще и подавляют рост газообразующих бактерии (например, Escherichia, Klebsiella и Enterobacter) [28, 29].
Механизм взаимодействия «мозг и кишечник» через центральную и энтеральную нервную систему включает нейрокринные и эндокринные пути (нейротрансмиттеры: серотонин и дофамин, нервно-мышечный контроль перистальтики, стресс-индуцированный кортизол и стимуляцию секреции слизи) [30]. Активация блуждающего нерва, нейропептиды и нейротрансмиттеры (лептин и серотонин), иммунная сигнализация через секреторный IgA, целостности барьера слизистой оболочки (белок зонулин и короткоцепочечные жирные кислоты, такие как бутират) оказывают влияние на перистальтику и висцеральную чувствительность кишечника [31, 32]. Метаболиты микробиоты встречно оказывают влияние на центральную нервную систему младенца. Например, некоторые штаммы Lactobacillus и Bifidobacterium могут вырабатывать гамма-аминомасляную кислоту (ГАМК), которая является доминирующим тормозным нейротрансмиттером. Другие виды бактерий, такие как Enterococcus и Escherichia, и некоторые штаммы Candida могут вырабатывать серотонин и дофаминовые нейротрансмиттеры. Продукты микробного метаболизма (масляная кислота, пропионовая кислота и уксусная кислота), стимулируют симпатическую нервную систему последовательно высвобождают серотонин слизистой, оказывая влияние на процессы памяти и обучения в мозге [33].
Одной из современных теорий развития минимальных пищеварительных дисфункций, включая колики, стала теория «системного низкоактивного воспаления» [23]. В литературе феномен активации локального воспалительного ответа у пациентов с функциональными заболеваниями ЖКТ описан термином low-grade inflammation (низкоактивное воспаление). Нарушения барьерной функции, связанные с нарушением плотных контактов, приводят к повышению проницаемости слизистой оболочки кишечника и поступлению различных внутрипросветных факторов в собственную пластинку слизистой, способствуя активации иммунокомпетентных клеток (рис. 2, 3). Последние, вырабатывая ряд цитокинов, оказывают влияние на висцеральную гиперчувствительность и изменяют моторную функцию кишечника [34]. Исследования A. Partty с коллегами (2017) доказали повышение уровня провоспалительных цитокинов, хемокинов, включая IL-8 и CC-хемокиновый лиганд 4 (CCL4) в сыворотке крови и корреляцию с низким содержанием бифидобактерий (Bifidobacterium breve) у детей с коликами [35]. Липополисахарид внешних мембран грамотрицательных бактерий является одним из значимых факторов влияния на провоспалительный ответ [36].
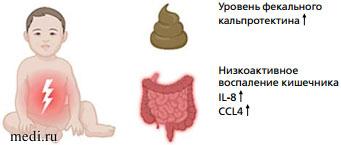 Рис. 2. Низкоактивное воспаление кишечника у детей с коликами
Рис. 2. Низкоактивное воспаление кишечника у детей с коликами 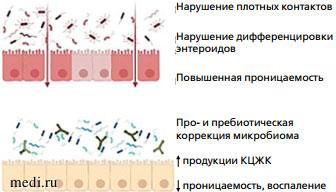 Рис. 3. Состояние кишечного барьера при патологии и после коррекции
Рис. 3. Состояние кишечного барьера при патологии и после коррекции Маркеры воспаления
Фекальный кальпротектин - антимикробный белок, высвобождаемый из кишечных нейтрофилов [37] - рассматривается в качестве основного биомаркера воспаления в кишечнике (рис. 2). Установлено, что у всех младенцев уровень фекального кальпротектина повышен, однако у младенцев с коликами фиксируются более повышенные концентрации фекального кальпротектина в 5-7 раз, по сравнению со здоровыми. Последовательные измерения кальпротектина у младенцев с коликами постоянно показывали снижение этого маркера по мере сокращения времени плача [38, 39].
Исследования влияния пробиотиков на разные органы и системы показывают, что разные штаммы имеют свое таргетное влияние, выживаемость и метаболическую активность. Использование синбиотиков имеет большие перспективы в использовании за счет комбинации с пребиотиком [40]. Пребиотики являются питательным субстратом для пробиотических штаммов, что способствует росту и/или активности метаболизма микроорганизмов [41].
В 2017 г. Международная научная ассоциация пробиотиков и пребиотиков обновила определение пребиотика: субстрата, который избирательно используется микроорганизмами-хозяевами, принося пользу для здоровья [41]. Это определение позволило расширить спектр пребиотиков, включив в него неуглеводные соединения, обладающие указанной активностью, а также сферу их применения вне ЖКТ, помимо продуктов питания.
Согласно принятому документу, пребиотические соединения должны обладать рядом особенностей [41, 42]:
- устойчивостью к кислотности желудка, гидролизу пищеварительными ферментами и желудочнокишечной абсорбции;
- быть доступными к ферментации кишечной микробиотой, которая может быть оценена in vitro;
- приводить к стимулированию роста кишечных бактерий, оказывающих благотворное влияние на здоровье и благополучие организма.
Пребиотические структуры могут избирательно стимулировать рост или активность специфических бактерий и, таким образом, способствовать выработке короткоцепочечных жирных кислот (КЦЖК), которые оказывают плейотропное действие как локально, так и системно на другие ткани [42]. Результаты клинических исследований доказывают влияние пребиотиков на иммунитет, снижение риска развития аллергии [43], а гипотеза о связи головного мозга и кишечника получает все больше доказательств весомого вклада пребиотиков в поддержание психического здоровья [44, 45].
Основная польза природного комплекса разнообразных по составу олигосахаров заключается в том, что они в неизмененном виде (не перевариваются ферментами человека) проходят почти весь ЖКТ до толстой кишки, где утилизируются бифидобактериями, лактобактериями, вейлонеллами, бактероидами и другими полезными (пробиотическими) анаэробами, способствуя их росту и размножению в этом биотопе [46].
Пребиотики позволяют эффективно корректировать дисбиоз как потенциальный триггер воспалительных заболеваний ЖКТ. Было показано, что пребиотики способствуют уменьшению воспаления, избирательно стимулируя рост защитных микроорганизмов, таких как бифидобактерии и повышая устойчивость к колонизации болезнетворными бактериями, такими как Bacteroides spp [47].
На сегодняшний день наиболее изученным пребиотическим комплексом олигосахаридов, применяемых в детском питании, является уникальный комплекс scGOS/lcFOS (короткоцепочечные галактолигосахариды / длинноцепочечные фруктоолигосахариды) в соотношении 9:1, разработанный компанией Nutricia на основании более 50-летнего изучения грудного молока. Добавление в детские смеси было одобрено Европейской директивой 2006/141/ЕС, а высокий уровень безопасности подтвержден EFSA и US FDA присвоением статус GRAS (Generally recognized as Safe) US FDA GRAS Notice (GRN) No.477.
Пребиотическая смесь scGOS/lcFOS 9:1 в количестве 0,8 г/100 мл содержит около 100 различных структур олигосахаридов и, таким образом, более полно воспроизводит видовое и количественное разнообразие пула олигосахаридов грудного молока (ОГМ), нежели добавление одного или нескольких синтезированных ОГМ. Помимо имитации разнообразия структур и соотношений короткой и длинной цепи ОГМ, пребиотический комплекс scGOS/lcFOS воспроизводит эффекты грудного молока [49] . Комплекс scGOS/lcFOS, оказывая дозозависимый эффект, способствует росту полезных бактерий и подавляет рост патогенных [50], нормализует частоту и консистенцию стула, снижает частоту инфекционных заболеваний (респираторных и кишечных) [51], уменьшает потребность в антибиотиках, оказывает аллергопротективное действие и модулирует местный иммунный ответ, увеличивая выработку sIgA [49].
Сочетание пребиотиков scGOS/lcFOS с другими функциональными ингредиентами, например с модифицированным жировым компонентом (бета-положение пальмитиновой кислоты в триглицериде), позволяет комплексно влиять на предрасполагающие механизмы функциональных нарушений пищеварения.
Показано, детские смеси, обогащенные в-пальмитиновой кислотой, приближают видовое и количественное разнообразие микробиоты у детей на искусственном вскармливании к показателям микробиоты у детей на грудном вскармливании, влияют на развитие воспаления в кишечнике как на животной модели, так и в доклинических испытаниях [51]. На мышиной модели животных с дефицитом муцина продемонстрировано уменьшение количества эрозий кишечника по сравнению с группой, где животные получали смесь, содержащую растительное масло с низким содержанием в-пальмитата. Авторы предполагают, что к этому могла приводить способность в-пальмитинов ой кислоты активизировать выработку антиоксидантных ферментов (супероксиддисмутазы, глутатионпероксидаза), стимулировать Т-регуляторные лимфоциты (через повышение экспрессии транскрипции фактора Foxp3), а также увеличивать экспрессию гена PPAR-ү и цитокина TGF-p, выполняющих важные функции в поддержании гомеостаза слизистой оболочки кишечника и регуляции воспалительной реакции на различные стимулы [51].
Тонкие механизмы младенческих ФНП до сих пор окончательно не расшифрованы, в связи с чем у детей на искусственном вскармливании представляется обоснованной стратегия комплексного влияния на возможные причины развития колик, запоров и срыгиваний. Это возможно при использовании Нутрилон Комфорт как продукта первого выбора благодаря содержанию нескольких функциональных ингредиентов (частично гидролизованного белка, пребиотического комплекса scGOS/lcFOS 0,8 г/100 мл, модифицированного жирового компонента с высоким уровнем бета-пальмиата). Эффективность смеси Нутрилон Комфорт подтверждена в десятке клинических исследований с участием более 1700 детей, в которых оценивалось влияние продукта на купирование колик, запоров и младенческих срыгиваний, что и обеспечило ей статус наиболее изученной на рынке детских смесей в категории «комфорт».
Заключение
На сегодняшний день дисбиотические нарушения микробиоты представляются ведущими в развитии минимальных пищеварительных дисфункций, что заставляет экспертов пересматривать их «функциональный» характер. Установлена прямая связь между возникновением ФНП и низкоактивным воспалением в кишечнике, подтверждена вероятность развития в старшем возрасте ряда гастроэнтерологических заболеваний с воспалительным компонентом. В этой связи модуляция кишечной микробиоты младенцев в «окно возможностей» открывает перспективы влияния не только на развитие функциональных нарушений, но и, возможно, на показатели здоровья в отсроченной перспективе.
Литература
1. The infant gut microbiome as a microbial organ influencing host well-being / F Turroni [et al.] // Italian Journal of Pediatrics. 2020. Feb 5. Vol. 46, No. 1. P. 16.
2. Microbial prevalence, diversity and abundance in amniotic fluid during preterm labor: a molecular and culture-based investigation / D.B. DiGiulio [et al.] // PLoS One. 2008. Aug 26. Vol. 3, No. 8. P. e3056.
3. Discordant transmission of bacteria and viruses from mothers to infants at birth / R. Maqsood [et al.] // Microbiome. 2019. Vol. 7, No. 156.
4. Isolation of commensal bacteria from umbilical cord blood of healthy neonates born by cesarean section / E. Jimenez [et al.] // Current Microbiology. 2005. Vol. 51, No. 4. P. 270-274.
5. The First Microbial Colonizers of the Human Gut: Composition, Activities, and Health Implications of the Infant Gut Microbiota / C. Milani [et al.] // Microbiology and Molecular Biology Reviews. 2017. Nov. 8. Vol. 81, No. 4. P. e00036-17.
6. Mother-to-Infant Microbial Transmission from Different Body Sites Shapes the Developing Infant Gut Microbiome / P. Ferretti [et al.] // Cell Host & Microbe. 2018. Jul. 11. Vol. 24, No. 1. P. 133-145.e5.
7. The infant microbiome development: mom matters / N.T. Mueller [et al.] // Trends Molecular Medicine. 2015. Vol. 21, No. 2. P. 109-117.
8. Human gut colonisation may be initiated in utero by distinct microbial communities in the placenta and amniotic fluid / M.C. Collado [et al.] // Scientific Reports. 2016. Mar. 22;6:23129.
9. The Relationship Between the Human Genome and Microbiome Comes into View / J.K. Goodrich [et al.] // Annual Review of Genetics. 2017. Nov. 27. Vol. 51. P. 413-433.
10. Fonseca Early Life Microbial Exposure and Immunity Training Effects on Asthma Development and Progression / A.D. Cereta [et al.] // Frontiers in Medicine (Lausanne). 2021. Jun. 16. Vol. 8:662262.
11. Diversity of gut microbiota metabolic pathways in 10 pairs of Chinese infant twins / S. Zhou [et al.] // PLoS ONE. 2016. Vol. 11(9): e0161627.
12. Early Life Microbial Exposure and Immunity Training Effects on Asthma Development and Progression / A.D. Cereta [et al.] // Frontiers in Medicine (Lausanne). 2021 Jun. 16;8:662262.
13. Minireview: Gut microbiota: the neglected endocrine organ / G. Clarke [et al.] // Molecular Endocrinology. 2014. Vol. 28, No. 8. P 1221-1238.
14. Agus A., Planchais J., Sokol H. Gut Microbiota Regulation of Tryptophan Metabolism in Health and Disease // Cell Host & Microbe. 2018. Jun. 13. Vol. 23, No. 6. P 716-724.
15. The Role of Gut Microbiota in the Etiopathogenesis of Multiple Chronic Diseases / L. Pires [et al.] // Antibiotics (Basel). 2024. Apr. 25. Vol. 13, No. 5. P. 392.
16. Feng T., Elson C.O. Adaptive immunity in the host-microbiota dialog // Mucosal Immunology. 2011. Vol. 4, No. 1. P 15-21.
17. Microbial transmission in the social microbiome and host health and disease / A. Sarkar [et al.] // Cell. 2024. Jan. 4. Vol. 187, No. 1. P 17-43.
18. DuPont H.L., Salge M.M.H. The Importance of a Healthy Microbiome in Pregnancy and Infancy and Microbiota Treatment to Reverse Dysbiosis for Improved Health // Antibiotics (Basel). 2023. Nov. 1112(11):1617.
19. Compositional and functional variability of the gut microbiome in children with infantile colic / S. Kozhakhmetov [et al.] // Scientific Reports. 2023. Jun. 12. Vol. 13, No. 1. P. 9530.
20. Pham V.T., Lacroix C., Braegger C.P., Chassard C. Lactate utilization is associated with gut microbiota dysbiosis in colicky infants // Scientific Reports. 2017; 7:11176.
21. Infant colic is an inflammation of the intestines and dysbiosis / J.M. Rhodes [ et al.] // The Journal of Pediatrics. 2018 Vol. 203. P 55-61.e3.
22. Gut microbiota of colicky infants: development and specific features / C. De Weerth [et al.] // Pediatrics. 2013; 131:e550-e558.
23. Infant Colic Represents Gut Inflammation and Dysbiosis / J.M. Rhoads [et al.] // The Journal of Pediatrics. 2018. Vol. 203. P 55-61.e3.
24. Comparison of formula-fed infants with and without colic revealed significant differences in total bacterial counts, enterobacteriaceae, and fecal ammonia / F Savino [et al.] // Acta Paediatrica. 2017. Vol. 106. P 573-578.
25. Seeding the Infant Gut in Early Life-Effects of Maternal and Infant Seeding with Probiotics on Strain Transfer, Microbiota, and Gastrointestinal Symptoms in Healthy Breastfed Infants / C. Melsaether [et al.] // Nutrients. 2023. Sep. 15. Vol. 15, No. 18. P. 4000.
26. Bifidobacteria isolated from infants and cultured on human milk oligosaccharides affect intestinal epithelial function / M. Chichlowski [et al.] // Journal of Pediatric Gastroenterology and Nutrition. 2012. Vol. 55, No. 3. P. 321-327.
27. Hilliard M.A., Sela D.A. Transmission and Persistence of Infant Gut-Associated Bifidobacteria // Microorganisms. 2024. Apr. 27. Vol. 12, No. 5. P. 879.
28. Antagonistic effect of Lactobacillus strains against gas-producing coliforms isolated from colicky infants / F Savino [et al.] // BMC Microbiology. 2011. Jun. 30. Vol. 11. P. 157.
29. Faecal Microbiota in Infants and Young Children with Functional Gastrointestinal Disorders: A Systematic Review / D. Hofman [et al.] // Nutrients. 2022. Feb. 25. Vol. 14, No. 5. P 974.
30. The Brain-Gut-Microbiome Axis / C.R. Martin [et al.] // Cell Mol Gastroenterol Hepatol. 2018. Apr. 12. Vol. 6, No. 2. P. 133-148.
31. Strandwitz P. Neurotransmitter modulation by the gut microbiota // Brain Research. 2018. Aug. 15. Vol. 1693 (Pt B). P. 128-133.
32. Osadchiy V., Martin C.R., Mayer E.A. The Gut-Brain Axis and the Microbiome: Mechanisms and Clinical Implications / Clinical Gastroenterology and Hepatology. 2019. Vol. 17, No. 2. P 322-332.
33. Gut microbiota in various childhood disorders: Implication and indications / N.K. Saeed [et al.] // World Journal of Gastroenterology. 2022. Vol. 28, No. 18. P 1875-1901. [PMID: 35664966
34. Андреев Д.Н. Роль нарушения проницаемости слизистой оболочки кишечника в генезе функциональных заболеваний желудочно-кишечного тракта / Consilium Medicum.2019. Vol. 21, No. 8. P 29-34.
35. Infantile Colic Is Associated With Low-grade Systemic Inflammation / A. Partty [et al.] // Journal of Pediatric Gastroenterology and Nutrition. 2017. Vol. 64, No. 5. P. 691-695.
36. Infant colic: mechanisms and management / J. Zeevenhooven [et al.] // Nature Reviews Gastroenterology & Hepatology. 2018. Vol. 15, No. 8. P 479-496.
37. Altered fecal microflora and increased fecal calprotectin in infants with colic / J.M. Rhoads [et al.] // The Journal of Pediatrics. 2009. Vol. 155, No. 6. P 823-828.e1.
38. Probiotic Lactobacillus rhamnosus GG therapy and microbiological programming in infantile colic: a randomized, controlled trial / A. Patty [et al.] // Pediatric Research. 2015. Vol. 78, No. 4. P 470-475.
39. Crying Time and RORy/FOXP3 Expression in Lactobacillus reuteri DSM17938-Treated Infants with Colic: A Randomized Trial / F Savino [et al.] // The Journal of Pediatrics. 2018. Vol. 192. P 171-177.e1.
40. Expert consensus document: The International Scientific Association for Probiotics and Prebiotics (ISAPP) consensus statement on the definition and scope of prebiotics / G.R. Gibson [et al.] // Nature Reviews Gastroenterology & Hepatology. 2017. Vol. 14, No. 8. P 491-502.
41. Prebiotics in the management of pediatric gastrointestinal disorders: Position paper of the ESPGHAN special interest group on gut microbiota and modifications / F Indrio [et al.] // Journal of Pediatric Gastroenterology and Nutrition. 2024. Vol. 78, No. 3. P 728-742.
42. Infant Formula Supplemented with Biotics: Current Knowledge and Future Perspectives / S. Salminen [et al.] // Nutrients. 2020. Jun. 30. Vol. 12, No. 7. P 1952.
43. Pujari R., Banerjee G. Impact of prebiotics on immune response: from the bench to the clinic // Immunology & Cell Biology. 2021. Vol. 99, No. 3. P 255-273.
44. Probiotics, prebiotics, and postbiotics in health and disease / J. Ji [et al.] // MedComm (2020). 2023. Nov 4. Vol. 4, No. 6. P. e420.
45. The Effects of Probiotics and Prebiotics on Mental Disorders: A Review on Depression, Anxiety, Alzheimer, and Autism Spectrum Disorders / F Ansari [et al.] // Current Pharmaceutical Biotechnology. 2020. Vol. 21, No. 7. P 555-565.
46. The use of probiotics and prebiotics in decolonizing pathogenic bacteria from the gut; a systematic review and meta-analysis of clinical outcomes / M.N. Rahman [et al.] // Gut Microbes. 2024. Jan-Dec;16(1):2356279.
47. The Gut-Organ Axis within the Human Body: Gut Dysbiosis and the Role of Prebiotics / G. Saxami [ et al.] // Life (Basel). 2023. Oct 8;13(10):2023.
48. Intestinal microbiota in infants at high risk for allergy: Effects of prebiotics and role in eczema development / H. Wopereis [et al.] // The Journal of Allergy and Clinical Immunology. 2018. Vol 141, No. 4. P 1334-1342.e5.
49. Pre-, pro-, syn-, and Postbiotics in Infant Formulas: What Are the Immune Benefits for Infants? / A. Lemoine [et al.] // Nutrients. 2023. Feb. 28. Vol. 15, No. 5. P 1231.
50. Biotics and Children's and Adolescents' Health: A Narrative Review / E. Xenopoulou [et al.] // Children (Basel). 2024. Mar. 9. Vol. 11, No. 3. P 329.
51. Beta-palmitate - a natural component of human milk in supplemental milk formulas / Z. Havlicekova [et al.] // The Journal of Nutrition. 2016. Mar. 17. Vol. 15. P. 28.

