Смотри также:
Пластический бронхит у детей: результаты многоцентрового исследования
СтатьиН.И. Колганова1, Д.Ю. Овсянников1, 2, д-р мед. наук, А.Б. Малахов2, д-р мед. наук, С.В. Старевская3-5, д-р мед. наук, А.В. Орлов4, 6, канд. мед. наук, М.А. Абрамян2, д-р мед. наук, Ю.Н. Шамрин2, д-р мед. наук, В.П. Мирошниченко2, А.С. Реминная1, А.Б. Корнилова3, А.А.Пашкевич6, В.С. Матвеев6, 7, Е.М. Жоголева8, А.В. Выборнов9, Т.В. Сушкова10, 11
1 ФГАОУ ВО «Российский университет дружбы народов», г. Москва
2 ГБУЗ «Морозовская детская городская клиническая больница Департамента здравоохранения г. Москвы»
3 СПбГБУЗ «Детский многопрофильный клинический специализированный центр высоких медицинских технологий», г. Санкт-Петербург
4 ФГБОУ ВО «Северо-Западный государственный медицинский университет им. И.И. Мечникова» Минздрава России, г. Санкт-Петербург
5 ФГБУ «Санкт-Петербургский научно-исследовательский институт фтизиопульмонологии» Минздрава России
6 СПбГБУЗ «Детская городская больница святой Ольги», г. Санкт-Петербург
7 ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России
8 ГБУЗ МО «Щелковская городская больница»
9 ГБУЗ ЯО «Клиническая больница № 2», г. Ярославль
10 ГБУЗ «Самарская областная детская клиническая больница им. Н.Н. Ивановой»
11 ФГБОУ ВО «Самарский государственный медицинский университет» Минздрава России
Ключевые слова: пластический бронхит, кашель, бронхиальная астма, бронхоскопия, дети
Keywords: plastic bronchitis, cough, bronchial asthma, bronchoscopy, children
Резюме. Цель исследования – описать ассоциированные с пластическим бронхитом (ПБ) заболевания, особенности его манифестации, методы его терапии и его исходы у детей. Материал и методы. С 2002 по 2022 г. наблюдались 20 пациентов с ПБ, медиана возраста 4,5 [2,9; 7,5] года. Проводились рентгенография, компьютерная томография органов грудной клетки, бронхоскопия, цитологическое исследование слепков, определение уровня специфических иммуноглобулинов E, спирометрия. Результаты. Самым частым ассоциированным с ПБ заболеванием была бронхиальная астма, которая развивалась и после перенесенного ПБ. Он манифестирует кашлем со слепками бронхов, дыхательной недостаточностью, ателектазами; большинству пациентов проводились неоднократные бронхоскопии с положительным эффектом; летальных исходов не было. Заключение. При развитии кашля, ателектазов, дыхательной недостаточности, откашливании слепков бронхов, наличии ассоциированных с ПБ заболеваний необходимо включать данное редкое заболевание в диагностический поиск.
Summary. The purpose of the study: to describe associated diseases, features of manifestation, therapy and outcomes of plastic bronchitis (PB) in children. Materials and methods. From 2002 to 2022, 20 patients with PB were observed, median age 4.5 [2.9; 7.5] years. X-ray, computed tomography of the chest organs, bronchoscopy, cytological examination of casts, determination of the level of specific immunoglobulins E, spirometry were performed. Results. The most frequent disease associated with PB was bronchial asthma, which also developed after undergoing PB; PB manifests with cough with bronchial casts, respiratory insufficiency, atelectasis; most patients underwent repeated bronchoscopy with a positive effect; no deaths were registered. Conclusion. With the development of cough, atelectasis, respiratory insufficiency, coughing up bronchial casts, the presence of PB-associated diseases, it is necessary to include this rare disease in the diagnostic search.
Для цитирования: Пластический бронхит у детей: результаты многоцентрового исследования / Н.И. Колганова [и др.] // Практика педиатра. 2023. № 2. С. 35-41.
For citation: Kolganova N.I. et al. Plastic bronchitis in children: results of a multicenter study. Pediatrician's Practice. 2023;(2):35-41. (In Russ.)
Введение
Пластический бронхит (ПБ) – это редкое заболевание, характеризующееся наличием плотных ветвящихся слепков, выполняющих просвет дыхательных путей (ДП). Данное заболевание известно со времен Галена, который назвал ПБ venae arteriosae expectoranti, считая, что пациенты откашливают легочные вены. ПБ в разные периоды обозначали терминами «фибринозный бронхит», «псевдомембранозный бронхит», «бронхиальный круп». Диагноз подтверждается при обнаружении плотных слепков в ДП, нередко повторяющих ветвление бронхиального дерева. В некоторых случаях пациенты откашливают слепки самостоятельно, при этом слепки можно принять за кусочки пищи, гельминтов; в других – их извлекают при проведении бронхоскопии [1-5].
ПБ может развиться в любом возрасте, чаще в 10-30 лет, хотя описаны случаи заболевания у 3-недельного младенца и у 75-летнего мужчины. Преобладают пациенты мужского пола, кроме случаев ПБ, ассоциированного с аллергическими заболеваниями, что чаще встречается у лиц женского пола [6, 7]. Вероятно, частота ПБ недооценивается. Он диагностируется, по всей видимости, только у лиц с наиболее тяжелым течением заболевания, при образовании крупных слепков, обширных ателектазов, обструкции ДП. Диагноз нередко устанавливается лишь на аутопсии, смерть чаще всего наступает вследствие дыхательной недостаточности (ДН). Пациенты с легким течением ПБ обычно выздоравливают самостоятельно [5].
Образование слепков связано с организацией экссудата или транссудата на фоне сниженного клиренса ДП и дегидратации секрета у генетически предрасположенных лиц [1, 8, 9]. Слепки («пробки») при ПБ, как правило, содержат большое количество муцина, причем в отличие от нормального муцина, нити которого соединяются последовательно, при ПБ полимеры имеют перекрестные связи. В слепках может обнаруживаться большое количество фибрина, а также воспалительные клетки, эозинофилы, кристаллы Шарко-Лейдена [5, 8]. В отличие от слепков при ПБ, слизистые пробки при бронхоэктазах и муковисцидозе содержат большое количество полимерной ДНК и F-актина, имеют относительно низкую плотность; возможность их трансформации в сложные ветвящиеся слепки спорна. Морфология слепков при ПБ также отличается от морфологии слизистых пробок при аллергическом бронхолегочном аспергиллезе [1].
У младенцев ПБ ассоциируется преимущественно с врожденными пороками сердца, особенно после операции Фонтена с формированием одножелудочкового кровообращения [1, 10]. Распространенность, тяжесть течения и частота обострений ПБ у пациентов с врожденными пороками сердца широко варьируют. Иногда ПБ манифестирует по прошествии нескольких лет после операции. У некоторых пациентов наблюдается субклиническое течение заболевания с откашливанием небольших слепков в редкие периоды обострений. Остается до конца неясным, у каких пациентов с одножелудочковой гемодинамикой риск развития ПБ более высокий, однако отмечается связь с энтеропатией с потерей белка, повышением центрального венозного давления, аритмиями, сниженным сердечным выбросом, аномалиями тканевого тромбопластина [1, 5, 9, 11]. ПБ ассоциируется с аномалиями лимфатических сосудов – как при врожденных пороках сердца, так и при первичных нарушениях лимфообращения. Описывают случаи разрешения ПБ после перевязки грудного лимфатического протока [12, 13].
ПБ может рассматриваться в контексте атипичной манифестации тяжелой бронхиальной астмы (БА) с секреторной гиперреактивностью. Закупорка мелких ДП слизью с образованием эозинофильных слепков при неконтролируемой БА может привести к развитию ПБ [4, 5, 14, 15].
Описаны случаи ПБ при инфекции, вызванной гриппом H1N1, Mycoplasma pneumoniae, у больных талассемией, серповидно-клеточной анемией [5, 16-18]. Неясно, приводит ли образование слепков в бронхах к острому грудному синдрому, или же он сам предрасполагает к развитию ПБ. Доказана возможность развития данного заболевания при вдыхании токсических газов или аспирации агрессивной жидкости [14].
Вопрос о возможности развития ПБ при муковисцидозе является дискутабельным [19]. Не описано случаев ПБ при бронхоэктазах и бактериальной пневмонии, поэтому антибиотики не рекомендованы при лечении ПБ [1, 4]. Исключением является микоплазменная пневмония, при которой в случае формирования бронхиальных слепков ускорить выздоровление может их механическое удаление, назначение макролидов, системных стероидов [17]. В табл. 1 приведены обобщенные сведения о заболеваниях, которые могут сочетаться с ПБ.
Таблица 1. Заболевания, ассоциированные с пластическим бронхитом
| Доказанная ассоциация | Возможная ассоциация | Маловероятное сочетание |
| • Врожденные пороки сердца после операции Фонтена • Врожденные аномалии лимфатических сосудов легких • Талассемия • Серповидно-клеточная анемия • Грипп • Ингаляция токсичных газов |
• Цианотические врожденные пороки сердца • Аномалии внелегочных лимфатических сосудов • Тяжелая (фатальная) бронхиальная астма • Аллергический бронхолегочный аспергиллез • Микоплазменная пневмония |
• Муковисцидоз • Хроническая обструктивная болезнь легких • Бронхоэктазы • Бактериальная пневмония |
Выделяют 2 типа ПБ в зависимости от клеточного состава слепков. При I типе (клеточном, или воспалительном) слепки представляют собой плотные инфильтраты, состоящие из фибрина, эозинофилов, кристаллов Шарко-Лейдена. При II типе (бесклеточном, или невоспалительном) у пациентов с сердечной патологией обнаруживаются муциновые слепки с малым содержанием клеток [1]. В 2002 г. T.V. Brogan и соавт. предложили выделять аллергический/астматический ПБ, связанный с сердечной патологией ПБ и идиопатический вариант [3]. В 2005 г. P. Madsen и соавт. предложили классифицировать ПБ в первую очередь в зависимости от ассоциированного заболевания, а если оно неизвестно – в зависимости от гистологических особенностей слепков [5].
Диагноз ПБ устанавливается на основании клинической и бронхоскопической картины, обнаружения в ряде случаев заболеваний, сочетающихся с ПБ. Характерными симптомами ПБ являются приступообразный кашель, откашливание слепков бронхов, одышка, свистящее дыхание, боли или дискомфорт в грудной клетке, часто на стороне поражения, иногда субфебрилитет или лихорадка. Интенсивность перечисленных симптомов зависит от величины образовавшегося в бронхах слепка. Этот фактор также определяет объем ателектазов – одного из постоянных симптомов ПБ. При аускультации легких могут выслушиваться сухие свистящие хрипы или отсутствие дыхание над пораженным участком, феномен, описанный как шум «развевающегося флага». На рентгенограммах органов грудной клетки обнаруживаются ателектазы пораженных сегментов легкого, доли легкого или всего легкого с компенсаторной гиперинфляцией, в некоторых случаях описывают множественные участки консолидации. При бронхоскопии, выполняемой не только с диагностической, но и с лечебной целью, у пациентов с ПБ обнаруживают плотные белые или серые массы, обтурирующие просвет ДП. Слепки могут быть довольно плотно связаны со стенкой бронха, из-за чего невозможно их удалить при помощи электроотсоса, в таком случае прибегают к использованию бронхоскопических щипцов [1, 4, 5, 8].
Течение ПБ может быть острым или, что встречается чаще, рецидивирующим [1, 5]. Жизнеугрожающие события при ПБ встречаются у пациентов с кардиальной патологией чаще, чем у пациентов с БА [9]. После удаления слепка ателектазы, как правило, расправляются, рентгенологические изменения разрешаются. При дифференциальной диагностике исключают другие заболевания, сопровождающиеся сухим кашлем, бронхообструктивным синдромом, развитием ателектазов (инородное тело бронха, приступ БА и др.) [1, 4, 20].
На сегодняшний день не разработано единых подходов к терапии ПБ. Ввиду редкости ПБ сведения об эффективной терапии данного заболевания ограничиваются описанием отдельных клинических случаев или серий наблюдений. Кроме того, большинство пациентов получает несколько видов терапии одновременно, в связи с чем представляется сложным оценить эффективность отдельного метода и/ или лекарственного препарата. При невозможности самостоятельного откашливания слепков их удаляют в ходе бронхоскопии, однако данный метод не предотвращает рецидивов заболевания [1, 5, 6, 8, 20]. Очищение ДП представляется наиболее безопасным и эффективным методом терапии ПБ. У пациентов с уже диагностированным ПБ ежедневная высокочастотная компрессия грудной клетки с помощью специального жилета или использование инсуффлятора-аспиратора, осуществляющего неинвазивное очищение ДП методом моделирования естественного кашля (аппарат Cough Assist), может снизить вероятность формирования новых слепков [4]. Ежедневная физическая нагрузка и полноценное питание, в частности восполнение недостатка белка у пациентов, страдающих энтеропатией с потерей белка, являются важной частью комплексной терапии ПБ [1].
При ПБ оказались неэффективными в2-агонисты, ингаляционные глюкокортикостероиды (исключением могут быть случаи БА), дорназа альфа (так как слепки не содержат полимерной ДНК), гвайфенезин, гипертонический раствор, N-ацетилцистеин. Мукоактивные препараты следует использовать с осторожностью ввиду их способности вызывать гиперсекрецию слизи и усиливать воспалительную реакцию в ДП [1, 4]. Ингаляции активатора тканевого плазминогена (tPA) могут облегчить течение ПБ за счет деполимеризации фибрина. Однако tPA имеет высокую стоимость и может вызывать раздражение ДП, кровохарканье или одышку. У больных с тяжелым ПБ можно рассмотреть возможность применения tPA в виде аэрозоля в дозе 0,7-1,0 мг/кг каждые 4 ч [1, 4, 21-24]. Описан положительный эффект ингаляций урокиназы, гепарина. Гепарин не влияет на уже сформированные фибриновые слепки, но может предотвратить активацию тканевого фактора и снизить секрецию слизи. Гепарин также обладает противовоспалительными свойствами, гораздо меньше раздражает ДП и стоит значительно дешевле, чем некоторые другие препараты. При ПБ следует рассмотреть возможность применения аэрозольного гепарина в дозе 5000 ЕД каждые 4 ч [25-27]. Встречаются единичные описания уменьшения образования слепков при использовании ингаляционных антихолинергических препаратов [1, 4]. Применение макролидов может способствовать угнетению секреции муцина за счет ингибирования киназ, регулируемых внеклеточными сигналами (ERK1, ERK2). Имеются сообщения о том, что макролиды могут снижать тяжесть течения ПБ (благодаря тому же их эффекту, что и при муковисцидозе) [4, 28].
У пациентов с аномалиями лимфатических сосудов может оказаться эффективной перевязка грудного лимфатического протока. Увеличение сердечного выброса может способствовать снижению тяжести течения ПБ [1, 12, 13, 29].
Прогноз ПБ зависит от тяжести, заболевание может иметь рецидивирующее течение. После удаления слепков клинические проявления, а также рентгенологические изменения обычно исчезают. В ряде случаев стойкого эффекта удается достичь путем трансплантации сердца [30]. Летальность, как правило вследствие ДН, колеблется от 6 до 60% [5]. Создан Международный реестр пациентов с ПБ по всему миру c целью изучения причин развития и возможностей терапии данного заболевания [31].
Материал и методы
С 2002 по 2022 г. наблюдались 20 детей с ПБ в возрасте от 10 мес до 11 лет (медиана 4,5 [2,9; 7,5] года). Диагноз был подтвержден при откашливании слепков бронхов и/или при их обнаружении в ходе бронхоскопии (рис. 1, 2). Пациенты были госпитализированы ввиду неэффективности лечения бронхообструктивного синдрома, развития ДН, ателектазов. Обследование включало бронхоскопию, обзорную рентгенографию, компьютерную томографию органов грудной клетки, цитологическое исследование слепков, для подтверждения диагноза БА – определение уровня специфических иммуноглобулинов E, спирометрию с бронхолитическим тестом. Анализировали частоту ассоциированных с ПБ заболеваний, особенности манифестации и течения ПБ, эффективность различных методов его терапии и его исходы.
Результаты и обсуждение
Характеристика пациентов, включенных в исследование, результатов обследований и терапии представлена в табл. 2 и на рис. 1-5.
Таблица 2. Характеристика пациентов с пластическим бронхитом
| Характеристика | Число пациентов | |
| абс. | % | |
| Пол | ||
| Мальчики | 13/20 | 65 |
| Девочки | 7/20 | 35 |
| Ассоциированные заболевания (на момент манифестации пластического бронхита) | ||
| Бронхиальная астма | 5/11 | 46 |
| Состояние после операции Фонтена | 2/11 | 18 |
| Иммунодефицит | 2/11 | 9 |
| Врожденный порок развития лимфатической системы | 1/11 | 9 |
| Бронхолегочная дисплазия | 1/11 | 9 |
| Рентгенологическая картина | ||
| Ателектазы левого легкого | 9/20 | 45 |
| Ателектазы правого легкого | 6/20 | 30 |
| Терапия | ||
| Бронхоскопическая санация | 15/20 | 75 |
| Азитромицин | 2/20 | 10 |
| Илопрост (ингаляции) | 2/20 | 10 |
| Алтеплаза(ингаляции) | 1/20 | 5 |
| Селективная эмболизация лимфатических сосудов | 1/20 | 5 |
 Рис. 1. Слепок бронхиального дерева у пациента с пластическим бронхитом, развившимся после операции Фонтена
Рис. 1. Слепок бронхиального дерева у пациента с пластическим бронхитом, развившимся после операции Фонтена
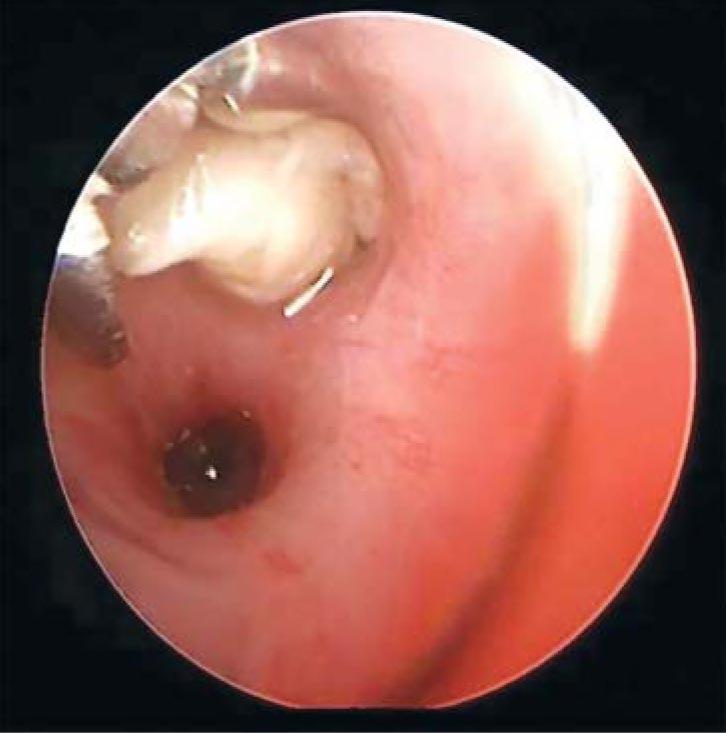 Рис. 2. Удаление слепков бронхов при помощи эндоскопических щипцов
Рис. 2. Удаление слепков бронхов при помощи эндоскопических щипцов
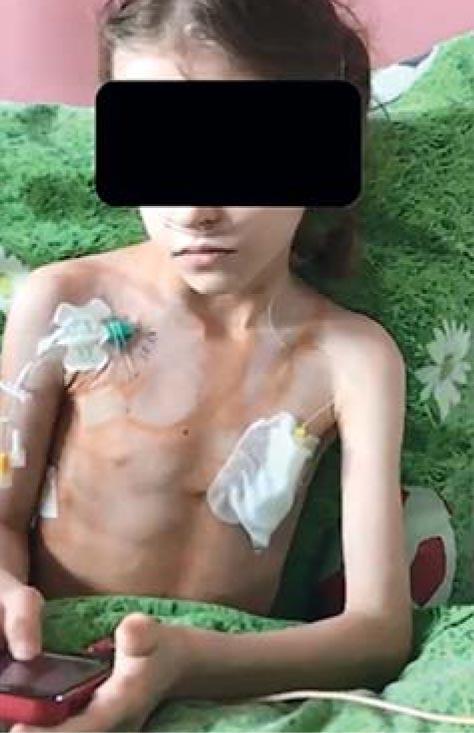 Рис. 3. Пациентка К. с пластическим бронхитом, тяжелой бронхиальной астмой, тяжелой белково-энергетической недостаточностью, проходящая длительную домашнюю кислородотерапию
Рис. 3. Пациентка К. с пластическим бронхитом, тяжелой бронхиальной астмой, тяжелой белково-энергетической недостаточностью, проходящая длительную домашнюю кислородотерапию
 Рис. 4. Рентгенограмма органов грудной клетки в прямой (а) и боковой (б) проекции пациентки К. Ателектаз средней доли правого легкого
Рис. 4. Рентгенограмма органов грудной клетки в прямой (а) и боковой (б) проекции пациентки К. Ателектаз средней доли правого легкого
 Рис. 5. Компьютерная томография органов грудной клетки пациентки К. Субсегментарный ателектаз средней доли, дилатация бронхов, картина «дерева в почках»
Рис. 5. Компьютерная томография органов грудной клетки пациентки К. Субсегментарный ателектаз средней доли, дилатация бронхов, картина «дерева в почках»
У 11 из 20 пациентов были выявлены ассоциированные с ПБ заболевания/состояния: у 2 – состояние после операции Фонтена, осложнившееся хилотораксом (мальчик 4 лет, девочка 5 лет), у 5 – БА (девочка 9 лет, мальчик 11 лет, 2 мальчика 6 лет; мальчик 7 лет), у 1 – врожденный порок развития лимфатической системы – стеноз большого лимфатического протока (мальчик 1 года 8 мес). У 1 пациента диагностирована болезнь Брутона. У 1 мальчика 3 лет 6 мес имела место ВИЧ-инфекция, у 1 недоношенной девочки 2-го года жизни с бронхолегочной дисплазией – течение РСВ-бронхиолита. В доступной литературе сведений об ассоциации ПБ с бронхолегочной дисплазией, бронхиолитами, иммунодефицитами нами обнаружено не было.
Начало заболевания чаще было постепенным, наблюдался кашель, как правило, сухой, приступообразный, симптомы бронхообструктивного синдрома, ДН. У большинства пациентов развились ателектазы: у 9 диагностировали ателектазы сегментов нижней доли левого легкого или всей нижней доли, у 6 – ателектазы справа, средней и нижней доли. Девочка К. 9 лет с ПБ, сопутствующими заболеваниями: тяжелой неконтролируемой БА, синдромом средней доли, тяжелой белково-энергетической недостаточностью (рис. 3-5) – находилась на длительной домашней кислородотерапии до достижения контроля БА. Откашливание слепков бронхов прекратилось на фоне адекватной базисной терапии БА.
Большинству пациентов (15 из 20) проводились неоднократные бронхоскопии (от 1 до 9 процедур) с удалением слепков при помощи электроотсоса или бронхоскопических щипцов. У ребенка с ПБ после операции Фонтена (рис. 1) выполнена селективная эмболизация лимфатических сосудов, приведшая к выздоровлению. Четырем пациентам с ПБ, наблюдавшимся в Детской городской больнице святой Ольги (г. Санкт-Петербург), случаи которых были описаны ранее [4], проведены бронхоскопии, при которых выявлена полная окклюзия соответствующих долевых и сегментарных бронхов светло-желтыми плотными массами, которые невозможно было удалить электроотсосом, но удавалось частично извлечь бронхоскопическими щипцами. Эти массы представляли собой слепки, повторяющие строение бронхов и состоящие, по данным цитологического исследования, из фибрина и клеток крови (I тип сгустков). Содержание клеток в этих сгустках было различным. Нейтрофилы составляли от 30 до 90%, макрофаги – от 8 до 26%, эозинофилы – от 3 до 30%, лимфоциты – от 3 до 15%.
Исход у всех пациентов был благоприятный, рецидивов ПБ не было. У 3 пациентов без выявленных ассоциированных с ПБ состояний/заболеваний в течение 3 лет после наблюдаемого нами эпизода ПБ развились астматические приступы, была назначена базисная противоастматическая терапия в связи с диагностированной БА. Таким образом, в целом частота БА у пациентов с ПБ, который, по нашему мнению, можно расценивать как атипичную форму либо проявление коморбидности неконтролируемой БА [15, 32], составила 40% (8 из 20 пациентов, включая 5 больных с БА на момент манифестации ПБ). По данным систематического обзора P. Madsen и соавт., из 22 зарегистрированных пациентов с ПБ и эозинофильными слепками у 12 было определенное атопическое или астматическое состояние [5]. T.V. Brogan и соавт. проанализировали 42 случая ПБ у детей и в 31% констатировали его связь с БА и иной аллергической патологией. ПБ может сопровождаться и синдромом средней доли [3], что было отмечено и нами. Необходима адекватная контролирующая терапия БА для предотвращения развития ПБ у данных пациентов.
Заключение
ПБ – редкая форма рецидивирующего бронхита у детей, которая характеризуется образованием плотных слепков в просвете ДП. Заболевание встречается при врожденных пороках сердца, аномалиях лимфатических сосудов и, не менее часто, при БА. В нашей серии наблюдений у некоторых пациентов с ПБ в качестве ассоциированного заболевания имелась в анамнезе БА, у других детей она была диагностирована позже, при сборе катамнеза. Характерными клиническими признаками ПБ являются откашливание слепков бронхов, развитие ателектазов. При помощи бронхоскопии возможно не только обнаружение, но и удаление образовавшихся слепков бронхов. При доказанных аномалиях лимфатических сосудов высокоэффективна их эмболизация, приводящая к выздоровлению.
Литература
- Rubin B.K., Moskowitz W.B. Plastic bronchitis // Paediatric Respiratory Medicine. ERS handbook / Ed. by E. Eber, F. Medulla. ERS, 2013. P 577-581.
- Recycling plastic: diagnosis and management of plastic bronchitis among adults / P. Ntiamoah [et al.] // European Respiratory Review. 2021. Vol. 30, No. 161. DOI: 10.1183/16000617.0096-2021.
- Plastic bronchitis in children: a case series and review of the medical literature / T.V Brogan [et al.] // Pediatric Pulmonology. 2002. Vol. 34, No. 6. P 482-487.
- Четыре случая пластического бронхита у детей 2-7 лет. Лечение с использованием бронхоскопий, аэрозолей илопроста и 3% раствора NaCl / А.В. Орлов, М.С. Кузьмина, Л.А. Желенина, В.С. Матвеев // Вестник Северо-Западного государственного медицинского университета им. И.И. Мечникова. 2014. Т. 6, № 2. С. 113-119.
- Madsen P, Shah S.A., Rubin B.K. Plastic bronchitis: new insights and a classification scheme // Paediatric Respiratory Reviews. 2005. Vol. 6, No. 4. P. 292-300. DOI: 10.1016/j.prrv.2005.09.001.
- Plastic bronchitis in adult and pediatric patients: a review of its presentation, diagnosis, and treatment / N. Patel [et al.] // Missouri medicine. 2021. Vol. 118, No. 4. P. 363-373.
- Current evaluation and management of plastic bronchitis in the pediatric population / Y. Li [et al.] // International Journal of Pediatric Otorhinolaryngology. 2020. Vol. 130. DOI: 10.1016/j.ijporl.2019.109799.
- Течение пластического бронхита у детей / А.Б. Малахов [и др.] // Педиатрия. Consilium Medicum. 2020. № 3. С. 65-72. DOI: 10.26442/26586630.2020.3.200348.
- King W., Schowengerdt K.O. Jr. Pulmonary disease associated with congenital heart disease // Kendig's Disorders of the Respiratory Tract in Children. 9th edn. / Ed. by R.W. Wilmott [et al.]. Elsevier, 2018. P. 2280-2312.
- Immunophenotyping and protein profiling of Fontan-associated plastic bronchitis airway casts / J. Racz [et al.] // Annals of the American Thoracic Society. 2013. Vol. 10. No. 2. P. 98-107. DOI: 10.1513/AnnalsATS.201209-080OC.
- Белок-теряющая энтеропатия – осложнение операции Фонтена у ребенка с единственным желудочком сердца: клиническое наблюдение / Л.В. Пушко [и др.] // Трудный пациент. 2018. Т. 16, № 1-2. С. 43-47.
- Successful management of plastic bronchitis in a child post Fontan: case report and literature review / P. Do [et al.] // Lung. 2012. Vol. 190, No. 4. P. 463-468. DOI: 10.1007/s00408-012-9384-x.
- Successful treatment of plastic bronchitis with low fat diet and subsequent thoracic duct ligation in child with fontan physiology / K. Parikh [et al.] // Lymphology. 2012. Vol. 45. No. 2. P. 47-52.
- Pulmonary hyperinflation and respiratory distress following solvent aspiration in a patient with asthma: expectoration of bronchial casts and clinical improvement with high-frequency chest wall oscillation / T. Koga, T. Kawazu, K. Iwashita, R. Yahata // Respire Care. 2004. Vol. 49. No. 11. P. 1335-1338.
- Коморбидность бронхиальной астмы у детей: причинная, осложненная, неуточненная, обратная / Д.Ю. Овсянников [и др.] // Журнал «Педиатрия» им. Г.Н. Сперанского. 2021. Т. 100, № 2. С. 127-137.
- Plastic bronchitis in three children associated with 2009 influenza A(H1N1) virus infection / J. Deng [et al.] // Chest. 2010. Vol. 138, No. 6. P. 1486-1488. DOI: 10.1378/chest.10-0548.
- Bronchial casts associated with Mycoplasma pneumoniae pneumonia in children / S. Lu [et al.] // Journal of International Medical Research. 2020. Vol. 48, No. 4. DOI: 10.1177/0300060520911263.
- Plastic bronchitis in a child with thalassemia alpha / T.N. Veras [et al.] // Journal of Pediatrics. 2005. Vol. 81, No. 6. P. 499-502. DOI: 10.2223/JPED.1425.
- Plastic bronchitis as an unusual cause of mucus plugging in cystic fibrosis / D. Mateos-Corral, E. Cutz, M. Solomon, F. Ratjen // Pediatric Pulmonology. 2009. Vol. 44, No. 9. P. 939-940. DOI: 10.1002/ppul.21063.
- Plastic bronchitis mimicking foreign body aspiration that needs a specific diagnostic procedure / O. Noizet [et al.] // Intensive Care Medicine. 2003. Vol. 29, No. 2. P. 329-331.
- A multifaceted approach to the management of plastic bronchitis after cavopulmonary palliation / C.M. Avitabile [et al.] // Annals of Thoracic Surgery. 2014. Vol. 98. No. 2. P. 634-640.
- Treatment of plastic bronchitis in a Fontan patient with tissue plasminogen activator: a case report and review of the literature / J.M. Costello [et al.] // Pediatrics. 2002. Vol. 109, No. 4. P. e67. DOI: 10.1542/peds.109.4.e67.
- Management of Plastic bronchitis with topical tissue-type plasminogen activator / E. Gibb [et al.] // Pediatrics. 2012. Vol. 130. P. 446-450. DOI: 10.1542/peds.2011-2883.
- Prospective, longitudinal study of plastic bronchitis cast pathology and responsiveness to tissue plasminogen activator / L. Heath [et al.] // Pediatric Cardiology. 2011. Vol. 32, No. 8. P. 1182-1189. DOI: 10.1007/s00246-011-0058-x.
- Plastic bronchitis occurring late after the Fontan procedure: treatment with aerosoloized urokinase / M.W. Quasney [et al.] // Critical Care Medicine. 2000. Vol. 28. P. 2107-2111.
- Treatment of plastic bronchitis using serial flexible bronchoscopy and aerosolized heparin therapy / P.A. Walker [et al.] // European Journal of Pediatric Surgery. 2013. Vol. 23, No. 2. P. 157-160. DOI: 10.1055/s-0032-1315803.
- Aerosolized heparin in the treatment o f Fontan related plastic bronchitis / D.E. Eason [et al.] // Cardiology in the Young. 2014. Vol. 24, No. 1. P. 1-3. DOI: 10.1017/S1047951112002089.
- Kanoh S., Rubin B.K. Macrolides as immunomodulatory medications. Mechanisms of action and clinical applications // Clinical Microbiology Reviews. 2010. Vol. 23, No. 3. P. 590-615. DOI: 10.1128/CMR.00078-09.
- Fenestration of the Fontan circuit as treatment for plastic bronchitis / J. Wilson, J. Russell, W. Williams, L. Benson // Pediatric Cardiology. 2005. Vol. 26, No. 5. P. 717-719. DOI: 10.1007/s00246-005-0913-8.
- Treatment of plastic bronchitis by orthotopic heart transplantation / J.E. Laubisch, D.M. Green, P.J. Mogayzel, W.R. Thompson // Pediatric Cardiology. 2011. Vol. 32, No. 8. P. 1193-1195. DOI: 10.1007/s00246-011-9989-5.
- International Plastic Bronchitis Registry. URL: https://clinicaltrials.gov/ct2/show/NCT01663948.
- Овсянников Д.Ю., Фурман Е.Г., Елисеева Т.И. Бронхиальная астма у детей : монография / под ред. Д.Ю. Овсянникова. М. : РУДН, 2019. 211 с.


