Нефропатии у детей при гормональной дисфункции
СтатьиЭ.А. Юрьева, д-р мед. наук, профессор, Е.В. Тозлиян, канд. мед. наук, врач-эндокринолог, В.В. Длин, д-р мед. наук, профессор, Е.С. Воздвиженская, канд. биол. наук, Е.И. Шабельникова, канд. мед. наук
ОСП «Научно-исследовательский клинический институт педиатрии им. акад. Ю.Е. Вельтищева» ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России, г. Москва
Резюме. В обзоре кратко описана физиология и патофизиология эндокринной системы, в том числе у детей, рассмотрено влияние эндокринопатий на структуру и функции почек (рост, развитие функций, их циркадную периодичность и появление различных наследственных и приобретенных нефропатий).
Ключевые слова: гормональная дисфункция, болезни почек, дети
Summary. In this review brief data are presented on the physiology and pathophysiology of the endocrine system, including in children, and on the effect of endocrinopathies on the structure and function of the kidneys, including growth, development of functions, their circadian frequency and the appearance of various nephropathies of hereditary and acquired genesis.
Keywords: hormonal dysfunction, kidney disease, children
Проблемой болезней почек при гормональной дисфункции в разное время занимались Ю.Е. Вель-тищев, Л. Теодосиев, A.W. Norman и многие другие, однако и в настоящее время она остается актуальной.
Почки - важнейший орган, который выполняет регуляторные, гомеостатические функции, а также сохраняет «строительные материалы» для организма, элиминирует избыточные и токсические продукты обмена веществ, участвует в процессах детоксикации (очищения). Почки контролируют водно-электролитный, белковый, углеводный, минеральный обмен, тонус сосудов. В то же время почки являются органом-мишенью для большинства эндокринных воздействий. Гормоны регулируют процессы канальцевой реабсорбции, секреции, мембранный транспорт различных веществ, экспрессию сигнальных молекул, обменные процессы в интерстициальной соединительной ткани [15]. Важную роль в осуществлении гормонального контроля почечных функций играет чувствительность клеточных рецепторов к гормонам, физиологический баланс между циркулирующими гормонами-антагонистами, что обеспечивает взаимную регуляцию их активности. Сами по себе почки также выступают как эндокринный орган, обеспечивающий синтез таких гормонов, как кальцитриол (гормональная форма витамина D), эритропоэтин, ренин, а также его антагонисты - простагландины. Последние являются производными арахидоновой кислоты, обладают сильным вазодилататорным действием. Синтез простагландинов стимулируется ангиотензином II, вазопрессином, диуретиками. Простагландины являются медиаторами ангиотензина II и вазопрессина, стимулируют секрецию ренина, участвуют в регуляции почечного плазмотока в норме и при патологии, регулируют экскрецию натрия и воды, осмолярность мочи. Синтез простагландинов осуществляется в толстом колене петли Генле, дистальных канальцах и собирательных трубках в ответ на ишемию почек [5].
Представленные данные обусловливают актуальность проблемы влияния нарушений гормональной регуляции работы почек на их структуру и функции, на возникновение болезней почек.
Ренин - один из гормонов, продуцирующихся в юкстагломерулярном аппарате клубочков почек. Благодаря ренину почка и сердечно-сосудистая система обеспечивают контроль объема циркулирующей крови и ответственны за дисбаланс сосудосуживающих и сосудорасширяющих веществ в генезе артериальной гипертензии. Рениновая протеаза (ангиотензинпревращающий фермент) превращает ангиотензиноген в ангиотензин I и контролирует его содержание в крови [6]. При мутации гена ренина в клетках накапливается аномальный ренин, что сопровождается апоптозом клеток почек. Ренин входит в состав ренин-ангиотензин-альдостероновой системы (РААС), в которой взаимодействуют, помимо ренина, такие гормоны, как альдостерон, антидиуретический гормон (АДГ), ангиотензин II и катехоламины. Именно РААС определяет объем циркулирующей крови и активность вазоконстрикторных факторов. Большое значение для развития гипертензии и ишемии почек имеют нарушение чувствительности сосудов и изменение активности этой системы. Повышение уровня ренина в циркулирующей крови сопровождается повреждением почечных сосудов, так как ренин оказывает на них токсическое действие (прямое или косвенное). Активация РААС происходит при снижении содержания натрия в крови, кровопотере, травмах, снижении артериального давления, анестезии. В норме ангиотензин II и брадикинин стимулируют выброс простагландинов, которые, в свою очередь, усиливают синтез ингибиторов ангиотензинпревращающего фермента (иАПФ). Простагландины являются антагонистами системы РААС, участвуют во внутрипочечной системе регуляции почечного плазмотока: РААС активируется в ответ на вазоконстрикцию, снижение потребления натрия, повышение уровня ангиотензина II в крови. Нагрузка натрием ослабляет активность РААС: повышается уровень гломерулярной фильтрации (УГФ), снижается тонус сосудов под действием иАПФ, понижается артериальное давление [1]. Аномальное повышение активности РААС приводит к ишемии почек, прогрессирующему фиброзу ткани почек. При токсическом влиянии ренина на почки терапевтический эффект оказывают натрийуретики, иАПФ, бета-адреноблокаторы, блокаторы медленных кальциевых каналов. Индометацин подавляет синтез ренина.
Эритропоэтин - второй гормон, синтезируемый в юкстагломерулярном аппарате клубочков почек в ответ на уменьшение количества эритроцитов в крови. Он стимулирует дифференцировку и созревание эритроцитов в костном мозге. Синтез эритропоэтина снижается при хронической почечной недостаточности (ХПН).
Третий почечный гормон - кальцитриол (1,25(OH)2D3), активная форма которого образуется в проксимальных канальцах почечного эпителия из предшественника 25(OH)D3, в основном попадающего в организм из жира рыб или образующегося в коже под действием ультрафиолетовых лучей. Образование активной формы витамина D происходит под действием 1-альфа-гидроксилазы (CYP27B1), активность которой стимулируется паратгормоном, пролактином, эстрогенами, гормоном роста, низким уровнем кальция и фосфатов в сыворотке. Ее активность ингибирует кальцитриол. Образуется feetback-петля (механизм отрицательной обратной связи), с помощью которой регулируется синтез кальцитриола (см. рисунок) [7, 8]. Кальцитриол действует главным образом на 4 органа-мишени: паращитовидную железу (ПЩЖ), костные клетки, тонкий кишечник и почки. Циркулирующий в крови кальцитриол связывается с белком и проникает в клетки органов-мишеней, где взаимодействует с ядерным рецептором и активирует VDRE - так называются участки генома, работа которых регулируется витамином D (vitamin D response elements). В тонком кишечнике кальцитриол регулирует адсорбцию кальция и (в меньшей степени) фосфора, в ПЩЖ подавляет синтез паратгормона. Помимо участия в минеральном обмене кальцитриол выполняет и другие функции, включая клеточную дифференцировку, пролиферацию, иммунные функции, защиту от инфекции, благодаря которым его используют в терапии рака, кожных болезней и др. [9]. Гипервитаминоз D3 обусловлен в основном пищевыми или лекарственными перегрузками, а также (редко) повышенной чувствительностью рецепторов к витамину D3. Токсическое действие избытка кальцитриола в организме характеризуется повышением адсорбции кальция в кишечнике, гиперкальциемией, нефрокальцинозом, резким усилением перекисных процессов. В последнем случае больше всего повреждается липидный компонент щеточных каемок канальцевого эпителия почек с атрофией, деструкцией канальцев, появлением мощных липидных медиаторов воспаления с лимфогистиоцитарной пролиферацией в интерстиции почек. В моче повышается содержание липидов, перекисей, метаболитов коллагена, средних молекул. Характерна микропротеинурия, лейкоцитурия. С лечебной целью применяется обильное питье, фуросемид, назначаются кальцитонин, бисфосфонаты, кальцимиметики (имитирующие высокий уровень кальция в сыворотке крови и снижение содержания витамина D3). Недостаток витамина D отмечается при снижении его поступления в организм, низком уровне ультрафиолетового излучения, а также при мальабсорбции, укорочении тонкого кишечника, снижении активности 1-альфа-гидроксилазы, ХПН III-V степени. Характерные признаки рахита -гипокальциемия (снижение уровня ионизированного кальция), гипоальбуминемия, уратемия, потеря с мочой бикарбонатов, ацидоз, судороги в мышцах ног, напряжение мышц, симптом Хвостека, снижение абсорбции кальция в кишечнике, вторичный гиперпаратиреоз с нарушением минерального обмена в костях. С лечебной целью применяют глюконат кальция, хлористый кальций, витамин D3, препараты магния, тиазидные диуретики, повышающие реабсорбцию кальция в канальцах почек, кальцимиметики (для снижения вторичного гиперпаратиреоза) [7].
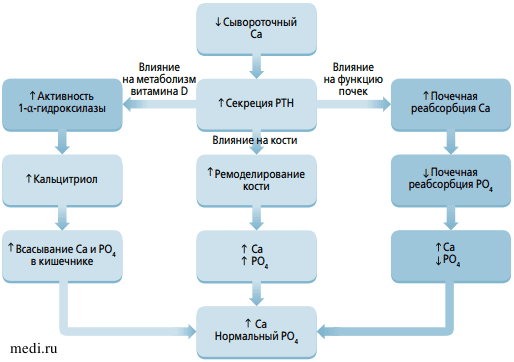 Гормональная регуляция фосфорно-кальциевого обмена в почках, костях, кишечнике [7]
Гормональная регуляция фосфорно-кальциевого обмена в почках, костях, кишечнике [7] Функциональный антагонист кальцитриола -паратгормон, который синтезируется в ПЩЖ, наряду с витамином D3 является регулятором фосфор-но-кальциевого обмена и вместе с почками поддерживает гомеостаз кальция. Эта функция паратгормона осуществляется посредством усиления: 1) растворения костных минералов и выхода в кровь кальция и фосфатов; 2) реабсорбции кальция в почках и увеличения экскреции фосфатов и 3) кишечной адсорбции кальция и фосфора с помощью стимуляции синтеза 1,25(QH)2D3 через активацию 1-альфа-гидроксилазы в клетках проксимальных канальцев почек. В результате повышение уровня паратгормона в сыворотке эффективно сохраняет постоянный уровень кальция и фосфатов в сыворотке крови (см. рисунок).
В связи с тем, что почки являются одним из органов-мишеней для паратгормона, нарушение его секреции и взаимодействия с почками критически сказывается на их структуре и функциях. Однако и патология почек может быть причиной повышения содержания паратгормона в циркулирующей крови, так как почки - основной орган (кроме печени), инактивирующий гормон и элиминирующий его из организма (ХПН). Как первичные причины гиперпаратиреоза выступают опухоли ПЩЖ и семейные, или врожденные эндокринопатии, а как вторичные причины - гиперпродукция паратгормона в условиях гипокальциемии или гиперфосфатемии, повышенная резорбция кости, снижение уровня кальцитриола (ХПН). Гиперпаратиреоз характеризуется повышением содержания кальция в крови, усилением его фильтрации и реабсорбции в почках. При этом почки могут оказаться неспособными реабсорбировать весь профильтровавшийся кальций, что приводит к гиперкальциурии и нефрокальцинозу (с образованием нерастворимых оксалатов или фосфатов кальция). Сам по себе паратгормон обусловливает ишемию почечной ткани, снижение секреции водородных ионов в дистальных канальцах, что в сочетании с преобладанием экскреции аммония обусловливает щелочную реакцию мочи. Это, в свою очередь, является фактором риска кристаллизации фосфатных солей -трипельфосфатов (двойных фосфатов магния и аммония, струвитов) с образованием рыхлых трипельфосфатных камней в почках. Кальциурия также может быть причиной образования фосфатных или оксалатных камней. Кроме того, паратгормон активирует прооксидантный фермент ксантиноксидазу, в результате чего резко усиливаются перекисные процессы в мембранных фосфолипидах щеточных каемок клеток канальцевого эпителия с образованием липидных медиаторов воспаления (лейкотриенов), оксалатов, различных провоспалительных факторов роста, усиливающих воспалительные процессы. Это способствует повышению клеточной пролиферации в ПЩЖ и в почках [10, 11]. Основные лечебные мероприятия - контроль гиперкальциемии и ишемии почек. Применяются иАПФ, бисфосфонаты, кальцимиметики (сансипар) (активаторы кальцийчувствительных рецепторов, что позволяет ослаблять синтез паратгормона), а также мембраностабилизаторы. Необходимо также поддерживать нормальное содержание кальцитриола при его дефиците. Гипопаратиреоз может быть результатом удаления ПЩЖ, врожденного дефекта чувствительности к паратгормону, действия радиации. При этом ПЩЖ нечувствительна к низкому содержанию кальция в крови. Симптомы обычно либо отсутствуют, либо слабо выражены -имеют место судороги, тетания, симптомы Хвостека, Труссо. Постановке диагноза способствует нагрузка паратгормоном: в норме повышается цАМФ в крови и моче и усиливается экскреция фосфатов, а при гипопаратиреозе эти признаки отсутствуют. С лечебной целью в острых случаях внутривенно вводят глюконат или хлорид кальция, назначают кальцитриол, магний, тиазидные диуретики [7].
Антагонистом паратгормона является кальцитонин - гормон щитовидной железы, который участвует в регуляции фосфорно-кальциевого обмена, снижает синтез паратгормона. Синтез кальцитонина усиливается при увеличении содержания кальция в крови. Он используется в качестве лечебного средства при гиперкальциемии. Недостаток синтеза кальцитонина может быть причиной вторичного гиперпаратиреоза [5].
В работе большой группы гормонов надпочечников (глюкокортикоидов, минералокортикоидов, катехоламинов) важную роль играют почки (РААС), которые являются для этих гормонов органом-мишенью.
Альдостерон - минералокортикоидный гормон коры надпочечников, регулирующий обмен натрия, калия, хлора, а также фосфатов. Действует непосредственно на дистальные канальцы почек: стимулирует реабсорбцию натрия, экскрецию калия и клиренс фосфатов [1]. Повышение альдостерона в крови характерно для болезни Конна (первичный гиперальдостеронизм) и Баттера (вторичный гиперальдостеронизм). Болезнь Конна обусловлена злокачественной опухолью надпочечников с усилением синтеза альдостерона, что сопровождается никтурией, полиурией, дегидратацией, изостенурией, щелочной рН мочи, микропротеинурией, артериальной гипертензией и даже пиурией. Отмечается выраженная гипокалиемия (гипокалиемическая нефропатия), гипернатриемия, повышенное содержание калия, натрия и альдостерона в моче. При острой почечной недостаточности, ХПН повышение уровня альдостерона в крови сопровождается отеками. Синдром Баттера обусловлен врожденной частичной резистентностью сосудистой стенки к действию ангиотензина II, что сочетается с резким повышением в крови содержания альдостерона. Снижение артериального давления сочетается с гипоплазией почек и повышением синтеза ренина. Характерен гипокалиемический и гипохлоремический алкалоз, понижение давления крови в приносящих артериолах почек, гипоксия почек, гиперплазия юкстагломерулярного аппарата. Усиление синтеза ренина и ангиотензина II приводит к повышению синтеза альдостерона, в силу чего содержание последнего в крови резко увеличивается. В отличие от синдрома Конна, отсутствует гипертензия из-за блокады действия ангиотензина II. Отмечаются значительные потери натрия и калия с мочой. В моче много альдостерона. Для гистологической картины почек при гиперальдостеронизме характерна вакуолизация клеток канальцев, дистрофия и некротические изменения с отложением в канальцах кальция. Существует также рецепторный гипоальдостеронизм (солевой диабет) с массивной потерей натрия в детском возрасте, обусловленный врожденной нечувствительностью канальцев к альдостерону, -псевдогипоальдостеронизм. Болезнь проявляется в первые дни после рождения плохим аппетитом, рвотой, снижением оссификации скелета (гиперфосфатурией), задержкой роста, отставанием в физическом и умственном развитии, гиповолемией, коллапсом, тахикардией, летальным исходом от дегидратации. Резко повышается экскреция альдостерона с мочой, снижается уровень натрия в крови и повышается содержание калия. С лечебной целью необходимо введение натрия. С возрастом этот дефект исчезает - восстанавливается чувствительность дистальных канальцев к альдостерону. Кроме того, существует еще один синдром изменения чувствительности дистальных канальцев - повышение реабсорбции натрия (синдром Лидла). Эта дистальная тубулопатия характеризуется резким повышением чувствительности натриевых каналов клеток эпителия собирательных трубочек, что сопровождается значительным усилением реабсорбции натрия и воды с одновременным подавлением секреции ренина и альдостерона и значительной потерей калия с мочой. В клинической картине преобладает тяжелая объемная артериальная гипертензия, задержка психоэмоционального развития, мышечная гипотония, повышенная утомляемость, гипокалиемия, метаболический алкалоз. При лечении необходимо ограничение потребления натрия, назначение калийсберегающих диуретиков (амилорида, триамтерена). Отсутствие адекватной терапии может привести к ХПН, вплоть до терминальной стадии [5].
Глюкокортикостероиды - гормоны, синтезируемые корой надпочечников. Повышение уровня глюкокортикостероидов в крови отмечается при стрессе под стимулирующим влиянием адренокортикотропного гормона (АКТГ), а также при опухолях надпочечников. Повышение содержания глюкокортикостероидов (кортизола и др.) сопровождается усилением плазмотока и УГФ в почках; при высоких концентрациях глюкокортикостероиды усиливают реабсорбцию натрия в канальцах, снижают реабсорбцию калия, обусловливают развитие внеклеточного алкалоза и дегидратации клеток [1, 2]. Повышенное выделение воды происходит независимо от натрия - через повышение клиренса свободной воды с понижением проницаемости дистальных канальцев для воды. Кроме того, глюкокортикостероиды участвуют в регуляции суточного ритма (циркадной периодичности) выведения натрия, калия и воды, экскреция которых в норме днем выше (под действием высокого содержания глюкокортикостероидов в крови), в то время как при надпочечниковой недостаточности большая часть воды выделяется ночью (никтурия). Естественным примером гиперглюкокортицизма (независимого от АКТГ) является синдром Иценко - Кушинга при опухоли надпочечников с повышением содержания кортизола в крови, 11- и 17-оксикортикостероидов в моче. Отсутствует реакция на АКТГ. Поражение почек обычно протекает бессимптомно, за исключением тяжелых случаев гиперглюкокортицизма. В последнем случае лабораторными методами выявляется протеинурия (1-3%), единичные эритроциты, гиалиновые цилиндры. Увеличивается выделение воды, отмечается полиурия, никтурия, склонность к гипоизостенурии, снижается реабсорбция мочевины и увеличивается ее экскреция. Характерно снижение почечного плазмотока и УГФ, в крови снижается содержание калия и натрия и повышается их выделение с мочой, развивается гипокалиемическая нефропатия (внеклеточный алкалоз и дегидратация). При длительном течении болезни без лечения появляется риск летального исхода. Клинически наблюдается большая прибавка веса и специфическое его отложение (живот, плечи, лицо), синяки на коже, плохое заживление ран, стрии, потеря мышечной массы, слабость, остеопороз, кифоз, переломы, депрессия, интолерантность к глюкозе (предиабет), гипертензия, образование тромбов [13]. При опухоли гипофиза в крови повышается уровень АКТГ, в отличие от опухоли надпочечников, когда характерно его снижение. При морфологическом исследовании выявляется увеличение почек, утолщение коркового слоя, иногда очаги некроза, утолщение капиллярных мембран в клубочках (внутренний гидронефроз), склероз, зернистая деструкция проксимальных канальцев с уменьшением их просвета. В дистальных канальцах зернистые цилиндры закупоривают просвет. Склероз, ишемия артериол и интерстиция, гиперплазия юкстагломерулярного аппарата. Лечение синдрома Иценко - Кушинга является симптоматическим до и после хирургического удаления опухоли. Клиническая картина гиперглюкокортицизма в результате длительного интенсивного лечения глюкокортикоидами напоминает синдром Иценко - Кушинга и постепенно проходит после отмены препарата. Примером гипоглюкокортицизма является болезнь Аддисона - хроническая недостаточность функции надпочечников (дистрофия) [1, 2]. Болезнь характеризуется адинамией, низким артериальным давлением, гиперпигментацией кожи и слизистых, потерей солей, нарушением углеводного обмена (плоская сахарная кривая), снижением иммунитета, психическим возбуждением, снижением аппетита, болями в спине, мышечной гипотонией. В крови отмечается снижение уровня натрия и хлора, а также повышение содержания калия. В моче повышается уровень натрия, хлора и кортикостероидов. Выявляется полиурия, дистрофия канальцевого эпителия. Нет ответа на введение АКТГ.
Адреналин - основной катаболический гормон мозгового слоя надпочечников. Его синтез резко повышается при стрессе, он стимулирует активность симпатической нервной системы (действие направлено на ликвидацию угрозы, а норадреналин - медиатор бодрствования). Адреналин действует на альфа- и бета-рецепторы, способствует усилению синтеза ренина, активирует гипоталамо-гипофизарную систему, повышает артериальное давление, синтез АКТГ и кортизола, сужает сосуды брюшной полости, скелетных и гладких мышц. Кроме того, адреналин обусловливает развитие тахикардии вплоть до аритмии, расслабляет гладкую мускулатуру бронхов, повышает содержание глюкозы в крови (антиинсулиновый эффект) [2]. Характерна интенсификация процессов перекисного окисления в почках и других органах, катаболизма белков, липидов, глюкозы. Помимо устранения бронхоспазма, адреналин оказывает противоаллергическое и противовоспалительное действие (снижает уровень гистамина, серотонина, калликреина). В почках адреналин ослабляет почечный плазмоток и УГФ, вызывает спазм почечных вен, повышает реабсорбцию натрия, калия и воды (снижает экскрецию калия и натрия), может вызывать олигурию. В моче увеличивается содержание средних молекул (катаболизм белков), перекисей липидов, метаболитов коллагена, снижается антиоксидантная защита мочи. Развиваются дистрофические изменения в эпителии канальцев. Терапевтический эффект при хроническом стрессе оказывают гипотензивные средства, антиоксиданты, мембраностабилизаторы.
Почка реагирует на действие различных гормонов (гипрофиза и гипоталамуса) - стимуляторов синтеза целого ряда периферических гормонов эндокринных желез.
АКТГ стимулирует функцию коры надпочечников. Гормон синтезируется в передней доле гипофиза, и его синтез регулируется гипоталамусом. АКТГ усиливает продукцию кортикостероидов (кортизола) при стрессе. Повышение секреции АКТГ сопровождается симптомами, характерными для синдрома Иценко - Кушинга (гиперглюкокортицизма). Снижение синтеза АКТГ нарушает гормональную регуляцию функций почек [1, 2].
АДГ - пептидный гормон, который синтезируется в передней доле гипоталамуса. Основная функция АДГ - сохранение воды в организме и сужение кровеносных сосудов, в связи с чем его еще называют вазопрессином. От содержания АДГ в плазме зависит транспорт воды в почках: гормон активирует гиалуронидазу, разрыхляющую гиалуроновые «пробки» в межклеточных пространствах, и увеличивает поры в клеточных мембранах эпителия дистальных канальцев и собирательных трубочек (которые непроницаемы для воды в отсутствие АДГ), что сопровождается увеличением всасывания воды. АДГ снижает объем суточной мочи и повышает ее концентрацию [5]. В норме при снижении диуреза активность гиалуронидазы ослабевает, гиалуроновая кислота уплотняется и диурез увеличивается. Во всех случаях транспорт воды является пассивным процессом: он сочетается с транспортом натрия. Кроме того, АДГ оказывает кровеостанавливающее действие за счет спазма мелких сосудов и повышает содержание фактора VIII (фактора Виллебранда) свертывающей системы крови и уровень активатора плазминогена, усиливает агрегацию тромбоцитов, а также чувствительность сосудистой стенки к действию катехоламинов (констрикторный эффект). АДГ повышает тонус гладкой мускулатуры внутренних органов, особенно желудочно-кишечного тракта и сосудов, с повышением периферического сопротивления и артериального давления. При отсутствии секреции АДГ развивается несахарное («центральное») мочеизнурение, несахарный диабет. Отмечается снижение физического развития у детей, дегидратация, полиурия, полидипсия, гипостенурия, повышение осмолярности крови. Несахарное мочеизнурение нефрогенного генеза обусловлено отсутствием реакции почек на АДГ (нет рецепторов в дистальных канальцах), что приводит к снижению обратного всасывания воды. В основном эта патология наблюдается у детей мужского пола (аутосомно-доминантное наследование, сцепленное с полом через Х-хромосому). Болезнь проявляется с рождения, характерна полиурия, полидипсия, снижение УГФ, повышение температуры, рвота, снижение массы тела, задержка психического и физического развития. В тяжелых случаях появляются обезвоживание, альбуминурия, аминоацидурия, азотемия, гипернатриемия и гиперхлоремия. С лечебной целью ограничивают натрий, применяют хлортиазид (снижение клиренса воды на 20-70%), повышают потребление воды. «Несостоятельность» АДГ в настоящее время выявлена у больных COVID-19 (с индийским вариантом «дельта»): резкое обезвоживание, выраженная гипонатриемия и гипокалиемия, рвота, клонико-тонические судороги, дезориентация, полиурия с повышением осмолярности мочи. Эти изменения в первые дни болезни преобладали над легочными и сердечно-сосудистыми симптомами и поддавались коррекции путем внутривенного введения жидкости или солевого раствора [14, 15]. Секреция АДГ повышается при повышении осмолярности крови, снижении объема внеклеточной жидкости, шоке, травмах, кровопускании, болях, психозах и под действием некоторых лекарств [12]. АДГ встраивается в мембрану клеток эпителия собирательных трубок (аквапорин), повышает проницаемость их для воды и увеличивает ее реабсорбцию вслед за реабсорбцией натрия. При повышении АДГ в крови увеличивается объем циркулирующей крови (гиперволемия, гипонатриемия и гипоосмия). Применяются мочегонные средства.
Соматотропный гормон (гормон роста) синтезируется в передней доле гипофиза, усиливает эпифизарный рост хряща и отложение кальция в костях, повышает содержание белков в тканях, обусловливает гипергликемию, глюкозурию, иммобилизацию жиров [12]. Обладает ренотрофическим действием (рост почек), стимулирует почечный плазмоток и почечную фильтрацию, снижает выделение натрия, калия и фосфатов с мочой, может значительно снизить диурез. В связи с этим увеличивается объем внеклеточной жидкости, улучшается функция почек. Повышение уровня соматотропного гормона в крови не оказывает выраженного действия на функции почек, лишь увеличивает их объем, также отмечается утолщение базальных мембран, гиалиноз междольковых артерий, нефросклероз. При анализе мочи выявляется альбуминурия, единичные эритроциты и лейкоциты, гиалиновые цилиндры. В тяжелых случаях (акромегалия, высокий рост) выявляется снижение концентрации мочевины, нефросклероз. При снижении синтеза соматотропного гормона отмечается задержка роста, карликовость, снижение почечного плазмотока, клубочковой фильтрации и клиренса мочевины. Введение соматотропного гормона с лечебной целью оказывает терапевтический эффект [2, 3].
На функции щитовидной железы влияет тиреотропный гормон, который синтезируется в гипофизе, стимулирует продукцию тиреоидных гормонов. Тироксин - главный циркулирующий в крови гормон, из которого синтезируются трийодтиронин и тетрайодтиронин. Тиреоидные гормоны регулируют основной обмен организма, выполняя многочисленные функции: стимулируют рост и развитие, дифференцирование тканей, повышают потребность в кислороде, повышают частоту сердечных сокращений, уровень бодрствования, психическую и двигательную активность, температуру тела, уровень глюкозы в крови и гликолиз, тормозят синтез гликогена в печени и скелетных мышцах, усиливают липолиз и тормозят образование и отложение жира в тканях, повышают чувствительность к катехоламинам, понижают гидрофильность тканей и канальцевую реабсорбцию воды [1]. В малых дозах оказывают анаболический эффект и наоборот. Тиронин улучшает почечные функции, почечный плазмоток, клубочковую фильтрацию и секрецию в канальцах. У больных гипертиреозом расширяются приносящие и выносящие сосуды клубочков, увеличивается минутный объем сердца, отмечается гиперкальциемия и снижение уровня холестерина в крови. У больных микседемой увеличивается содержание холестерина в крови, снижается почечный плазмоток, клубочковая фильтрация, диурез при уменьшении минутного объема сердца [4, 16, 17].
Выявлено влияние дисфункции половых гормонов на работу и структуру почек. Эстрогены - стероидные половые гормоны, синтезируются в яичниках и надпочечниках, регулируют менструальный цикл, половое и физическое созревание. Действие половых гормонов на почки незначительно: снижается выведение натрия, хлора, фосфатов, не отмечено действия на клубочковую фильтрацию. Однако установлено, что у девочек с пиелонефритом в пре-пубертатном и пубертатном возрасте выявляется задержка появления вторичных половых признаков в 3 раза чаще, чем в норме, а также в 5 раз чаще при позднем менархе. У таких девочек с пиелонефритом отмечаются метаболические, нейровегетативные нарушения, снижение физического развития, олиго- или аменорея [2, 5].
Нарушение функции инсулина - регулятора обмена сахаров - оказывает патологическое действие на работу почек. Инсулин - полипептидный гормон, который синтезируется в бета-клетках островков Лангерганса в поджелудочной железе. Он обеспечивает нормальное функционирование клеток, питание организма глюкозой, регулирует усвоение глюкозы, аминокислот, жирных кислот в клетках, подавляет разрушение глюкозы, катаболизм белков и жиров. Кроме того, инсулин стимулирует синтез коллагена и костного матрикса, функционирование хрящей, необходим для минерализации скелета, дифференцировки функций остеобластов. Снижение синтеза инсулина нарушает обмен глюкозы и другие функции гормона, обусловливает развитие сахарного диабета [1, 2, 12]. В возникновении сахарного диабета играют роль наследственные факторы (I тип), возраст (II тип), инсулинорезистентность при метаболическом синдроме, нарушения питания (ожирение) [18-21]. При сахарном диабете нередко возникает поражение почек в связи со: 1) специфическими сосудисто-дегенеративными изменениями в клубочковых капиллярах (диабетический интеркапиллярный гломерулосклероз, гиалиноз; 2) атеросклеротическими изменениями в артериолах и мелких сосудах (артерио- и артериолонефросклероз); 3) воспалительными изменениями в интерстициальной ткани (пиелонефрит, некротический папиллит). Частота диабетической нефропатии составляет 10-70% (в 2 раза чаще у женщин, чем у мужчин). Выраженность патологии зависит от длительности течения сахарного диабета (13-14 лет), тяжести течения болезни, регулярности лечения (диета, медикаменты). Большую патогенетическую роль играют метаболические нарушения и депонирование продуктов нарушенного обмена (холестерин, бета-липопротеиды, триглицериды перекиси липидов, гликированный гемоглобин и другие белки, сиаловые кислоты, мукополисахариды, мукопротеиды). Такие продукты превращаются в гиалиноподобное вещество, накапливаются в капиллярах, нарушая микроциркуляцию крови. Морфологическая картина диабетической нефропатии неспецифична: узелковые изменения, диффузные экссудативные признаки поражения капилляров клубочков, гиалинизация базальных мембран капилляров, фибриноидные образования на периферии клубочков (полулуния). Изменения в канальцах менее выражены: гиалинизация мелких сосудов, интерстициальный фиброз или склероз. При электронной микроскопии выявляется утолщение базальных мембран клубочков, деградация подоцитов. Клиническая картина диабетической нефропатии не всегда выражена и недостаточно специфична. В тяжелых случаях иногда отмечают генерализованные отеки (нефрогенного, кардиогенного типа), массивную протеинурию (от 9 до 10-30 г/сут), гипо-изостенурию на фоне полиурии, гипертонию, в поздние сроки развивается ХПН. Протеинурия - наиболее ранний и сравнительно постоянный признак. Тяжелое течение диабетической нефропатии чаще наблюдается при ювенильной форме с признаками нефротического синдрома. Отеки трудно поддаются лечению диуретиками. Характерна ретинальная макулярная дегенерация (слепота). В крови отмечается гипоальбуминемия, повышение холестерина, липидов, глюкозурия, гипер-фосфатурия, протеинурия, полиурия, гипостенурия, гиалиновые цилиндры, редко выявляются эритроциты и лейкоциты. Лечение диабетической нефропатии неспецифическое (лечение сахарного диабета). Профилактика сводится к активному лечению любой инфекции мочевых путей, исключению любых манипуляций на мочевом пузыре, обеспечению двигательной активности больных, антибиотикотерапии, диеты без углеводов, жира, холестерина, регулярному лечению сахарного диабета [1, 2, 12].
Заключение
Болезни почек и патология эндокринной системы взаимосвязаны в силу того, что многочисленные функции почек регулируются гормонами, а сами почки являются эндокринным органом. Это имеет особое значение в детском возрасте, когда продолжается созревание функций почек и различных эндокринных органов, их рост, дифференцировка функций почек, совершенствование регуляции водно-солевого обмена, циркадной периодичности функций почек. На последнее обстоятельство неоднократно указывал акад. РАМН Ю.Е. Вельтищев, который в течение всей своей научной деятельности изучал возрастные особенности гормональных функций у детей, физиологию и патофизиологию гормональной регуляции обменных процессов и причастность их нарушений к развитию различных заболеваний. Авторы считают своевременным обратить внимание педиатров на проблему нефропатий при эндокринопатиях.
Литература
1. Дедов И.И., Мельниченко Г.А., Фадеев В.В. Эндокринология. М. : ГЭОТАР-Медиа, 2014. 432 с.
2. Дедов И.И., Петеркова В.А. Справочник детского эндокринолога. М. : Литерра, 2020. 496 с.
3. Федеральные клинические рекомендации по клинике, диагностике, дифференциальной диагностике и методам лечения акромегалии / И.И. Дедов, Н.Н. Молитвословова, Л.Я. Рожинская, Г.А. Мельниченко // Проблемы эндокринологии. 2013. № 6. С. 4-17.
4. Гарднер Д., Шобек Д. Базисная и клиническая эндокринология. М. : БИНОМ, 2018. 464 с.
5. Юрьева Э.А., Длин В.В. Руководство по клинико-лабораторной диагностике болезней почек у детей. М. : Оверлей, 2020. 244 с.
6. Autpsomal-dominant tubulointerstitial kidney disease: diagnosis, classification and management A KDIGO consensus report / K.U. Eckardt [et al.] // Kidney International. 2015. Vol. 88, No. 4. P. 676-683.
7. Moe S.M. Disorders involving calcium, phosphorus and magnesium // Primary Care. 2008. Vol. 35, No. 2. P. 215-237.
8. Hou Y.-C., Lu C.-L., Lu K.C. Mineral bone disordes in chronic kidney disease // Nephrology. 2018. Vol. 23, Suppl. 4. P. 88-94.
9. Dusso A.S., Brown A.J., Slatopolsky E. Vitamin D // American Journal of Physiology. Renal Physiology. 2005. Vol. 289. P. 8-28.
10. Добронравов В.А. Cовременный взгляд на патофизиологию вторичного гиперпаратиреоза: роль фактора роста фибробластов 23 и Klotho // Нефрология. 2011. Т. 15, № 4. С. 12-20.
11. EGFR activation increases parathyroid hypetrplasia and calcitriol resistance in kidney disease / M.V. Arsidiacono [et al.] // Journal of the American Society of Nephrology. 2008. Vol. 19, No. 2. P. 310-320.
12. Дедов И.И., Кураева Т.Л., Петеркова В.А. Сахарный диабет у детей и подростков. М. : ГЭОТАР-Медиа, 2013. 271 c.
13. Болезнь Иценко - Кушинга: клиника, диагностика, дифференциальная диагностика, методы лечения / Г.А. Мельниченко [и др.] // Проблемы эндокринологии. 2015. Т. 61, № 2. С. 55-77.
14. Пандемия covid-19 и эндокринопатии / Н.Г. Мокрышева [и др.] // Проблемы эндокринологии. 2020. Т. 66, № 1. С. 7-13.
15. Covid-19-associated SIADH: a clue in the times of pandemic! / Z. Yousaf, S.D. Al-Shokri, J. Soub, M.F.H. Mohamed // American Journal of Physiology-Endocrinology and Metabolism. 2020. Vol. 318, No. 6. P. E882-E885.
16. Sindrome of inappropriate antidiuretic hormone as the initial presentation of Covid-19: a novel case report / K.S. Ho [et al.] // Nephrologia. 2021. Vol. 41, No. 2. P. 210-226.
17. Larsen P.R., Zavacki A.M. The role of the iodothyronine deiodinases in the physiology and pathophysiology of the thyroid hormone action // European Thyroid Journal. 2012. Vol. 1, No. 4. P. 232242.
18. Калинченко С.Ю., Тюзиков И.А., Ворслов Л.О. Ожирение, инсулинорезистентность и репродуктивное здоровье мужчин: патогенетические взаимодействия и патогенетическая фaрмакология // Эффективная фармакология. 2015. № 27. С. 66-79.
19. Алгоритмы специализированной медицинской помощи больным сахарным диабетом / под ред. И.И. Дедова, М.В. Шестаковой, А.Ю. Майорова // Сахарный диабет. Спецвыпуск 1. 2019. Т. 22. С. 1-44.
20. Бутрова С.А. От эпидемии ожирения к эпидемии сахарного диабета // Международный эндокринологический журнал. 2013. Т. 2, № 50. С. 45-50.
21. Owen J.G., Reisin E. Anti-hypertensive drug treatment of patients with and the metabolic syndrome and obesity: a review of evidence, meta-analysis, post hoc and guidelines publications // Current Hypertension Reports. 2015. Vol. 17, No. 6. P. 46-52.
Комментарии
ПРАКТИКА ПЕДИАТРА

