Роль и место безглютеновой диеты в питании детей
СтатьиЮ.А. Дмитриева1, канд. мед. наук, И.Н. Захарова1, д-р мед. наук, профессор, Е.Р. Радченко2, А.С. Воробьева2, канд. мед. наук, Е.В. Скоробогатова2, канд. мед. наук, Ж.В. Полякова2, Т.И. Бочарова2, О.В. Шулешко2
1 ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России, г. Москва
2 ГБУЗ «Детская городская клиническая больница им. З.А. Башляевой Департамента здравоохранения г. Москвы»
Ключевые слова: глютен, пшеница, дети, целиакия, аллергия, чувствительность к глютену, аутизм, шизофрения, безглютеновая диета, скрытый глютен
Keywords: gluten, wheat, children, celiac disease, allergies, gluten sensitivity, autism, schizophrenia, gluten free diet, hidden gluten
Резюме. Глютен представляет собой важную белковую фракцию пшеницы, ржи и ячменя. Структурные особенности данного белка, его высокий аллергенный и иммуногенный потенциал определяют широкий спектр патологических состояний, патогенез которых связан с употреблением глютенсодержащих злаков. Современная классификация глютен-ассоциированных заболеваний, основанная на их патогенезе, включает целиакию, аллергию на пшеницу и не ассоциированную с целиакией непереносимость глютена. Единственным способом лечения указанных состояний является строгое соблюдение безглютеновой диеты, обеспечивающей контроль над клиническими проявлениями и профилактику потенциальных осложнений. В статье рассмотрена действующая классификация глютен-ассоциированных заболеваний, определены подходы к их диагностике и описан спектр клинических проявлений. Обсуждаются структурные особенности глютена и современные требования к соблюдению безглютеновой диеты.
Summary. Gluten is an important protein fraction in wheat, rye and barley. The structural features of this protein, its high allergenic and immunogenic potential determine a wide range of pathological conditions, the pathogenesis of which is associated with the use of gluten-containing cereals. The current classification of gluten-associated diseases, based on their pathogenesis, includes celiac disease, wheat allergy, and non-celiac gluten intolerance. The only treatment for these conditions is strict adherence to a gluten-free diet, which ensures control over clinical manifestations and prevention of potential complications. The article discusses the current classification of gluten-associated diseases, identifies approaches to their diagnosis and describes the spectrum of clinical manifestations. The structural features of gluten and current requirements for adherence to a gluten-free diet are discussed.
Глютен представляет собой важную белковую фракцию пшеницы, ржи и ячменя, составляя до 80% массы белков эндосперма указанных злаков. Данная фракция в различных злаках имеет собственное название (глиадины пшеницы, секалины ржи, хордеины ячменя), при этом в медицинской литературе указанные белки объединены общим названием «глютен» с учетом филогенетического (рис. 1) и структурного сходства, а также аналогичного воздействия на организм человека [1].
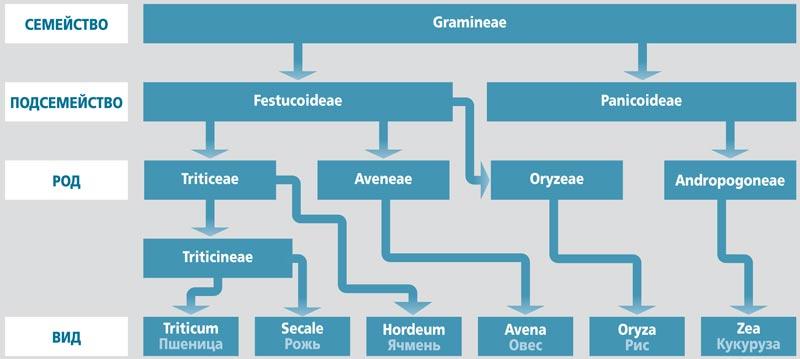 Рис. 1. Фрагмент филогенетической классификации злаковых
Рис. 1. Фрагмент филогенетической классификации злаковых
Глиадины пшеницы – отдельные полипептидные цепи с молекулярным весом от 33 до 75 кДа, распределяющиеся при электрофорезе на 4 основные фракции: α, β, γ и ω. Благодаря высокому содержанию пролина данные полипептиды устойчивы к воздействию желудочных, панкреатических и интестинальных протеиназ, что определяет сохранение их высокого иммуногенного потенциала при прохождении через желудочно-кишечный тракт человека [2]. В структуре глиадина на настоящий момент выделено не менее 50 эпитопов, стимулирующих активность Т-лимфоцитов слизистой оболочки желудочно-кишечного тракта, при этом основным инициатором воспалительного ответа признан 33-мерный пептид LQLQPFPQPQLPYPQPQLPYPQPQL PYPQPQPH, выделенный в составе α2-фракции рекомбинантного глиадина L. Shan и соавт. в 2002 г. [3].
Наряду с высокой устойчивостью к воздействию энзимов, структура глютена уникальна еще и тем, что содержит пептидные фрагменты, облегчающие его проникновение через эпителиальный барьер кишечника (рис. 2).
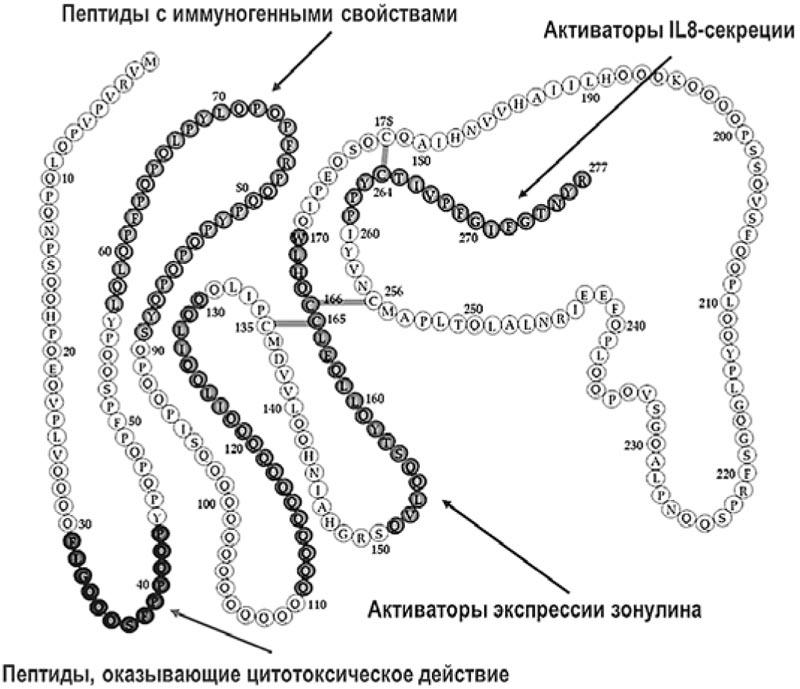 Рис. 2. Молекулярная структура глютена (адаптировано из [4])
Рис. 2. Молекулярная структура глютена (адаптировано из [4])
В регуляции проницаемости кишечника важную роль играет зонулин – белок группы гаптоглобинов, вырабатываемый в печени и внутреннем эпителии и являющийся главным модулятором тесных белковых соединений в межклеточном пространстве. В настоящее время доказано, что отдельные эпитопы глютена являются активаторами экспрессии зонулина, которая нарушает тесные связи между энтероцитами. Указанные изменения приводят к избыточному проникновению различных антигенов, включая сам глютен, во внутреннюю среду организма и, как следствие, к активации иммунной системы и продукции комплекса провоспалительных цитокинов [4].
Структурные элементы глиадина способны не только активировать T-клеточный иммунный ответ, но и провоцировать развитие IgE-опосредованных аллергических реакций, что определяет высокий аллергенный потенциал пшеницы, включенной в «большую восьмерку» пищевых аллергенов. Клинические исследования продемонстрировали, что у 60% пациентов, имеющих аллергические проявления при употреблении пшеницы, вырабатываются специфические IgE к α-, β-глиадинам и низкомолекулярным субъединицам пшеничного белка, у 55% обследованных – к γ-глиадину, у 48% – к ω-глиадинам, у 26% – к высокомолекулярным субъединицам пшеничного белка [5].
Указанные структурные особенности глютена, высокий аллергенный и иммуногенный потенциал глютенсодержащих злаков определяют широкий спектр состояний, объединенных в группу глютен-ассоциированных. В феврале 2011 г. результатом рабочей встречи европейских экспертов стала классификация глютен-ассоциированных заболеваний, основанная на их патогенезе (рис. 3) [2].
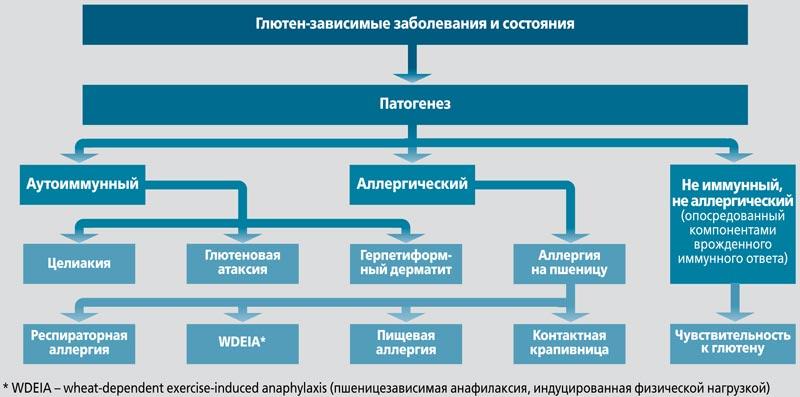 Рис. 3. Спектр глютен-ассоциированных заболеваний (адаптировано из [2])
Рис. 3. Спектр глютен-ассоциированных заболеваний (адаптировано из [2])
Целиакия представляет собой иммуноопосредованное системное заболевание, которое возникает в ответ на употребление глютена или проламинов генетически предрасположенными индивидуумами и характеризуется наличием комбинации глютен-зависимых клинических проявлений, выработкой специфических антител (к тканевой трансглутаминазе, эндомизию, деамидированным пептидам глиадина), наличием гаплотипов HLA-DQ2 или HLA-DQ8 и энтеропатии [6].
Скрининговые эпидемиологические исследования, проведенные за последние 35 лет с использованием высокочувствительных серологических методов, свидетельствуют о том, что частота целиакии в странах Европы и Северной Америки достигает 1% [6]. Согласно выводам систематического обзора, опубликованного в 2018 г., средняя частота выявления специфичных для целиакии антител (к тканевой трансглутаминазе и эндомизию) в мире составляет 1,4%, при этом у 0,7% населения мира заболевание подтверждено гистологическими методами. В таблице представлена распространенность целиакии в разных регионах [7].
Частота выявления специфических антител и гистологически подтвержденной целиакии в мире [7]
| Регион | Число серопозитивных лиц,% | Частота гистологически подтвержденной целиакии,% |
| Африка | 1,1 | 0,5 |
| Азия | 1,8 | 0,6 |
| Австралия | 1,4 | 0,8 |
| Европа (включая европейскую часть России) | 1,3 | 0,8 |
| Северная Америка | 1,4 | 0,5 |
| Южная Америка | 1,3 | 0,4 |
Употребление в пищу глютенсодержащих продуктов является необходимым, но не достаточным условием развития целиакии. Целиакия – генетически детерминированное заболевание, в патогенезе которого важную роль играют гены, входящие в главный комплекс гистосовместимости человека, в частности аллели DQ2 и DQ8 [8]. Антигены (молекулы), кодируемые HLA-DQ2/DQ8, экспрессируются на поверхности антигенпрезентирующих клеток и представляют собой гетеродимеры – белки, состоящие из 2 цепей (α и β) [9]. Роль данных молекул в патогенезе целиакии обусловлена их участием в процессе презентации пептидов глиадина CD4-лимфоцитам. Активированные CD4-лимфоциты продуцируют провоспалительные цитокины (интерферон у, интерлейкины 10, 15, 21), которые повреждают энтероциты, а также стимулируют продукцию В-лимфоцитами антител к глиадину, тканевой трансглутаминазе и эндомизию тонкой кишки, которые попадают в системный кровоток и могут быть выявлены при проведении серологического исследования (рис. 4) [10].
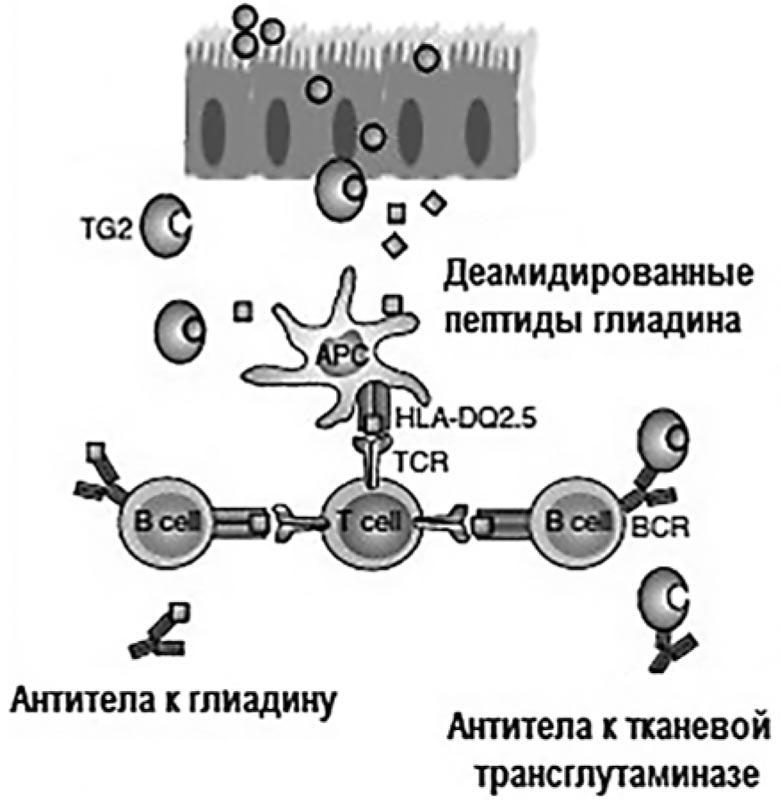 Рис. 4. Патогенез целиакии (адаптировано из [10])
Рис. 4. Патогенез целиакии (адаптировано из [10])
Провоспалительные цитокины с током крови могут распространяться далеко за пределы кишечника, а образующиеся иммунные комплексы могут быть выявлены как в слизистой оболочке тонкой кишки, так и в других органах и тканях, включая печень, головной мозг и периферические нервные волокна, лимфатические узлы, почки, кожу, что в совокупности обусловливает системность клинических проявлений целиакии [1]. В настоящее время преобладают малосимптомные и скрытые формы заболевания, что существенно затрудняет постановку диагноза. Поздняя диагностика и недостаточный комплаенс при соблюдении безглютеновой диеты значительно повышают риск развития серьезных осложнений, таких как бесплодие, остеопороз, неврологические и онкологические заболевания (в особенности Т-клеточная лимфома тонкой кишки) [1, 11, 12].
Комплексный подход к диагностике целиакии определен российскими и международными протоколами и включает оценку уровня высокочувствительных серологических маркеров заболевания (антител к тканевой трансглутаминазе и эндомизию), проведение эндоскопического исследования с биопсией слизистой оболочки двенадцатиперстной кишки и последующим детальным гистологическим исследованием, а также выполнение генетического тестирования пациентов из группы риска развития заболевания с целью качественного динамического наблюдения за носителями аллелей HLA-DQ2/DQ8 [6, 13-16].
Герпетиформный дерматит представляет собой хроническое заболевание кожи, характеризующееся сухостью кожных покровов и наличием везикуло-папулезных высыпаний преимущественно на локтях и коленях, сопровождающихся выраженным зудом. Распространенность заболевания составляет около 1 случая на 10 тыс. человек, согласно эпидемиологическим исследованиям, проведенным в Великобритании и США [17]. Как при герпетиформном дерматите, так и при целиакии пациенты являются носителями аллелей HLA-DQ2 (90%) и HLA-DQ8 (5%) [17]. В соответствии с современными представлениями герпетиформный дерматит перестал расцениваться как ассоциированное с целиакией заболевание и включен в спектр ее возможных внекишечных проявлений. При гистологическом исследовании наблюдаются депозиты IgA в сосочковом слое дермы, а в биоптатах слизистой оболочки тонкой кишки часто выявляются признаки атрофической энтеропатии даже при отсутствии у пациентов каких-либо гастроинтестинальных симптомов. При серологическом исследовании обнаруживаются специфические для целиакии аутоантитела, при этом антитела к тканевой трансглутаминазе преимущественно ориентированы на эпидермальную фракцию фермента (TG3) [18]. Назначение больным безглютеновой диеты приводит к исчезновению кожных проявлений и нормализации структуры слизистой оболочки кишечника [2].
Глютеновая атаксия изначально рассматривалась как идиопатическая атаксия с положительными серологическими маркерами сенсибилизации к глютену. Аналогично целиакии данное заболевание характеризовалось аутоиммунным повреждением структур мозжечка с развитием атаксии. При обследовании 800 пациентов с прогрессирующей идиопатической атаксией на протяжении 15 лет было установлено, что у 148 (23%) из 635 больных вырабатывались антитела к глиадину [2]. Патогенез данного состояния, вероятнее всего, связан с перекрестной реакцией антител к глиадину с антигенными эпитопами клеток Пуркинье. Депозиты антител к тканевой трансглутаминазе у пациентов выявляются вокруг сосудов головного мозга с максимальным отложением в мозжечке, структурах моста и продолговатого мозга. У данной категории больных преимущественно вырабатываются антитела к 6-й фракции тканевой трансглутаминазы, выявляемой в тканях центральной нервной системы [19, 20]. Эффективность безглютеновой диеты у пациентов с глютеновой атаксией зависит от длительности заболевания. Потеря клеток Пуркинье вследствие длительной аутоиммунной реакции, ассоциированной с употреблением глютена, является необратимой, однако в случае своевременной диагностики элиминация глютенсодержащих продуктов из рациона обеспечивает благоприятный прогноз заболевания и купирование неврологических проявлений [2].
Пшеница входит в «большую восьмерку» пищевых аллергенов. Пшеничный белок наряду с белками коровьего молока и белком куриного яйца выступает как один из трех основных триггеров аллергии у детей и взрослых. Аллергия на пшеницу может иметь классические симптомы, характерные для пищевых аллергий, а также проявляться в форме контактной крапивницы, астмы пекарей или в форме пшеницезависимой анафилаксии, индуцированной физической нагрузкой (wheat-dependent exercise-induced anaphylaxis). В патогенезе указанных состояний ведущую роль играют специфические IgE, вырабатываемые в ответ на употребление злака предрасположенными пациентами. В исследованиях, проведенных в странах Европы, установлено, что частота аллергии на пшеницу варьирует от 0,3 до 3,4%, при этом частота сенсибилизации к данному аллергену может достигать 13,9% [21-23].
Астма пекарей известна со времен Римской Империи. Состояние характеризуется развитием обструктивного синдрома или ринита в ответ на вдыхание муки. По результатам польского исследования, характерные для данного состояния респираторные симптомы отмечались у 4,2% сотрудников пекарен через 1 год работы и у 8,6% работников через 2 года [24]. Диагноз ставят на основании результатов кожных скарификационных тестов, повышения уровня специфических IgE к белкам пшеницы, ржи и ячменя, а также к α-амилазе. В настоящее время в исследованиях продемонстрировано, что одними из основных аллергенов среди белков пшеницы являются ингибиторы α-амилазы. В то же время данные исследований свидетельствуют о взаимодействии IgE сыворотки пациентов с другими белковыми фракциями, включая зародышевый агглютинин, пероксидазу и неспецифичные белки-переносчики липидов [25].
Пшеницезависимая анафилаксия, индуцированная физической нагрузкой, может проявляться широким спектром симптомов – от крапивницы до тяжелых форм аллергических реакций, включая анафилаксию. В качестве основных триггеров развития данной формы непереносимости глютена в настоящее время рассматриваются 7 эпитопов (QQIPQQQ, QQLPQQQ, QQFPQQQ, QQSPEQQ, QQSPQQQ, QQYPQQQ и PYPP) в структуре ω5-фракции глиадина [25].
Первичная диагностика аллергии на пшеницу включает проведение аллергологического исследования с определением уровня специфических IgE, а также выполнение кожных скарификационных проб. Прогностическая ценность положительного результата в данном случае не превышает 75%, особенно у взрослых пациентов, в связи с перекрестной реакцией с другими пыльцевыми аллергенами. В связи с этим в определенных случаях главным методом верификации диагноза аллергии на пшеницу является проведение провокационной пищевой пробы. Стоит отметить, что наличие в сыворотке специфических антител класса IgG к пшенице или глиадину не может рассматриваться в качестве специфического маркера заболевания [2].
К началу XXI в. стало очевидно, что перечень глютен-ассоциированных заболеваний включает и другие заболевания, кроме целиакии и аллергии на пшеницу. В клинической практике часто встречаются пациенты, у которых имеются глютензависимые симптомы, исчезающие при исключении глютенсодержащих продуктов из рациона, при этом на этапе диагностического поиска характерных серологических и гистологических маркеров целиакии и аллергии выявить не удается [26]. Данное обстоятельство стало основанием для включения в современную классификацию глютен-ассоциированных состояний непереносимости глютена, или не ассоциированной с целиакией чувствительности к глютену (non celiac gluten sensitivity). Это состояние, при котором у пациента наблюдаются глютензависимые симптомы, но аутоиммунные и аллергические механизмы их развития исключены (нормальный уровень антител к тканевой трансглутаминазе и эндомизию у пациентов с нормальным уровнем общего IgA, нормальное ворсинчатое строение слизистой оболочки двенадцатиперстной кишки). У некоторого числа пациентов в сыворотке может быть повышен уровень антител к глиадину, однако окончательная верификация диагноза основана на положительных результатах диетодиагностики и возвращении симптомов при проведении слепой провокационной пробы. Симптомы чувствительности к глютену напоминают таковые при целиакии, часто с более выраженными внекишечными проявлениями, включающими поведенческие нарушения, боли в костях, суставах и мышцах, снижение массы тела и хроническую усталость. Из 5896 пациентов, консультированных в Центре по изучению целиакии Университета штата Мэриленд с 2004 по 2010 г., у 347 (6%) была диагностирована чувствительность к глютену. Клинические проявления в данной группе пациентов включали боль в животе (68%), экзему и высыпания на коже (40%), головные боли (35%), ощущение «тумана в голове» (34%), усталость (33%), диарею (33%), депрессию (22%), анемию (20%), онемение ног, рук, пальцев (20%) и боль в суставах (11%). Безглютеновая диета в данной группе пациентов способствовала полному исчезновению симптомов и стабилизации состояния [2].
Патогенез не ассоциированной с целиакией чувствительности к глютену продолжает изучаться. Результаты современных исследований свидетельствуют о том, что употребление глютена данными пациентами может приводить к развитию патологической иммунной реакции в слизистой оболочке кишечника. Эта реакция отличается от специфического иммунного ответа, характерного для целиакии. Исследования D. Schuppan и соавт. указывают на то, что значительную роль в развитии системной иммунной реакции на фоне употребления глютена играют белки семейства ингибиторов амилазы и трипсина, являющиеся составной частью белковой фракции пшеницы. Данные белки характеризуются устойчивостью к воздействию протеолитических ферментов и способны связываться с Toll-подобными рецепторами на поверхности моноцитов, макрофагов и дендритных клеток в слизистой оболочке кишечника, активируя продукцию провоспалительных цитокинов, попадающих в системный кровоток и определяющих комплекс клинических проявлений чувствительности к глютену [27].
Безглютеновая диета все чаще обсуждается в настоящее время в качестве перспективного дополнения к стандартной терапии при аутизме. Интересно, что первые попытки назначения диеты больным аутизмом были обусловлены высокой частотой выявления у них различных расстройств со стороны желудочно-кишечного тракта [28]. Сопутствующие положительные изменения в поведении больных и улучшение коммуникативных способностей по субъективной оценке родителей определили дальнейший интерес к использованию диеты в качестве терапевтического мероприятия, в том числе у пациентов без сопутствующего поражения желудочно-кишечного тракта.
К сожалению, результаты современных клинических исследований применения безглютеновой диеты при аутизме довольно противоречивы. В систематический обзор, опубликованный в 2017 г. группой польских исследователей, были включены 6 рандомизированных контролируемых исследований (214 участников), в рамках которых проводилась оценка эффективности безглютеновой бесказеиновой диеты при аутизме у детей [29]. Результаты показали, что в целом диета с исключением глютена и казеина не оказывала достоверного влияния на характер симптомов при аутизме, оцениваемых по стандартным шкалам. Однако в одном исследовании диетотерапия была достоверно эффективна в отношении коммуникативных способностей детей, оцениваемых по шкале наблюдения для диагностики аутизма (Autism Diagnostic Observation Scale) и в отношении способности к социальному взаимодействию, оцениваемой по шкале Гиллиам (Gilliam Autism Rating Scale). Достоверные различия по аналогичным параметрам наблюдались еще в одном исследовании, использовавшем датскую оценочную шкалу. Подобные работы последних лет, целью которых была систематизация данных об эффективности диетотерапии при расстройствах аутистического спектра, также указывают на недостаточно убедительную доказательную базу и необходимость проведения дополнительных хорошо организованных клинических исследований. При этом авторы вовсе не отрицают возможную эффективность безглютеновой диеты, принимая во внимание субъективное мнение родителей пациентов и положительные результаты отдельных работ [30, 31].
Еще одним заболеванием, в терапии которого, возможно, будет применяться безглютеновая диета, является шизофрения. Интерес к роли глютена в патогенезе психиатрических расстройств возник в середине XX в., когда L. Bender впервые указал на ассоциацию целиакии и ювенильной шизофрении [32]. Несколькими годами позже F. Dohan представил собственную «злаковую» теорию шизофрении, основываясь на результатах эпидемиологического исследования по оценке риска развития шизофрении в зависимости от характера питания. Автор отметил, что во время Второй мировой войны в странах, испытывавших нехватку зерновых продуктов, частота госпитализаций по поводу шизофрении существенно снижалась [33]. Этот же исследователь впервые продемонстрировал эффективность безглютеновой бесказеиновой диеты в терапии пациентов [34]. Аналогичные данные были получены в работах M.M. Singh и S.R. Kay, которые показали, что нарушение безглютеновой бесказеиновой диеты больными шизофренией негативно влияло на эффективность медикаментозной терапии, в то время как возвращение к строгому соблюдению диеты вновь приводило к улучшению их состояния [35]. В 1984 г. в рамках крупного эпидемиологического исследования была проанализирована заболеваемость шизофренией взрослых жителей Тихоокеанских островов. На фоне традиционного для региона рациона питания с низким содержанием злаковых хроническая форма шизофрении была выявлена лишь у 2 из 65 тыс. обследованных. Последующее приобщение к западной диете, включающей продукты из пшеницы, в том числе пиво, способствовало росту заболеваемости шизофренией до уровня, соответствующего европейским показателям [36]. Несмотря на первичные обнадеживающие результаты, дальнейшие клинические исследования продемонстрировали довольно противоречивые результаты в отношении эффективности безглютеновой диеты при шизофрении, в том числе появились сообщения о том, что, вероятно, существует отдельная группа больных, для которых диетотерапия является эффективной [37]. Несмотря на необходимость дополнительных исследований, безглютеновая диета в настоящее время все же рассматривается как возможное эффективное дополнение к стандартной терапии шизофрении согласно современным рекомендациям [38].
В основе элиминационной диетотерапии представленных выше заболеваний лежит полное исключение из рациона питания продуктов, содержащих глютен или его следы. Принципиально важным является отказ от употребления не только тех продуктов, которые «явно» содержат глютен (хлебобулочные, кондитерские, макаронные изделия, пшеничная, манная, ячневая, перловая крупы, булгур, кускус, полба, спельта, тритикале, камут; мясные, рыбные и овощные полуфабрикаты в панировке, пельмени, вареники и т. п.), но и тех, которые содержат «скрытый» глютен в качестве пищевой добавки:
- вареные колбасы, сосиски, полуфабрикаты из измельченного мяса и рыбы;
- многие мясные, рыбные консервы, в особенности в томатном соусе;
- многие овощные и фруктовые консервы, в том числе томатные пасты, кетчупы, баклажанная и кабачковая икра;
- некоторые сорта мороженого, йогуртов, творожные сырки и пасты, мягкие и плавленые сыры;
- маргарины с глютенсодержащими стабилизаторами;
- некоторые виды уксусов и салатных соусов, майонезов;
- соевые соусы;
- многокомпонентные сухие приправы и пряности;
- концентрированные сухие супы, бульонные кубики, картофельное пюре быстрого приготовления;
- картофельные и кукурузные чипсы;
- замороженный картофель фри;
- некоторые виды чая, кофе- и какао-смеси для быстрого приготовления (быстрорастворимые);
- кукурузные хлопья с добавлением ячменного солода;
- имитации морепродуктов – «крабовые палочки», «крабовое мясо»;
- карамель, соевые и шоколадные конфеты с начинкой, восточные сладости, повидло промышленного производства.
Нетоксичными злаками при глютен-ассоциированных заболеваниях считаются рис, гречиха, кукуруза, пшено, амарант, киноа, монтина, чумиза, саго, сорго, тефф, при условии отсутствия загрязнения (контаминации) их глютеном в процессе сбора урожая, транспортировки, складирования и переработки. Безопасными являются мука и крахмалы, приготовленные из корнеплодов (картофеля, маниоки, тапиоки, батата), бобовых (фасоли, гороха, бобов, сои), различных орехов. Состав рациона больных зависит от возраста, тяжести состояния и периода заболевания и строится на основании общих принципов: углеводный компонент обеспечивают переносимые крупы, картофель, бобовые, овощи, фрукты, ягоды; белковый и жировой – мясо, яйца, рыба, молочные продукты, растительное и сливочное масло. Рекомендуется использование специализированных безглютеновых продуктов – заменителей хлебобулочных, макаронных и кондитерских изделий. В продуктах, маркированных как «безглютеновые» или «не содержащие глютена», примесь глютена не должна превышать 20 ppm (20 мг/кг готового продукта) [39].
Определенную сложность представляет формирование рациона у пациентов самого раннего возраста, с учетом частой ассоциации целиакии с пищевой аллергией и возможной поливалентной сенсибилизации к пищевым аллергенам. Требования к продуктам промышленного изготовления, рекомендуемым данной категории детей, чрезвычайно высоки и определяют качество и безопасность первичного сырья, современные технологии производства и гарантированное отсутствие глютена. На российском рынке детского питания особого внимания заслуживает продукция компании HiPP, которая стала первым производителем органического детского питания, успешно прошедшим сертификацию в соответствии с новым российским законом об органической продукции. Компания HiPP имеет более чем полувековой опыт производства органического питания, основанный на отказе от использования минеральных удобрений и пестицидов, антибиотиков и продуктов генной инженерии. Высокое качество первичного сырья (злаков, овощей, фруктов) достигается за счет его культивирования на высококачественных почвах с учетом естественных механизмов обновления. С продуктами компании HiPP родители могут быть уверены в научно обоснованной пищевой ценности, составе, соответствующем возрастным потребностям ребенка, и строго контролируемом органическом качестве. В линейке HiPP представлены злаковые продукты для первого прикорма ребенка – безмолочные гречневая, рисовая и кукурузная каши, гарантированно не содержащие глютен, что позволяет безопасно использовать их в питании детей раннего возраста, страдающих различными формами глютен-ассоциированных заболеваний. Стоит отметить также широкий ассортимент безглютеновых фруктовых и овощных продуктов, позволяющих сформировать максимально сбалансированный и разнообразный рацион ребенка, имеющего пищевые ограничения.
Литература
- Захарова И.Н., Боровик Т.Э., Рославцева Е.А. и др. Целиакия: клинические особенности // Педиатрия. Приложение к журналу Consilium Medicum. 2014. № 3. С. 62-67.
- Sapone A., Bai J.C., Ciacci C. et al. Spectrum of gluten-related disorders: consensus on new nomenclature and classification // BMC Medicine. 2012. No. 10. P. 13. DOI: 10.1186/1741-7015-10-13.
- Shan L., Molberg 0., Parrot I. et al. Structural basis for gluten intolerance in celiac sprue // Science. 2002. Vol. 297. No. 5590. P. 2275-2279. DOI: 10.1126/science.1074129.
- Fasano A. Zonulin and its regulation of intestinal barrier function: the biological door to inflammation, autoimmunity, and cancer // Physiological Reviews. 2011. Vol. 91. No. 1. P. 151175. DOI: 10.1152/physrev. 00003.2008.
- Tatham A.S., Shewry P.R. Allergens in wheat and related cereals // Clinical & Experimental Allergy. 2008. Vol. 38. No. 11. P. 1712-1726. DOI: 10.1111/j.1365-2222.2008.03101.x.
- Husby S., Koletzko S., Korponay-Szabo I.R et al. European Society for Pediatric Gastroenterology, Hepatology, and Nutrition guidelines for the diagnosis of coeliac disease // Journal of Pediatric Gastroenterology and Nutrition. 2012. Vol. 54. No. 1. P. 136-160. DOI: 10.1097/MPG.0b013e31821a23d0.
- Singh P., Arora A., Strand T.A. et al. Global prevalence of celiac disease: systematic review and meta-analysis // Clinical Gastroenterology and Hepatology. 2018. Vol. 16. No. 6. P. 823-836. DOI: 10.1016/j.cgh.2017.06.037.
- Sollid L.M. Molecular basis of celiac disease // Annual Review of Immunology. 2000. Vol. 18. P. 53-81. DOI: 10.1146/ annurev.immunol.18.1.53.
- Дранник Г.Н. Клиническая иммунология и аллергология. М.: Медицинское информационное агентство, 2003. 604 с.
- Sollid L.M., Jabri B. Celiac disease and transglutaminase 2: a model for posttranslational modification of antigens and HLA association in the pathogenesis of autoimmune disorders //Current Opinion in Immunology. 2011. Vol. 23. No. 6. P. 732-738. DOI: 10.1016/j.coi.2011.08.006.
- Дмитриева Ю.А., Захарова И.Н. Неврологические проявления у больных целиакией // Медицинский совет. 2017. № 9. С. 93-96. DOI: 10.21518/2079-701X-2017-9-93-96.
- Дмитриева Ю.А., Захарова И.Н. Эффективность безглютеновой диеты при неврологических заболеваниях и психиатрических расстройствах: миф или реальность? // Медицинский совет. 2018. № 2. С. 156-161. DOI: 10.21518/2079-701X-2018-2-156-161.
- Министерство здравоохранения Российской Федерации, Союз педиатров России. Федеральные клинические рекомендации по оказанию медицинской помощи детям с целиакией. M., 2015. mosgorzdrav.ru/ru-RU/science/default/download/107.…
- Парфенов А.И., Маев И.В., Баранов А.А. и др. Всероссийский консенсус по диагностике и лечению целиакии у детей и взрослых (Принят на 42-й научной сессии Центрального научно-исследовательского института гастроэнтерологии; Москва, 2-3 марта 2016 г.) // Альманах клинической медицины. 2016. Т. 44. № 6. С. 661-688. DOI: 10.18786/2072-0505-2016-44-6-661-688.
- Шаповалова Н.С., Новикова В.П., Ревнова М.О. и др. Серонегативная целиакия в свете рекомендаций Европейского общества изучения целиакии (ESsCD) 2019 года // Вопросы детской диетологии. 2019. Т. 17. № 6. С. 14-22. DOI: 10.20953/1727-5784-2019-6-14-22.
- Al-Toma A., Volta U., Auricchio R. et al. European Society for the Study of Coeliac Disease (ESsCD) guideline for coeliac disease and other gluten-related disorders // United European Gastroenterology Journal. 2019. Vol. 7. No. 5. P. 583-613. DOI: 10.1177/2050640619844125.
- Salmi T.T., Hervonen K., Kautiainen H. et al. Prevalence and incidence of dermatitis herpetiformis: a 40-year prospective study from Finland // British Journal of Dermatology. 2011. Vol. 165. No. 2. P. 354-359. DOI: 10.1111/j.1365-2133.2011.10385.x.
- Rose C., Armbruster F.P., Ruppert J. et al. Autoantibodies against epidermal transglutaminase are a sensitive diagnostic marker in patients with dermatitis herpetiformis on a normal or gluten-free diet // Journal of the American Academy of Dermatology. 2009. Vol. 61. No. 1. P. 39-43. DOI: 10.1016/j.jaad.2008.12.037.
- Hadjivassiliou M., Aeschlimann P., Strigun A. et al. Autoantibodies in gluten ataxia recognize a novel neuronal transglutaminase // Annals of Neurology. 2008. Vol. 64. No. 3. P. 332-343. DOI: 10.1002/ana.21450.
- Abele M., Burk K., Schols L. et al. The aetiology of sporadic adult-onset ataxia // Brain. 2002. Vol. 125. P. 961-968. DOI: 10.1093/brain/awf107.
- Osterballe M., Hansen T.K, Mortz C.G. et al. The prevalence of food hypersensitivity in an unselected population of children and adults // Pediatric Allergy and Immunology. Vol. 16. No. 7. P. 567-573. DOI: 10.1111/j.1399-3038.2005.00251.x.
- Venter C., Pereira B., Voigt K. et al. Prevalence and cumulative incidence of food hypersensitivity in the first 3 years of life // Allergy. Vol. 63. No. 3. P. 354-359. DOI: 10.1111/j.1398-9995.2007.01570.x.
- Ronchetti R., Jesenak M., Trubacova D. et al. Epidemiology of atopy patch tests with food and inhalant allergens in an unselected population of children // Pediatric Allergy and Immunology. Vol. 19. No. 7. P. 599-604. DOI: 10.1111/j.1399-3038.2007.00712.x.
- Walusiak J., Hanke W., Gorski P., Palczynski C. Respiratory allergy in apprentice bakers: do occupational allergies follow the allergic march? // Allergy. 2004. Vol. 59. P. 442-450. DOI: 10.1111/j.1398-9995.2003.00418.x.
- Tatham A.S., Shewry P.R. Allergens in wheat and related cereals // Clinical and Experimental Allergy. 2008. Vol. 38. No. 11. P. 1712-1726. DOI: 10.1111/j.1365-2222.2008.03101.x.
- Sapone A., Lammers K.M., Mazzarella G. et al. Differential mucosal IL-17 expression in two gliadin-induced disorders: gluten sensitivity and the autoimmune enteropathy celiac disease // International Archives of Allergy and Immunology. 2010. Vol. 152. No. 1. P. 75-80. DOI: 10.1159/000260087.
- Schuppan D., Pickert G., Ashfaq-Khan M., Zevallos V. Non-celiac wheat sensitivity: differential diagnosis, triggers and implications // Best Practice & Research. Clinical gastroenterology. 2015. Vol. 29. No. 3. P. 469-476. DOI: 10.1016/j. bpg.2015.04.002.
- McElhanon B.O., McCracken C., Karpen S., Sharp W.G. Gastrointestinal symptoms in autism spectrum disorder: a metaanalysis // Pediatrics. 2014. Vol. 133. P. 872-883. DOI: 10.1542/peds.2013-3995.
- Piwowarczyk A., Horvath A., tukasik J. et al. Gluten- and casein-free diet and autism spectrum disorders in children: a systematic review // European Journal of Nutrition. 2018. Vol. 57. No. 2. P. 433-440. DOI: 10.1007/s00394-017-1483-2.
- Lyra L., Rizzo L.E., Sunahara C.S. et al. What do Cochrane systematic reviews say about interventions for autism spectrum disorders? // Sao Paulo Medical Journal. 2017. Vol. 135. No. 2. P. 192-201. DOI: 10.1590/1516-3180.2017.0058200317.
- Sathe N., Andrews J.C., McPheeters M.L. et al. Nutritional and dietary interventions for autism spectrum disorder: a systematic review // Pediatrics. 2017. Vol. 139. No. 6. DOI: 10.1542/ peds.2017-0346.
- Bender L. Childhood schizophrenia // Psychiatric Quarterly. 1953. Vol. 27. P. 663-681. DOI: 10.1007/BF01562517.
- Dohan F.C. Cereals and schizophrenia. Data and hypothesis // Acta Psychiatrica Scandinavica. 1966. Vol. 42. No. 2. P. 125-152. DOI: 10.1111/j.1600-0447.1966.tb01920.x.
- Dohan F.C., Grasberger J., Lowell F. et al. Relapsed schizophrenics: more rapid improvement on a milk-and cereal-free diet // British Journal of Psychiatry. 1969. Vol. 115. No. 522. P. 595-596. DOI: 10.1192/bjp.115.522.595.
- Singh M.M., Kay S.R. Wheat gluten asa pathogenic factor in schizophrenia // Science. 1976. Vol. 191. No. 4225. P. 401-402. DOI: 10.1126/science.1246624.
- Dohan F.C., Harper E.H., Clark M.H. et al. Is schizophrenia rare if grain is rare? // Biological Psychiatry 1984. Vol. 19. No. 3. P. 385-399.
- Vlissides D.N., Venulet A., Jenner F. A double-blind gluten-free/gluten-load controlled trial in a secure ward population // British Journal of Psychiatry. 1986. Vol. 148. No. 4. P. 447-452. DOI: 10.1192/bjp.148.4.447.
- Arroll M.A., Wilder L., Neil J. Nutritional interventions for the adjunctive treatment of schizophrenia: a brief review // Nutrition Journal. 2014. Vol. No. 13. P. 91. DOI: 10.1186/1475-2891-13-91.
- Программа оптимизации вскармливания детей первого года жизни в Российской Федерации: методические рекомендации. М., 2019. С. 39-41.


