Матриксные металлопротеиназы и заболевания сердца у детей
СтатьиЛ.А. Максимяк, Н.П. Котлукова, д-р мед. наук, профессор, ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России
Ключевые слова: матриксные металлопротеиназы, тканевые ингибиторы матриксных металлопротеиназ, CD147, врожденные пороки сердца, кардиомиопатия
Keywords: matrix metalloproteinases, tissue inhibitors of matrix metalloproteinases, CD147, congenital heart defects, cardiomyopathy
Резюме. Заболевания сердца у детей 1-го года жизни являются распространенной проблемой и могут отличаться тяжелым клиническим течением. В настоящее время известно о роли протеолитической системы матриксных металлопротеиназ (ММП), их тканевых ингибиторов (ТИММП) и индуктора (CD147) в процессах ремоделирования соединительной ткани сердца у взрослых. Целью настоящего исследования стало определение референсных значений ММП-1, ММП-2, ММП-3, ММП-9, ММП-13, ТИММП-1, ТИММП-4 и CD147 у детей 1-го года жизни, выявление взаимосвязи лабораторных маркеров с эхокардиографическими показателями при врожденных пороках сердца (ВПС), кардиомиопатиях с дилатационным и гипертрофическим фенотипом. В исследование было включено 73 ребенка в возрасте от 1 до 11 мес. В зависимости от анамнеза они были разделены на 3 группы: с ВПС (n = 37), с кардиомиопатией с дилатационным (n = 8) и гипертрофическим (n = 8) фенотипом. В группу сравнения вошли 20 здоровых детей. Проведена эхокардиография, методом иммуноферментного анализа определены концентрации лабораторных маркеров. Результаты. Впервые установлены референсные значения для ММП, ТИММП, CD147 у детей в возрасте 1-11 мес. Выявлено связанное с возрастом снижение концентрации ММП-2. Уровень ММП-1 у детей с ВПС коррелирует с конечным диастолическим размером левого желудочка, конечным диастолическим объемом левого желудочка, ударным объемом. Уровень ММП-2 отрицательно коррелирует с размером дефекта межжелудочковой перегородки. Концентрация ТИММП-1 у детей со II функциональным классом сердечной недостаточности по Ross выше, чем у детей с III классом и у детей группы сравнения. Заключение. Можно сделать предположение о влиянии ММП, ТИММП и CD147 на размеры и функцию сердца у детей 1-го года жизни. Дальнейшее изучение этих показателей представляется перспективным и необходимым для совершенствования знаний о процессах ремоделирования соединительной ткани, для разработки новых диагностических методов и лекарственных средств, прогнозирования течения заболеваний.
Summary. Heart disease in children of the first year of life is a common problem and can be characterized by a severe clinical course. It is known about the role of the proteolytic system of matrix metalloproteinases (MMPs), their tissue inhibitors (TIMMPs) and inducer (CD147) in the processes of remodeling of the connective tissue of the heart in adults. The aim of this study was to determine the reference values for MMP-1, MMP-2, MMP-3, MMP-9, MMP-13, TIMMP-1, TIMMP-4 and CD147 in children of the first year of life, to identify the relationship between laboratory markers and echocardiographic measurements in children with congenital heart defects (CHD), dilated cardiomyopathies and hypertrophic cardiomyopathies. The study included 73 children aged 1 to 11 months. The patients were divided into 3 groups: CHD (n = 37), dilated cardiomyopathies (n = 8), and hypertrophic cardiomyopathies (n = 8). The comparison group consisted of 20 healthy children. Echocardiography was performed, the concentrations of laboratory markers were determined by enzyme immunoassay. Results. Reference values for MMPs, TIMMPs, and CD147 was determined for the first time in children aged 1-11 months. An age-related decrease in the concentration of MMP-2 was found. MMP-1 in children with CHD correlates with left ventricle end-diastolic diameter, left ventricle end-diastolic volume, and stroke volume. The level of MMP-2 has a negative correlation with the size of the ventricular septal defect. The concentration of TIMMP-1 was increased in heart failure Ross functional class II in relation to Ross functional class III and the comparison group. The results of our study demonstrate the activity of MMPs, TIMPs, CD147 in children with different heart diseases and its relationship with echocardiographic data. Continuing to study these indicators is promising for improving knowledge about the processes of connective tissue remodeling, developing new diagnostic methods and medicines, and predicting the course of diseases.
Введение
В настоящее время в структуре сердечно-сосудистой заболеваемости детей растет удельный вес врожденных пороков сердца (ВПС), нарушений сердечного ритма, кардиомиопатий на фоне снижения частоты ревматической и инфекционной патологии. Ежегодно в Российской Федерации приблизительно у 20 тыс. из 1,7-2,0 млн рождающихся детей диагностируются ВПС, причем 25% из них являются критическими [1]. Кардиомиопатии отличаются тяжелым клиническим течением с развитием сердечной недостаточности (СН), аритмий, сопряжены с риском внезапной сердечной смерти. В их патогенез вовлечены генетические, вирусные, аутоиммунные, инфильтративные и другие факторы [2].
Все чаще внимание исследователей фокусируется на процессах ремоделирования миокарда на фоне заболеваний сердца. Оно определяется как группа молекулярных, клеточных и интерстициальных преобразований, проявляющихся в виде изменения размеров, формы и функции сердца в результате гемодинамической перегрузки, стресса, травмы или иного воздействия. Основной единицей ремоделирования считается кардиомиоцит. Но в нем активно участвуют и другие компоненты, в том числе соединительная ткань миокарда и межклеточное вещество [3]. Гомеостаз и обновление экстрацеллюлярного матрикса находятся под контролем ферментов, относящихся к семейству матриксных металлопротеиназ (ММП) [4].
ММП – цинксодержащие протеазы, участвующие в расщеплении волокон межклеточного вещества и некоторых других соединений. Они играют роль в ремоделировании тканей на фоне физиологических и патологических процессов [5]. Известно их участие в патогенезе заболеваний сердца [6]. Активность ММП регулируется несколькими тканевыми ингибиторами (ТИММП) [7]. Известен также индуктор экстраклеточных металлопротеиназ – CD147 [8]. Последний является рецептором для циклофилина А (CyPA). Их взаимодействие запускает каскад процессов, способствующих ишемии миокарда, реперфузионному повреждению и ремоделированию [9]. Известна роль CD147 в патогенезе инфекционных процессов, в том числе новой коронавирусной инфекции (COVID-19) [10]. Взаимоотношения между протеазами, их ингибиторами и CD147 имеют решающее значение для поддержания целостной структуры межклеточного вещества.
Компоненты системы ММП рассматриваются в качестве перспективных диагностических маркеров и терапевтических мишеней при сердечно-сосудистой патологии. Одним из примеров является неприлизин (нейтральная эндопептидаза, neutral endopeptidase, neprilysin, NEP) – цинкзависимая ММП, функция которой заключается в инактивации эндогенных вазоактивных пептидов [11]. Комбинация ингибитора неприлизина (сакубитрила) с антагонистом рецепторов ангиотензина II стала новейшим классом нейрогормональных модуляторов. Эффективность препарата оценивалась в многоцентровом рандомизированном исследовании PARADIGM-H: продемонстрированы явные его преимущества перед прежним «золотым стандартом» – эналаприлом [12].
Целью настоящего исследования являлось определение референсных значений ММП-1, ММП-2, ММП-3, ММП-9, ММП-13, ТИММП-1, ТИММП-4 и CD147 у детей 1-го года жизни, выявление взаимосвязей лабораторных маркеров с эхокардиографическими показателями при ВПС и кардиомиопатии.
Материалы и методы
В исследование были включены 73 ребенка в возрасте от 1 мес до 1 года. Дети проходили обследование в III грудном отделении перинатального кардиологического центра Городской клинической больницы № 67 им. Л.А. Ворохобова Департамента здравоохранения г. Москвы. У 53 пациентов имелась патология сердца: ВПС с симптомами СН без кардиохирургического вмешательства в анамнезе (n = 37), кардиомиопатия с дилатационным (n = 8) или гипертрофическим (n = 8) фенотипом. Пороки носили характер «бледных» с гиперволемией в малом круге кровообращения. Среди пациентов было 23 ребенка с единичными дефектами межжелудочковой перегородки различной величины (медиана (Me) 7 мм, интерквартильный размах (IQR) 6,0-8,0 мм), которые были объединены в отдельную группу для изучения взаимосвязи лабораторных маркеров с размером дефекта. У 20 оставшихся детей не было патологии сердца на момент обследования; они составили группу сравнения. Их показатели использовались для определения референсных значений исследуемых лабораторных маркеров, возрастных и связанных с полом особенностей.
Стадию СН верифицировали в соответствии с классификацией Стражеско-Василенко в модификации Н.А. Белоконь, функциональный класс (ФК) определяли по модифицированной шкале Ross. Симптомы СН наблюдались у 49 детей (IIА стадия – у 45, I стадия – у 4), из них 16 имели III ФК, 33 – II ФК по Ross.
Развернутое эхокардиографическое исследование проводилось с расчетом Z-score для измеряемых показателей. Z-score (z-фактор) представляет собой дистанцию между анализируемой величиной и средней величиной в популяции, выраженную в единицах стандартного отклонения.
Методом иммуноферментного анализа определяли концентрацию ММП-1, ММП-2, ММП-3, ММП-9, ММП-13, ТИММП-1, ТИММП-4, CD147 в сыворотке крови.
Данные обрабатывали с использованием методов непараметрической статистики. Вычисляли Me и IQR, отражающий диапазон значений между 25-м и 75-м процентилями. Показатели независимых выборок сравнивали с использованием теста Манна-Уитни, степень зависимости между показателями определялась путем вычисления коэффициента корреляции Спирмена. Полученные результаты считались статистически значимыми при p <0,05.
Результаты и обсуждение
Впервые установлены процентильные значения ММП, ТИММП, CD147, которые могут быть использованы в качестве нормативных у детей в возрасте 1-11 мес (Me 4,0 мес, IQR 2,5-5,0 мес) при проведении будущих исследований (см. таблицу).
Референсные значения сывороточных концентраций компонентов системы матриксных металлопротеиназ у детей в возрасте 1-11 мес (n = 20)
| Показатель | Me | Процентили | |||||
| 5% | 25% | 50% | 75% | 95% | 97,5% | ||
| ММП-1, пг/мл | 0 | 0 | 0 | 0 | 1284,00 | 28950,00 | 37800,00 |
| ММП-2, нг/мл | 121,49 | 84,68 | 99,04 | 121,49 | 147,27 | 154,02 | 156,61 |
| ММП-3, нг/мл | 2,70 | 0,42 | 1,18 | 2,70 | 4,64 | 9,86 | 12,55 |
| ММП-9, нг/мл | 67,14 | 33,34 | 52,49 | 67,14 | 77,90 | 314,70 | 376,18 |
| ММП-13, пг/мл | 243,27 | 1,00 | 10,70 | 243,27 | 3235,26 | 7595,58 | 8033,61 |
| ТИММП-1, пг/мл | 18501,20 | 10885,40 | 13320,45 | 18501,20 | 21209,40 | 38742,95 | 46500,00 |
| ТИММП-4, пг/мл | 0 | 0 | 0 | 0 | 0 | 386,50 | 520,80 |
| CD147, пг/мл | 1076,59 | 358,73 | 552,47 | 1076,59 | 3135,74 | 12150,00 | 12600,00 |
Примечание. ММП – матриксная металлопротеиназа; ТИММП – тканевый ингибитор матриксной металлопротеиназы.
Выявлено возрастное снижение концентрации ММП-2 – отрицательная корреляция с возрастом (r = -0,57, p = 0,008). Эта особенность может свидетельствовать об участии фермента в процессах активного роста и дифференцировки тканей у ребенка 1-го года жизни. Аналогичная взаимосвязь установлена с массой тела (r = -0,56, p = 0,011), длиной тела (r = -0,53, p = 0,015), площадью поверхности тела (r = -0,58, p = 0,008). Связанных с полом различий не выявлено.
ММП-1 (коллагеназа-1) – фермент, обеспечивающий деградацию основных видов фибриллярного коллагена. Он широко представлен в тканях, испытывающих постоянную и интенсивную механическую нагрузку, к которым относится и миокард. Концентрация ММП-1 у детей с ВПС напрямую коррелирует с рабочими размерами и объемом левого желудочка (ЛЖ): конечным диастолическим размером (r = 0,33, p = 0,045), конечным диастолическим объемом (r = 0,33, p = 0,045), ударным объемом (r = 0,34, p = 0,042). Ранее J.Y. Рагк и соавт. также продемонстрировали зависимость между уровнем этой коллагеназы и величиной преднагрузки на ЛЖ. Они выявили прямую корреляцию между индексированным конечным диастолическим объемом ЛЖ и концентрацией ММП-1 у пациентов с аортальным стенозом [13]. Поддержание оптимального уровня фибриллярных коллагенов в стенках магистральных артерий обеспечивает их физиологическую упругость. L. Zou и соавт. обнаружили связь экспрессии гена ММП-1 с возникновением легочной гипертензии [14]. В экспериментальных условиях было установлено, что ММП-1 препятствует отложению коллагена и снижает пролиферацию гладкомышечных клеток в стенках легочных артерий [15].
Желатиназы ММП-2 и ММП-9 продолжают процессы деградации компонентов межклеточного вещества, начатые коллагеназами. У детей с единичными дефектами межжелудочковой перегородки выявлена прямая корреляция между размером дефекта и концентрацией ММП-2 (r = 0,41, p = 0,049), свидетельствующая о возможном участии протеазы в развитии порока, т. е. о диагностической и прогностической важности фермента. В настоящее время уже известно о роли компонентов межклеточного вещества в формировании перегородок сердца. Нарушение этого процесса может приводить к возникновению ВПС [16]. Повышение уровня ММП-2 у пациентов с дефектами межжелудочковой перегородки в сравнении с уровнем у здоровых детей, зависимость между размером дефекта и активностью фермента была также продемонстрирована K.S. Cheng и соавт. [17]. Согласно нашим данным, концентрация ММП-2 снижается с возрастом. Сохраняющиеся повышенные уровни фермента могут служить маркером нарушений процессов эмбриогенеза, приводящих к возникновению дефектов перегородки, и использоваться в комплексной диагностике порока. Концентрация другой желатиназы, ММП-9, имеет прямую корреляцию с Z-score конечного систолического размера ЛЖ (r = 0,37, p = 0,023) у детей с ВПС. Деградация волокон межклеточного вещества может способствовать увеличению размеров ЛЖ.
В этой же группе выявлены связи между коллагеназами ММП-1 и ММП-13 (r = 0,67, p = 0,00001), желатиназами ММП-2 и ММП-9 (r = 0,35, p = 0,032). Их наличие может быть обусловлено общими для протеаз субстратами и схожими механизмами активации.
Действие ММП-3 (стромелизина-1) распространяется на ряд фибриллярных коллагенов, продукты их частичного расщепления и некоторые неколлагеновые волокна, такие как эластин, фибронектин. В группе сравнения выявлены отрицательные корреляции между концентрацией фермента и конечным диастолическим размером ЛЖ (r = -0,47, p = 0,037), а также рассчитанными на его основе показателями: Z-score конечного диастолического размера ЛЖ (r = -0,62, p = 0,003), конечным диастолическим объемом ЛЖ (r = -0,47, p = 0,037), Z-score массы миокарда (r = -0,56, p = 0,01), ударным объемом (r = -0,53, p = 0,016), минутным объемом сердца (r = -0,47, p = 0,04). Предполагается участие ММП-3 в патогенезе кардиомиопатий с гипертрофическим фенотипом в молодом возрасте [18], влияние на систолическую функцию и прогноз у пациентов после инфаркта миокарда [19].
Подавляя действие ММП, тканевые ингибиторы обеспечивают постоянство гомеостаза межклеточного вещества, выполняющего механическую, структурную, трофическую и другие функции, тем самым препятствуя или способствуя ремоделированию миокарда.
У детей с СН I и IIА стадий уровень ТИММП-1 оказался статистически значимо более высоким (Me 18501,2 пг/мл, IQR 13320,45-21209,40 пг/мл), чем в группе сравнения (Me 21812,50 пг/мл, IQR 17529,10-27625,20 пг/мл, p = 0,042) (рис. 1).
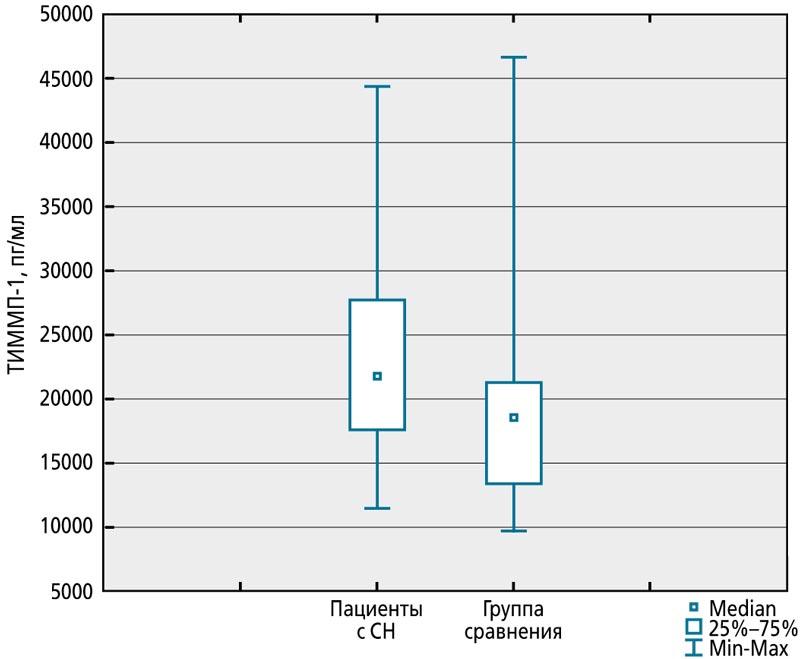 Рис. 1. Концентрация тканевого ингибитора матриксных металлопротеиназ 1 у детей с сердечной недостаточностью и здоровых детей в возрасте 1-11 мес
Рис. 1. Концентрация тканевого ингибитора матриксных металлопротеиназ 1 у детей с сердечной недостаточностью и здоровых детей в возрасте 1-11 мес
Уровень ТИММП-1 повышен при СН II ФК по Ross (Me 22111,90 пг/мл, IQR 18205,00-31309,40 пг/мл) в сравнении со здоровыми детьми (p = 0,008) и детьми с III ФК (Me 17699,85пг/мл, IQR14072,90-25295,90 пг/мл, p = 0,02). Статистически значимых различий между концентрацией ингибитора у детей группы сравнения и детей с III ФК не обнаружено (рис. 2).
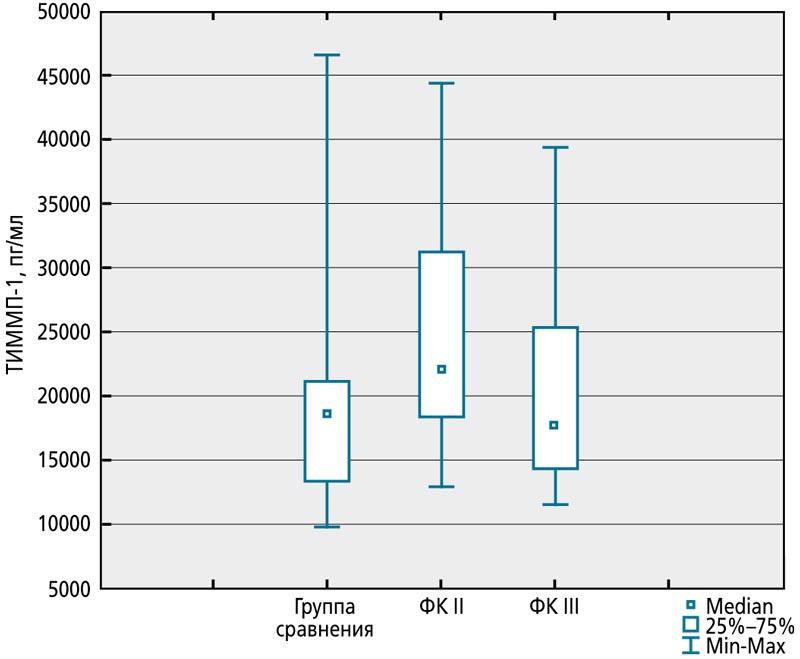 Рис. 2. Концентрация тканевого ингибитора матриксных металлопротеиназ 1 у детей с сердечной недостаточностью II и III функциональных классов по Ross и здоровых детей в возрасте 1-11 мес
Рис. 2. Концентрация тканевого ингибитора матриксных металлопротеиназ 1 у детей с сердечной недостаточностью II и III функциональных классов по Ross и здоровых детей в возрасте 1-11 мес
Вероятно, на фоне гемодинамической перегрузки сердца ТИММП-1 может способствовать накоплению волокон межклеточного вещества, выполняющих каркасную функцию, обеспечивающих прочность и эластичность сердечной мышцы, для поддержания формы ЛЖ и его сократительной способности. Клинически у пациента в это время отмечаются симптомы СН I-IIA стадии, II ФК по Ross. Но избыток компонентов экстрацеллюлярного матрикса усугубляет нарушение геометрии сердца и миокардиальной дисфункции. Известно также, что ТИММП-1 сам по себе обусловливает повышение активности фибробластов, синтезирующих и другие компоненты протеолитической системы [20]. Клинически у ребенка в это время отмечаются более выраженные проявления СН III ФК по Ross. ТИММП-1 может стать лабораторным маркером начальных стадий СН.
Статистически значимо более высокий уровень ТИММП-1 выявлен у детей с кардиомиопатией с дилатационным фенотипом (Me 26984,95 пг/мл, IQR 21573,00-32164,20 пг/мл) в сравнении со здоровыми детьми (Me 18501,20 пг/мл, IQR 13320,45-21209,40 пг/мл, р = 0,02). Несмотря на небольшое число обследованных (n = 8), результат соответствует имеющимся в научной литературе данным [21,22]. В этой же группе установлена отрицательная корреляция между уровнем CD147 и показателями систолической функции – фракцией выброса ЛЖ (r = -0,81, p = 0,015) и фракцией укорочения (r = -0,83, p = 0,01).
Во всех группах выявлена сильная положительная корреляция между концентрацией ММП-13 и CD147, включая группу сравнения (r = 0,93, p = 0,0000001), что говорит о преимущественном влиянии индуктора на синтез этой коллагеназы.
Заключение
Можно предположить, что ММП, ТИММП и CD147 влияют на размеры и функцию сердца у детей 1-го года жизни. Дальнейшее изучение этих показателей позволить углубить знания о процессах ремоделирования соединительной ткани и разработать новые диагностические методы и лекарственные средства, а также способы прогнозирования течения заболеваний.
Литература
- Бокерия Е.Л. Перинатальная кардиология: настоящее и будущее. Часть I: врожденные пороки сердца // Российский вестник перинатологии и педиатрии. 2019. Т. 64. № 3. С. 5-10. DOI: 10.21508/1027-4065-2019-64-3-5-10.
- Lipshultz S.E., Law Y.M., Asante-Korang A. et al. Cardiomyopathy in children: classification and diagnosis: a scientific statement from the American Heart Association // Circulation. 2019. Vol. 140. No. 1. P. e9-e68. DOI: 10.1161/CIR.0000000000000682.
- Cohn J.N., Ferrari R., Sharpe N. Cardiac remodeling – concepts and clinical implications: a consensus paper from an international forum on cardiac remodeling. Behalf of an International Forum on Cardiac Remodeling // Journal of the American College of Cardiology. 2000. Vol. 35. No. 3. Р. 569-582.
- Riaz S., Zeidan A., Mraiche F. Myocardial proteases and cardiac remodeling // Journal of Cellular Physiology. 2017. Vol. 232. No. 12. P. 3244-3250. DOI: 10.1002/jcp.25884.
- Cui N., Hu M., Khalil R.A. Biochemical and biological attributes of matrix metalloproteinases // Progress in Molecular Biology and Translational Science. 2017. No. 147. P 1-73. DOI: 10.1016/bs.pmbts.2017.02.005.
- DeLeon-Pennell K.Y., Meschiari C.A., Jung M., Lindsey M.L. Matrix metalloproteinases in myocardial infarction and heart failure // Progress in Molecular Biology and Translational Science. 2017. Vol. 147. P. 75-100. DOI: 10.1016/bs.pmbts.2017.02.001.
- Moore L., Fan D., Basu R. et al. Tissue inhibitor of metalloproteinases (TIMPs) in heart failure // Heart Failure Reviews. 2012. Vol. 17. No. 4-5. Р 693-706. DOI: 10.1007/s10741-011-9266-y.
- Grass G.D., Toole B.P. How, with whom and when: an overview of CD147-mediated regulatory networks influencing matrix metalloproteinase activity // Bioscience Reports. 2015. Vol. 36. No. 1. e00283. DOI: 10.1042/BSR20150256.
- Seizer P, Gawaz M., May A.E. Cyclophilin A and EMMPRIN (CD147) in cardiovascular diseases // Cardiovascular Research. 2014. Vol. 102. No. 1. Р 17-23. DOI: 10.1093/cvr/cvu035.
- Wang K., Chen W, Zhang Z. et al. CD147-spike protein is a novel route for SARS-CoV-2 infection to host cells // Signal Transduction and Targeted Therapy. 2020. Vol. 5. No. 1. P 283. DOI: 10.1038/s41392-020-00426-x.
- Feygina E.E., Katrukha A.G., Semenov A.G. Neutral endopeptidase (neprilysin) in therapy and diagnostics: yin and yang // Biochemistry (Moscow). 2019. Vol. 84. No. 11. P. 1346-1358. DOI: 10.1134/S0006297919110105.
- McMurray J.J.V, Packer M., Desai A.S. et al. Angiotensin-neprilysin inhibition versus enalapril in heart failure // New England Journal of Medicine. 2014. Vol. 371. No. 11. P 993-1004. DOI: 10.1056/NE-JMoa1409077.
- Park J.Y., Ryu S.K., Choi J.W et al. Association of inflammation, myocardial fibrosis and cardiac remodelling in patients with mild aortic stenosis as assessed by biomarkers and echocardiography // Clinical and Experimental Pharmacology and Physiology. 2014. Vol. 41. No. 3. P 185-191. DOI: 10.1111/1440-1681.12206.
- Zou L., Xu X., Zhai Z. et al. Identification of downstream target genes regulated by the nitric oxide-soluble guanylate cyclase-cyclic guanosine monophosphate signal pathway in pulmonary hypertension // Journal of International Medical Research. 2016. Vol. 44. No. 3. P 508-519. DOI: 10.1177/0300060516636751.
- George J., Sun J., D’Armiento J. Transgenic expression of human matrix metalloproteinase-1 attenuates pulmonary arterial hypertension in mice // Clinical science (London). 2012. Vol. 122. No. 2. P. 83-92. DOI: 10.1042/CS20110295.
- Deepe R., Fitzgerald E., Wolters R. et al. The mesenchymal cap of the atrial septum and atrial and atrioventricular septation // Journal of Cardiovascular Development and Disease. 2020. Vol. 7. No. 4. P 50. DOI: 10.3390/jcdd7040050.
- Cheng K.S, Liao Y.C., Chen M.Y. et al. Circulating matrix metalloproteinase-2 and -9 enzyme activities in the children with ventricular septal defect // International Journal of Biological Sciences. 2013. Vol. 9. No. 6. Р 557-563. DOI: 10.7150/ijbs.6398.
- Zachariah J.P, Colan S.D., Lang P et al. Circulating matrix metalloproteinases in adolescents with hypertrophic cardiomyopathy and ventricular arrhythmia // Circulation: Heart Failure. 2012. Vol. 5. No. 4. Р 462-466. DOI: 10.1161/CIRCHEARTFAILURE.111.966200.
- Abd El-Aziz T.A., Mohamed R.H. Matrix metalloproteinase 3 gene polymorphism and its level predict morbidity after acute myocardial infarction // American Journal of Clinical Pathology. 2016. Vol. 145. No. 1. P. 134-139. DOI: 10.1093/ajcp/aqv008.
- Nagase H., Visse R., Murphy G. Structure and function of matrix metalloproteinases and TIMPs // Cardiovascular Research. 2006. Vol. 69. No. 3. Р 562-573. DOI: 10.1016/j.cardiores.2005.12.002.
- Hsia T.Y., Ringewald J.M., Stroud R.E. et al. Determinants of extracellular matrix remodelling are differentially expressed in paediatric and adult dilated cardiomyopathy // European Journal of Heart Failure. 2011. Vol. 13. No. 3. Р. 271-277. DOI: 10.1093/eurjhf/hfq184.
- Бершова Т.В., Баканов М.И., Басаргина Е.Н., Иванов А.П. Дилатационная кардиомиопатия у детей: молекулярно-клеточные механизмы дисфункции // Педиатрия. Журнал им. Г.Н. Сперанского. 2013. Т. 92. № 5. С. 6-11.
Комментарии
ПРАКТИКА ПЕДИАТРА

