Первичная лимфома центральной нервной системы у взрослых. Клинические рекомендации.
Статьи
Первичная лимфома центральной нервной системы у взрослых
- Национальное гематологическое общество Российское профессиональное общество онкогематологов
Оглавление
- Ключевые слова
- Список сокращений
- Термины и определения
- 1. Краткая информация
- 2. Диагностика
- 3. Лечение
- 4. Реабилитация
- 5. Профилактика и диспансерное наблюдение
- 6. Дополнительная информация, влияющая на течение и исход заболевания
- Критерии оценки качества медицинской помощи
- Список литературы
- Приложение А1. Состав рабочей группы
- Приложение А2. Методология разработки клинических рекомендаций
- Приложение Б. Алгоритмы ведения пациента
- Приложение В. Информация для пациентов
Ключевые слова
Первичная лимфома центральной нервной системы,
стереотаксическая биопсия,
гемато-энцефалический барьер,
Список сокращений
АРТ - антиретровирусная терапия
ВДХТ – высокодозная химиотерапия
ВИЧ – вирус иммунодефицита человека
ГЭБ – гемато-энцефалический барьер
КТ – компьютерная томография
ЛТ – лучевая терапия
МРТ – магнитно-резонансная томография
ПЛЦНС - первичная лимфома центральной нервной системы
ПЭТ – позитронно-эмиссионная томография
СМЖ – спинномозговая жидкость
Термины и определения
Первичная лимфома центральной нервной системы (ПЛЦНС) – это одна из самых агрессивных экстранодальных лимфом, которая может поражать все структуры центральной нервной системы (ЦНС), в том числе заднюю стенку глаза.
Посттерапевтическая нейротоксичность – лейкоэнцефалопатия, проявляющаяся когнитивными нарушениями, а также такими серьезными нарушениями, как слабоумие, нарушения походки и недержание мочи.
1. Краткая информация
1.1 Определение
Первичная лимфома центральной нервной системы (ПЛЦНС) – это одна из самых агрессивных экстранодальных лимфом, которая может поражать все структуры центральной нервной системы (ЦНС), в том числе заднюю стенку глаза [1].
1.2 Этиология и патогенез
Патогенез ПЛЦНС является спорным. Некоторые исследования показывают, что распространение злокачественного клона может произойти среди нормальных B-лимфоцитов, расположенных в ЦНС, теория поддерживается доказательством возникновения лимфомы в белом веществе головного мозга. Другая теория: клон злокачественных лимфоцитов при помощи специальных молекул адгезии может путешествовать и проникнуть в ЦНС [1].
1.3 Эпидемиология
Первичная лимфома ЦНС (ПЛЦНС) является редким заболеванием. Она определяется как поражение паренхимы головного или спинного мозга, оболочек мозга, глаза, без признаков системного заболевания.
Частота встречаемости ПЛЦНС за последние два десятилетия возросла в 7?10 раз, как у людей с иммунодефицитом, так и без него. На первичную лимфому ЦНС приходится около 4-7% от всех первичных опухолей головного мозга, 2-3% от всех неходжкинских лимфом и 4-6% от всех экстранодальных лимфом. Медиана возраста больных – 60-65 лет [22].
Наиболее часто ПЛЦНС поражают больных с ослабленным иммунитетом: так, ПЛЦНС составляют 20% от всех ВИЧ-ассоциированных лимфом [17, 18]. До начала применения антиретровирусной терапии (АРТ), число случаев возникновения ПЛЦНС у ВИЧ-инфицированных лиц постоянно росло. Однако, влияя на количество CD4-клеток, может снижать частоту возникновения ПЛЦНС, поскольку вероятность её возникновения обратно пропорциональна числу CD4-клеток [1,2].
1.4 Кодирование по МКБ 10
С81-С88 (локализация в ЦНС).
1.5 Классификация
Чаще первичные лимфомы головного мозга представлены одиночными или множественными внутримозговыми узлами, которые локализуются в лобной доле (приблизительно в 50% случаев), в мозолистом теле и глубинных структурах мозга (приблизительно в 40% случаев). В 35% случаев отмечается мультифокальный рост объемного образования. Значительно реже встречаются лептоменингеальный вариант (16%) и поражение спинного мозга (<1%).
Исследования иммунофенотипа показали, что в большинстве случаев это В-клеточные опухоли, а именно диффузная В-клеточная крупноклеточная лимфома (ДВККЛ) – более 90% случаев, в то время как индолентные В-клеточные лимфомы, лимфобластные, Т-клеточные лимфомы и лимфома Ходжкина встречаются крайне редко. Характерной морфологической особенностью ДВККЛ ЦНС является преимущественное расположение опухоли вдоль мозговых сосудов. Зачастую отмечается «пропитывание» лимфоидными клетками стенок сосудов, что обуславливает картину васкулита. Возможно поэтому границы опухоли нечеткие и опухолевые клетки микроскопически определяются в отдалении от макроскопически определяемых очагов поражения.
В настоящее время отмечается рост заболеваемости Т-клеточными лимфомами ЦНС, однако их доля все равно не превышает 2-5%, что намного меньше, чем у больных с периферическими лимфопролиферативными заболеваниями.
1.6 Клинические признаки
ПЛЦНС в большинстве случаев (более 70%) манифестируют очаговой неврологической симптоматикой. Часто встречаются изменения психики (43%), повышение внутричерепного давления (33%), судорожные припадки (14%).
2. Диагностика
2.1 Жалобы и анамнез
-
Рекомендуется уточнить жалобы на судорожные припадки, оценить наличие неврологического дефекта.[4, 22, 24].
Уровень убедительности рекомендаций II (уровень достоверности доказательств – B)
Комментарии: сбор жалоб и анамнеза позволит определить объем обследования больного и предположить локализацию опухолевого очага .
2.2 Физикальное обследование
-
Рекомендуется оценка очаговой неврологической симптоматики. [4, 22, 24].
Уровень убедительности рекомендаций II (уровень достоверности доказательств – B)
Комментарии: часто встречаются изменения психики (43%), повышение внутричерепного давления (33%), судорожные припадки.
2.3 Лабораторная диагностика
Диагностика ПЛЦНС должна выполняться с учетом рекомендаций по диагностике злокачественных лимфопролиферативных новообразований.
2.3.1. Обязательные тесты лабораторной диагностики:
-
Рекомендуется обязательно всем пациентам проведение общеклинических лабораторных тестов: общий анализ крови, биохимический анализ крови, коагулограмма, ВИЧ, вирусы гепатитов В и С, исследование костного мозга (цитологическое и гистологическое), общий анализ мочи. [17, 18].
Уровень убедительности рекомендаций I (уровень достоверности доказательств – A)
Комментарии: результаты исследования необходимы для оценки функционального состояния внутренних органов и выявления сопутствующей патологии. Исследование на ВИЧ необходимо с для исключения ПЛЦНС, связанной с имммунодефицитом у пациентов с ВИЧ инфекцией.
-
Рекомендуется обязательное морфологическое и иммуногистохимическое подтверждение лимфопролиферативного заболевания.[1, 4, 22, 24].
Уровень убедительности рекомендаций I (уровень достоверности доказательств – A)
Комментарий: обязательным критерием диагноза ПЛЦНС является морфологическая и иммуногистохимическая верификация очагового образования ЦНС. Золотым стандартом получения гистологического материала для верификации диагноза является стереотаксическая биопсия образования головного мозга. Методами выбора являются трепанация черепа и биопсия или удаление образования головного мозга, ламинэктомия и биопсия или удаление образования спинного мозга. Однако, следует помнить, что удаление морфологически верифицированной опухоли не проводится в связи с неэффективностью данного метода лечения.
-
Рекомендуется цитологическое и гистологическое исследование костного мозга (односторонняя трепанобиопсия костного мозга). [1, 4, 22, 24].
Уровень убедительности рекомендаций I (уровень достоверности доказательств – A)
Комментарии: миелограмма обязательна всем больным для исключения поражения костного мозга лимфопролиферативным заболеванием, очаговое поражение центральной нервной системы возможно при распространенной опухоли.
-
Рекомендуется обязательное проведение серологического исследования с определением антител к Toxoplasma gondii для ВИЧ-положительных и других иммуноскомпрометированных пациентов.[17, 18].
Уровень убедительности рекомендаций I (уровень достоверности доказательств – A)
2.3.2. Потенциально информативные методы лабораторного обследования:
-
Рекомендуется цитологическое исследование ликвора. [1, 4, 22, 24].
Уровень убедительности рекомендаций II (уровень достоверности доказательств – B)
Комментарий: при морфологически верифицированном диагнозе не является обязательным исследованием.
2.3.3. Методы лабораторного обследования с недоказанной информативностью
-
Не рекомендуется иммуноцитохимическое исследование или проточная цитофлоуметрия спинномозговой жидкости. [13, 24].
Уровень убедительности рекомендаций IV (уровень достоверности доказательств –C)
Комментарии: мало информативны и крайне редко могут быть диагностически значимы.
2.4 Инструментальная диагностика
-
Рекомендуется обязательно проведение МРТ головного и спинного мозга с внутривенным контрастированием. [1, 12].
Уровень убедительности рекомендаций I (уровень достоверности доказательств – A)
Комментарии: допускается выполнение КТ, а также выполнение исследования без контрастирования в случае аллергических реакций на контрастное вещество, а также снижения скорости клубочковой фильтрации.
Уровень убедительности рекомендаций I (уровень достоверности доказательств – А)
Комментарии: системное обследование направлено на поиск других очагов, первичной опухоли.
-
Рекомендуется проведение ПЭТ-исследования с целью уточнения наличия других очагов первичной опухоли.[1, 12].
Уровень убедительности рекомендаций II (уровень достоверности доказательств – B)
Комментарий: дополнительная опция.
-
Рекомендуется МРТ спинного мозга с контрастированием гадолиниумом при наличии клиники спинального поражения или положительном цитологическом исследовании спинномозговой жидкости (СМЖ).[1, 12].
Уровень убедительности рекомендаций II (уровень достоверности доказательств – B)
Комментарий: дополнительная опция.
-
Рекомендуется обязательное проведение ультразвукового исследования яичек у мужчин необходимо.[1, 3, 4, 12].
Уровень убедительности рекомендаций I (уровень достоверности доказательств – A)
Комментарий: для исключения первичной лимфомы яичка.
2.5 Дополнительные исследования, консультации специалистов
-
Рекомендуется обязательная консультация невропатолога, окулиста. [1, 3, 4, 12].
Уровень убедительности рекомендаций I (уровень достоверности доказательств – A)
Комментарии: необходимо детальное неврологическое обследование с описанием неврологического статуса, офтальмологическое обследование с осмотром в щелевой лампе).
2.6 Стадирование, формулирование диагноза
Диагноз ПЛЦНС формулируется с указанием локализации очага поражения.
3. Лечение
Без лечения медиана выживаемости больных первичной лимфомой ЦНС ограничена несколькими месяцами.
3.1 Консервативное лечение
В связи с редкостью ПЛЦНС, до сих пор существует лишь небольшое количество рандомизированных исследований III фазы по лечению данных больных. В связи с этим оптимальные режимы лечения пациентов с ПЛЦНС до сих пор не разработаны.
-
Рекомендуется лечение, включающее высокие дозы метотрексата** (МТХ ? 3,5 г/м2). [5, 6, 13, 15, 25, 26].
Уровень убедительности рекомендаций II (уровень достоверности доказательств – B)
Комментарий: считаются одним из наиболее эффективных для лечения ПЛЦНС. Несколько исследований показали частоту ответов до 40% и продление медианы общей выживаемости.
-
Рекомендуется лечение комбинацией MTX** с другими препаратами, проникающими через ГЭБ: темозоломидом**, прокарбазином**, этопозидом**, ритуксимабом**, цитарабином** с последующей лучевой терапией рисунок 1.[10, 11, 21, 24].
Уровень убедительности рекомендаций I (уровень достоверности доказательств – A)
Комментарий: применение данного подхода привело к существенному увеличению частоты полных ремиссий, а медиана длительности ответа возросла до 2 лет и более. Влияние высоких доз цитарабина (HD-AraC) было определено в исследовании IELSG20. Пациентам назначали четыре курса HD-МТХ (3,5 г/м2) отдельно или в сочетании с HD-AraC (2 г/м2) два раза в день в дни 2-3. Добавление HD-AraC привело к значительному улучшению результатов: частота полных ответов составила 18% и 46% (р = 0,006), а 3-летняя выживаемость 32% и 46% (р = 0,07), соответственно [10, 11]. Таким образом, добавление цитарабина к MTX значительно улучшает непосредственные и отдаленные результаты лечения больных ПЛЦНС. Влияние переносимости и эффективности добавлении ритуксимаба (R) ± тиотепы (TT) к комбинации метотрексата и цитарабина было определено в исследовании IELSG32 [9]. Пациенты были распределены на три группы: в первой группе назначали четыре курса HD-МТХ (3,5 г/м2) в сочетании с HD-AraC (2 г/м2) два раза в день в дни 2-3, во второй группе был добавлен ритуксимаб в дозе 375 мг/м2 в дни -5 и 0 день, в третьей группе на день 4 к ритуксимабу, цитарабину и метотрексату добавлялась тиотепа (ТТ) в дозе 30 мг/мДобавление ритуксимаба и тиотепы привело к значительному улучшению результатов: частота полных ответов составила 23%, 30% и 49% в соответствующих группах, а частота общего ответа составила 53%, 74% и 87% соответственно. Таким образом, добавление ритуксимаба и тиотепы к комбинации цитарабина и метотрексата еще более улучшает непосредственные и отдаленные результаты лечения больных ПЛЦНС.
Рисунок 1. Современные принципы терапии первичных лимфом ЦНС
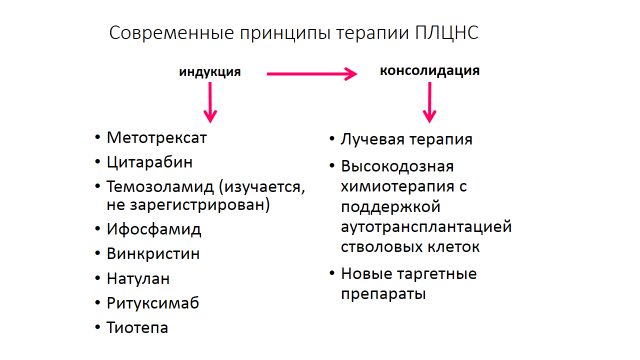
-
Рекомендуется добавление к химиотерапии ЛТ для улучшения общей выживаемости ПЛЦНС. [6-8, 15].
Уровень убедительности рекомендаций II (уровень достоверности доказательств – B)
Комментарий: сочетание химиотерапии с ЛТ на весь мозг показало очень высокую частота ответа, но связано с значительным риском нейротоксичности (30% всех пациентов, и 40-50% у пациентов старше 60 лет) [7, 8, 19].
-
Рекомендуется ВДХТ в ряде случаев.[13].
Уровень убедительности рекомендаций II (уровень достоверности доказательств – B
Комментарий: пациентам ВДХТ с ПЛЦНС показала обнадеживающие результаты, в основном, когда были использованы режимы кондиционирования на основе тиотепы. При медиане наблюдения 63 месяца 5-летняя выживаемость для всех пациентов составила 69% и 87% для тех, которые завершили ВДХТ [20]. Но со временем у 5 из 30 пациентов развилась лейкоэнцефалопатия [20].
-
Рекомендуется применение глюкокортикоидов в случае установленного диагноза ПЛЦНС.[1, 13].
Уровень убедительности рекомендаций V (уровень достоверности доказательств – B)
Комментарии: глюкокортикоиды высоко эффективны (около 40%), однако, следует избегать их применения до проведения биопсии, в связи с невозможностью дальнейшей гистологической интерпретации опухоли. Большинство пациентов с ПЛЦНС имеют неврологические дефициты и психоневрологические симптомы. Симптомы повышенного внутричерепного давления и эпилептиформные приступы встречаются существенно реже. Примерно 20% больных имеют поражение глаз на момент постановки диагноза ПЛЦНС. Назначение глюкокортикоидов необходимо при проведении лечения для снятия локального отека головного мозга (в зоне опухолевого поражения), что приводит к быстрому улучшению неврологической симптоматики практически у всех пациентов. Обычно применяется дексаметазон**.
3.2 Хирургическое лечение
-
Не рекомендуется оперативное лечение. [1, 13].
Уровень убедительности рекомендаций IV (уровень достоверности доказательств – C)
Комментарий: попытка тотального удаления лимфомы часто сопровождается повреждением глубинных структур мозга из-за трудности определения границ опухоли во время операции, что приводит к глубокому неврологическому дефициту и инвалидизации пациента.
3.3 Иное лечение
-
Рекомендуется в ряде случаев облучение головного мозга.[6-8, 15].
Уровень убедительности рекомендаций III (уровень достоверности доказательств – C)
Комментарий: облучение всего головного мозга в суммарной дозе 40?50 Гр. является стандартом лечения. К сожалению, при высокой частоте ответа на лечение (80%), рецидивы возникают практически у всех пациентов, медиана выживаемости составляет 12?18 месяцев. Увеличение доз облучения на ложе опухоли (до 60 Гр) не влияет на частоту возникновения рецидивов и продолжительность жизни больных. Краниоспинальное облучение не увеличило выживаемость, но ассоциировалось со значительной токсичностью, ограничивая возможности применения последующего лекарственного лечения.
Лечение рецидивов ПЛЦНС
Риск возникновения рецидива для пациентов, получающих комбинированную терапию, составляет примерно 50 %. Большинство рецидивов возникает в течение 2-х лет с момента окончания первоначальной терапии, но возможно и более позднее возникновение, в течение 5 лет.
Прогноз при рецидивах опухоли у большинства больных неблагоприятный.
В случае позднего рецидива возможно проведение терапии по ранее выполненной схеме. Некоторые пациенты продолжают демонстрировать чувствительность к лекарственному воздействию. Сообщалось об эффективном применении высоких доз метотрексата** (даже для пациентов, уже получавших лечение этим препаратом), цитарабина, комбинации PCV (прокарбазин, ломустин и винкристин) и высоких доз циклофосфамида.
Нет данных рандомизированных исследований о терапии второй линии. Проведение высокодозной химиотерапии с трансплантацией стволовых клеток периферической крови (костного мозга) является маловероятным в связи с коморбидностью пациентов. Перспективным является включение данных пациентов в клинические исследования.
Возможно проведение лучевой терапии, если ранее она не была выполнена.
4. Реабилитация
Специальных методов реабилитации при ПЛЦНС не существует. Реабилитация при возникновении осложнений в течение заболевания и лечения проводится в рамках соответствующих нозологий. Рекомендуется вести здоровый образ жизни, исключить избыточную инсоляцию и тепловые физиопроцедуры.
5. Профилактика и диспансерное наблюдение
Методов профилактики лимфомы центральной нервной системы в настоящее время не существует, поскольку неизвестен этиологический фактор, ведущий к развитию заболевания. Диспансерное наблюдение гематологом или онкологом осуществляется в период лечения и после достижения ремиссии лимфомы.
Динамическое наблюдение осуществляется через месяц после окончания лечения для подтверждения состояния ремиссии необходимо полное клинико-лабораторное обследование, включающее МРТ головного мозга.
Динамическое наблюдение проводится в первый год 1 раз в 3 месяца, во 2-3 годы – 2 раза в год, далее 1 раз в год до 5 лет или по клиническим показаниям. Необходимо выполнение клинического и биохимического анализов крови, КТ грудной, брюшной полостей и малого таза по показаниям.
6. Дополнительная информация, влияющая на течение и исход заболевания
6.1 Ошибки и необоснованные назначения
Удаление морфологически верифицированной опухоли не проводится в связи с неэффективностью данного метода лечения. Попытка тотального удаления лимфомы часто сопровождается повреждением глубинных структур мозга из-за трудности определения границ опухоли во время операции, что приводит к глубокому неврологическому дефициту и инвалидизации пациента. Наиболее распространенный симптом посттерапевтической нейротоксичности – лейкоэнцефалопатия, проявляющаяся когнитивными нарушениями, а также такими серьезными нарушениями, как слабоумие, нарушения походки и недержание мочи. С лейкоэнцефалопатией связана 30% смертность. Основными факторами риска для развития лейкоэнцефалопатии являются ЛТ, возраст старше 60 лет, интратекальная терапия и химиотерапия после ЛТ [20].
6.2 Лимфомы и беременность
-
Рекомендуется со всеми больными детородного возраста обоих полов обсуждать вопрос о возможности криоконсервации спермы или ткани яичника перед началом терапии.
Комментарии: химиотерапия и облучение области таза могут привести к необратимой стерильности пациента
-
Рекомендуется с женщинами детородного возраста обсуждать вопрос о необходимости гормональной защиты от беременности, а также о методах возможной гормональной защиты яичников при проведении интенсивных программ лечения.
6.3 Прогноз
Прогноз для больных ПЛЦНС в целом неблагоприятный. Продолжительность жизни без лечения не превышает 2-3 мес. На сегодняшний день чаще всего применяется специально разработанный для ПЛЦНС прогностический индекс IELGS, однако его практическое применение требует дополнительных исследований.
Прогностический индекс для ПЛЦНС IELGS
|
Факторы прогноза |
Группа риска |
|
Возраст старше 60 лет |
0-1 фактор – низкий риск (2-лет. ОВ 80%) |
|
ECOG ? 2 |
2-3 фактора – промежуточный риск (2-лет. ОВ 48%) |
|
Повышение ЛДГ |
4-5 факторов – высокий риск (2-лет. ОВ 15%) |
|
Повышение белка в ликворе |
|
|
Поражение глубоких структур мозга |
|
Также могут быть использованы прогностические классы MSKCC (Memorial Sloan-Kettering Cancer Center), более простые и доступные в применении.
Определены три различных прогностических класса в зависимости от возраста и состояния пациента:
-
класс 1 пациенты <50 лет;
-
класс 2 пациенты ? 50, индекс Карновского ? 70;
-
класс 3 пациенты ? 50, индекс Карновского <70.
В то же время статистически значимой зависимости прогноза ПЛЦНС от морфологического варианта по данным литературы не отмечено.
Критерии оценки качества медицинской помощи
Список литературы
|
|
Приложение А1. Состав рабочей группы
Коллектив авторов:
Авторы клинических разделов:
Абдурахманов Джамал Тинович. Доктор медицинских наук, врач-гепатолог, профессор кафедры внутренних, профессиональных болезней и пульмонологии Первого Московского государственного медицинского университета имени И.М. Сеченова, Москва.
Асланиди Ираклий Павлович. Доктор медицинских наук, профессор, руководитель отдела ядерной диагностики ФГБУ «Научный центр сердечно-сосудистой хирургии им. А.Н. Бакулева».
Байков Вадим Валентинович. Доктор медицинских наук, профессор кафедры патологической анатомии, заведующий лабораторией патоморфологии НИИ детской онкологии, гематологии и трансплантологии им. Р.М. Горбачевой Первого СПбГМУ им. акад. И.П. Павлова, Санкт-Петербург.
Бабичева Лали Галимовна. Кандидат медицинских наук, врач-онкогематолог, доцент кафедры онкологии ГБОУ ДПО “Российская медицинская академия последипломного образования”, Москва.
Барях Елена Александровна. Кандидат медицинских наук, врач-гематолог, ассистент кафедры гематологии ГБОУ ДПО “Российская медицинская академия последипломного образования”, Москва.
Виноградова Юлия Николаевна. Доктор медицинских наук, врач-радиотерапевт, ведущий научный сотрудник отделения лучевой терапии системных заболеваний, возглавляет кафедру радиологии и хирургических технологий ФГБУ «Российский научный центр радиологии и хирургических технологий» МЗ РФ, Санкт-Петербург.
Демина Елена Андреевна. Доктор медицинских наук, профессор, врач-онкогематолог, ведущий научный сотрудник отделения химиотерапии гемобластозов ФГБУ «Российский онкологический научный центр им. Н.Н. Блохина» Минздрава России, г. Москва.
Екаева Ирина Викторовна. к.хим.н., отдел ядерной диагностики ФГБУ «Научный центр сердечно-сосудистой хирургии им. А.Н. Бакулева».
Желудкова Ольга Григорьевна. Доктор медицинских наук, профессор, детский онколог высшей категории, главный научный сотрудник лаборатории комплексных методов лечения онкологических заболеваний у детей ФГБУ «РНЦРР» Минздрава России, г. Москва.
Ильин Николай Васильевич. Доктор медицинских наук, профессор, врач-радиотерапевт высшей категории, руководитель радиотерапевтического отделения № 1 ФГБУ "Российский научный центр радиологии и хирургических технологий" МЗ РФ, Санкт-Петербург.
Катунина Татьяна Анатольевна. к.м.н., отдел ядерной диагностики ФГБУ «Научный центр сердечно-сосудистой хирургии им. А.Н. Бакулева».
Ковригина Алла Михайловна. Доктор биологических наук, врач-патоморфолог, профессор кафедры патологической анатомии, цитологии и молекулярной патологии ИПК ФМБА РФ, заведующая патологоанатомическим отделением ФГБУ «Гематологический научный центр» МЗ РФ, Москва.
Константинова Татьяна Семеновна. Кандидат медицинских наук, врач-гематолог, заведующая гематологическим отделением Свердловской областной клинической больницы №1, ассистент кафедры пропедевтики внутренних болезней Уральской государственной медицинской академии, г. Екатеринбург.
Криволапов Юрий Александрович. Доктор медицинских наук, профессор, врач-патологоанатом, заведующий отделением клинической молекулярной морфологии Северо-Западного государственного медицинского университета им. И. И. Мечникова, Санкт-Петербург.
Кузьмин Алексей Александрович. Врач-онколог высшей квалификационной категории, заведующий отделением химиотерапии №2 ГАУЗ "Республиканский клинический онкологический диспансер МЗ РТ", г. Казань.
Левшин Николай Юрьевич. Кандидат медицинских наук, доцент кафедры поликлинической терапии и клинической лабораторной диагностики Ярославской государственной медицинской академии, Ярославль.
Лопаткина Татьяна Николаевна. Кандидат медицинских наук, врач – терапевт, гастроэнтеролог, доцент кафедры терапии, профессиональных болезней и пульмонологии Первого МГМУ им. И.М. Сеченова, Москва.
Мационис Александр Эдуардович. Доктор медицинских наук, академик РАЕН, врач-патоморфолог высшей категории, заведующий лабораторией иммуноморфологии ГБУ Ростовской области «Патолого-анатомическое бюро», Ростов-на-Дону.
Михайлова Наталья Борисовна. Доктор медицинских наук, врач-гематолог, руководитель отдела клинической онкологии (химиотерапии) НИИ детской онкологии, гематологии и трансплантологии им. Р.М. Горбачевой, Санкт-Петербург.
Мухортова Ольга Валентиновна. Доктор медицинских наук, врач-радилог высшей категории, старший научный сотрудник Отдела ядерной диагностики (ПЭТ-центр) на базе Научного центра сердечно-сосудистой хирургии им. А.Н. Бакулева, Москва.
Поддубная Ирина Владимировна. Член-корреспондент РАН, заслуженный деятель образования РФ, доктор медицинских наук, профессор, заведующая кафедрой онкологии, проректор по учебной работе и международному сотрудничеству ГБОУ ДПО «Российская медицинская академия последипломного образования» (РМАПО) МЗ РФ, г. Москва.
Попова Марина Олеговна. Кандидат медицинских наук, врач-гематолог Института детской гематологии и онкологии им. Р.М. Горбачевой, Санкт-Петербург.
Птушкин Вадим Вадимович. Доктор медицинских наук, врач-гематолог, заместитель главного врача ГКБ им С.П.Боткина по гематологии, профессор кафедры онкологии, гематологии и лучевой терапии РНИМУ им. Н. И. Пирогова, Главный внештатный специалист гематолог- трансфузиолог Департамента здравоохранения города Москвы.
Ройтман Евгений Витальевич. Доктор биологических наук, профессор кафедры гематологии, онкологии и лучевой терапии ФГБОУ ВО РНИМУ им. Н.И.Пирогова Минздрава России, г. Москва.
Свешникова Юлия Валентиновна. Врач-гематолог высшей категории, гематологическое отделение Свердловской областной клинической больницы №1.
Снеговой Антон Владимирович. Кандидат медицинских наук, старший научный сотрудник, ФГБУ «Российский онкологический научный центр им. Н.Н. Блохина» РАМН, г. Москва.
Сотников Владимир Михайлович. Доктор медицинских наук, профессор, врач-радиолог, врач-онколог высшей категории, главный научный сотрудник, заведующий лабораторией лучевой терапии научно?исследовательского отдела инновационных технологий в радиотерапии и химиолучевого лечения злокачественных новообразований ФГБУ РНЦРР МЗ РФ, Москва.
Трофимова Оксана Петровна. Доктор медицинских наук, врач-радиолог, ведущий научный сотрудник радиологического отделения РОНЦ им. Н.Н. Блохина, Москва.
Шмаков Роман Георгиевич. Доктор медицинских наук, главный врач ФГБУ "Научный центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова" МЗ РФ, г. Москва.
Юрин Олег Геральдович. Эпидемиолог, старший научный сотрудник Российского научно-методического центра по профилактике и борьбе со СПИДом, г. Москва.
Приложение А2. Методология разработки клинических рекомендаций
Целевая аудитория данных клинических рекомендаций:
-
Гематологи
-
Онкологи
Методология сбора доказательств
Методы, использованные для сбора / селекции доказательств:
Поиск публикаций в специализированных периодических печатных изданиях с импакт-фактором > 0.3;
Поиск в электронных базах данных.
Базы данных, использованных для сбора / селекции доказательств:
Доказательной базой для рекомендаций являются публикации, вошедшие в Кохрайновскую библиотеку, базы данных PUBMED и MEDLINE. Глубина поиска составляла 30 лет.
Методы, использованные для анализа доказательств:
-
Обзоры опубликованных мета-анализов;
-
Систематические обзоры с таблицами доказательств.
Методы, использованные для качества и силы доказательств:
-
Консенсус экспертов;
-
Оценка значимости доказательств в соответствии с рейтинговой схемой доказательств (табл.4,5).
В настоящих клинических рекомендациях в квадратных скобках приведены уровни доказательности рекомендаций, в соответствии со шкалами, разработанными Американским обществом клинической онкологии (ASCO) и Европейским обществом медицинской онкологии (ESMO).
Таблица П1 Уровни доказательности
|
Уровень доказательности |
Тип доказательности |
|
I |
Как минимум одно крупное рандомизированное контролируемое исследование высокого качества (с низкой вороятностью ошибок) или мета-анализ гомогенных рандомизированных исследований высокого качества |
|
II |
Неблольшие рандомизированные исследования или крупные рандомизированные исследования с высокой вероятностью ошибок. Мета-анализ подобных исследований или мета-анализ гетерогенных исследований |
|
III |
Проспективные когортные исследования |
|
IV |
Ретроспективные когортные исследования или исследования «случай-контроль» |
|
V |
Исследования без контрольной группы, отдельные случаи, мнение экспертов |
Таблица П2 Степени доказательности
|
Степень |
Градация |
|
A |
Достоверные данные о высокой клинической эффективности, настоятельно рекомендуется |
|
B |
Достоверные или убедительные данные об умеренной клинической эффективности, рекомендуется |
|
C |
Недостоверные данные об эффективности, которая не перевешивает риск или недостатки лечения (нежелательные явления, стоимость и т.д.), может применяться как один из вариантов |
Индикаторы доброкачественной клинической практики (Good Practice Points – GPPs):
Доброкачественная практика рекомендаций основывается на квалификации и клиническом опыте авторского коллектива.
Методология валидизации рекомендаций
Методы валидизации рекомендаций:
-
Внешняя экспертная оценка;
-
Внутренняя экспертная оценка.
Описание методики валидизации рекомендаций:
Настоящие рекомендации в предварительной версии были рецензированы независимыми экспертами, которых попросили прокомментировать, насколько качественно интерпретированы доказательства и разработаны рекомендации. Также была проведена экспертная оценка изложения рекомендаций и их доступности для понимания.
Рекомендации обсуждены и одобрены ведущими специалистами профильных Федеральных центров РФ и практическими врачами. Проект клинических рекомендаций был рассмотрен на совещаниях рабочей группы в 2015-2016 гг., на Форуме экспертов по вопросам диагностики и лечения злокачественных лимфопролиферативных заболеваний «Лимфорум», ежегодной Российской конференции с международным участием «Злокачественные лимфомы», а также III Конгресса гематологов России.
Окончательная редакция:
Для окончательной редакции и контроля качества рекомендации были повторно проанализированы членами авторского коллектива, которые пришли к заключению, что все существенные замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке сведен к минимуму.
Клинические рекомендации утверждены на XIII Российской конференции с международным участием «Злокачественные лимфомы» в 2016.
Приложение Б. Алгоритмы ведения пациента
Приложение В. Информация для пациентов
Пациент должен четко выполнять все предписания врача относительно времени и сроков выполнения диагностических процедур, а также курсов химиотерапии. Обязательно должен сообщить о нежелательных явлениях, если таковые имеются, во время прохождения лечения.
