Зинфоро - инструкция по применению
Синонимы, аналоги Статьи
Регистрационный номер:
ЛП-001912Торговое название:
Зинфоро® (Zinforo®)Международное непатентованное название:
цефтаролина фосамилЛекарственная форма:
порошок для приготовления концентрата для приготовления раствора для инфузийСОСТАВ
В 1 флаконе содержится:
Активное вещество: цефтаролина фосамила ацетат моногидрат 668,4 мг,эквивалентный цефтаролину фосамилу 600,0 мг.
Вспомогательное вещество: L-аргинин 395,0 мг
ОПИСАНИЕ
Порошок от желтовато-белого до светло-желтого цвета
Фармакотерапевтическая группа:
Антибиотик, цефалоспоринФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА
Фармакодинамика
После внутривенного введения пролекарство цефтаролина фосамил быстро превращается в активный цефтаролин.
Механизм действия
Цефтаролин – антибиотик класса цефалоспоринов с активностью в отношении грамположительных и грамотрицательных микроорганизмов. В исследованиях in vitro показано бактерицидное действие цефтаролина, обусловленное ингибированием биосинтеза клеточной стенки бактерий за счет связывания с пенициллинсвязывающими белками (ПСБ). Цефтаролин проявляет бактерицидную активность в отношении метициллин-резистентного Staphylococcus aureus (MRSA) и в отношении пенициллин-нечувствительного Streptococcus pneumoniae (PNSP) в связи с его высоким сродством к измененным ПСБ этих микроорганизмов.
Связь фармакокинетики и фармакодинамики
Антимикробная активность цефтаролина, также как и других бета-лактамных антибиотиков, лучше всего коррелирует с интервалом времени, в течение которого концентрация препарата остается выше минимальной подавляющей концентрации (МПК) инфицирующего микроорганизма (%T > МПК).
Механизм резистентности
Цефтаролин не активен в отношении штаммов Enterobacteriaceae, продуцирующих бета-лактамазы расширенного спектра (БЛРС) семейств TEM, SHV или CTX-M, сериновые карбапенемазы (такие как KPC), металло-бета-лактамазы класса В или класса С (цефалоспориназы AmpC). Резистентность также может быть связана с нарушением проницаемости клеточной стенки бактерий или с активным выведением антибиотика (эффлюкс). Микроорганизм может обладать одним или несколькими механизмами резистентности.
Перекрестная резистентность
Несмотря на возможное развитие перекрестной резистентности, некоторые штаммы, резистентные к другим цефалоспоринам, могут быть чувствительны к цефтаролину.
Микроорганизмы, обладающие природной резистентностью: Chlamydophila spp. Legionella spp. Mycoplasma spp. Proteus spp. Pseudomonas aeruginosa
Взаимодействие с другими антимикробными препаратами
Исследования in vitro не выявили антагонизма при применении цефтаролина в комбинации с другими часто назначаемыми антимикробными препаратами (такими как амикацин, азитромицин, азтреонам, даптомицин, левофлоксацин, линезолид, меропенем, тигециклин и ванкомицин).
Чувствительность
Чувствительность антибиотиков in vitro меняется в зависимости от географического региона и с течением времени, поэтому при выборе антибактериальной терапии необходимо учитывать местную информацию о резистентности. Если локальная резистентность такова, что эффективность препарата в отношении некоторых инфекций становится сомнительной, необходимо обратиться за консультацией к эксперту. Чувствительность к цефтаролину должна определяться с помощью стандартных методов. Интерпретацию результатов следует проводить в соответствии с локальными руководствами. Клиническая эффективность в отношении отдельных патогенных микроорганизмов Ниже перечислены патогенные микроорганизмы (по показаниям к применению), чувствительные к цефтаролину in vitro, в отношении которых в клинических исследованиях была показана эффективность цефтаролина.
Осложненные инфекции кожи и мягких тканей
Грамположительные микроорганизмы
Staphylococcus aureus (включая метициллин-резистентные штаммы)
Streptococcus pyogenes
Streptococcus agalactiae
Группа Streptococcus anginosus (включает S. anginosus, S. intermedius и S. constellatus) Streptococcus dysgalactiae
Грамотрицательные микроорганизмы
Escherichia coli
Klebsiella pneumoniae
Klebsiella oxytoca
Morganella morganii
Внебольничная пневмония
Грамположительные микроорганизмы
Streptococcus pneumoniaе (включая случаи, сопровождающиеся бактериемией) Staphylococcus aureus (только метициллин-чувствительные штаммы)
Грамотрицательные микроорганизмы
Escherichia coli
Haemophilus influenzae
Haemophilus parainfluenzae
Klebsiella pneumoniae
Эффективность в отношении других значимых патогенных микроорганизмов Клиническая эффективность цефтаролина в отношении перечисленных ниже патогенных микроорганизмов не была установлена, однако результаты исследований in vitro позволяют предполагать, что они чувствительны к цефтаролину в отсутствие приобретенных механизмов резистентности.
Грамположительные анаэробы Peptostreptococcus spp.
Грамотрицательные анаэробы Fusobacterium spp.
Фармакокинетика
Максимальная концентрация (Cmax) и площадь под кривой «концентрация-время» (AUC) цефтаролина увеличиваются почти пропорционально дозе при однократном введении препарата в диапазоне доз от 50 до 1000 мг. Не наблюдалось заметной кумуляции цефтаролина после многократного внутривенного введения препарата в дозе 600 мг в течение 60 минут каждые 12 часов в течение 14 дней здоровым добровольцам с нормальной функцией почек.
Распределение
Степень связывания цефтаролина с белками плазмы низкая (примерно 20%), препарат не проникает в эритроциты. Медиана объема распределения в равновесном состоянии у здоровых взрослых мужчин после однократного внутривенного введения 600 мг цефтаролина фосамила, меченного изотопом, составила 20,3 л, почти как и объем внеклеточной жидкости.
Метаболизм
В плазме крови под действием фосфатаз пролекарство цефтаролина фосамил быстро преобразуется в активный цефтаролин; концентрации пролекарства поддаются измерению в плазме, преимущественно, во время внутривенной инфузии. При гидролизе бета-лактамного кольца цефтаролина образуется микробиологически неактивный метаболит, цефтаролин М-1. Соотношение средних значений AUC цефтаролина М-1 к цефтаролину в плазме крови после однократного внутривенного введения 600 мг цефтаролина фосамила здоровым добровольцам составляет примерно 20-30%. Метаболизм цефтаролина протекает без участия изоферментов системы цитохрома P450.
Экскреция
Цефтаролин выводится, преимущественно, почками. Почечный клиренс цефтаролина примерно равен или немного ниже скорости клубочковой фильтрации в почках. Исследования транспортеров in vitro показывают, что активная секреция не способствует почечной элиминации цефтаролина. Средний период полувыведения цефтаролина у здоровых взрослых людей составляет примерно 2,5 часа. После однократного внутривенного введения 600 мг меченного изотопом цефтаролина фосамила здоровым взрослым мужчинам примерно 88% радиоактивности обнаруживалось в моче и 6% – в фекалиях.
Особые группы пациентов
Почечная недостаточность
После однократной внутривенной инфузии 600 мг цефтаролина фосамила в течение 60 минут Cmax цефтаролина в плазме составила 28,4 ± 6,9 мкг/мл, 28,2 ± 5,4 мкг/мл и 30,8 ± 4,9 мкг/мл у пациентов с нормальной функцией почек, легкой почечной недостаточностью и почечной недостаточностью средней степени тяжести, соответственно. Cmax цефтаролина достигалась приблизительно через 60 минут после начала инфузии. AUC цефтаролина увеличивалась пропорционально степени почечной недостаточности и составила 75,6 ± 9,7 мкг×ч/мл, 92,3 ± 25,3 мкг×ч/мл и 114,8 ± 14,1 мкг×ч/мл у пациентов с нормальной функцией почек, легкой почечной недостаточностью и почечной недостаточностью средней степени тяжести, соответственно. Пациентам с почечной недостаточностью средней и тяжелой степени, терминальной стадией почечной недостаточности, включая пациентов, находящихся на гемодиализе, требуется коррекция дозы (см. раздел «Способ применения и дозы»).
Печеночная недостаточность
Исследования фармакокинетики цефтаролина у пациентов с печеночной недостаточностью не проводили. Так как цефтаролин не подвергается печеночному метаболизму в значительной степени, не ожидается, что печеночная недостаточность будет существенно влиять на системный клиренс цефтаролина. Поэтому не рекомендуется корректировать дозу препарата у пациентов с печеночной недостаточностью.
Пожилые пациенты (≥ 65 лет)
После однократного внутривенного введения 600 мг цефтаролина фосамила параметры фармакокинетики препарата были схожими у здоровых пожилых людей (≥ 65 лет) и здоровых молодых пациентов (18-45 лет). У пожилых добровольцев отмечено небольшое увеличение AUC0-∞ (на 33%), что обусловлено, главным образом, возрастными изменениями функции почек. Не требуется коррекции дозы препарата у пожилых пациентов с клиренсом креатинина выше 50 мл/мин.
Дети
Безопасность и эффективность препарата Зинфоро® у детей в возрасте до 18 лет не установлены.
Пол
Параметры фармакокинетики цефтаролина были схожими у мужчин и женщин. Не требуется коррекции дозы в зависимости от пола пациента.
Раса
Не наблюдалось существенных различий параметров фармакокинетики цефтаролина у пациентов, принадлежащих к разным этническим группам. Не требуется корректировать дозу препарата в зависимости от расы пациента.
ПОКАЗАНИЯ
Препарат Зинфоро® показан для лечения у взрослых следующих инфекций:
• осложненные инфекции кожи и мягких тканей, вызванные чувствительными штаммами следующих грамположительных и грамотрицательных микроорганизмов: Staphylococcus aureus (включая метициллин-резистентные штаммы), Streptococcus pyogenes, Streptococcus agalactiae, Streptococcus anginosus, Streptococcus dysgalactiae, Escherichia coli, Klebsiella pneumoniae, Klebsiella oxytoca и Morganella morganii;
• внебольничная пневмония, вызванная чувствительными штаммами следующих грамположительных и грамотрицательных микроорганизмов: Streptococcus pneumoniae (включая случаи, сопровождающиеся бактериемией), Staphylococcus aureus (только метициллин-чувствительные штаммы), Haemophilus influenzae, Haemophilus parainfluenzae, Klebsiella pneumoniae и Escherichia coli
ПРОТИВОПОКАЗАНИЯ
- Повышенная чувствительность к цефтаролина фосамилу или L-аргинину.
- Повышенная чувствительность к цефалоспоринам.
- Тяжелые реакции повышенной чувствительности немедленного типа (например, анафилактическая реакция) на любое другое антибактериальное средство, имеющее бета-лактамную структуру (например, пенициллины или карбапенемы).
- Детский возраст до 18 лет.
С ОСТОРОЖНОСТЬЮ: судорожный синдром в анамнезе.
ПРИМЕНЕНИЕ ПРИ БЕРЕМЕННОСТИ И В ПЕРИОД ГРУДНОГО ВСКАРМЛИВАНИЯ
Беременность
Клинические данные о применении цефтаролина фосамила у беременных женщин отсутствуют. Исследования на животных не выявили неблагоприятного воздействия цефтаролина фосамила на фертильность, беременность, роды или послеродовое развитие. Препарат Зинфоро® не следует применять во время беременности, за исключением случаев, когда потенциальная польза для матери превышает возможный риск для плода.
Период грудного вскармливания
Данные о проникновении цефтаролина в грудное молоко отсутствуют. Однако, в связи с тем, что многие бета-лактамные антибиотики выделяются с грудным молоком, в случае необходимости терапии препаратом Зинфоро® рекомендуется прекращение грудного вскармливания.
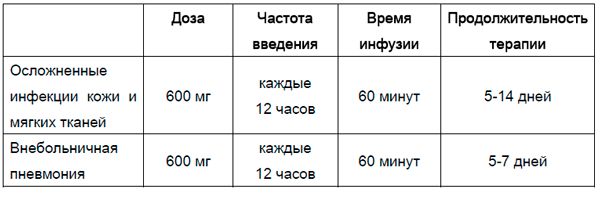
СПОСОБ ПРИМЕНЕНИЯ И ДОЗЫ
Зинфоро® вводится внутривенно в виде инфузии в течение 60 минут (см. «Приготовление раствора для инфузий»).
Продолжительность терапии должна устанавливаться в зависимости от типа и тяжести инфекции, ответа пациента на терапию.
Рекомендуется следующий режим дозирования:
Применение у особых групп пациентов
Почечная недостаточность
Если клиренс креатинина (КК) ≤ 50 мл/мин, дозу препарата следует корректировать следующим образом:
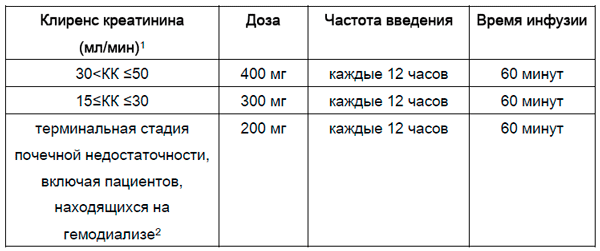
1. Рассчитывается по формуле Кокрофта-Голта.
2. Цефтаролин удаляется при гемодиализе. Препарат следует вводить по окончании процедуры гемодиализа в дни её проведения.
Печеночная недостаточность
Нет необходимости корректировать дозу препарата у пациентов с печеночной недостаточностью.
Пожилые пациенты (≥ 65 лет)
Нет необходимости корректировать дозу препарата у пожилых пациентов с КК > 50 мл/мин.
Дети
Безопасность и эффективность препарата Зинфоро® у детей в возрасте до 18 лет не установлены.
Приготовление раствора для инфузий
При приготовлении и введении препарата необходимо соблюдать стандартные правила асептики. Каждый флакон предназначен только для однократного применения.
Зинфоро® порошок для приготовления концентрата для приготовления раствора для инфузий следует растворить в 20 мл стерильной воды для инъекций. Один мл концентрата содержит 30 мг цефтаролина фосамила. Полученный концентрат представляет собой раствор бледно-желтого цвета, свободный от видимых частиц. Концентрат необходимо немедленно использовать, не хранить (время от начала растворения порошка до полного приготовления раствора для внутривенных инфузий не должно превышать 30 минут).
Для приготовления раствора для инфузий полученный концентрат встряхивают и переносят в инфузионный флакон, содержащий одну из перечисленных ниже совместимых инфузионных жидкостей:
- 0,9% раствор натрия хлорида,
- 5% раствор декстрозы,
- 0,45% раствор натрия хлорида и 2,5% раствор декстрозы,
- раствор Рингер лактат.
При применении дозы препарата 600 мг во флакон с совместимой инфузионной жидкостью переносят весь полученный концентрат (20 мл), при применении дозы 400 мг - 14 мл концентрата. Для применения дозы 300 мг следует перенести 10 мл концентрата, а для дозы 200 мг - 7 мл концентрата. Раствор для инфузий можно приготовить путем добавления концентрата во флакон с инфузионной жидкостью объемом 50 мл, 100 мл или 250 мл. После приготовления раствора для инфузий его следует использовать в течение 6 часов с момента приготовления. Приготовленный раствор для инфузий сохраняет стабильность в течение 24 часов при хранении в холодильнике (2-8°С).
После извлечения из холодильника раствор для инфузий необходимо использовать в течение 6 часов при комнатной температуре.
Неиспользованный препарат или отходы необходимо утилизировать в соответствии с местными требованиями.
ПОБОЧНОЕ ДЕЙСТВИЕ
Объединенные исследования фазы 3
В четырех клинических исследованиях по показаниям осложненные инфекции кожи и мягких тканей и внебольничная пневмония с участием 1305 взрослых пациентов, препарат Зинфоро® назначался в дозе 600 мг в виде внутривенной инфузии продолжительностью 60 минут каждые 12 часов.
Наиболее частыми нежелательными реакциями, развившимися у ≥ 3% больных, получавших цефтаролин, были диарея, головная боль, тошнота и зуд, которые были обычно слабо или умеренно выраженными.
Дополнительные исследования фазы 3
В исследовании по показанию внебольничная пневмония, которое проводилось в азиатских странах с участием 381 взрослого пациента, профиль безопасности препарата Зинфоро® (600 мг в виде внутривенной инфузии продолжительностью 60 минут каждые 12 часов) соответствовал профилю безопасности в объединенных клинических исследованиях фазы 3 по показаниям осложненные инфекции кожи и мягких тканей и внебольничная пневмония.
В исследовании по показанию осложненные инфекции кожи и мягких тканей с участием 506 взрослых пациентов препарат Зинфоро® назначался в дозе 600 мг в виде внутривенной инфузии продолжительностью 120 минут каждые 8 часов (см. далее по тексту раздела и раздел «Особые указания»).
Ниже представлены нежелательные реакции, отмечавшиеся в объединенных клинических исследованиях фазы 3 по показаниям осложненные инфекции кожи и мягких тканей и внебольничная пневмония (1305 взрослых пациентов в группе терапии Зинфоро®). Частота нежелательных реакций представлена в виде следующей градации: очень часто (≥ 1/10), часто (≥ 1/100, < 1/10), нечасто (≥ 1/1000, < 1/100), редко (≥ 1/10000, < 1/1000).
Частота развития нежелательных реакций по классу системы органов
|
Органы и системы |
Нежелательная реакция |
|
Лабораторные показатели |
Очень часто: положительная прямая проба Кумбса1 |
|
Нечасто: удлинение протромбинового времени, |
|
|
удлинение активированного частичного тромбопластинового времени, увеличение международного нормализованного отношения |
|
|
Желудочно-кишечный тракт |
Часто: диарея, тошнота, рвота, боль в животе, запор |
|
Нервная система |
Часто: головная боль, головокружение |
|
Нечасто: судороги |
|
|
Кожа и подкожные ткани |
Часто: сыпь, зуд |
|
Нечасто: крапивница |
|
|
Печень и желчевыводящие пути |
Часто: повышение активности трансаминаз |
|
Нечасто: гепатит |
|
|
Сердечно-сосудистая система |
Часто: флебит, брадикардия |
|
Нечасто: ощущение сердцебиения |
|
|
Обмен веществ и питание |
Часто: гипергликемия, гипокалиемия |
|
Нечасто: гиперкалиемия |
|
|
Общие расстройства и реакции в месте введения |
Часто: лихорадка, реакции в месте инфузии (эритема, флебит, боль) |
|
Кровь и лимфатическая система |
Нечасто: анемия, лейкопения, нейтропения, тромбоцитопения |
|
Редко: эозинофилия |
|
|
Иммунная система |
Нечасто: гиперчувствительность / анафилаксия1,2, отек губ и лица |
|
Инфекции и инвазии |
Нечасто: колит, вызванный Clostridium difficile1 |
|
Почки и мочевыводящие пути |
Нечасто: нарушение функции почек (повышение концентрации креатинина крови) |
1. См. раздел «Особые указания».
2. См. раздел «Противопоказания».
Описание отдельных нежелательных реакций
Сыпь
Сыпь часто отмечалась у пациентов с осложненными инфекциями кожи и мягких тканей, получавших цефтаролина фосамил в дозе 600 мг как в виде внутривенной инфузии продолжительностью 60 минут каждые 12 часов (в объединенных исследованиях фазы 3), так и в виде внутривенной инфузии продолжительностью 120 минут каждые 8 часов. Однако в подгруппе пациентов монголоидной расы, получавших цефтаролина фосамил каждые 8 часов, сыпь отмечалась очень часто (18,5%).
ПЕРЕДОЗИРОВКА
Данные о передозировке ограничены. Вероятность передозировки выше у пациентов с нарушением функции почек. При применении препарата в дозах выше рекомендованных наблюдались схожие нежелательные реакции, как и при применении препарата в рекомендованных дозах.
Лечение: симптоматическое. Цефтаролин частично выводится с помощью гемодиализа.
ВЗАИМОДЕЙСТВИЕ С ДРУГИМИ ЛЕКАРСТВЕННЫМИ СРЕДСТВАМИ И ДРУГИЕ ВИДЫ ЛЕКАРСТВЕННОГО ВЗАИМОДЕЙСТВИЯ
Клинические исследования по изучению лекарственного взаимодействия с цефтаролином не проводились.
В исследованиях in vitro цефтаролин не ингибировал изоферменты цитохрома P450 CYP1A1, CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E1 и CYP3A4 и не индуцировал изоферменты CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19, или CYP3A4/5. В связи с этим вероятность взаимодействия цефтаролина с препаратами, которые метаболизируются под действием изоферментов системы цитохрома Р450, низка.
Цефтаролин не метаболизируется под действием изоферментов цитохрома P450 in vitro, поэтому, маловероятно влияние на параметры фармакокинетики цефтаролина при совместном применении с индукторами или ингибиторами изоферментов цитохрома P450. In vitro цефтаролин не переносится эффлюксными транспортерами P-gp или BCRP. Цефтаролин не ингибирует P-gp, следовательно, взаимодействие с субстратами, такими как дигоксин, не ожидается. Цефтаролин является слабым ингибитором BCRP, но данный эффект не имеет клинической значимости. Исследования in vitro показали, что цефтаролин не является субстратом, и не ингибировал транспортеры органических катионов (OCT2) и анионов (OAT1, OAT3) в почках; поэтому, маловероятно взаимодействие с препаратами, которые ингибируют активную почечную секрецию (например, пробенецид) или с препаратами, которые являются субстратами этих транспортеров.
Взаимодействие с другими антибактериальными препаратами
Тесты in vitro не выявили антагонизма при совместном применении цефтаролина и других часто используемых антибактериальных препаратов (например, амикацина, азитромицина, азтреонама, даптомицина, левофлоксацина, линезолида, меропенема, тигециклина и ванкомицина).
ОСОБЫЕ УКАЗАНИЯ
При применении препарата необходимо руководствоваться официальными рекомендациями по надлежащему использованию антибактериальных препаратов.
Реакции гиперчувствительности
Как и при применении всех бета-лактамных антибиотиков, возможно развитие серьёзных реакций гиперчувствительности (иногда с летальным исходом).
У пациентов с гиперчувствительностью к цефалоспоринам, пенициллинам или другим бета-лактамным антибиотикам в анамнезе может также развиться аллергическая реакция на цефтаролина фосамил. Перед началом терапии препаратом Зинфоро® следует тщательно изучить данные пациента на предмет выявления реакций гиперчувствительности к бета-лактамным антибиотикам.
Препарат противопоказан пациентам с повышенной чувствительностью к цефалоспоринам в анамнезе. Также препарат противопоказан пациентам, у которых ранее отмечались тяжелые реакции повышенной чувствительности немедленного типа (например, анафилактическая реакция) на любое другое антибактериальное средство, имеющее бета-лактамную структуру (например, пенициллины или карбапенемы). При развитии тяжелой аллергической реакции необходимо прекратить введение лекарственного препарата и принять соответствующие меры.
Диарея, ассоциированная с Clostridium difficile
При применении почти всех антибактериальных препаратов, в том числе препарата Зинфоро®, сообщалось о развитии антибиотикоассоциированного колита и псевдомембранозного колита, которые могут варьировать по тяжести от легких до угрожающих жизни форм. Следует принимать во внимание возможность развития колита при возникновении диареи на фоне применения цефтаролина фосамила. В этом случае необходимо прекратить терапию препаратом Зинфоро®, проводить поддерживающие мероприятия и назначить специфическое лечение Clostridium difficile.
Пациенты с судорожным синдромом в анамнезе
Как и при применении других цефалоспоринов, в исследованиях токсичности цефтаролина наблюдалось развитие судорог при приеме препарата в дозах, превышающих Сmax в 7-25 раз. Опыт применения цефтаролина у пациентов с судорожным синдромом в анамнезе ограничен, в связи с чем следует соблюдать осторожность при применении препарата Зинфоро® у этой группы пациентов.
Прямой антиглобулиновый тест (проба Кумбса) Положительный прямой антиглобулиновый тест (ПАТ) может быть получен на фоне применения цефалоспоринов. Частота положительного ПАТ у пациентов, получавших цефтаролина фосамил в дозе 600 мг в виде внутривенной инфузии продолжительностью 60 минут каждые 12 часов, составила 10,7% в объединенных исследованиях фазы 3 и 32,3% в исследовании, где цефтаролина фосамил назначался в дозе 600 мг в виде внутривенной инфузии продолжительностью 120 минут каждые 8 часов. Ни у одного пациента с положительным ПАТ на фоне применения цефтаролина фосамила не выявлены признаки гемолиза.
Нечувствительные микроорганизмы
При применении цефтаролина фосамила, как и других антибиотиков, может развиться суперинфекция.
ВЛИЯНИЕ НА СПОСОБНОСТЬ УПРАВЛЯТЬ ТРАНСПОРТНЫМИ СРЕДСТВАМИ, МЕХАНИЗМАМИ
Не проводилось исследований по изучению влияния препарата Зинфоро® на способность к вождению автотранспорта и управлению иными механизмами. Во время терапии может возникать головокружение, поэтому следует соблюдать осторожность при управлении транспортными средствами и при занятиях другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций. При появлении описанного выше нежелательного явления следует воздержаться от выполнения указанных видов деятельности.
ФОРМА ВЫПУСКА
Порошок для приготовления концентрата для приготовления раствора для инфузий, 600 мг.
По 600 мг активного вещества в прозрачные стеклянные флаконы вместимостью 20 мл (тип I Евр.Фарм.) закрытые бромбутиловой резиновой пробкой с покрытием из фторированного полимера, закрытой сверху алюминиевым колпачком c полипропиленовой крышкой (“флип-офф”). По 1 или 10 флаконов с инструкцией по применению в картонную пачку с контролем первого вскрытия.
УСЛОВИЯ ХРАНЕНИЯ
При температуре не выше 30 °С. Хранить в местах, недоступных для детей.СРОК ГОДНОСТИ
3 года. Не применять по истечении срока годности, указанного на упаковке.УСЛОВИЯ ОТПУСКА
По рецепту.ПРОИЗВОДИТЕЛЬ
ЭйСиЭс Добфар С.п.А. Виале Аддетта 4/12, 20067 Трибиано, Милан, Италия ACS Dobfar S.p.A. Viale Addetta, 4/12, 20067 Tribiano, Milano, Italy
ФАСОВЩИК (ПЕРВИЧНАЯ УПАКОВКА), УПАКОВЩИК (ВТОРИЧНАЯ (ПОТРЕБИТЕЛЬСКАЯ) УПАКОВКА), ВЫПУСКАЮЩИЙ КОНТРОЛЬ КАЧЕСТВА
Факта Фармачеутичи С.п.А.
Нуклео Индастриале С. Атто, 64100 Терамо, Италия
Facta Farmaceutici S.p.A
Nucleo Industriale S. Atto, 64100 Teramo, Italy
Дальнейшая информация предоставляется по требованию:
Представительство АстраЗенека ЮК Лимитед Великобритания в г. Москве и ООО АстраЗенека Фармасьютикалз:
125284 Москва, ул. Беговая д. 3, стр. 1
