Микамин - инструкция по применению
Синонимы, аналоги СтатьиРегистрационное удостоверение:
ЛСР-009005/09Торговое название:
МикаминМеждународное непатентованное название:
микафунгинЛекарственная форма:
лиофилизат для приготовления раствора для инфузийСостав на один флакон:
Активное вещество: микафунгин (в виде микафунгина натрия) 50 мг или 100
Вспомогательные вещества: лактозы моногидрат 200 мг, лимонная кислота безводная q.s. до pH от 5,0 до 7,0, натрия гидроксид q.s. до pH от 5,0 до 7,0.
Описание:
лиофилизированная масса белого цвета.Фармакотерапевтическая группа
противогрибковые препараты для системного применения, другие противогрибковые препараты для системного применения
Код ATX:
[J02AX05].
Фармакологические свойства
ФармакодинамикаМеханизм действия
Микафунгин неконкурентно подавляет синтез 1,3-p-D-глюкана, важного компонента клеточной стенки грибов. 1,3-p-D-глюкан отсутствует в клетках млекопитающих. Микафунгин обладает фунгицидной активностью в отношении грибов рода Candida spp. и значительно подавляет активный рост гиф Aspergillus spp.
Спектр активности
Микафунгин in vitro активен в отношении различных видов Candida spp, в т.ч. Candida albicans, Candida glabrata, Candida tropicalis, Candida krusei, Candida kefyr, Candida parapsilosis, Candida guilliermondii,Candida lusitaniae, в отношении чувствительных к микафунгину видов из рода Aspergillus spp.: Aspergillus fumigatus, Aspergillus flavus, Aspergillus niger, Aspergillus terreus, Aspergillus nidulans, Aspergillus versicolor, а также диморфных грибов (Histoplasma capsulatum, Blastomyces dermatitidis, Coccidioides immitis). Препарат in vitro не активен против Cryptococcus spp., Pseudallescheria spp., Scedosporium spp., Fusarium spp., Trichosporon spp. и Zygomycetes spp. Вероятность развития вторичной резистентности к препарату является очень низкой.
Вид грибов рода Candida | Минимальная ингибирующая концентрация, мг/л (Европейские данные) |
Candida albicans | [0,007-0,25] |
Candida glabrata | [0,007-0,12] |
Candida tropicalis | [0,007-0,12] |
Candida krusei | [0,015-0,12] |
Candida kefyr | [0,03 - 0,06] |
Candida parapsilosis | [0,12 - 2] |
Candida guilliermondii | [0,5] |
Candida lusitaniae | [0,12-0,25] |
Candida spp. (в том числе C famata, C. dubliniensis, C. lipolytica, C. pelliculosa, C. rugosa, C. stellatoidea и C.zeylanoides) | [0,015-0,5] |
Фармакокинетика
Препарат вводят внутривенно. В диапазоне суточных доз 12,5-200 мг и 3-8 мг/кг микафунгин характеризуется линейной фармакокинетикой. Нет данных о системной кумуляции препарата при повторном введении, равновесная концентрация устанавливается в течение 4-5 дней с момента начала применения.
Распределение
После внутривенного введения концентрация микафунгина биэкспоненциально снижается. Микафунгин быстро распределяется в тканях. В системном кровотоке микафунгин активно связывается с белками плазмы (> 99%), главным образом, с альбумином. Связывание с альбумином остается стабильным в диапазоне концентраций 10-100 мкг/мл. Объем распределения при достижении равновесной концентрации (Vss) составляет 18-19 л.
Метаболизм
Микафунгин циркулирует в системном кровотоке преимущественно в неизмененном виде. Было показано, что микафунгин метаболизируется с образованием нескольких соединений; из них М-1 (катехоловая форма), М-2 (метоксипроизводное М-1) и М-5 (образуется в результате гидроксилирования боковой цепи) производные микафунгина определяются в небольших количествах в системном кровотоке. Метаболиты не оказывают существенного влияния на эффективность микафунгина.
Несмотря на то, что in vitro микафунгин может метаболизироваться изоферментами CYP3A, гидроксилирование при участии изоферментов CYP3A не является основным путем метаболизма препарата in vivo.
Элиминация и экскреция
Период полувыведения микафунгина (Т1/2) составляет 10 - 17 ч, не меняется в диапазоне доз до 8 мг/кг после однократного и повторных введений препарата. Общий клиренс у здоровых добровольцев и взрослых пациентов как при однократном, так и при повторных введениях, составил 0,15-0,3 мл/мин/кг и не зависел от дозы. Через 28 дней после однократного введения 25 мг 14С-микафунгина здоровым добровольцам только 11,6% радиоактивной метки обнаруживали в моче, а 71,0% - в фекалиях, что свидетельствует о преимущественно непочечной элиминации микафунгина. Метаболиты М-1 и М-2 обнаруживали в плазме в следовых концентрациях, а метаболит М-5 составил 6,5% от исходного соединения.
Фармакокинетика у различных групп пациентов
Дети: у детей величина площади под фармакокинетической кривой «концентрация-время» (AUC) пропорциональна дозе препарата в диапазоне 0,5-4 мг/кг. Клиренс зависит от веса: средние величины клиренса у детей младшего возраста от 4 месяцев до 5 лет и у детей в возрасте от 6 до 11 лет примерно в 1,35 и 1,14 раза соответственно выше, чем у детей старшего возраста (12 - 16 лет) и взрослых. Средний клиренс у детей младше 4-месячного возраста примерно в 2,6 раз выше, чем у детей старшего возраста (12 - 16 лет) и в 2,3 раза выше, чем у взрослых.
Связующее исследование фармакокинетики и фармакодинамики показало дозозависимое проникновение микафунгина в центральную нервную систему (ЦНС) с минимальным значением AUC 170 мкг*час/л, необходимым для достижения максимальной эрадикационной активности в отношении грибковой инфекции в тканях ЦНС. При помощи популяционного моделирования фармакокинетики было установлено, что доза 10 мг/кг у детей в возрасте до 4 месяцев будет достаточной для достижения целевой концентрации микафунгина в лечении инфекций ЦНС, вызванных грибами рода Candida.
Пожилые пациенты: при инфузионном введении 50 мг микафунгина в течение 1 ч фармакокинетические параметры у лиц пожилого возраста (66-78 лет) существенно не отличались от таковых у молодых (20-24 года).
Пациенты с нарушенной функцией печени: в исследовании, проводившемся с участием 8 пациентов с нарушением функции печени средней степени тяжести (индекс Чайлд-Пью -7-9), фармакокинетика микафунгина незначительно отличалась от фармакокинетики у 8 здоровых добровольцев. В исследовании, проводившемся с участием 8 пациентов с тяжелой печеночной недостаточностью (индекс Чайлд-Пью - 10-12) наблюдалась сниженная концентрация микафунгина в плазме и повышенная концентрация в плазме гидроксида метаболита (М-5) по сравнению с данными, полученными у 8 здоровых добровольцев.
Пациенты с почечной дисфункцией: тяжелая почечная недостаточность (клубочковая фильтрация < 30 мл/мин) не оказывала существенного влияния на фармакокинетику микафунгина.
Пол/раса: пол и раса не оказывали существенного влияния на фармакокинетические параметры микафунгина.
Показания к применению
Взрослые (в т.ч. пожилые) и подростки ≥ 16 лет:- лечение инвазивного кандидоза;
- лечение кандидоза пищевода у пациентов, которым требуется внутривенное применение противогрибковых препаратов;
- профилактика кандидоза у пациентов после аллогенной трансплантации кроветворных стволовых клеток или больных, у которых предполагается нейтропения (количество нейтрофилов < 500/мкл) в течение 10 дней и более.
Дети (в т.ч. новорожденные) и подростки < 16 лет:
- лечение инвазивного кандидоза;
- профилактика кандидоза у пациентов после аллогенной трансплантации кроветворных стволовых клеток или больных, у которых предполагается нейтропения (количество нейтрофилов < 500/мкл) в течение 10 дней и более.
Противопоказания к применению
Гиперчувствительность к активному веществу, к другим эхинокандинам или любому из вспомогательных компонентов или их непереносимость (непереносимость галактозы, недостаточность лактазы, глюкозо-галактозная мальабсорбция).С осторожностью
Тяжелые нарушения функции печени, хронические заболевания печени (фиброз печени, цирроз печени, вирусный гепатит, неонатальные заболевания печени или врожденные дефекты ферментов), сопутствующая гепатотоксическая и/или генотоксическая терапия, детский возраст (особенно до 1 года), почечная недостаточность, одновременное применение с сиролимусом, нифедипином, итраконазолом и амфотерицином В.Применение при беременности и в период грудного вскармливания
БеременностьКлинического опыта применения препарата у беременных нет. В исследованиях на животных отмечалось проникновение микафунгина через плацентарный барьер, а также репродуктивная токсичность. Поэтому Микамин® следует применять во время беременности, только после тщательной оценки соотношения риск/польза.
Период грудного вскармливания
Неизвестно, проникает ли микафунгин в грудное молоко. Решение о продолжении/прекращении грудного вскармливания или о продолжении/прекращении лечения препаратом Микамин® следует принимать, учитывая пользу грудного вскармливания для ребенка и пользу лечения препаратом Микамин® для матери.
Фертильность
В исследованиях на животных отмечались токсические эффекты в отношении тестикул. Микафунгин может нарушать репродуктивную функцию мужчин.
Способ применения и дозы
Микамин® предназначен для внутривенного введения.Режим дозирования препарата Микамин® с учетом показаний, возраста и массы тела пациента представлен в таблицах.
Режим дозирования препарата Микамин® у взрослых, подростков ≥16 лет и пациентов пожилого возраста:
Показание | Масса тела > 40 кг | Масса тела ≤ 40 кг |
Лечение инвазивного кандидоза | 100 мг/день* | 2 мг/кг/день* |
Лечение кандидоза пищевода | 150 мг/день | 3 мг/кг/день |
Профилактика кандидоза | 50 мг/день | 1 мг/кг/день |
*Если у пациента наблюдается недостаточный ответ - например, в посевах продолжает обнаруживаться возбудитель или клиническое состояние не улучшается - дозу можно увеличить до 200 мг/сутки у пациентов с массой тела > 40 кг или до 4 мг/кг/сутки у пациентов с массой тела ≤ 40 кг.
Режим дозирования препарата Микамин® у детей в возрасте ≥ 4 месяцев и подростков в возрасте <16 лет:
Показание | Масса тела > 40 кг | Масса тела ≤ 40 кг |
Лечение инвазивного кандидоза | 100 мг/день* | 2 мг/кг/день* |
Профилактика кандидоза | 50 мг/день | 1 мг/кг/день |
* Если у пациента наблюдается недостаточный ответ - например, в посевах продолжает обнаруживаться возбудитель или клиническое состояние не улучшается - дозу можно увеличить до 200 мг/сутки у пациентов с массой тела > 40 кг или до 4 мг/кг/сутки у пациентов с массой тела ≤ 40 кг.
Режим дозирования препарата Микамин® у детей (включая новорожденных) < 4 месяцев:
Показание к применению | |
Лечение инвазивного кандидоза | 4-10 мг/кг/сутки* |
Профилактика инфекций, вызванных Candida | 2 мг/кг/сутки |
* При лечении инвазивного кандидоза у детей в возрасте младше 4 месяцев применение препарата в дозе 4 мг/кг обеспечивает экспозицию микафунгина, достигаемую у взрослых при назначении препарата в дозе 100 мг/сутки. При подозрении на инфекцию ЦНС препарат следует применять в более высокой дозе (например, 10 мг/кг) в связи с дозозависимым проникновением микафунгина в ЦНС.
Безопасность и эффективность лечения инвазивного кандидоза с вовлечением ЦНС у детей (включая новорожденных) в возрасте младше 4 месяцев препаратом в дозах 4 мг/кг и 10 мг/кг не были достаточно изучены в контролируемых клинических исследованиях.
Длительность лечения
Лечение инвазивного кандидоза по продолжительности должно составлять не менее 14 дней. Противогрибковое лечение следует продолжать в течение, по меньшей мере, одной недели после получения двух последовательных отрицательных результатов исследования крови и исчезновения клинических признаков кандидоза.
Для лечения кандидоза пищевода Микамин® следует применять, по меньшей мере, в течение одной недели после разрешения клинических признаков.
Для профилактики кандидоза Микамин® следует применять, по меньшей мере, в течение одной недели после восстановления концентрации нейтрофилов. Опыт профилактического применения препарата Микамин® у детей младше 2 лет ограничен.
Режим дозирования у отдельных категорий пациентов
Пол/раса: коррекция дозы в зависимости от пола или рассы не требуется.
Пациенты с нарушением функции печени
При легкой и средней степени тяжести нарушениях функции печени коррекция режима дозирования препарата не требуется. В настоящее время недостаточно данных о применении препарата Микамин® у пациентов с тяжелой печеночной недостаточностью, поэтому использовать его у данной категории пациентов не рекомендуется.
Пациенты с нарушением функции почек
При почечной недостаточности режим дозирования не меняется.
Способ применения
Раствор препарата Микамин® для инфузии готовят при комнатной температуре с соблюдением правил асептики следующим образом:
1. Пластиковый колпачок снимают с флакона, пробку дезинфицируют спиртом.
2. 5 мл 0,9% раствора хлорида натрия для инфузий или 5% раствора декстрозы, отбираемых из флакона/пакета на 100 мл, в асептических условиях медленно вводят в каждый флакон с порошком по внутренней стенке. При приготовлении раствора свести к минимуму количество образующейся пены. Необходимо использовать указанное в таблице количество флаконов препарата Микамин®, чтобы получить необходимую для инфузии дозу препарата в мг (см. таблицу ниже).
3. Флакон следует поворачивать осторожно. НЕ ВСТРЯХИВАТЬ. Порошок должен раствориться полностью. Концентрат следует использовать немедленно. Флакон предназначен для однократного применения. Неиспользованный раствор следует выбросить.
4. Полученный концентрат забирают из флакона и перемещают в флакон/пакет с инфузионным раствором, из которого он был первоначально взят (см. п. 2). Приготовленный раствор для инфузий следует использовать немедленно. После разведения вышеуказанным способом химическая и физическая стабильность во время использования составляет 96 часов при хранении в защищенном от света месте при температуре 25° С.
5. Флакон/пакет для инфузий следует осторожно перевернуть, но НЕ взбалтывать, чтобы избежать образования пены. Не используйте раствор, если он мутный или содержит осадок.
6. Флакон/пакет, содержащий приготовленный раствор для инфузий, следует поместить в закрывающийся непрозрачный мешок для защиты от света.
Таблица.
Приготовление раствора для инфузии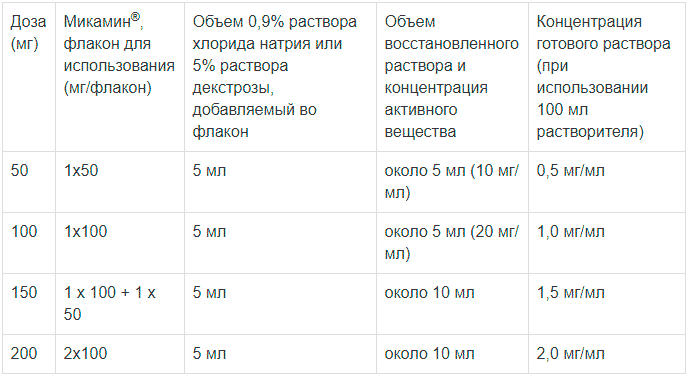
Готовый раствор для инфузий вводят внутривенно капельно в течение около 1 часа. Более быстрая инфузия может увеличивать риск гистамин-опосредованных реакций.
Восстановленный раствор во флаконе
Химическая и физическая стабильность сохраняется до 48 ч при 25°С, если в качестве растворителя используется 0,9% раствор хлорида натрия или 5% раствор декстрозы.
Готовый раствор для инфузий
Химическая и физическая стабильность сохраняется до 96 часов при 25 °С, если обеспечивается защита от света, а в качестве растворителя используется 0,9% раствор хлорида натрия или 5% раствор декстрозы. Микамин® не содержит консервантов. Приготовленные растворы следует использовать немедленно. В норме время хранения не должно превышать 24 ч при температуре от 2 до 8°С.
Побочное действие
При анализе данных по безопасности в зависимости от пола или расы не было выявлено клинически значимых различий.Нежелательные реакции по разным органам и системам с указанием частоты приведены ниже: часто: ≥ 1/100 - < 1/10, нечасто: ≥ 1/1000 - < 1/100, редко: ≥ 1/10 000 - < 1/1000, частота неизвестна (невозможно оценить на основании имеющихся данных). В рамках каждой группы реакции перечислены по мере снижения степени серьезности.
Нарушения со стороны крови и лимфатической системы
часто: лейкопения, нейтропения, анемия;
нечасто: панцитопения, тромбоцитопения, эозинофилия, гипоальбуминемия;
редко: гемолитическая анемия, гемолиз;
частота неизвестна: диссеминированное внутрисосудистое свертывание.
Нарушения со стороны иммунной системы
нечасто: анафилактические/анафилактоидные реакции, реакции гиперчувствительности.
Эндокринные нарушения
нечасто: потливость.
Нарушения метаболизма и питания
часто: гипокалиемия, гипомагниемия, гипокальциемия;
нечасто: гипонатриемия, гиперкалиемия, гипофосфатемия, анорексия.
Психические нарушения
нечасто: бессонница, тревожность, спутанность сознания.
Нарушения со стороны нервной системы
часто: головная боль;
нечасто: сонливость, тремор, головокружение, извращение вкуса.
Нарушения со стороны сердца
нечасто: тахикардия, учащенное сердцебиение, брадикардия.
Нарушения со стороны сосудов
часто: флебит (преимущественно у ВИЧ-инфицированных пациентов с периферическими катетерами);
нечасто: артериальная гипотензия, артериальная гипертензия, приливы;
частота неизвестна: шок.
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения
нечасто: одышка.
Желудочно-кишечные нарушения
часто: тошнота, рвота, диарея, боль в животе;
нечасто: диспепсия, запор.
Нарушения со стороны печени и желчевыводящих путей
часто: повышение активности щелочной фосфатазы, повышение активности аспартатаминотрансферазы, повышение активности аланинаминотрансферазы, повышение концентрации билирубина в сыворотке крови (включая гипербилирубинемию), изменение функциональных печеночных тестов;
нечасто: печеночная недостаточность, повышение активности гамма глутамилтранспептидазы, желтуха, холестаз, гепатомегалия, гепатит;
частота неизвестна: гепатоцеллюлярные поражения, в т.ч. случаи летального исхода.
Нарушения со стороны кожи и подкожных тканей
часто: сыпь;
нечасто: крапивница, зуд, эритема;
частота неизвестна: токсические высыпания на коже, многоформная эритема, синдром Стивенса-Джонсона, токсический эпидермальный некролиз.
Нарушения со стороны почек и мочевыводящих путей
нечасто: повышение концентрации креатинина, мочевины в сыворотке крови, прогрессирование почечной недостаточности;
частота неизвестна: нарушение почечной функции, острая почечная недостаточность.
Общие нарушения и реакции в месте введения
часто: гипертермия, озноб;
нечасто: тромбоз в месте инъекции, воспаление в месте инфузии, боль в месте инъекции; периферический отек.
Лабораторные и инструментальные данные
нечасто: повышение активности лактатдегидрогеназы в сыворотке крови.
Описание отдельных нежелательных реакций
Возможные симптомы, напоминающие аллергическую реакцию: в клинических исследованиях наблюдались такие симптомы, как сыпь и озноб. Большинство из них носили легкий или умеренный характер и не приводили к прекращению лечения. Серьезные реакции (например, анафилактоидная реакция 0,2 %, 6/3028) встречались нечасто во время лечения микафунгином и лишь у пациентов с серьезными фоновыми заболеваниями (например, прогрессирующим СПИДом, злокачественными новообразованиями), нуждающихся в многочисленных сопутствующих лекарственных препаратах.
Нежелательные реакции со стороны печени: общая частота нежелательных реакций со стороны печени у пациентов, получавших микафунгин в клинических исследованиях, составляла 8,6 % (260/3028). Большинство нежелательных реакций со стороны печени носили легкий или умеренный характер. Наиболее частыми реакциями являлись повышение щелочной фосфатазы (2,7 %), аспартатаминотрансферазы (2,3 %), аланинаминотрансферазы (2,0%), билирубина крови (1,6%) и отклонение от нормы показателей функции печени (1,5%). Небольшое число пациентов (1,1%, 0,4% с серьезными реакциями) прекратили лечение в связи с развитием осложнения со стороны печени. Случаи серьезного нарушения функции печени отмечались нечасто.
Реакции в месте инъекции: ни одна из нежелательных реакций в месте инъекции не приводила к ограничению лечения.
Педиатрические пациенты
Частота некоторых нежелательных реакций, перечисленных ниже, у детей была выше, чем у взрослых. Кроме того, у детей до 1 года в два раза чаще, чем у детей старшего возраста, выявляли увеличение активности аланинаминотрансферазы, аспартатаминотрансферазы и щелочной фосфатазы. В клинических исследованиях, вероятно, это было связано с различиями в фоновых заболеваниях по сравнению со взрослыми и детьми старшего возраста. В момент включения в исследование количество детей с нейтропенией (40,2 % детей и 7,3 % взрослых), с аллогенной трансплантацией гемопоэтических стволовых клеток (29,4% детей и 13,4% взрослых) и гематологическими злокачественными новообразованиями (29,1% детей и 8,7% взрослых) было в несколько раз выше, чем взрослых.
Нарушения со стороны крови и лимфатической системы
часто: тромбоцитопения.
Нарушения со стороны сердца
часто: тахикардия.
Нарушения о стороны сосудов
часто: артериальная гипертензия, артериальная гипотензия.
Нарушения со стороны печени и желчевыводящих путей
часто: гипербилирубинемия, гепатомегалия.
Нарушения со стороны почек и мочевыводящих путей
часто: острая почечная недостаточность, повышение концентрации мочевины в сыворотке крови.
Передозировка
В ходе клинических исследований взрослым пациентам назначались повторные суточные дозы до 8 мг/кг (максимальная общая доза 896 мг), при этом признаков дозолимитирующей токсичности не отмечалось. В одном спонтанном случае сообщалось о применении дозы 16 мг/кг/сутки у новорожденного пациента. Нежелательных реакций, связанных с такой высокой дозой, не наблюдалось.Нет данных о передозировке микафунгина. В случае возможной передозировки следует применять общие поддерживающие меры и симптоматическое лечение. Микафунгин характеризуется высокой степенью связывания с белками и не выводится при диализе.
Взаимодействие с другими лекарственными средствами
Микафунгин обладает низким потенциалом взаимодействий с лекарственными средствами, которые метаболизируются с участием изоферментов CYP3A.Микамин® нельзя смешивать или вводить пациентам одновременно с другими фармацевтическими продуктами, за исключением 0,9% раствора хлорида натрия и 5% раствора декстрозы.
При одновременном применении микафунгина с такими препаратами, как микофенолата мофетил, циклоспорин, такролимус, преднизолон, сиролимус, нифедипин, флуконазол, ритонавир, рифампицин, итраконазол, вориконазол и амфотерицин В, коррекции режима дозирования микафунгина не требуется.
При использовании микафунгина AUC итраконазола, сиролимуса и нифедипина незначительно увеличивалась - на 22%, 21% и 18%, соответственно.
Совместное применение микафунгина и амфотерицина В дезоксихолата ассоциировалось с 30 % повышением экспозиции амфотерицина В дезоксихолата. Поскольку это может иметь клиническое значение, к такому совместному применению следует прибегать только в том случае, если польза явно превышает риск, с тщательным контролем токсичности амфотерицина В дезоксихолата.
Пациентам, получающим сиролимус, нифедипин или итраконазол в комбинации с препаратом Микамин®, необходим мониторинг с целью выявления токсического действия сиролимуса, нифедипина или итраконазола и, при необходимости, снижения дозы указанных препаратов.
Особые указания
При введении микафунгина возможны анафилактические/анафилактоидные реакции, включая шок. При их возникновении необходимо прекратить инфузию микафунгина и назначить необходимое лечение.При применении микафунгина возможно появление эксфолиативных кожных реакций, таких как синдром Стивенса-Джонсона и токсический эпидермальный некролиз. Если у пациентов развивается сыпь, их следует тщательно контролировать и прекратить прием микафунгина в случае ее прогрессирования.
В редких случаях у пациентов на фоне лечения микафунгином наблюдались гемолиз, включая острый внутрисосудистый гемолиз, и гемолитическая анемия.
При появлении клинических или лабораторных признаков гемолиза, следует обеспечить тщательный мониторинг за состоянием пациента и оценить соотношение риска и пользы продолжения лечения.
При использовании микафунгина отмечено изменение функции почек, в том числе развитие почечной недостаточности, поэтому во время лечения необходимо обеспечить тщательный мониторинг функции почек.
Применение микафунгина может сопровождаться значительным ухудшением функции печени (увеличение активности аланинаминотрансферазы, аспартатаминотрансферазы или общего билирубина, более чем в 3 раза превышающее верхнюю границу нормы) как у здоровых добровольцев, так и у пациентов. В отдельных случаях отмечали более тяжелую дисфункцию печени (гепатит или печеночная недостаточность с летальным исходом). У пациентов в возрасте до 2 лет увеличен риск гепатотоксичности.
У крыс при применении препарата в течение ≥ 3 месяцев наблюдалось появление локальных очагов измененных гепатоцитов и формирование печеночно-клеточных опухолей. Значимость этого факта для клинического применения препарата у пациентов не установлена. В процессе лечения микафунгином необходимо обеспечить тщательный мониторинг функции печени. Для того, чтобы свести к минимуму риск адаптивной регенерации и, как следствие, возможного последующего образования опухолей печени, при значительном или персистирующем повышении активности аланинаминотрансферазы, аспартатаминотрансферазы рекомендуется отмена препарата.
Лечение микафунгином следует проводить, тщательно взвешивая соотношение риска и пользы, особенно у пациентов с тяжелым нарушением функции печени или хроническими заболеваниями печени, которые представляют собой предопухолевые состояния, такие, как выраженный фиброз печени, цирроз, вирусный гепатит, болезни печени у новорожденных или врожденные ферментопатии, а также в случае одновременного применения препаратов, оказывающих гепатотоксическое и/или генотоксическое действие.
Частота некоторых побочных реакций была выше у детей, чем у взрослых пациентов. У детей до 1 года примерно в два раза отмечалось увеличение активности аланинаминотрансферазы, аспартатаминотрансферазы и щелочной фосфатазы, чем у детей старше 1 года. Наиболее вероятной причиной этих различий было разное исходное состояние детей до 1 года в клинических исследованиях, по сравнению с детьми более старшего возраста и взрослыми больными. На момент включения в исследование, доля больных с нейтропенией. после аллогенной трансплантации костного мозга, а также со злокачественными гематологическими образованиями среди детей (соответственно 40,2%, 29,4% и 29,1%) была в несколько раз выше, чем среди взрослых (соответственно 7,3%, 13,4% и 8,7%).
Влияние на способность управлять транспортными средствами и работу с механизмами
Никаких исследований по оценке влияния микафунгина на способность управлять транспортными средствами и работу с механизмами не проводилось. Однако возможно возникновение нежелательных реакций, которые могут отрицательно повлиять на способность управлять транспортными средствами и работу с механизмами.Форма выпуска
Лиофилизат для приготовления раствора для инфузий 50 мг и 100 мг. По 52,5 мг (дозировка 50 мг) или 106,0 мг (дозировка 100 мг) микафунгина (в виде микафунгина натрия) во флакон из бесцветного стекла (тип I), укупоренный пробкой, колпачком из алюминия/полипропилена и упаковочной термоусадочной пленкой.По 1 флакону вместе с инструкцией по применению помещают в картонную пачку.
Условия хранения
В оригинальной упаковке, в защищенном от света месте при температуре не выше 25°С. Хранить в недоступном для детей месте.Срок годности
3 года.Не использовать по истечении срока годности.
Условия отпуска из аптек
По рецепту.Владелец регистрационного удостоверения
«Астеллас Фарма Юроп Б.В.»,
Силвиусвег 62, 2333 BE Лейден, Нидерланды
Производитель
Астеллас Фарма Тех Ко. Лтд.,Такаока плант 30 Тойдесакае-мачи,
Такаока сити, Тояма 939-1118. Япония
Фасовщик (первичная упаковка)
Астеллас Фарма Тех Ко. Лтд.,
Такаока плант 30 Тойдесакае-мачи,
Такаока сити, Тояма 939-1 118. Япония
Упаковщик (вторичная/ потребительская упаковка)
Астеллас Ирланд Ко. Лтд.,
Киллорглин, округ Керри, Ирландия
или
АО «ОРТАТ», Россия
157092, Костромская обл., Сусанинский район, с. Северное, мкр. Харитоново.
Выпускающий контроль качества
Астеллас Ирланд Ко. Лтд.,
Киллорглин, округ Керри, Ирландия
или
АО «ОРТАТ», Россия
157092, Костромская обл., Сусанинский район, с. Северное, мкр. Харитоново.
Претензии потребителей принимаются Представительством Частной компании с ограниченной ответственностью «Астеллас Фарма Юроп Б.В.» (Нидерланды) в г. Москва по адресу:
109147, Россия, г. Москва, ул. Марксистская, 16
Комментарии
ПРАКТИКА ПЕДИАТРА
