Козэнтикс п/к раствор - инструкция по применению
Синонимы, аналоги СтатьиВнимательно прочитайте эту инструкцию перед тем, как начать прием/применение этого лекарства.
Сохраните инструкцию, она может потребоваться вновь.
Если у Вас возникли вопросы, обратитесь к врачу.
Это лекарство назначено лично Вам, и его не следует передавать другим лицам, поскольку оно может причинить им вред даже при наличии тех же симптомов, что и у Вас.
Регистрационный номер:
ЛП-003780
Торговое наименование:
Козэнтикс
МНН или группировочное наименование:
секукинумаб
Лекарственная форма:
раствор для подкожного введения.
Состав
Действующее вещество: секукинумаб 150,00 мг;
вспомогательные вещества: трегалозы дигидрат 75,67 мг, гистидин/гистидина гидрохлорида моногидрат 3,103 мг, метионин 0,746 мг, полисорбат-80 0,200 мг, вода для инъекций 1069 мг.
Описание:
от бесцветного до светло-желтого цвета прозрачный или опалесцирующий раствор.
Фармакотерапевтическая группа:
ингибиторы интерлейкина.
Код ATX:
L04AC10.
Фармакологические свойства
Механизм действия
Секукинумаб представляет собой полностью человеческое антитело (иммуноглобулин G1, IgGl), которое селективно связывается и нейтрализует провоспалительный цитокин -интерлейкин-17А (ИЛ-17А). Секукинумаб оказывает направленное действие на ИЛ-17 и ингибирует его взаимодействие с рецептором ИЛ-17, который экспрессируется разными типами клеток, включая кератиноциты и синовиоциты. В результате этого секукинумаб ингибирует высвобождение провоспалительных цитокинов, хемокинов и медиаторов повреждения тканей, снижает вклад ИЛ-17А в аутоиммунные и воспалительные заболевания. Секукинумаб в клинически значимых концентрациях достигает кожи и снижает концентрацию воспалительных маркеров. Прямым следствием лечения секукинумабом является уменьшение выраженности покраснения, уплотнения и шелушения кожи, что наблюдается в очагах поражения при бляшечном псориазе.
ИЛ-17А является естественным цитокином, который участвует в нормально протекающих реакциях воспаления и иммунного ответа. ИЛ-17А играет ключевую роль в патогенезе бляшечного псориаза, псориатического артрита и анкилозирующего спондилита. В крови у пациентов с бляшечным псориазом, псориатическим артритом и анкилозирующим спондилитом, а также в клетках пораженных участков кожи у пациентов с бляшечным псориазом обнаружено увеличение концентрации ИЛ-17А, а также увеличение количества лимфоцитов и клеток врожденного иммунитета, продуцирующих ИЛ-17А. Продукция ИЛ-17А существенно повышена в пораженных участках по сравнению со здоровыми участками кожи у пациентов с бляшечным псориазом. Кроме того, у пациентов с псориатическим артритом в синовиальной жидкости отмечается увеличение количества клеток, продуцирующих ИЛ-17А. У пациентов с анкилозирующим спондилитом значительное увеличение количества клеток, продуцирующих ИЛ-17А, отмечается в субхондральном костном мозге фасеточных суставов. ИЛ-17А также способствует развитию воспаления тканей, инфильтрации нейтрофилами, деструкции костей и тканей, а также ремоделированию тканей, включая ангиогенез и фиброз.
Применение секукинумаба у пациентов с бляшечным псориазом в дозе 300 мг обеспечивает более выраженное очищение кожных покровов по сравнению с применением в дозе 150 мг, с максимальным эффектом на 16 неделе. Секукинумаб демонстрирует эффективность как у пациентов, ранее не получавших терапию генно-инженерными биологическими препаратами (ГИБП), так и у пациентов с недостаточным ответом на терапию ГИБП-ингибиторами ФНОа (фактор некроза опухоли а), при этом несколько более выраженный ответ отмечен у пациентов, ранее не получавших терапию вышеуказанными препаратами. При применении секукинумаба отмечено улучшение симптомов и признаков заболевания, улучшение качества жизни, связанное с функциональным статусом и состоянием здоровья, а также замедление прогрессирования поражения периферических суставов.
У пациентов с псориатическим артритом на фоне терапии секукинумабом отмечается схожий ответ на лечение вне зависимости от применения его в монотерапии или в комбинации с метотрексатом. При применении секукинумаба к 16 и 24 неделям отмечено улучшение периферических симптомов псориатического артрита (например, уменьшение количества болезненных/припухших суставов, разрешение дактилитов, энтезитов, уменьшение степени выраженности поражения ногтей). Применение секукинумаба в дозе 150 мг к 24 неделе значительно подавляло степень прогрессирования поражения периферических суставов (относительного исходного показателя модифицированного общего счета Шарпа). Рентгенологические признаки подавления прогрессии отмечены как у пациентов, ранее не получавших терапию ингибиторами ФНОа, так и у пациентов с недостаточным ответом на предшествующую терапию указанными препаратами. Схожее подавление структурного поражения отмечалось вне зависимости от комбинированного применения метотрексата.
Применение секукинумаба у пациентов с анкилозирующим спондилитом приводило к улучшению подвижности позвоночника и его функции, уменьшению активности заболевания (в том числе снижению концентрации высокочувствительного СРБ). У пациентов, получавших секукинумаб без предшествующей терапии ингибиторами ФНОа, при магниторезонансной томографии к 16 неделе отмечено уменьшение признаков воспаления крестцово-подвздошных сочленений и позвоночника относительно исходных показателей.
Фармакодинамика
Концентрация общего ИЛ-17А (свободного и связанного с секукинумабом) в сыворотке крови увеличивается в пределах 2-7 дней вследствие замедления клиренса, связанного с секукинумабом ИЛ-17А, свидетельствуя, что секукинумаб селективно связывается со свободным ИЛ-17А, который играет ключевую роль в патогенезе бляшечного псориаза.
В исследовании у пациентов с бляшечным псориазом после одной-двух недель лечения секукинумабом значительно снижались инфильтрация эпидермиса нейтрофилами и количество различных ассоциированных с ними маркеров, которое часто повышено в пораженных участках кожи у данных пациентов.
На фоне терапии секукинумабом у пациентов с псориатическим артритом и анкилозирующим спондилитом в течение 1-2 недель отмечалось снижение концентрации С-реактивного белка, являющегося маркером воспаления.
Фармакокинетика
Всасывание
После однократного подкожного (п/к) введения в дозе 150 мг или 300 мг при бляшечном псориазе максимальная концентрация секукинумаба в сыворотке крови составляла соответственно 13,7±4,8 мкг/мл или 27,3±9,5 мкг/мл в интервале между 5 и 6 днем после введения.
После первоначального еженедельного введения во время первого месяца максимальная концентрация достигалась между 31 и 34 днем.
Максимальная концентрация в равновесном состоянии (Cmax,ss) после п/к введения 150 мг или 300 мг составила 27,6 мкг/мл и 55,2 мкг/мл соответственно. Равновесная концентрация достигается после 20 недель при ежемесячном режиме введения.
По сравнению с экспозицией после однократной дозы отмечено двукратное повышение максимальной концентрации и площади под фармакокинетической кривой «концентрация-время» (AUC) после многократного ежемесячного введения во время поддерживающей терапии.
Секукинумаб всасывается со средним показателем абсолютной биодоступности 73%.
Распределение
Средний объем распределения в терминальной фазе (Vz) после однократного внутривенного введения варьировал между 7,10 и 8,60 л у пациентов с бляшечным псориазом, что позволяет предположить, что секукинумаб ограниченно распределяется на периферии.
Концентрации секукинумаба в межклеточной жидкости кожи у пациентов с бляшечным псориазом варьировали от 28% до 39% от таковой в сыворотке крови на 1-2 неделе после однократного п/к введения в дозе 300 мг.
Выведение
Средний системный клиренс (CL) у пациентов с бляшечным псориазом составил 0,19л/сутки. Клиренс был дозо- и время-зависимым, как и предполагалось для терапевтического IgGl моноклонального антитела, взаимодействующего с растворимой цитокиновой мишенью, такой как ИЛ-17А.
Средний период полувыведения у пациентов с бляшечным псориазом составлял 27 дней. Расчетный период полувыведения у отдельных пациентов с псориазом варьировал от 17 до 41 дня.
Линейность / нелинейность
Фармакокинетические параметры при однократном и многократном введении секукинумаба у пациентов с бляшечным псориазом были определены в нескольких исследованиях с внутривенным введением в дозах от 1x0,3 мг/кг до 3x10 мг/кг и с п/к введением в дозах, от 1 х25 мг до многократной дозы 300 мг. При всех режимах дозирования экспозиция была пропорциональна дозе.
Фармакокинетические параметры секукинумаба у пациентов с псориатическим артритом, анкилозирующим спондилитом и бляшечным псориазом одинаковы.
Фармакокинетика в особых клинических случаях
Пациенты старше 65 лет
По данным популяционного фармакокинетического анализа клиренс у пациентов старше 65 лет и пациентов моложе данной возрастной группы был сходным.
Пациенты с нарушениями функции печени или почек
Нет данных по фармакокинетике секукинумаба у пациентов с нарушениями функции печени или почек.
Показания к применению
- Лечение псориаза среднетяжелой и тяжелой степени у взрослых пациентов, которым показана системная терапия или фототерапия.
- Лечение активного псориатического артрита в монотерапии или в комбинации с метотрексатом у взрослых пациентов при недостаточном ответе на предшествующую терапию базисными препаратами.
- Лечение активного анкилозирующего спондилита у взрослых пациентов при недостаточном ответе на стандартную терапию.
Противопоказания
- Тяжелые реакции гиперчувствительности к секукинумабу или к другим вспомогательным веществам препарата.
- Клинически значимые инфекции в стадии обострения (например, активный туберкулез).
- Возраст до 18 лет в связи с отсутствием данных по эффективности и безопасности.
- Беременность и период грудного вскармливания.
С осторожностью
- Хронические рецидивирующие инфекции в анамнезе;
- риск развития реакции гиперчувствительности к латексу;
- болезнь Крона в активной фазе;
- вакцинация.
Применение при беременности и в период грудного вскармливания
Беременность
Резюме рисков
Нет достаточных данных по применению препарата у беременных женщин.
Исследования у животных не показали прямого или косвенного негативного влияния секукинумаба на беременность, эмбриональное/фетальное развитие, роды или постнатальное развитие. Поскольку результаты исследований у животных не всегда позволяют предположить ответ у человека, препарат противопоказан к применению во время беременности.
Данные исследований у животных
В исследовании эмбриофетального развития при применении секукинумаба у яванских макак во время органогенеза и на поздних стадиях гестации не выявлено явлений материнской токсичности, эмбриотоксичности или тератогенных свойств.
Грудное вскармливание
Неизвестно, проникает ли секукинумаб в грудное молоко у человека. Поскольку иммуноглобулины проникают в грудное молоко человека, не рекомендуется применять препарат Козэнтикс в период грудного вскармливания.
Влияние на фертильность
Данные о влиянии секукинумаба на мужскую и женскую фертильность отсутствуют. В исследованиях у животных не отмечено прямого или непрямого негативного влияния секукинумаба на фертильность.
Способ применения и дозы
Препарат Козэнтикс вводят путем п/к инъекции. По возможности следует избегать для инъекции пораженных участков кожи при бляшечном псориазе.
Лечение псориаза среднетяжелой и тяжелой степени у взрослых пациентов, которым показана системная терапия или фототерапия: рекомендуемая доза составляет 300 мг в виде п/к инъекции в качестве начальной дозы на 0, 1, 2, 3 неделе с последующим ежемесячным введением в качестве поддерживающей дозы, начиная с 4 недели. Каждую дозу 300 мг вводят в виде двух отдельных п/к инъекций по 150 мг.
Лечение активного псориатического артрита в монотерапии или в комбинации с метотрексатом у взрослых пациентов при недостаточном ответе на предшествующую терапию базисными препаратами: рекомендуемая доза составляет 150 мг в виде п/к инъекции в качестве начальной дозы на 0, 1, 2, 3 неделе с последующим ежемесячным введением в качестве поддерживающей дозы, начиная с 4 недели. В зависимости от клинического ответа, дозу препарата можно увеличить до 300 мг.
Для пациентов с неадекватным ответом на терапию препаратами ингибиторами ФНОа или для пациентов с сопутствующим псориазом средней и тяжелой степени тяжести рекомендуемая доза составляет 300 мг в виде п/к инъекции в качестве начальной дозы на 0, 1, 2, 3 неделе с последующим ежемесячным введением в качестве поддерживающей дозы, начиная с 4 недели.
Каждую дозу 300 мг вводят в виде двух отдельных п/к инъекций по 150 мг.
Лечение активного анкилозирующего спондилита у взрослых пациентов при недостаточном ответе на стандартную терапию: рекомендуемая доза составляет 150 мг в виде п/к инъекции в качестве начальной дозы на 0, 1, 2, 3 неделе с последующим ежемесячным введением в качестве поддерживающей дозы, начиная с 4 недели.
Особые группы пациентов
Пациенты с нарушением функции печени или почек
Отсутствуют данные по применению препарата Козэнтикс у пациентов данной группы.
Пациенты моложе 18 лет
Эффективность и безопасность препарата у детей до 18 лет не установлена.
Пациенты старше 65 лет
Коррекция дозы не требуется.
На усмотрение лечащего врача после соответствующего обучения технике подкожной инъекции пациент может самостоятельно вводить препарат Козэнтикс, однако врач должен обеспечить соответствующее наблюдение пациента. Следует проинструктировать пациента о необходимости в полной мере соблюдать инструкцию по введению препарата Козэнтикс в соответствии с Указаниями по применению.
Указания по применению
Инструкция по применению препарата Козэнтикс в предварительно заполненном шприце с устройством для пассивной защиты иглы
Прочтите инструкцию полностью перед инъекцией. Не пытайтесь самостоятельно вводить препарат, пока Вы не прошли подготовку с Вашим врачом. В пачке находятся 1 или 2 предварительно заполненных шприца в блистере.
Описание препарата Козэнтикс в предварительно заполненном шприце с устройством для пассивной защиты иглы
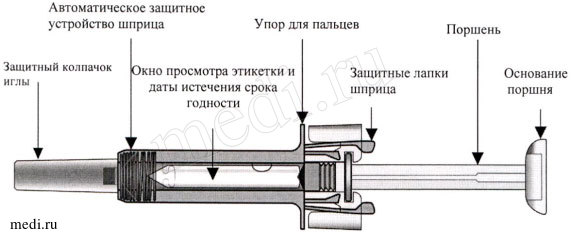
После того, как препарат был введен, автоматическое защитное устройство шприца активируется и скрывает иглу. Предварительно заполненный шприц с устройством для пассивной защиты иглы обеспечивает дополнительную защиту от случайных уколов иглой для медицинских работников, пациентов, которые самостоятельно вводят препарат по предписанию врача, а также ухаживающих за пациентом лиц.
Что нужно дополнительно для проведения инъекции:

- Спиртовой тампон.
- Ватный или марлевый тампон.
- Контейнер для утилизации острых предметов.
Важная информация по безопасности
Внимание: храните препарат в недоступном для детей месте.
Колпачок иглы шприца может содержать сухой каучук (латекс), который не рекомендовано использовать лицам с гиперчувствительностью к этому веществу.
Не открывайте запечатанную пачку, пока Вы не будете готовы использовать препарат.
Не используйте препарат при нарушении целостности пачки или блистера, поскольку применение в этом случае небезопасно.
Никогда не оставляйте препарат в местах, доступных для других лиц.
Не встряхивайте предварительно заполненный шприц.
Будьте осторожны и не прикасайтесь к защитным лапкам шприца до использования.
Прикосновение к ним может вызвать преждевременную активацию автоматического защитного устройства шприца.
Не снимайте колпачок с иглы до непосредственного момента введения препарата.
Недопустимо повторное использование предварительно заполненного шприца. Утилизируйте использованный предварительно заполненный шприц с устройством для пассивной защиты иглы сразу после использования в контейнер для острых предметов.
Хранение препарата Козэнтикс
Храните препарат Козэнтикс в закрытой оригинальной упаковке для защиты от света. Храните в холодильнике при температуре от 2° С до 8° С. Не замораживать!
Перед инъекцией достаньте предварительно заполненный шприц из холодильника и дайте ему согреться до комнатной температуры (от 15 до 30 минут).
При необходимости, препарат может храниться до 4 дней вне холодильника, при комнатной температуре, не превышающей 30°С.
Не используйте с препарат после истечения срока годности, указанного на упаковке или этикетке шприца.
Места для инъекций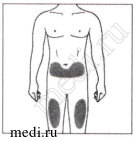
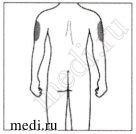
Рекомендуемые зоны для инъекций располагаются на передней поверхности бедер. Вы также можете вводить препарат в нижнюю треть живота, избегая пятисантиметровой области вокруг пупка. Если инъекцию проводит лицо, осуществляющее уход за пациентом, инъекция может быть проведена в наружную поверхность плеча.
Каждый раз меняйте места инъекции.
Не следует проводить инъекции в места с поражением кожных покровов (истончение, покраснение, раздражение, уплотнение, шелушение). Избегайте введения в места с наличием рубцов и растяжек.
Подготовка к использованию препарата Козэнтикс в предварительно заполненном шприце с устройством для пассивной защиты иглы
Достаньте упаковку с препаратом из холодильника, и оставьте его, не вскрывая, на 15-30 минут, чтобы он согрелся до комнатной температуры.
Вымойте тщательно руки водой с мылом перед использованием.
Протрите место инъекции спиртовым тампоном.
Извлеките предварительно заполненный шприц с устройством для пассивной защиты иглы из пачки, а затем из блистера.
Осмотрите предварительно заполненный шприц. Жидкость в нем должна быть прозрачной. Ее цвет может варьировать от бесцветного до слегка желтоватого. Вы можете увидеть небольшой пузырек воздуха. НЕ ИСПОЛЬЗУЙТЕ препарат, если жидкость содержит видимые частицы, мутная или очевидно коричневая. НЕ ИСПОЛЬЗУЙТЕ препарат, если целостность предварительно заполненного шприца нарушена. Во всех случаях обратитесь к врачу.
Как использовать препарат Козэнтикс в предварительно заполненном шприце с устройством для пассивной защиты иглы
Осторожно снимите колпачок иглы с предварительно заполненного шприца и выбросьте его. Вы можете увидеть каплю жидкости на конце иглы. Это нормально.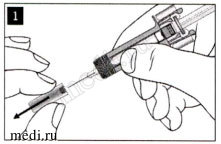
Аккуратно соберите кожную складку между пальцами в месте инъекции и введите иглу, как показано на рисунке. Введите иглу на всю длину, чтобы обеспечить полное введение препарата.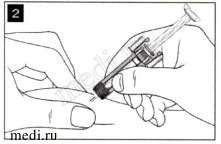
Придерживая шприц, как указано на рисунке, медленно нажимайте на поршень до тех пор, пока основание поршня не окажется между защитными боковыми лапками.
Удерживайте нажатый до упора поршень вместе со шприцем в течение 5 секунд.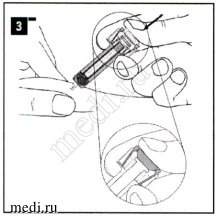
Удерживайте нажатый до упора поршень, пока Вы извлекаете иглу из места инъекции.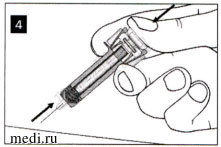
Медленно отпустите поршень и позвольте автоматическому защитному устройству скрыть иглу.
В месте инъекции может появиться небольшое количество крови. Вы можете приложить ватный или марлевый тампон к месту инъекции и удерживать его в течение 10 секунд. Не растирайте место инъекции. При необходимости можно закрыть место инъекции небольшим пластырем.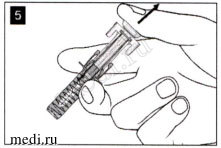
Инструкции по утилизации
Поместите использованный предварительно заполненный шприц в контейнер для острых предметов (закрывающийся, устойчивый к проколам контейнер). В целях Вашей безопасности и здоровья других, иглы и использованные шприцы недопустимо использовать повторно.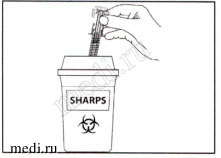
Инструкция по применению препарата Козэнтикс в предварительно заполненном шприце в автоинжекторе
Препарат Козэнтикс в предварительно заполненном шприце в автоинжекторе 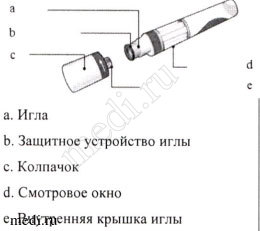
Предварительно заполненный шприц в автоинжекторе изображен со снятым колпачком.
Не снимайте колпачок до тех пор, пока Вы не будете готовы ввести препарат. Храните упаковку в холодильнике при температуре от 2°С до 8°С, в местах, не доступных для детей.
При необходимости, препарат может храниться до 4 дней вне холодильника, при комнатной температуре, не превышающей 30°С.
Не замораживать.
Не встряхивать.
Не используйте препарат если автоинжектор упал без колпачка.
Во избежание дискомфорта при введении, предварительно достаньте препарат из холодильника и оставьте при комнатной температуре в течение 15-30 минут перед введением.
Что Вам необходимо для инъекции:
Включено в упаковку:
Препарат Козэнтикс в предварительно заполненном шприце в автоинжекторе.
Не включено в упаковку:
- Спиртовой тампон.
- Ватный или марлевый тампон.
- Контейнер для утилизации острых предметов.

Перед инъекцией:
1. Что необходимо проверить для безопасного проведения инъекции:
Жидкость должна быть прозрачной. Ее цвет может варьировать от бесцветного до слегка желтоватого.
Не используйте препарат, если жидкость содержит легко видимые частицы, мутная или очевидно коричневая. Вы можете увидеть небольшой пузырек воздуха, что является нормальным.
Не используйте препарат Козэнтикс, если срок годности истек.
Не используйте, если целостность контроля первичного вскрытия нарушена.
2а. Выберите место для инъекции:
Рекомендуемые места располагаются на передней поверхности бедер. Вы также можете вводить препарат в нижнюю треть живота, избегая пятисантиметровой области вокруг пупка.
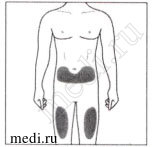
Каждый раз меняйте места инъекции.
Не следует проводить инъекции в места с поражением кожных покровов (истончение, покраснение, раздражение, уплотнение, шелушение). Избегайте введения в места с наличием рубцов и растяжек.
2b. Только для лиц, осуществляющих уход за пациентом, и медицинских работников:
Если инъекцию проводит медицинский работник или лицо, осуществляющее уход за пациентом, инъекция может быть проведена в наружную поверхность плеча.
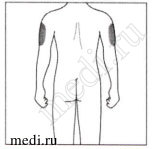
3. Обработка места инъекции:
Вымойте руки горячей водой с мылом.
Круговыми движениями протрите место инъекции спиртовым тампоном. Дождитесь пока поверхность кожи высохнет.
Не касайтесь предварительно обработанной области до инъекции.
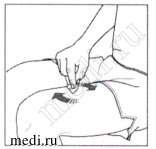
Инъекция:
4. Снятие колпачка:
Снимите колпачок с автоинжектора только когда будете готовы ввести препарат.
Отверните колпачок в направлении, указанном стрелкой.
После снятия выбросьте колпачок. Не пытайтесь повторно надеть колпачок.
Используйте препарат в течение 5 минут после удаления колпачка.
5. Положение предварительно автоинжектора:
Держите предварительно заполненный шприц в автоинжекторе под углом 90 градусов к обработанному месту инъекции.
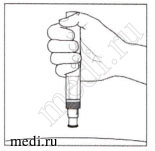

ОБЯЗАТЕЛЬНО ПРОЧТИТЕ ДАННУЮ ИНФОРМАЦИЮ ПЕРЕД ИНЪЕКЦИЕЙ 
Во время инъекции Вы услышите 2 громких щелчка.
1-й щелчок означает начало инъекции. Через несколько секунд 2-й щелчок укажет на то, что инъекция почти закончилась.
Удерживайте автоинжектор плотно прилегающим к коже, пока зеленый индикатор полностью заполнит смотровое окошко.
6. Начало инъекции:
Прижмите автоинжектор плотно к коже, чтобы начать введение.
1-й щелчок означает, что инъекция началась.
Удерживайте автоинжектор, плотно прилегающим к коже.
Зеленый индикатор показывает ход выполнения инъекции.
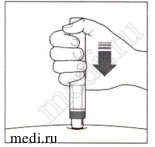
7. Завершение инъекции:
Прислушивайтесь ко 2-му щелчку. Он указывает на то, что инъекция почти завершена.
Убедитесь, что зеленый индикатор заполнил окно и перестал двигаться.
Теперь автоинжектор можно извлечь.
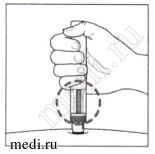
После инъекции:
8. Убедитесь, что зеленый индикатор заполнил окно:
Это означает, что лекарство было введено. Обратитесь к врачу, если зеленый индикатор не виден.
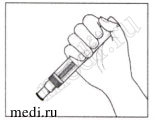
В месте инъекции может выступить небольшое количество крови. Вы можете приложить ватный или марлевый тампон к месту инъекции и удерживать его в течение 10 секунд. Не растирайте место инъекции. При необходимости можно закрыть место инъекции небольшим пластырем.
9. Утилизация:
Поместите использованный автоинжектор в контейнер для острых предметов (закрывающийся устойчивый к проколам контейнер).
Недопустимо использовать автоинжектор повторно.
Побочное действие
В клинических исследованиях секукинумаб получали более 11900 пациентов по различным показаниям, при этом 7100 пациент получал препарат на протяжении минимум 1 года.
Наиболее часто встречающимися нежелательными лекарственными реакциями (НЛР) на фоне применения препарата Козэнтикс были инфекции верхних дыхательных путей (наиболее часто назофарингит, ринит). Большинство из них были легкой или средней степени тяжести. В клинических исследованиях прекращение терапии препаратом в связи с развитием НЛР потребовалось около 1,2% пациентов, получавших секукинумаб, и около 1,2% пациентов, получавших плацебо.
НЛР, выявленные в клинических исследованиях у пациентов с псориазом, перечислены ниже в соответствии с системно-органным классом медицинского словаря для нормативноправовой деятельности MedDRA. В пределах каждого системно-органного класса НРЛ распределены по частоте возникновения в порядке уменьшения их важности. Для оценки частоты использованы следующие критерии: очень часто (≥1/10); часто (от ≥1/100 до <1/10); нечасто (от ≥1/1000 до <1/100); редко (от ≥1/10000 до <1/1000); очень редко (<1/10000), включая отдельные сообщения; частота неизвестна* - по имеющимся данным установить частоту возникновения не представляется возможным.
Инфекционные и паразитарные заболевания: очень часто - инфекции верхних дыхательных путей (в том числе: очень часто - назофарингит, часто - инфекция верхних отделов дыхательных путей, ринит, фарингит, нечасто - синусит, тонзиллит); часто - герпетическая инфекция слизистой оболочки полости рта; нечасто - кандидозная инфекция полости рта, грибковое поражение кожи стоп, наружный отит; частота неизвестна - кандидозная инфекция кожи и слизистых оболочек.
Нарушения со стороны крови и лимфатической системы: нечасто - нейтропения.
Нарушения со стороны иммунной системы: редко - анафилактические реакции.
Нарушения со стороны органа зрения: нечасто - конъюнктивит.
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения: часто - ринорея.
Нарушения со стороны желудочно-кишечного тракта: часто - диарея.
Нарушения со стороны кожи и подкожных тканей: часто - крапивница.
* - поскольку информация о данных НЛР получена методом спонтанных сообщений и точное число пациентов, принимавших препарат, не определено, оценить частоту возникновения данных реакций не представляется возможным, в связи с чем для них указано «частота неизвестна».
Инфекции
В плацебо-контролируемых клинических исследованиях у пациентов с бляшечным псориазом отмечено развитие инфекционных заболеваний у 28,7% и 18,9% пациентов, получавших секукинумаб и плацебо соответственно. Большинство случаев были легкой или средней степени тяжести. Серьезные инфекционные заболевания отмечены у 0,14% пациентов, получавших секукинумаб, и 0,3%, пациентов, получавших плацебо. При долгосрочной терапии препаратом в клинических исследованиях (до 52 недель терапии у большинства пациентов) инфекции отмечены у 47,5% пациентов, получавших секукинумаб, при этом серьезные инфекции зарегистрированы у 1,2% пациентов.
Частота инфекционных заболеваний была схожей в клинических исследованиях у пациентов с псориазом, псориатическим артритом и анкилозирующим спондилитом.
Реакции гиперчувствительности
В клинических исследованиях зарегистрированы случаи крапивницы и в очень редких случаях - анафилактических реакций на введение препарата.
Иммуногенность
По данным клинических исследований препарата Козэнтикс в <1% случаев наблюдалось образование антител к секукинумабу к 52 неделе терапии. Около половины антител, образовавшихся на фоне терапии, являлись нейтрализующими, что не ассоциировалось с потерей эффективности терапии или влиянием на фармакокинетические параметры препарата.
Профиль безопасности секукинумаба у пациентов с псориатическим артритом и анкилозирующим спондилитом соответствовал профилю безопасности у пациентов с псориазом по данным клинических исследований.
Если любые из указанных в инструкции побочных эффектов усугубляются, или Вы заметили любые другие побочные эффекты, не указанные в инструкции, сообщите об этом врачу.
Передозировка
В ходе клинических исследований препарата Козэнтикс сообщений о случаях передозировки не было.
В ходе клинических исследований внутривенное введение дозы до 30 мг/кг (т.е. приблизительно 2000-3000 мг) не сопровождалось развитием дозолимитирующей токсичности. В случае передозировки рекомендуется наблюдение пациента для выявления признаков и симптомов нежелательных реакций. При необходимости следует незамедлительно провести симптоматическое лечение.
Взаимодействие с другими лекарственными средствами
Препарат Козэнтикс нельзя применять одновременно с живыми вакцинами.
В клинических исследованиях у пациентов с псориазом не отмечено лекарственного взаимодействия между секукинумабом и мидазоламом (субстратом изофермента CYP ЗА4). Нет прямых данных, свидетельствующих об участии ИЛ-17А в экспрессии изоферментов системы цитохрома CYP450. Повышенная концентрация цитокинов в условиях хронического воспалительного процесса подавляет образование некоторых изоферментов системы цитохрома. Таким образом, противовоспалительная терапия, в т.ч. секукинумабом, ингибитором ИЛ-17А, может привести к нормализации активности изоферментов цитохрома CYP450, сопровождающейся уменьшением экспозиции одновременно применяемых препаратов, метаболизм которых осуществляется с участием указанных изоферментов. Таким образом, нельзя исключить клинически значимого влияния на препараты - субстраты изоферментов системы цитохрома с узким терапевтическим индексом, доза которых подбирается индивидуально (например, варфарин). Следует рассмотреть возможность терапевтического контроля при начале терапии секукинумабом у пациентов, получающих лечение препаратами вышеуказанных групп.
Не выявлено лекарственного взаимодействия секукинумаба с метотрексатом и/или глюкокортикостероидами при их одновременном применении у пациентов с псориатическим артритом и анкилозирующим спондилитом.
Особые указания
Инфекции
Препарат Козэнтикс может увеличивать риск развития инфекций. В клинических исследованиях у пациентов, получавших препарат Козэнтикс, наблюдались случаи развития инфекции, большинство которых были легкой или средней степени тяжести. Следует соблюдать осторожность при решении вопроса о применении препарата Козэнтикс у пациентов с хронической инфекцией или с рецидивирующей инфекцией в анамнезе.
Следует информировать пациента о необходимости обращения к врачу в случае появления признаков и симптомов, позволяющих заподозрить развитие инфекции. При развитии тяжелой инфекции необходимо тщательно наблюдать пациента, терапию препаратом следует отложить вплоть до разрешения инфекционного процесса.
В клинических исследованиях не получено сообщений об увеличении восприимчивости к туберкулезу, однако препарат Козэнтикс не следует применять у пациентов с активной формой туберкулеза. Перед началом лечения препаратом у пациентов с латентной формой туберкулеза следует рассмотреть возможность проведения противотуберкулезной терапии.
Болезнь Крона
Следует соблюдать осторожность при применении препарата у пациентов с болезнью Крона в активной фазе, поскольку в клинических исследованиях отмечены случаи обострения болезни Крона, в некоторых случаях тяжелые, у пациентов, получавших как препарат, так и плацебо. Следует тщательно наблюдать пациента с болезнью Крона в активной фазе, получающего терапию препаратом.
Реакции гиперчувствительности
В клинических исследованиях у пациентов, получавших препарат, отмечались редкие случаи развития анафилактических реакций. При возникновении анафилактических или других серьезных аллергических реакций применение препарата Козэнтикс следует немедленно прекратить и немедленно начать соответствующую терапию.
Пациенты с гиперчувствительностью к латексу
Съемный колпачок предварительно заполненного шприца с устройством для пассивной защиты иглы/предварительно заполненного шприца в автоинжекторе содержит производные натурального каучукового латекса. Хотя натуральный каучуковый латекс не обнаруживается в колпачке, безопасность применения препарата Козэнтикс в предварительно заполненном шприце с устройством для пассивной защиты иглы/предварительно заполненном шприце в автоинжекторе у пациентов с гиперчувствительностью к латексу не изучалась.
Вакцинация
На фоне терапии препаратом не следует проводить вакцинацию живыми вакцинами. Для пациента, получающего терапию препаратом, следует применять инактивированные или убитые вакцины. В клиническом исследовании у схожего количества пациентов, получавших препарат Козэнтикс, и получавших плацебо, отмечался адекватный иммунный ответ после вакцинации менингококковой и инактивированной гриппозной вакцинами, что проявлялось в виде 4-кратного увеличения титра антител к указанным вакцинам. Эти данные свидетельствуют, что препарат не подавляет гуморальный иммунный ответ к менингококковой и инактивированной гриппозной вакцинам.
Влияние на фертильность
Женщинам с сохраненным репродуктивным потенциалом следует использовать надежные методы контрацепции во время лечения препаратом и как минимум в течение 20 недель после прекращения терапии.
Влияние на способность управлять транспортными средствами и/или механизмами
Отсутствуют данные о влиянии препарата на способность управлять транспортными средствами и/или механизмами.
Форма выпуска
По 1 мл в стеклянный шприц с закрепленной иглой с защитным колпачком (предварительно заполненный шприц).
По 1 или 2 предварительно заполненных шприца с устройством для пассивной защиты иглы в блистер, заклеенный этикеткой, вместе с инструкцией по медицинскому применению в пачку картонную с контролем первичного вскрытия.
По 1 или 2 предварительно заполненных шприца в автоинжекторах (ручках) с контролем первичного вскрытия, вместе с инструкцией по медицинскому применению в пачку картонную с контролем первичного вскрытия.
Условия хранения
В защищенном от света месте при температуре от 2 до 8 °С. Не замораживать.
Хранить в недоступном для детей месте.
Срок годности
2 года.
Препарат не следует применять после истечения срока годности.
Условия отпуска
Отпускают по рецепту.
Наименование и адрес юридического лица, на имя которого выдано регистрационное удостоверение
Новартис Фарма АГ; Лихтштрассе 35, 4056 Базель, Швейцария / Novartis Pharma AG; Lichtstrasse 35, 4056 Basel, Switzerland
Производитель
Новартис Фарма Штейн АГ; Шаффхаузерштрассе, 4332 Штейн, Швейцария / Novartis Pharma Stein AG; Schaffhauserstrasse, 4332 Stein, Switzerland
Получить дополнительную информацию о препарате, а также направитьпретензии и информацию о нежелательных явлениях можно по следующему адресу в России:
ООО «Новартис Фарма»
125315, г. Москва, Ленинградский проспект, дом 72, корпус 3
Комментарии
ПРАКТИКА ПЕДИАТРА
