Развитие моторных флуктуаций у больных с различными стадиями болезни Паркинсона
СтатьиО.С.Левин
Центр экстрапирамидных заболеваний Минздрава РФ
Кафедра неврологии РМАПО
Болезнь Паркинсона (БП) – одно из наиболее частых неврологических заболеваний пожилого возраста. Введение препаратов леводопы произвело революцию в практике лечения этого заболевания, позволив в течение многих лет поддерживать двигательную активность пациента и за счет этого значительно увеличить продолжительность его жизни. Тем не менее, через несколько лет после начала заболевания у подавляющего большинства больных изменяется реакция на препараты леводопы – снижается длительность действия разовой дозы, появляются резкие колебания в состоянии больного (моторные флуктуации) и дискинезии, которые оказывают неблагоприятное влияние на жизнедеятельность пациента.
Выраженные флуктуации и дискинезии оказывают негативное влияние на качество жизни пациента и значительно увеличивают стоимость лечения. Поэтому предупреждение моторных флуктуаций и дискинезий служит одним из основных приоритетов при построении стратегии лечения БП.
Данные о распространенности моторных флуктуаций и дискинезий при БП варьируют, что объясняется различиями в контингенте обследуемых больных и критериях их диагностики. Так, в крупном проспективном исследовании DATATOP чуть более чем через 3 года от начала лечения препаратами леводопы феномен «истощения конца дозы» отмечен примерно у половины больных, дискинезии – у трети пациентов, а выраженный феномен «включения-выключения» - у 10% больных. В то же время в другом проспективном исследовании по завершении 5-летнего периода наблюдения за больными, принимавшими различные лекарственные формы леводопы/карбидопы (стандартные препараты и препараты с контролируемым высвобождением) флуктуации и дискинезии были отмечены лишь у 22% больных. Schrag и соавт (2002), обследовав первичную популяцию больных с БП, отметили, что у лиц с давностью заболевания до 5 лет флуктуации встречаются у 8% больных, а при давности заболевания более 5 лет – у 50% больных (аналогичные показатели для дискинезий составили 4 и 28%). По данным других исследователей, у больных БП с давностью заболевания более 10 лет распространенность флуктуаций достигает 75-85%. Таким образом, в среднем распространенность моторных флуктуаций среди больных БП увеличивается с каждым годом приема препарата леводопы примерно на 10%.
В ряде исследований было показано, что вероятность развития флуктуаций и дискинезий на фоне длительной терапии препаратами леводопы нарастает с увеличением давности и тяжести заболевания и таким образом зависит от выраженности дегенеративных изменений в базальных ганглиях. Вместе с тем, было отмечено, что риск флуктуаций и дискинезий увеличивается с повышением давности лечения препаратами леводопы, принимаемой на данный момент пациентами дозы леводопы, а также от кумулятивной (суммарной) дозы леводопы, которую принял в течение заболевания.
Это послужило основанием для введения практики откладывания начала терапии леводопой до того момента, когда без нее уже невозможно будет компенсировать состояние пациента, а до этого момента ограничиваться назначением иных препаратов, таких как агонистов дофаминовых рецепторов, амантадина, селегилина, в определенной степени жертвуя эффективностью терапии. Однако в какой мере откладывание назначения леводопы позволяет отсрочить момент развития флуктуаций?
Недавние контролируемые исследования, сравнивавшие вероятность развития флуктуаций у больных при начале лечения с агонистов дофаминовых рецепторов и препарата леводопы, казалось бы, дали ответ на этот вопрос. При начале лечения с препарата леводопы частота флуктуаций через 2-5 лет была достоверно выше, чем при начале лечения с агониста дофаминовых рецепторов с последующим подключением препарата леводопы для поддержания необходимого противопаркинсонического эффекта. Однако в исследования были преимущественно включены больные с ранними стадиями БП. Позволяет ли этот подход отсрочить момент развития флуктуаций у больных с более продвинутой стадией заболевания остается неясным.
Чтобы определить это, мы исследовали продолжительность периода от момента начала терапии леводопой до появления моторных флуктуаций и дискинезий, а также факторы, влияющие на ее величину, в том числе эффективность лечения леводопой.
Материал и методы исследования
В исследование были включены 84 больных с БП, принимавших препараты леводопы и наблюдавшихся в Центре экстрапирамидных заболеваний Минздрава РФ (средний возраст 65,7±6,3 лет, средняя длительность заболевания 7,0±3,9 лет). Диагноз был установлен в соответствие с критериями Мозгового банка Общества болезни Паркинсона Великобритании. Всем больным проводилось комплексное клинико-неврологическое исследование, включавшее количественную оценку двигательных нарушений с помощью Унифицированной рейтинговой шкалы болезни Паркинсона (Unified Parkinson’s Disease Rating Scale - UPDRS). Выраженность флуктуаций оценивалась по части IV UPDRS. Тяжесть заболевания оценивалась также по шкале Хен и Яра. Стадия по Хен – Яру у обследованных больных колебалась от 2 до 4 и составила в среднем 3,3±1,2. Выраженность аксиальных двигательных нарушений исследовалась с помощью специально разработанной шкалы, включавшей 10 пунктов, оценивавших гипомимию, дизартрию, дисфагию, вставание с кресла, кровати, повороты в кровати, туловищную ригидность и брадикинезию, ходьбу и постуральную неустойчивость. Выраженность когнитивных нарушений оценивалась с помощью Шкалы деменции Маттиса.
Длительность приема леводопы варьировала от 4 месяцев до 12 лет и составила в среднем по группе 6,2±4,8 лет. Доза леводопы варьировала от 150 до 800 мг/сут (в среднем 420,5±160,4 мг/сут) и позитивно коррелировала с длительностью заболевания (r=0,4, p<0,05). Моменты начала терапии леводопой и развития флуктуаций определялись ретроспективно со слов больного и его родственников и подтверждались по имеющейся медицинской документации.
Степень лечебного эффекта леводопы оценивалась в зависимости от динамики показателей шкалы повседневной активности Шваба – Ингланда по 4-бальной шкале (таблица 1). Предварительно проводилась необходимая коррекция терапии.
Таблица 1.
Оценка степени лечебного эффекта препаратов леводопы
|
Степень лечебного эффекта леводопы (баллы) |
Критерии |
|
0 |
Отсутствие значимых изменений |
|
1 |
Минимальный эффект (уменьшение выраженности некоторых симптомов) без изменения оценки по шкале повседневной активности Шваба – Ингланда |
|
2 |
Умеренный эффект, оценка по шкале повседневной активности Шваба – Ингланда повышается не более чем на 10% |
|
3 |
Выраженный эффект, оценка по шкале повседневной активности Шваба – Ингланда повышается на 20% и более |
Для оценки зависимости эффекта леводопы от ее дозы высчитывался индекс эффективности дозы леводопы путем деления показателя степени лечебного эффекта на дозу леводопы в граммах.
Результаты
Моторные флуктуации были выявлены у 48 (58%) больных c БП. Чаще всего встречался феномен «истощения» действия разовой дозы леводопы [у 31 (37%) больных], характеризовавшийся постепенным нарастанием двигательного дефекта к моменту приема очередной дозы леводопы, соответственно, действие разовой дозы продолжалось менее 4 часов. У 13 больных (15%) отмечался феномен "включения- выключения", характеризовавшийся резкими переходами (в течение нескольких минут) от относительно мобильного состояния (на фоне действия очередной дозы леводопы) к относительной обездвиженности. У 4 пациентов (5%) отмечены непредсказуемые «выключения», вслед за которым иногда отмечалось повторное спонтанное «включение» (феномен «йо-йо»).
Таблица 2.
Клинические особенности больных с равномерным эффектом леводопы и моторными флуктуациями
|
Показатели |
Больные |
Больные N=36 |
|
Возраст начала заболевания |
58,1± 9,0* |
67,3± 10,2 |
|
Длительность заболевания |
9,0 ±4,2* |
4,2±1,9 |
|
Стадия заболевания |
2,9±0,5ю* |
2,5±0,3 |
|
Средняя оценка по III части UPDRS |
36,5±9,8 |
34,7±8,8 |
|
Длительность приема леводопы |
6,3±3,1** |
2,0±1,4 |
|
Доза леводопы |
582,2±221,1 * |
357,0±184,1 |
|
Степень лечебного эффекта леводопы |
2,8±0,7* |
2,4±0,5 |
|
Индекс эффективности дозы леводопы |
6,7±1,8* |
6,2±2,1 |
|
Суммарный балл по шкале деменции Маттиса |
123,4±26,8* |
110,0±27,1 |
* различия между группами статистически достоверны (p<0,05)
У 28 (33%) пациентов выявлены лекарственные дискинезии Чаще всего встречались дискинезии пика дозы (у 16 (19%) больных), чаще всего имевших вид хореиформного гиперкинеза, вовлекавшего лицо, туловище и верхние конечности. У 10 (11%) больных отмечены дискинезии выключения в виде дистонии, преимущественно вовлекавшей нижние конечности. У 5 (6%) больных отмечались двухфазные дискинезии в виде дистонических или баллистических движений, первоначально вовлекавшие нижние конечности и часто сопровождавшиеся акатизией. У 3 пациентов отмелись 2 вида дискинезий. В 92% случаев дискинезии развивались у больных с моторными флуктуациями.
Больные с моторными флуктуациями имели более ранее начало заболевания и большую длительность заболевания (таблица 2). У больных с давностью терапии леводопой до 5 лет частота флуктуаций составила 32%, у больных с давностью заболевания от 5 до 10 лет – 60%, у больных с давностью заболевания 10 лет – 88%.
Кроме того, больные с флуктуациями принимали леводопу более длительно и в более высокой дозе, чем больные с равномерным эффектом, имели более высокую стадию заболевания, но достоверно не отличались от них по тяжести основных моторных симптомов и двигательного дефекта в целом, оцениваемых по III части UPDRS, а также по набору и дозам других противопаркинсонических препаратов.
Отмечена тенденция к более частому развитию флуктуаций при акинетико-ригидной форме по сравнению с дрожательной формой (p=0,08). Между больными с флуктуациями и без флуктуаций не было достоверных различий в выраженности основных симптомов, оценивавшихcя по III части UPDRS.
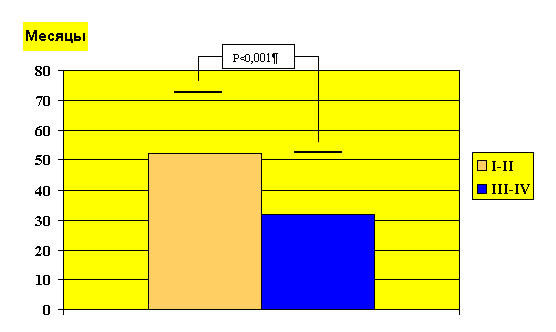
12 (139%) больным препараты леводопы были назначены на I стадии, 33 (39%) больным - на II стадии, 29 (34%) больным – на III стадии, 10 (12%) больным – на IV стадии. Среднее время развития флуктуаций после начала лечения леводопой составило 3,5±2,1 лет. В тех случаях, когда больные начинали принимать препарат леводопы на III или IV стадиях, флуктуации в среднем развивались быстрее, чем в тех случаях, когда больные начинали принимать препараты леводопы на I или II стадиях (соответственно 2,7±1,9 и 4,3±2,2 лет, p<0,001) (рисунок 1). Достоверных различий по времени развития моторных флуктуаций при начале лечения на первой и второй стадиях заболевания не отмечено. В то же время при начале лечения леводопой на IV стадии заболевания флуктуации появлялись значительно быстрее (1,1±0,8 лет) по сравнению с более ранним началом лечения леводопой (p<0,001).
Степень лечебного эффекта леводопы у исследуемых больных колебалась от 2 до3 баллов и составила в среднем 2,8±0,5 баллов, она не зависела от возраста больных, длительности заболевания, тяжести двигательного дефекта, оцениваемого по III части UPDRS. Индекс эффективности дозы леводопы составил в среднем 6,7±0,9 баллов. Он не коррелировал с возрастом больных, длительностью заболевания, оценкой по III части UPDRS, но был ниже у больных с более выраженными аксиальными двигательными нарушениями, такими как дизартрия, постуральная неустойчивость, нарушение ходьбы (r=-0,5, p<0,05) и коррелировал с оценкой по шкале деменции Маттиса (r=-0,4, p<0,05).
Рисунок 1.
Время появления моторных флуктуаций после начала лечения препаратами леводопы у больных с различной стадией заболевания
Степень лечебного эффекта и индекс эффективности леводопы у больных с флуктуациями оказались выше, чем у больных с равномерным эффектом леводопы, в то же время уровень когнитивных нарушений, оцениваемый по шкале деменции Маттиса, у больных с равномерным эффектом был выше, чем у больных с флуктуациями (p<0,05).
Как и в случае моторных флуктуаций, у больных с дискинезиями отмечены более ранее начало болезни (р<0,01), большая длительность заболевания (р<0,001), более высокая продолжительность терапии препаратами леводопы (р<0,01) и более высокая суточная доза препаратов леводопы (р<0,01). В среднем дискинезии развивались через 3,9±2,2 года после начала приема леводопы. При начале лечения леводопой на I и II стадиях дискинезии развивались медленнее, чем при начале лечения леводопой на III и IV стадиях (соответственно 5,2±2,9 vs. 2,8±2,0 лет, p<0,01). У больных с дискинезиями степень лечебного эффекта и индекс эффективности леводопы оказался выше, чем у больных без дискинезий.
Обсуждение
Поскольку препараты леводопы остаются наиболее эффективным лечебным средством на всех стадиях БП, их рано или поздно приходится назначать практически всем больным с этим заболеванием [2, 9, 26, 43]. Только у этих препаратов четко доказана способность длительно поддерживать двигательную активность и продлять срок жизни пациента с БП [22, 33, 40]. В то же время неизбежное развитие моторных флуктуаций и дискинезий через несколько лет после начала лечения существенно ограничивает терапевтический ресурс леводопы.
Как и другие исследователи, мы отметили, что развитие флуктуаций зависит как от тяжести и длительности самого заболевания (нозогенный фактор), так и от особенностей терапии леводопой (ятрогенный фактор). Способность леводопы индуцировать развитие флуктуаций на фоне ее длительного приема в первую очередь объясняется коротким периодом полужизни этого вещества в крови (60-90 мин). Тем не менее, эта возможность может проявиться лишь на фоне выраженных денервационных изменений в стариатуме.
В первые годы лечения при 3 кратном приеме эффект леводопы остается стабильным в течение суток. Это обеспечивается наличием не только краткосрочного эффекта, но и долгосрочного эффекта леводопы, развивающегося при регулярном приеме препарата. О существовании долгосрочного эффекта можно судить по постепенному нарастанию эффекта стабильной дозы леводопы в течение 2 недель после изменения дозы, а также по замедленному нарастанию паркинсонических симптомов после отмены препаратов леводопы, которое может растягиваться примерно на этот же срок (несмотря на то, что концентрация леводопы в крови практически близка к нулю уже на следующее утро после ее отмены). Долгосрочный эффект объясняют восполнением запасов эндогенного дофамина в пресинаптических окончаниях и/или перестройкой постсинаптических механизмов. Именно с редукцией долгосрочного эффекта леводопы в силу снижения численности нигростриарных окончаний и вторичных денервационных изменений можно связать развитие флуктуаций у больных, длительно принимающих этот препарат.
В результате уменьшения нигростриарных терминалей в стриатуме утрачивается их “буферная” функция - способность накапливать и плавно высвобождать дофамин. В сохранившихся нейронах ускоряется кругооборот дофамина - клетки быстрее высвобождают дофамин, а не накапливают его в везикулах. Леводопа все в большей степени перерабатывается в дофамин в соседних глиальных и недофаминергических нейронах, в которых содержится ДОФА-декарбоксилаза, но отсутствует механизма, регулирующий секрецию дофамина, что приводит к массивному неконтролируемому высвобождению дофамина вскоре после приема очередной дозы. Вновь синтезированный дофамин проникает в межклеточное пространство и диффундирует в синаптические щели. В результате концентрация дофамина в синапсе попадает в зависимость от колебаний уровня леводопы в крови. Вскоре после приема очередной дозы она резко повышается (у больных с флуктуациями уровень дофамина в синапсе через час после приема леводопы оказывается в 3 раза выше, чем у больных без флуктуаций), а затем быстро падает. В результате стимуляция дофаминовых рецепторов из тонической превращается в пульсирующую (псевдофазическую), нефизиологическую, что, в свою очередь, изменяет функциональное состояние рецепторного аппарата и стриарных нейронов [19, 28, 31, 34].
Ведущую роль дегенеративных изменений в стриатуме в развитии моторных флуктуаций подчеркивает и хорошо известный факт зависимости вероятности флуктуаций от возраста пациента и семейного анамнеза: у молодых лиц и в семейных случаях заболевания флуктуации развиваются быстрее.
С другой стороны, в эксперименте показано, что перемежающаяся стимуляция дофаминовых рецепторов является самостоятельным фактором, определяющим неуклонное снижение длительности действия дозы леводопы. В то же время повторное назначение леводопы сопровождается укорочением длительности ее действия только в том случае, когда погибло более 95% нигростриарных нейронов. При критическом снижении числа нейронов, реакция на леводопу изменяется быстро, в течение нескольких недель. Поэтому стремление отсрочить любой ценой назначение леводопы, чтобы отодвинуть развитие моторных флуктуцаций, не всегда оправдано.
Об этом свидетельствуют и полученные нами данные о более быстром развитии флуктуаций и дискинезий на поздних стадиях заболевания. Чем позже пациенту с БП назначался препарат леводопы, тем быстрее у него развивались моторные флуктуации и дискинезии. Поскольку изменение реакции на препараты леводопы, лежащее в основе феномена моторных флуктуаций, в первую очередь связано с естественным ходом заболевания, представляется не вполне корректным обозначать их, как это часто делается, «осложнением длительной терапии леводопой».
Полученные данные позволяют под новым углом взглянуть на некоторые вопросы стратегии лечения БП. Поскольку гибель нейронов компактной части черной субстанции и их окончаний в полосатом теле – основной фактор развития моторных флуктуаций, наиболее продуктивной стратегией предотвращения моторных флуктуаций могла бы быть нейропротекторная терапия, однако к настоящему моменту мы не располагаем средствами, которые бы доказательно приостанавливали или хотя бы замедляли прогрессирование БП.
В прошлые годы развитие флуктуаций некоторые авторы связывали с возможным токсическим действием леводопы на дофаминергические нейроны, выявленное в эксперименте на культуре ткани. Предполагалось, что при окислении леводопы или образовавшегося из нее дофамина продуцируются свободные радикалы, перекись водорода, хиноны, другие активные формы кислорода, которые могут спровоцировать перекисное окисление липидов, нарушать функционирование дыхательной цепи митохондрий и тем самым ускорять дегенеративный процесс. Однако доказательств, что этот эффект имеет место in vivo, получить не удалось. Вероятно, в условиях целостного организма с его мощными антиоксидантными системами (в том числе связанными с глиальными клетками) нейротоксическое действие леводопы не проявляется. Более того, показано, что длительное назначение препаратов леводопы крысам, у которых была повреждена черная субстанция, не замедляло, а даже ускоряло восстановление и приводило к повышению числа нормально функционирующих нейронов и увеличению продукции нейротрофических факторов.
Предположению о токсичности препарата противоречит и тот факт, что леводопа повышает продолжительность жизни больных. Не были получены доказательства токсичности леводопы и в недавно законченном масштабном исследовании ELLDOPA (Earlier vs Later L-DOPA), которое проводилось в 35 центрах США и Канады с тем, чтобы оценить влияние леводопы на прогрессирование БП. В ходе исследования около 360 больных, ранее не лечившихся, принимали плацебо или разные дозы леводопы (150, 300, 600 мг/сут) в течение 40 недель. По завершению 2-4 недельного отмывочного периода оказалось, степень прироста двигательного дефекта в группах, принимавших плацебо, оказалась даже ниже, чем в контрольной группе. Не получено достоверных различий между группами и по данным ОФЭКТ с bCIT, которая позволяла оценить степень утраты нигростриарных окончаний. Таким образом, токсичность леводопы не может служить основанием для откладывания момента ее назначения.
Тем не менее, несомненна зависимость развития флуктуаций от длительности приема и дозы леводопы. Поэтому, учитывая результаты нескольких крупномасшбных исследований, в том числе касающиеся возможности нейропротекторного действия агонистов дофаминовых рецепторов (АДР), представляется резонным (особенно у пациентов молодого и среднего возраста) начинать лечение с агонистов, присоединяя затем препараты леводопы по мере необходимости. Но на какой срок мы должны откладывать назначение препаратов леводопы больным БП, пытаясь отcрочить момент развития моторных флуктуаций и дискинезий?
Во-первых, следует учитывать, что более редкое (позднее) развитие флуктуаций и дискинезий при начале лечения с агониста дофаминовых рецепторов, достигалось ценой более низкой эффективности противопаркинсонической терапии и более частых побочных эффектов (таких как галлюцинации, сонливость, тошнота, отеки нижних конечностей). С другой стороны, откладывая момент назначения препаратов леводопы, мы рискуем не получить пользу, которую они могут принести данному конкретному пациенту. Так как период оптимального действия препаратов леводопы («медовый месяц») может сокращаться как за счет более быстрого развития флуктуаций (как показано в нашем исследовании), так и за счет нарастания симптомов, относительно резистентных к препаратам леводопы (нарушений равновесия и ходьбы, деменции, вегетативной дисфункции и т.д.). Кроме того, наши наблюдения показывают, что, впервые назначая препарат леводопы больному с поздней стадией заболевания, для получения нужного эффекта часто приходится назначать не малые дозы, эффективные на ранних стадиях заболевания (150-300 мг/сут), а дозы, близкие к верхнему пределу для больных БП (600-800 мг/сут).
Более того, анализируя результаты крупнейшего 10-летнего сравнительного исследования, в котором одна из групп пациентов начинала лечения с леводопы, а другая – с бромокриптина, Lees и соавт. (2001) пришли к выводу, что, хотя у больных, первоначально принимавших бромокриптин, частота дискинезий и в меньшей степени флуктуаций была ниже, чем у больных, сразу же начинавших лечение с леводопы, между этими группами не было достоверного различия в частоте умеренных и тяжелых дискинезий и флуктуаций, вызывающих трудности при лечении. Не приводило начало лечения бромокриптином и к уменьшению смертности. При этом, как и в других исследованиях, некоторое снижение частоты моторных осложнений доставалось ценой более выраженных двигательных нарушений, особенно в первые годы болезни, и более быстрого возвращения к исходному уровню двигательных функций. К тому же, как показали Marras и соавт. (2004), умеренные моторные флуктуации и дискинезии, по крайней мере, у больных с ранними стадиями БП, могут не оказывать отрицательного влияния на качество жизни больных.
Планируя лечение на длительный срок, нужно принимать во внимание и то, что монотерапия АДР способна обеспечить достаточную компенсацию двигательного дефекта лишь в течение ограниченного времени. Но если на ранней стадии болезни эффективность АДР приближается к эффективности леводопы, что, возможно, объясняется относительно высоким остаточным уровнем эндогенного дофамина или денервационной гиперчувствительностью D2-дофаминовых рецепторов, то по мере прогрессирования БП эффективность АДР падает, и лишь 15-20% пациентов могут оставаться на монотерапии АДР в течение 5 лет от начала лечения. В остальных случаях к АДР для поддержания адекватного эффекта необходимо подключать препарат леводопы. Но как только к АДР добавляется препарат леводопы, вероятность развития флуктуаций увеличивается, и в конечном итоге, они могут становиться столь же тяжелыми, какими бы они были, если бы АДР никогда не назначались.
На практике часто приходится сталкиваться с ситуацией, когда врачи догматично восприняв принцип отставленного начала терапии леводопой, долго пытаются вести больного на холинолитике, селегилине, АДР или других препаратах, несмотря на явную неэффективность такой комбинации и все более нарастающую обездвиженность больного. Иногда это бывает проявлением своеобразной, во многом иррациональной «леводопофобии», свойственной ряду пациентов и врачей.
Неадекватность терапии не только ограничивает активную жизнедеятельность больного в данное время, но, по-видимому, имеет и отдаленные неблагоприятные последствия в связи с социальной и семейной дезадаптацией, повышенным риском осложнений, обусловленных ограниченной подвижностью, а также патофизиологическими факторами - повышенной активностью субталамического ядра и усиленным выделением возбуждающих аминокислот, предположительно способствующих дальнейшему прогрессированию дегенеративного процесса c поражением не только дофаминергической, но и недофаминергических систем.
На основе полученных нами данных можно предположить, что существует своего рода ограниченное во времени «терапевтическое окно» для начала лечения леводопой - назначая препарат леводопы в пределах этого «окна», мы можем рассчитывать на получение оптимального эффекта препарата в течение максимально длительного времени. В то же время излишне раннее или слишком позднее назначение леводопы бывает нерациональным.
В подтверждение этого положения можно привести данные Rajput (2001), согласно которым увеличение продолжительности жизни на фоне лечения препаратами леводопы достигается только при относительно раннем ее назначении (не позднее стадии 2,5). Сопоставление времени достижения той или иной стадии БП до появления леводопы и после начала ее широкого применения показало, что главное изменение заключается в более чем 3-кратном удлинении 3-й стадии (и соответственно латентного периода наступления IV стадии), в то же время длительность 1 и 2, а также 4 и 5 стадий существенно не изменилась. Таким образом, момент открытия «терапевтического окна» можно соотнести именно с началом 3-й стадии. Об этом же свидетельствуют и данные Schoenfeld и соавт. (2003), которые отметили, что у больных с 1-2,5 стадиями независимо от возраста монотерапия агонистами дофаминовых рецепторов способна обеспечить не менее значимый противопаркинсонический эффект, чем препараты леводопы, тогда как начиная с 3-й стадии заболевания на фоне лечения препаратами леводопы (в комбинации с агонистом дофаминовых рецепторов или в виде монотерапии) достигается более существенного уменьшение двигательного дефекта, чем на фоне лечения агонистом дофаминовых рецепторов.
Тем не менее, представляется, что основным регулятором времени назначения леводопы должна быть не формальная оценка стадии болезни, а степень функционального дефекта и индивидуальная восприимчивость у данного конкретного больного. Если с помощью иных противопаркинсонических средств не удается поддерживать его на адекватном уровне, необходимом, например, для продолжения профессиональной деятельности или сохранения бытовой независимости, следует назначить наиболее эффективный препарат - леводопу.
Мнение о том, что леводопу следует применять в как можно более низкой дозе оспаривается в последние годы некоторыми специалистами, считающими, что поддержание стабильной концентрации дофамина в стриатуме и, что еще важнее, отсутствие ее падения ниже некой критической черты имеет более существенное значение для предупреждения флуктуаций. Тем не менее, учитывая выявленную связь флуктуаций с дозой препарата, большинство специалистов рекомендуют назначать препарат в минимальной эффективной дозе, обеспечивающей достаточный в данном конкретном случае уровень двигательной активности, а не в максимально переносимой дозе.
Анализ нескольких длительных плацебо-контролируемых исследований агонистов дофаминовых рецепторов показал, что у больных, первоначально лечившимися АДР, отмечается более высокий уровень двигательных нарушений в течение всего исследования, несмотря на то, что была возможность титровать дозу агониста до максимально переносимой и добавлять необходимую дозу леводопы. Это можно объяснить тем обстоятельством, что в результате менее эффективной начальной терапии у больных формируется более низкий уровень ожиданий, не требующей столь же быстрой эскалации дозы леводопы, как в группе, первоначально принимавшей леводопу. Следует предположить, что того же эффекта можно добиться, ограничивая на ранних стадиях БП дозу леводопы. Повышению эффективности небольших доз леводопы может способствовать ее комбинация с АДР и/или амантадином.
И еще один аспект важно затронуть. С какой лекарственной формы леводопы следует начинать лечение? Развитие флуктуаций во многом объясняется пульсирующей стимуляцией дофаминовых рецепторов, которая в свою очередь возникает в силу того, что после снижения числа нигростриарных окончаний до критического уровня концентрация дофамина в стриатуме начинает повторять колебания леводопы в крови.
В связи с этим поддержание стабильно высокой концентрации леводопы в крови, обеспечивая тоническую стимуляцию дофаминовых рецепторов в стриатуме, может предупреждать развитие флуктуаций. В пользу этого свидетельствуют как экспериментальные данные, так и клинические наблюдения, например, возможность обратного развития флуктуаций и дискинезий после постоянной внутривенной или внутрикишечной инфузии леводопы, а также длительной инфузии АДР короткого действия (например, апоморфина или лизурида).
Применение препаратов леводопы с замедленным (контролируемым) высвобождением (например, мадопара ГСС или синемета CR) обеспечивает более равномерную концентрацию леводопы в крови. Тем не менее, в проведенном 5-летнем контролируемом исследовании сравнение частоты развития моторных флуктуаций и дискинезий на фоне применения леводопы/карбидопы с замедленным высвобождением (синемета CR) и стандартного препарата не выявило существенных различий. В то же время, в указанном исследовании синемет CR назначался 2 раза в день, что может быть недостаточным для поддержания стабильной концентрации леводопы в крови. Кроме того, в группе, принимавшей синемет CR, доза леводопы (даже после поправки на более низкую биодоступность) и уровень повседневной активности больных оказались выше, чем в группе, принимавшей стандартный препарат леводопы. Таким образом, препарат с замедленным (контролируемым) высвобождением, может обеспечить более высокий уровень повседневной активности, чем стандартный препарат при том же риске развития флуктуаций. Более того, можно предположить, что, назначая препарат c замедленным высвобождением в более низкой дозе можно было бы добиться и более низкой частоты развития флуктуаций.
Это предположение могут подтвердить результаты небольшого двойного слепого плацебо-контролируемого исследования, проведенного Rinne (1991) и включавшего 40 больных с ранними стадиями БП. Автором было показано, что к концу 2-летнего периода наблюдения у пациентов, принимавших препарат леводопы/бензеразида с замедленным высвобождением (мадопар ГСС) 3-4 раза в день, флуктуации и дискинезии развивались значительно реже, чем у больных, лечившихся стандартным препаратом леводопы/бензеразида (при этом доза мадопара ГСС была лишь немного выше, чем доза стандартного препарата, соответственно 615,8 ± 50,9 vs. 555,0 ± 46,6 мг/сут). Хотя в последующем более крупном 5-летнем исследовании этот результат не был подтвержден, это могло быть связано с тем, что 2-3 кратный прием препарата с контролируемым высвобождением не обеспечивает стабильной концентрации леводопы в крови.
Поскольку препараты с замедленным (контролируемым) высвобождением имеют более низкую биодоступность, чем стандартные средства, следует особенно тщательно следить, чтобы пациент принимал их за 40-45 мин еды, а нарушение моторики желудочно-кишечного тракта своевременно корригировались. Именно в этом случае можно избежать критического снижения уровня леводопы в течение дня. Вместе с тем следует предостеречь от практики назначения частых (более 6 раз) минимальных доз стандартных препаратов леводопы, которые не только не обеспечивают стабильной концентрации леводопы в крови, но и не оказывают необходимого предсказуемого лечебного эффекта.
Принимая во внимание указанные обстоятельства, можно заключить, что не следует откладывать назначение препарата леводопы, если он необходим для поддержания адекватного уровня двигательной активности (обычно со 2,5-3 стадий заболевания). При этом может быть целесообразным использовать уже на ранней стадии лечения леводопой препарат с замедленным (контролируемым) высвобождением, назначая минимальную эффективную дозу (в виде монотерапии или в комбинации с агонистом дофаминовых рецепторов и/или амантадином).
Мы отметили, что вероятность развития флуктуаций выше у больных с более выраженным первоначальным эффектом леводопы. Именно у этой категории пациентов в особенно целесообразно применение препаратов с замедленным высвобождением и необходима особая осторожность в отношении наращивания дозы леводопы. С другой стороны, флуктуации и дискинезии реже развивались у больных с более низким эффектом леводопы и, вероятно, более существенной представленностью симптомов, относительно резистентных к леводопе, прежде всего аксиальных двигательных нарушений, которые, как и немоторные проявления БП, могут быть связаны с недофаминергическими механизмами. У этой же категории больных в среднем были более выражены когнитивные нарушения, по-видимому, за счет присутствия пациентов с более быстрым развитием когнитивных нарушений. В ряде исследований показано, что развитие деменции при БП сопряжено с более высоким темпом прогрессирования двигательного дефекта и снижением реакции на препараты леводопы, что отражает более значительную экспансию дегенеративного процесса. Таким образом, у больных с более быстрым нарастанием аксиальных двигательных расстройств и когнитивных нарушений в виду более низкой вероятности развития флуктуаций и дискинезий и более благоприятного соотношения эффективности и побочных эффектов целесообразно более раннее начало терапии препаратами леводопы.
