Концепция ступенчатого подхода к лечению неспецифической боли в нижней части спины
Статьи Опубликовано в журнале:«ВРАЧ»; 3; 2013; стр. 11-17.
А. Карнеев, доктор медицинских наук, профессор,
Э. Соловьева, доктор медицинских наук, профессор РНИМУ им. Н.И. Пирогова
Обсуждается выбор оптимального способа купирования болевого синдрома при обострении хронической скелетно-мышечной боли в спине. Отмечена возможность использования ступенчатого подхода: начинают терапию с наименьших эффективных доз нестероидных противовоспалительных препаратов (НПВП), при необходимости переходят на другие НПВП, комбинирование НПВП с другими немедикаментозными и медикаментозными средствами, в том числе с миорелаксантами, антидепрессантами и ГАМКергическими средствами.
Ключевые слова: скелетно-мышечная боль в спине, нестероидные противовоспалительные препараты (НПВП), миорелаксанты, ГАМКергические средства.
The Concept Of A Stepwise Approach To Treating Nonspecific Pain In The Lower Back
Professor A. Karneev, MD; Professor E. Solovyeva, MD
N.I. Pirogov Russian National Research Medical University, Moscow
The paper discusses the choice of an optimal mode to relieve pain syndrome on an exacerbation of chronic musculoskeletal pain in the back. It highlights the possibility of using a stepwise approach: therapy is started from the least effective doses of nonsteroidal anti-inflammatory drugs (NSAIDs) and, if required, switched to other NSAIDs, a combination of the latter with other non-drug and drug treatments, including those with myorelaxants, antidepressants, and GABAergic agents.
Key words: musculoskeletal pain in the back; nonsteroidal anti-inflammatory drugs; myorelaxants; GABAergic agents.
Боль в спине — наиболее частая причина обращаемости к врачу амбулаторной практики. Она развивается с одинаковой частотой у мужчин и женщин, представителей разного пола и профессий, проживающих на разных континентах. Заболеваемость ею в течение жизни составляет до 85% [1].
Согласно данным международных исследований, до 19— 43% обследованных взрослых из случайных выборок испытывали боль в спине в течение последнего месяца, 27—65% — в течение последнего года и 59—84% страдали от болей в спине хотя бы 1 раз в жизни [2].
В большинстве случаев эпизоды болей в спине носят неспецифический характер, чаще локализуются в поясничнокрестцовой области. В Международной классификации болезней 10-го пересмотра (МКБ-10) первичные неспецифические боли в нижней части спины (БНС) доброкачественного течения соответствуют шифру М 54.5.
При адекватной терапии у 80—90% больных БНС регрессируют в течение 1 мес [3]. Однако у части пациентов болевой синдром сохраняется длительное время и даже приводит к инвалидизации [2, 4]. Недавние работы показывают, что в 10—30% случаев острые боли рецидивируют и персистируют в течение 1 года и дольше, становясь хроническими [5—7].
По результатам изучения эпидемиологии болевых синдромов, у взрослого населения России распространенность хронической боли в спине составляет до 56,7% [8], причем выше она среди женщин, лиц с низкими доходами и пациентов пожилого возраста, связана с депрессией и эмоциональными стрессовыми факторами, имеет культурно-этнические особенности [9].
Несмотря на то, что пик распространенности боли в спине приходится на наиболее работоспособный и профессионально зрелый возраст (35—55 лет), она нередко встречается и в других возрастных группах, начинаясь даже в подростковом периоде. Зарубежные эпидемиологические исследования показывают, что диапазон частоты встречаемости болевого синдрома в спине у детей и подростков составляет от 10 до 44%.
Известно, что в основе формирования боли могут лежать различные патофизиологические механизмы, определяющие ее тип: ноцицептивная (НБ), невропатическая, психогенная боль.
НБ, как правило, острая, связана с активацией болевых рецепторов. Нейропатическая боль возникает как прямое следствие повреждения или болезни, затрагивающей соматосенсорную систему (Neu PSIG of IASP, 2007). Психогенная боль возникает вне зависимости от соматических, висцеральных или нейрональных повреждений и в большей степени определяется психологическими и социальными факторами.
В клинической практике чаще встречаются сочетанные формы болевых синдромов, разделяемые по временным характеристикам (острая и хроническая).
Острая боль, как правило, обусловлена ноцицептивной афферентацией и гораздо реже бывает невропатической природы, связанной с поражением периферических структур соматосенсорной системы. Причиной хронической боли могут быть периферическое ноцицептивное воздействие, а также дисфункция периферической нервной системы или ЦНС.
Наиболее частая причина НБ — скелетно-мышечные нарушения. В структуре болевых синдромов скелетно-мышечная (неспецифическая) боль в спине занимает 70—85%; боль, связанная со структурными изменениями позвоночника (наличием актуального дискорадикулярного конфликта, фасеточным, дискогенным болевым синдромом, болью при травматических повреждениях позвоночника), — 27%; боль, обусловленная висцеральной патологией, злокачественными новообразованиями, инфекционными и воспалительными поражениями позвоночника, — до 3% [4, 10].
При ноцицептивном механизме боли, независимо от источника болевого импульса, происходит выброс в межклеточную жидкость альгогенных соединений — медиаторов воспаления, включающих брадикинин, метаболиты арахидоновой кислоты (простагландины — Pg и лейкотриены), биогенные амины, пурины; они играют ключевую роль в формировании боли, обусловленной повреждением, ишемией и воспалением [11]. Патофизиологической основой «первичной гипералгезии» является повышение чувствительности (сенситизация) ноцицепторов, что электрофизиологически проявляется снижением порога их активации, увеличением частоты и длительности разрядов в нервных волокнах (группы Аδ и С) и приводит к усилению афферентного ноцицептивного потока. Сенситизации ноцицепторов при повреждении тканей способствуют не только тканевые и плазменные альгогены, но и нейропептиды, выделяющиеся из С-афферентов, — такие, как субстанция Р, нейрокинин А или кальцитонин-ген-родственный пептид [12, 13].
Определенное влияние оказывают эфференты симпатической нервной системы [11]. Во-первых, за счет повышения сосудистой проницаемости в зоне повреждения и увеличения концентрации медиаторов воспаления (непрямой путь) и, во-вторых, за счет прямого воздействия нейротрансмиттеров симпатической нервной системы — норадреналина и адреналина — на α2-адренорецепторы, расположенные на мембране ноцицепторов. Индуцированное ноцицептивной стимуляцией высвобождение глутамата и нейропептидов из центральных терминалей С-афферентов вызывает стойкие изменения возбудимости ноцицептивных нейронов дорсального рога, ядер таламуса и соматосенсорной зоны коры больших полушарий. Увеличение послеразрядов и расширение рецептивных полей приводят к формированию «вторичной гипералгезии», клинически характеризующейся повышением болевой чувствительности вне зоны повреждения.
Каскад патофизиологических и регуляторных процессов, затрагивающих всю ноцицептивную систему, от тканевых рецепторов до корковых нейронов, можно представить в виде следующей схемы: раздражение ноцицепторов при повреждении тканей →→ выделение альгогенов и сенситизация ноцицепторов в области повреждения → усиление ноцицептивного афферентного потока с периферии → сенситизация нейронов на различных уровнях ЦНС [13].
Периферическая сенситизация (ПС) — это увеличение возбудимости периферических ноцицепторов в ответ на воспаление. Центральная сенситизация (ЦС) — это повышение возбудимости нейронов в ЦНС в случае продолжения боли [13]. ЦС развивается вследствие сенситизации периферических рецепторов. На этой стадии периферические рецепторы уже обладают спонтанной активностью даже в отсутствие периферической стимуляции.
В связи с этим патогенетически обоснованным считается применение средств, направленных, во-первых, на ограничение поступления ноцицептивной импульсации из зоны повреждения в ЦНС (блокады местными анестетиками), во-вторых, на подавление синтеза медиаторов воспаления (нестероидные противовоспалительные препараты — НПВП), в-третьих, на активацию структур антиноцицептивной системы, контролирующей проведение ноцицептивной импульсации в ЦНС, например, тормозящих проведение нервных импульсов по чувствительным нервам и оказывющих агонистическое действие на ГАМКергические рецепторы нейронов задних рогов и клеток ядра спинномозгового пути тройничного нерва. Для этого может быть использован целый спектр (в зависимости от клинической задачи) медикаментозных и немедикаментозных средств, снижающих болевую чувствительность и негативное эмоциональное переживание: наркотические и ненаркотические анальгетики, противосудорожные препараты, агонисты α2-адренорецепторов, чрескожная электронейростимуляция (ЧЭНС), рефлексотерапия, физиотерапия, психотерапия и др. [14].
Результаты многочисленных рандомизированных контролируемых исследований убедительно показывают, что НПВП высокоэффективны при хронических болях в спине. Метаанализ 65 контролируемых исследований показал, что НПВП в целом достоверно эффективны как при острой боли в спине, так и при обострении хронической боли без корешкового синдрома [15—17].
Существует точка зрения, согласно которой поддержание хронической боли во многом обусловлено продолжающейся периферической сенситизацией, вызванной воспалительными изменениями [18]. Ряд исследований выявил в тканях поясничной области у пациентов с хронической неспецифической болью в спине маркеры воспаления: высокую активность С-реактивного белка [19], повышение уровня интерлейкина-6 (ИЛ6) [20], фактора некроза опухоли (ФНО) [21].
Все НПВП имеют общий механизм действия, заключающийся в подавлении активности фермента циклооксигеназы (ЦОГ), катализирующей превращение свободных полиненасыщенных жирных кислот в Pg, а также другие эйкозаноиды — тромбоксаны и простациклин. Доказано, что Pg имеют многостороннюю биологическую активность: являются медиаторами воспалительной реакции; сенсибилизируют рецепторы к медиаторам боли (гистамину, брадикинину) и механическим воздействиям, понижая порог чувствительности; повышают чувствительность гипоталамических центров терморегуляции к действию эндогенных пирогенов (ИЛ1 и др.), играют важную физиологическую роль в защите слизистой оболочки желудочно-кишечного тракта (ЖКТ); влияют на функцию почек.
Основным негативным свойством всех НПВП, связанным с угнетением синтеза Pg и эйкозаноидов, является высокий риск развития нежелательных реакций со стороны ЖКТ, почек, печени, сосудов, бронхолегочной системы.
Внедрение в клиническую практику препаратов, преимущественно подавляющих продукцию изофермента ЦОГ2, явилось шагом вперед на пути поиска безопасных НПВП. Исследования последних лет продемонстрировали, что ЦОГ2 является индуцибельным ферментом, экспрессирующим каскад превращений арахидоновой кислоты в провоспалительные Pg (PgF и PgI), повышающие чувствительность ноцицепторов к различным стимулам и способствующие формированию вторичной воспалительной гипералгезии и периферической сенситизации. Именно с ингибированием ЦОГ2 связывают важнейшие механизмы противовоспалительной и анальгетической активности, а с ингибированием ЦОГ1 — развитие большинства побочных реакций [22].
В последние 5 лет широко обсуждается вопрос об относительной безопасности селективных ингибиторов ЦОГ2 с точки зрения их кардиоваскулярных эффектов. С целью определения профиля кардиоваскулярной безопасности препаратов из группы НПВП P. McGettigan и D. Henry провели метаанализ контролируемых обсервационных исследований, посвященных данной проблеме [23] и пришли к выводу, что риск развития сердечно-сосудистых событий повышается при использовании как селективных, так и неселективных НПВП.
В клинических рекомендациях по диагностике, лечению и предупреждению неспецифической боли в нижней части спины, составленных Ассоциацией ревматологов России и Российским межрегиональным обществом по изучению боли, НПВП считаются препаратами 1-й линии при хронической неспецифической боли в спине, однако обращено внимание на высокую частоту побочных явлений при длительном использовании этих средств [24].
В настоящее время Комитет по медицинским продуктам, использующимся у человека, Европейского медицинского агентства рекомендует применение НПВП, в том числе селективных и неселективных, в наименьших эффективных дозах с наименьшей возможной продолжительностью, достаточной для контроля симптомов заболевания. [14, 23].
Исходя из этого нами изучено использование селективного ингибитора ЦОГ2 — мелоксикама (препарат Месипол, Польфарма) в наименьших эффективных дозах с наименьшей возможной продолжительностью лечения для оценки контроля обезболивающего эффекта препарата у больных с хроническими скелетно-мышечными болевыми синдромами в стадии обострения.
Мелоксикам (производное оксикамовой кислоты) широко и давно используется в медицинской практике. Результаты более 230 клинических исследований свидетельствуют, что по эффективности мелоксикам не уступает неселективным НПВП, но при этом у него лучше профиль безопасности [25]. Мелоксикам структурно отличается от коксибов, имея сбалансированный профиль избирательности по отношению к ЦОГ2 и обладая 5—20-кратной селективностью к ЦОГ2 по сравнению с ЦОГ1. Помимо влияния на синтез Pg, мелоксикам угнетает перекисное окисление липидов, снижает образование свободных кислородных радикалов, фактора активации тромбоцитов, ФНО, протеиназ и других медиаторов воспаления. Длительный период полувыведения мелоксикама (20 ч) позволяет принимать препарат 1 раз в сутки, что очень удобно [26]. Достоинство мелоксикама — его совместимость с антацидами, циметидином, ацетилсалициловой кислотой, метотрексатом, варфарином, фуросемидом — препаратами, которые чаще всего принимают больные среднего и пожилого возраста, страдающие не только болезнями суставов, но и сердечно-сосудистыми заболеваниями, нарушениями водно-солевого обмена, склонностью к гиперкоагуляции [27]. В отличие от традиционных НПВП мелоксикам не оказывает повреждающего действия на суставной хрящ [28]. Эффективность и лучшую переносимость мелоксикама по сравнению с традиционными НПВП при лечении остеоартрита засвидетельствовали 2 широкомасштабных клинических исследования — SELECT [29] и MELISSA [30], в которых участвовали около 20 тыс. больных. В этих исследованиях в сравнительном аспекте анализировались эффективность и безопасность мелоксикама, диклофенака и пироксикама как в краткосрочном, так и в долгосрочном режимах использования. Результаты показали, что все НПВП были сопоставимы по эффективности. В 12-недельном исследовании мелоксикам в дозах 7,5 и 15 мг/сут оказался столь же эффективным, как и диклофенак в дозе 100 мг/сут или пироксикам в дозе 20 мг/сут.
Метаанализ рандомизированных клинических исследований подтверждает низкий риск тяжелых побочных эффектов со стороны ЖКТ при приеме мелоксикама. Эти данные подтверждает и исследование IMPROVE, в котором оценивали «терапевтический успех» мелоксикама при остеоартрите [31], для чего были выбраны следующие параметры (конечная точка): завершение исследования без перехода на прием другого НПВП или завершение исследования и отсутствие необходимости принимать НПВП. Мелоксикам был назначен 662 больным, другие НПВП — 647 больным. Конечной точки достигли 67% из группы больных, принимавших мелоксикам, и 45% больных из группы сравнения (p<0,0005). Отмена лечения из-за побочных реакций произошла соответственно у 12 и 20% больных, из-за отсутствия эффекта — у 16 и 28% больных.
В последнее время во врачебную практику с целью быстрого купирования боли внедрена новая, парентеральная форма мелоксикама для внутримышечного введения. Фармакокинетические исследования показали, что максимальная плазменная концентрация после внутримышечного введения достигается уже через 1,5 ч (по сравнению с 5—7 ч после перорального приема) [32].
Преимущество использования парентеральной формы мелоксикама по сравнению с таблетированной продемонстрировано при ревматоидном артрите [32, 33], остеоартрозе [34], люмбоишиалгии [35]. Сегодня на российском рынке международных непатентованных наименований мелоксикам представлен разными брендированными препаратами. Один из них — препарат Месипол (Польфарма), который выпускается в инъекционной (ампулы по 1,5 мл/15 мг) форме. Инъекционный Месипол полностью абсорбируется после внутримышечного введения. Биодоступность препарата составляет около 100%. После внутримышечного введения 15 мг максимальная концентрация препарата в плазме, составляющая 1,62 мкг/мл, достигается приблизительно через 1 ч; выводится он преимущественно в виде метаболитов, в равной степени почками и кишечником. Препарат вводят посредством глубокой внутримышечной инъекции. Внутривенно он не используется.
Исследование проведено у 37 пациентов со скелетномышечными болевыми синдромами в стадии обострения, пояснично-крестцовой локализации. Критериями включения в исследование явились: возраст пациента от 18 до 75 лет; наличие скелетно-мышечной боли в спине длительностью более 12 нед; интенсивность боли >4 баллов по Визуальной аналоговой шкале (ВАШ); подписание информированного согласия.
Критерии исключения: аллергическая реакция на мелоксикам, кетопрофен, карбамазепин; участие в других исследованиях в течение последних 30 дней; язвенное поражение ЖКТ, злокачественное новообразование, алкогольная и наркотическая зависимость, травмы в анамнезе, болезнь Педжета; прием анальгетиков, включая, но не ограничиваясь перечисленными категориями, опиаты, НПВП, парацетамол в течение 3 ч до начала исследования; прием антиконвульсантов, антидепрессантов, барбитуратов, анксиолитиков, миорелаксантов менее чем за 24 ч до исследования; прием глюкокортикоидов в анамнезе; наличие частых эпизодов тошноты, диспепсии, боли в эпигастральной области, диареи, отеков лица и конечностей, головокружения и головной боли; наличие признаков поражения шейных, поясничных или крестцовых корешков (чувствительные, двигательные, рефлекторные нарушения) и других заболеваний, которые, по мнению исследователя, могут повлиять на результаты исследования или безопасность больного.
Средний возраст пациентов, участвующих в исследовании, составил 43,4±11,8 года; в том числе мужчин — 43±13,6 года; их было 18 (48,6%), женщин - 45±10,4 года; их было 19 (51,4%).
Дизайн исследования включал 4 визита пациента: исходный (0-й) — для уточнения характера боли, оценки состояния пациента и его соответствия критериям включения/исключения (методами клинического и лабораторно-инструментального исследования); 1-й визит — для осмотра, выбора и назначения лечения; 2-й визит (через 3 дня после начала лечения) — для осмотра, оценки аналгезирующей эффективности лекарств и выбора дальнейшей лечебной тактики, 3-й визит (через 5 дней после начала лечения) — для осмотра и коррекции терапии и 4-й визит (завершающий) — через 10 дней после начала лечения для оценки эффективности и безопасности лечения (см. рисунок).
Осмотр пациента при всех визитах включал соматическое, общее неврологическое и вертеброневрологическое обследование (в том числе измерение ограничения сгибания в поясничном отделе позвоночника по тесту Шобера), оценку интенсивности боли по ВАШ, влияния болевого синдрома на повседневную деятельность пациента по опроснику Освестри, а также нейропатического компонента боли по опроснику DN4.
Исходный осмотр пациентов выявил среднее значение интенсивности болевых ощущений в исследуемой группе до 6,08±2,4 балла по ВАШ. При этом 27 (72,9%) пациентов заявили об умеренной боли (интенсивность — 4,6±1,3 балла), 1-я подгруппа, и 10 (27,1%) — о выраженной боли (интенсивность — 7,3±1,7 балла), 2-я подгруппа. Средняя степень изменения процентного показателя жизнедеятельности (использован опросник Освестри) определилась на уровне 32,3±19,2% (индекс ответов ODI). При оценке функционального состояния поясничного отдела позвоночника по тесту Шобера величина растяжения в поясничном отделе позвоночника при максимальном сгибании вперед составила 2,5±0,4 см.
Всем больным, прошедшим обследование, был назначен Месипол в инъекционной форме по 1,5 мл/15 мг внутримышечно, ежедневно в течение 3 дней.
Дизайн и результаты исследования
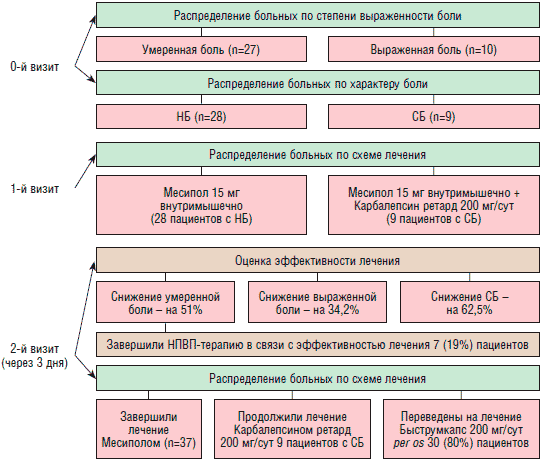
У 9 (24,3%) пациентов были выявлены признаки боли смешанного — СБ (ноцицептивного и нейропатического) характера (DN4≥3 баллов). Из них 3 отмечали умеренную выраженность болевого синдрома (4,4±0,3 балла по ВАШ), 6 -выраженную (6,4±0,6 балла по ВАШ). Всем пациентам с СБ была назначена комбинированная терапия Месиполом 15 мг/ сут и карбамазепином (препарат Карбалепсин ретард, Акрихин) в дозе 200 мг/сут, однократно на ночь. Карбамазепин -производное дибензазепина, активирующее центральную тормозную ГАМКергическую систему, блокирующее потенциалзависимые натриевые каналы мембран нервных клеток, что приводит к функциональной стабилизации нейронов. Ретардная форма карбамазепина позволяет снизить суточные колебания плазменного уровня препарата. После однократного приема максимальная концентрация сохраняется до 24 ч (на 25% меньше, чем после приема обычной таблетки).
При оценке состояния больных через 3 дня после лечения отмечена следующая динамика: средний балл по ВАШ во всей группе понизился с 6,08±2,4 до 4,2±0,9 (на 31%). В 1-й подгруппе с умеренной болью интенсивность уменьшилась с 4,6±1,3 до 2,1±0,7 балла (на 51%), во 2-й подгруппе с выраженной интенсивностью понижение было менее значимым - с 7,3±1,7 до 4,8±0,4 балла (на 34,2%). Вместе с тем пациенты, получавшие комбинированную терапию Месиполом и Карбалепсином ретард, отметили регресс болевых ощущений более чем в 2 раза: с 6,4±0,3 до 2,4±0,4 балла (на 62,5%). В подгруппе больных, получавших Месипол с исходно умеренной болью и среди пациентов, получавших комбинацию Месипола и Карбалепсина ретард, отмечено значительное снижение индекса ответов ODI — соответственно на 35,7 и 27,9%. Причем пациенты с исходно умеренной болью отмечали улучшение состояния на фоне кратковременного лечения Месиполом в виде уменьшения утренней скованности и ограничения сгибания в поясничном отделе позвоночника, увеличения дистанции ходьбы, расширения общей физической активности (показатель теста Шобера в этой группе больных увеличился с 3,1±0,4 до 4,4±0,3 см). Пациенты с СБ отмечали на фоне лечения Месиполом и Карбалепсином ретард улучшение сна, снижение ощущения жжения и покалывания, при этом значимых изменений в увеличении подвижности позвоночника не выявлялось.
Анализ полученных при 2-м визите результатов позволил 7 (19%) пациентам со снижением исходно умеренно выраженной боли до слабой назначить вместо приема НПВП миорелаксанты, витамины группы В, физиотерапевтические методы (ЧЭНС, массаж), лечебную физкультуру (ЛФК), акупунктуру и др.
30 пациентам с исходно умеренной или выраженной интенсивностью НБ, не купирующейся на фоне кратковременного применения инъекционной формы Месипола, было назначено лечение кетопрофеном (препарат Быструмкапс) в таблетках с модифицированным высвобождением в дозе 200 мг/сут; из них 9 пациентов с СБ продолжили прием Карбалепсина ретард (200 мг/сут).
Смена и выбор НПВП из группы кетопрофена были основаны на концепции ступенчатого подхода к лечению неспецифической боли в нижней части спины: от высокой дозы более слабого препарата — к низкой дозе более сильного средства [24].
Анальгетическое действие кетопрофена связано не только с подавлением центральных и периферических Pg, но и с влиянием на синтез и активность других нейроактивных веществ, играющих ключевую роль в восприятии болевого раздражения в ЦНС. Центральное противоболевое действие кетопрофена обусловлено способностью быстро проникать через гематоэнцефалический барьер благодаря исключительной жирорастворимости; оказывать центральное воздействие на уровне задних столбов спинного мозга путем ингибирования деполяризации нейронов задних столбов; селективно блокировать рецепторы N-метил-D-аспартат (NMDA) путем подавления деполяризации ионных каналов, оказывая таким образом прямое и быстрое действие на трансмиссию боли. Этот механизм обусловлен возвожностью кетопрофена стимулировать активность печеночного энзима триптофан-2,3-диоксигеназы, что непосредственно отражается на образовании кинуреновой кислоты — антагониста NMDA-рецепторов ЦНС; контролировать уровень некоторых нейротрансмиттеров — таких, как серотонин (через влияние на G-протеин и предшественник серотонина 5-гидрокситриптамин), уменьшать выработку субстанции Р; воздействовать на гетеротримерный G-протеин, меняя конфигурацию его α-подъединицы путем ее конкурентного замещения в зонах действия. G-протеин, находящийся в постсинаптической нейронной мембране, связывается с различными рецепторами, такими, как нейрокинины (NK1, NK2, NK3) и рецепторы глутамата, облегчающими прохождение афферентных болевых сигналов через мембрану [36].
При приеме кетопрофена пролонгированного действия (ретард) минимальная эффективная концентрация определяется через 45—60 мин. Стационарная концентрация вещества в плазме крови (Css) достигается через 24 ч после начала регулярного приема. Капсулы Быструмкапс 200 мг содержат гранулы с контролируемым высвобождением кетопрофена, которые предназначены для приема 1 раз в сутки. После перорального применения кетопрофен почти полностью абсорбируется из кишечного тракта (эффект «первого прохождения» через печень). Максимальная концентрация в плазме крови достигается через 6—8 ч после перорального применения дозы 200 мг.
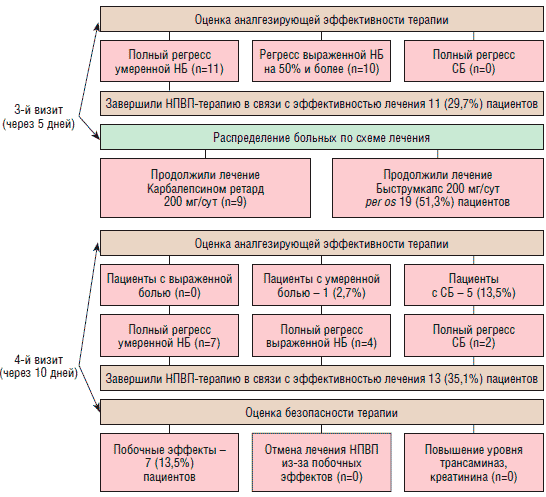
При 3-м визите, после 5 дней от начала основного лечения полный регресс болевых ощущений отметили 11 (29,7%) пациентов (индекс ответов ODI — 7,2±5%; показатель теста Шобера — 4,5±0,3 см; ВАШ — 0,6±0,4 балла), снижение боли на 50% и более — 10 (27%) больных (индекс ответов ODI — 24,5±8,7%; показатель теста - Шобера 3,5±0,7 см; ВАШ -3,1±1,8 балла). Причем достичь полного купирования болевого синдрома удалось только у пациентов в 1-й подгруппе (с умеренной выраженностью исходной НБ). Эти больные завершили НПВП-терапию в связи с эффективностью аналгезирующего эффекта, продолжив курс витамино- и физиотерапии, ЛФК и массажа.
В общей группе 19 (51,3%) пациентам продлили лечение приемом Быструмкапс в дозе 200 мг/сут, из них 9 пациентов с СБ продолжали прием Карбалепсина ретард в дозе 200 мг/сут.
Через 10 дней от начала лечения (4-й визит) полный регресс болевого синдрома (индекс ответов ODI - 5,2±3,3%; показатель теста Шобера — 4,5±0,6 см; ВАШ — 0,6±0,5 балла) выявлен у 13 (35,1%) пациентов (11 — с НБ, 2 — с СБ).
Оценка переносимости и безопасности лечения НПВП не выявила серьезных побочных явлений, которые могли бы привести к отмене исследуемых препаратов, а хорошая и удовлетворительная краткосрочная переносимость превышала 90% при использовании всех медикаментозных средств.
В то же время следует отметить, что у 7 больных (у 2 — при использовании Месипола, и у 5 — при использовании Быструмкапс) зафиксированы незначительные побочные явления, расцененные врачом как имеющие сомнительную связь с приемом исследуемого препарата и не потребовавшие его отмены или назначения дополнительной терапии. В основном преобладали жалобы на изменения со стороны ЖКТ (на диспепсию и боли в эпигастрии) у 5 больных, принимавших Быструмкапс. В 1 случае на фоне его приема наблюдалось обострение аллергического дерматита, а в 2 случаях при приеме инъекционной формы Месипола зарегистрировано повышение АД.
Для оценки безопасности препарата у всех больных определяли уровни ферментов печени аланин- и аспартатаминотрансферазы, креатинина и гемоглобина в крови. Показатели оценивали при первичном осмотре и через 5 дней от начала приема препарата. Уровни перечисленных лабораторных показателей достоверно не изменились и оставались в норме в течение всего исследования.
Таким образом, на фоне подобранной комбинации лечения НПВП и другими средствами достичь полного аналгезирующего эффекта удалось у 83,8% больных. У 6 (16,2%) пациентов сохранились умеренно (2,7%) и слабо (13,5%) выраженные болевые ощущения.
Суммарная оценка эффекта терапии по результатам настоящего исследования показала, что выбор оптимального способа купирования болевого синдрома при обострении хронической скелетно-мышечной боли в спине предполагает возможность использования ступенчатого подхода в ее лечении:
Концепция ступенчатого подхода дополняется концепцией оптимизации терапии за счет комбинирования НПВП с другими немедикаментозными и медикаментозными средствами, в том числе миорелаксантами (например, Баклосан в дозе 10—30 мг/сут) для достижения выраженного обезболивающего эффекта, улучшения функциональной способности опорно-двигательного аппарата и облегчения возможности проведения широких реабилитационных мероприятий.
В заключение следует отметить, что принцип лечения скелетно-мышечной боли в спине — рациональная полифармакотерапия. Купировать боль с помощью только 1 симптоммодифицирующего препарата удается далеко не всегда. При назначении лекарственных средств важно соблюдать баланс между их эффективностью и нежелательными эффектами, а также учитывать все патогенетические механизмы и факторы, принимающие участие в хронизации и поддержании болевого синдрома (использование антидепрессантов, психотерапия и пр.)
ЛИТЕРАТУРА
1. Kinkade S. Evaluation and treatment of acute low back pain // Am. Fam. Physician. - 2007; 75: 1181-8, 1190-2.
2. Borenstein D. Эпидемиология этиология, диагностическая оценка и лечение поясничной боли // Межд. мед. журн. - 2000; 35: 36-42.
3. McCarberg B: Acute back pain: benefits and risks of current treatments // Curr. Med. Res. Opin. - 2010; 26 (1): 179-90.
4. Подчуфарова Е.В., Яхно Н.Н. Боль в спине / М.: ГЭОТАР-Медиа, 2010; 368 с.
5. Costa Lda C, Maher C., McAuley J. et al. Prognosis for patients with chronic low back pain: inception cohort study // BMJ. - 2009; 339: b3829.
6. Freburger J., Holmes G., Agans R. et al. The rising prevalence of chronic low back pain // Arch. Intern. Med. - 2009; 169 (3): 251-8.
7. Henschke N., Maher C., Refshauge K. et al. Prognosis in patients with recent onset low back pain in Australian primary care: inception cohort study // BMJ. -2008; 337: a171.
8. Павленко С.С., Денисов В.Н., Фомин Г.И. Организация медицинской помощи больным с хроническими болевыми синдромами / Новосибирк, 2002; 221 с.
9. Carson J., Keefe F., Goli Vet al. Forgiveness and chronic low back pain: a preliminary study examining the relationship of forgiveness to pain, anger, and psychological distress // J. Pain. - 2005; 6 (2): 84-91.
10. Duffy R. Low Back Pain: An Approach to Diagnosis and Management // Prim. Care Clin. Office Pract. - 2010; 37: 729-41.
11. Wall P., Melzack R. Textbook of pain. 4th еd. - Edinburgh: Churchill Livingstone, 1999; р. 1143-53.
12. Вейн А.М. Болевые синдромы в неврологической практике // М.: Медпресс-информ, 2001.
13. Кукушкин М.Л., Хитров Н.К. Общая патология боли. М.: Медицина-2004.- 144 с.
14. Haldeman S. Low back pain. Current physiologic concepts // Neurol.Clin. -1999; 17 (1): 1-15.
15. Haroutiunian S., Drennan D., Lipman A. Topical NSAID therapy for musculoskeletal pain // Pain Medicine. - 2010; 11: 535-49.
16. Machado L., Kamper S., Herbert R. et al. Analgesic effects of treatments for non-specific low back pain: a meta-analysis of placebo-controlled randomized trials // Rheumatology. - 2009; 48: 520-7.
17. Roelofs P., Deyo R., Koes B. et al. Nonsteroidal anti-inflammatory drugs for low back pain: an updated Cochrane review // Spine. - 2008; 33: 1766-74.
18. Omoigui S. The biochemical origin of pain: the origin of all pain is inflammation and the inflammatory response. Part 2 of 3 - inflammatory profile of pain syndromes // Med. Hypothes. - 2007; 69: 1169-78.
19. Rannou F., Ouanes W., Boutron I. et al. High-sensitivity C-reactive protein in chronic low back pain with vertebral end-plate Modic signal changes // Arthritis. Rheum. - 2007; 57: 1311-5.
20. Burke J., Watson R., McCormack D. et al. Intervertebral discs which cause low back pain secrete high levels of proinflammatory mediators // J. Bone Joint. Surg. Br. - 2002; 84: 196-201.
21. Ohtori S., Inoue G., Ito T. et al. Tumor necrosis factor-immunoreactive cells and PGP 9.5-immunoreactive nerve fibers in vertebral endplates of patient with discogenic low back pain and modic type 1 or type 2 changes on MRI // Spine. -2006; 31: 1026-31.
22. Насонов Е.Л. Применение нестероидных противовоспалительных препаратов: терапевтические перспективы // РМЖ. - 2002; 10 (4): 206-12.
23. McGettigan P., Henry D. Cardiovascular risk and inhibition of cyclooxygenase. A systematic review of the observational studies of selective and nonselective inhibitors of cyclooxygenase // JAMA. - 2006; 13 (296): 1-12.
24. Неспецифическая боль в нижней части спины. Диагностика, лечение, предупреждение / М.: КомплектСервис, 2008; 70 с.
25. Euller-Ziegler L.,Velicitat P., Bluhmki E. et al. Meloxicam: a review of its pharmacokinetics, efficacy and tolerability following intramuscular administration // Inflam. Res. - 2001; 50 (1): 5-9.
26. Zeidler H., Kaltwasser J., Leonard J. et al Prescription and Tolerability of Meloxicam in Day-to-Day Practice: Postmarketing Observational Cohort Study of 13,307 Patients in.
27. Davies N., Skjodt N. Clinical pharmacokinetics of meloxicam: a cyclooxygenase-2 preferential non-steroidal anti-inflammatory drug // Clin. Pharmacokinet. - 1999; 36: 115-26.
28. Цветкова Е.С., Панасюк Е.Ю., Иониченок Н.Г. и др. Перспективы применения ингибиторов циклооксигеназы-2 при остеоартрозе // Consilium Medicum. - 2004; 6 (2): 100-5.
29. Dequeker J., Hawkey С., Kahan A. et al. Improvement in gastrointestinal tolerability on the selective cyclooxygenase (COX)-2 inhibitor meloxicam, compared with piroxicam: results of the safety and Efficacy Large scale Evalution of COX inhibiting Therapies (SELECT) trial in osteoarthritis // Br. J. Rheaumatol. - 1998; 37: 946-51.
30. Hawkey С., Kahan A., Steinbruck K. et al. Gastrointestinal tolerability of meloxicam compared to diclofenac in osteoarthritis patients. International MELISSA Study Group. Meloxicam Large Scale International Study Safety Assessment // Br J. Rheaumatol. - 1988; 37: 937-45.
31. Singh G., Triadafilopoulos G. Meloxicam has a low risk of serious gastrointestinal complication: pooled analysis of 27039 patients: the results of the IMPROVE trial // EULAR Congress. - 2001, Prague.
32. Combe B., Velicitat P., Garson N. et al. Comparison of intramuscular and oral meloxicam in rheumatoid arthritis patients // Inflam. Res. - 2001; 50 (Suppl. 1): S10-6.
33. Vidal L., Kneer W., Baturone M. et al. Meloxicam in acute episodes of soft-tissue rheumatism of the shoulder // Inflam. Res. - 2001; 50 (Suppl. 1): S24-9.
34. Цветкова Е.С. Эффективность и переносимость ступенчатой терапии мовалисом (мелоксикамом) при ревматических заболеваниях // Тер. арх. -2004; 12: 78-80.
35. Алексеев В.В. Применение мелоксикама в лечении люмбоишиалгического синдрома // РМЖ. - 2003; 7 (11): 416-8.
36. Вознесенский А.Г. Клиническая фармакология нестероидных противовоспалительных средств. Волгоград, 1999.
