Актовегин как компонент комплексной терапии осложненных форм хронической венозной недостаточности нижних конечностей
СтатьиОпубликовано:
Русский медицинский журнал, том 15, № 12, 2007
Д.м.н. И.Г. Учкин, к.м.н. А.Г. Мосесов, А.А. Цырульников
ММ А имени И. М. Сеченова, ЦКБ №2 им. Н.А. Семашко ОАО «РЖД», Москва
Хроническая венозная недостаточность (ХВН) нижних конечностей чрезвычайно распространена в современном мире. В России различными ее формами страдают более 35 млн человек, причем у 15% из них имеются трофические изменения кожи, открытые или рецидивирующие трофические язвы [8]. ХВН с проявлениями трофических расстройств, как следствие тромбоза вен нижних конечностей, является причиной длительной нетрудоспособности и инвалидности лиц наиболее трудоспособного возраста.
Конечной мишенью патофизиологических расстройств при ХВН являются изменения в микроциркуляторном русле. Ряд клинических тестов (лазерная флоуметрия, измерение интерстициального давления, капилляроскопия, микролимфография) подтверждают их наличие в той или иной степени выраженности [1,3,9].
Изучение основных молекулярных и клеточных механизмов формирования ХВН важно с точки зрения разработки патогенетически обоснованных программ профилактики и лечения этого патологического состояния [2].
Основополагающим моментом в лечении осложненных форм ХВН является комплексный подход, этапность и правильный выбор лекарственного средства соответственно стадии раневого процесса. Этапность лечения предусматривает санацию и/или закрытие язвы, после чего возможно хирургическое вмешательство [4,11].
В предоперационной подготовке и послеоперационной реабилитации, а также в качестве самостоятельного вида лечения придается большое значение методам консервативной терапии, оказывающим положительное воздействие на нормализацию микроциркуляторных процессов в тканях [7].
Расширяется спектр лекарственных препаратов для системной фармакотерапии, оказывающих флеботонизирующее и ангиопротективное действие, нормализующих проницаемость каппиляров, укрепляющих сосудистую стенку, уменьшающих агрегацию тромбоцитов [8].
Для местного лечения флебостатических трофических язв нижних конечностей пациентам назначаются биологически активные перевязочные средства: сорбционно–аппликационная терапия с биологически активными сорбентами, гелевыми повязками с антимикробным, обезболивающим и протеолитическим действием, используются биологически активные стимулирующие покрытия со специфическим воздействием на процессы регенерации, эпитализации [5].
В настоящем исследовании пациентам назначали препарат Актовегин в виде геля, мази и крема на различных стадиях заживления раневого процесса.
Актовегин является гемодериватом крови телят, полученным посредством диализа и ультрафильтрации. Препарат вызывает увеличение утилизации и потребления кислорода, повышает энергетический метаболизм и потребление глюкозы. Суммарный эффект всех этих процессов заключается в усилении энергетического состояния клетки, особенно в условиях исходной ее недостаточности. Таким образом, препарат Актовегин, обладая вышеуказанным механизмом действия, способствует ускорению заживления ран, что делает оправданным его применение у пациентов с осложненными формами ХВННК.
Благодаря уникальному механизму действия, Актовегин обеспечивает клиническую эффективность в условиях временно индуцированного стресса и гипоксии тканей у пациентов с ХВН. Являясь мощным антигипоксантом, способствующим активации метаболизма глюкозы и кислорода, Актовегин в виде раствора для внутривенных инфузий используется в качестве препарата для системной фармакотерапии пациентов с осложненными формами ХВННК в настоящем исследовании.
Материалы и методы исследования
Всего обследовали и наблюдали в динамике на фоне лечения 55 пациентов с осложненными формами ХВННК. Все пациенты были рандомизированы на 3 основные группы (табл. 1). В лечении 22 больных (I группа) применялись:
- гидрофильные мази с антимикробным и/или противовоспалительным действием: метилурацил, левомеколь и диоксиколь;
- препарат венотонизирующего и ангиопротективного действия диосмин в дозе 1000 мг/сут.;
- внутривенные инфузии: реополиглюкин 200 мл 10% раствора + 100 мг (5 мл) пентоксифиллина 1 раз в сутки в течение 10 дней.
22 пациентам (II группа) для местного лечения применяли препарат Актовегин по схеме:
- в стадии экссудации использовали Актовегин гель 20% толстым слоем с последующим наложением компресса с Актовегином – 5%–й мазью;
- в стадии пролиферации использовали повязку с Актовегином – 5%–м кремом;
- в стадии грануляции применяли повязку с Актовегином – 5%–м гелем.
Замену повязки осуществляли 1 раз в сутки.
Таблица 1. Характеристика методов лечения
| Группа I (n=22) | Группа II (n=22) | Группа III (n=11) | ||
| Местное лечение (наложение повязок на трофическую язву) |
Метилурацил левомеколь диоксиколь |
Актовегин 20% гель 5% крем 5% мазь |
Актовегин 20% гель 5% крем 5% мазь |
|
| Системная фармакотерапия |
Таблетированные препараты |
Диосмин | Диосмин | Диосмин |
| Внутривенные инфузии |
Реополиглюкин Пентоксифиллин |
Реополиглюкин Пентоксифиллин |
Реополиглюкин Пентоксифиллин Актовегин |
|
В лечении 11 пациентов (III группа) наряду с местным применением Актовегина использовали сочетание терапии реополиглюкином, пентоксифиллином и 20%–м раствором Актовегина по 250 мл ежедневно в течение 10 дней.
В исследование включили больных с осложненными формами ХВН как на фоне варикозной болезни, так и с посттромбофлебитическим синдромом. Верификация диагноза осуществлялась согласно клинической международной классификации (система СЕАР): все пациенты имели 4, 5 или 6 стадии ХВННК.
Локализация трофических язв практически у всех пациентов была типичной – нижняя треть голени. Анамнез заболевания ХВННК составил от 6 до 25 лет (средний – 15 лет). Срок появления трофических изменений на коже голени до момента госпитализации колебался от 1 до 36 месяцев. Размер язв – от 2 до 7 см в диаметре.
38 (70%) пациентов имели сопутствующую патологию, по поводу которой получали подобранную симптоматическую и патогенетическую терапию.
Состояние пациентов во всех группах, давность основного заболевания, а также тяжесть трофических дефектов были сходными.
Методы оценки эффективности лечения
Для оценки эффективности проводимой терапии анализировали динамику клинических, инструментальных и лабораторных показателей, отражающих активность заболевания и состояние микроциркуляторного русла через 1 месяц от начала наблюдения.
Клинические, лабораторные и инструментальные показатели исследовались в динамике с целью сравнения течения заболевания и оценки влияния применяемых схем терапии на состояние микроциркуляторного русла (табл. 2).
Таблица 2. Лабораторно–инструментальные методы обследования пациентов
| Лабораторные методы | Инструментальные методы | |
| Оценка состояния микроциркуляторного русла |
1. Определение вязкости крови, плазмы и суспензии эритроцитов 2. Определение индекса ригидности эритроцитов (метод L. Dintenfass) 3. Определение агрегации эритроцитов 4. Определение уровня фибриногена и белковых фракций |
Лазерная допплерфлоуметрия |
| Другие методы определения эффективности терапии |
1. Бактериологическое исследование отпечатков с трофической язвы 2. Цитологическое исследование раневого экссудата 3. Фотохемолюминисценция смывов с трофических язв для определения фагоцитарной активности макрофагов |
Ультразвуковое дуплексное сканирование |
Клинические параметры оценки эффективности лечения:
- наличие отека, болевого синдрома, ограничение физической активности;
- сроки заживления язвенного дефекта: формирование грануляционной ткани и/или эпителизация трофических дефектов.
Для оценки эффективности воздействия проводимого лечения на состояние микроциркуляторного русла пациентам было выполнено исследование вязкости крови. Исследование проводилось на базе независимого лабораторного комплекса «INVITRO» (Москва).
Метод лазерной допплерофлоуметрии представлял собой исследование с помощью аппарата BLF–21 фирмы Transonic Systems Inc.
Всем больным было выполнено ультразвуковое дуплексное сканирование (УЗДС) вен нижних конечностей. При дуплексном сканировании оценивали проходимость глубоких вен, наличие или отсутствие недостаточности клапанного аппарата глубоких и коммуникантных вен нижних конечностей.
Всем пациентам было выполнено бактериологическое и цитологическое исследование содержимого язв с определением уровня микробной обсемененности и чувствительности флоры к антибиотикам.
Фагоцитарная активность макрофагов оценивалась методом фотохемолюминисценции в камере «Macintosh». Культуру макрофагов получали методом центрифугирования смывов с трофических язв.
Результаты исследования
Известно, что клиническая картина ХВННК может быть весьма вариабельна. В исследовании оценивали динамику наиболее типичных клинических синдромов:
- наличие и/или уменьшение отека дистальных отделов нижних конечностей;
- синдром «тяжелых ног» (боли, тяжесть, утомляемость конечности).
Результаты, полученные при анализе жалоб пациентов и данных осмотра через 1 месяц от момента первого наблюдения, представлены в таблицах 3 и 4.
Таблица 3. Динамика уменьшения отечного синдрома через 1 месяц от момента первого наблюдения
| Группы пациентов | Первое наблюдение | Через 1 месяц | |
| Пациенты с клинически выраженным отечным синдромом (%) |
Группа I (n=22) | 79% | 50%* |
| Группа II (n=22) | 78,3% | 49%8* | |
| Группа III (n=11) | 76,7%* | 37,2%* |
Таблица 4. Динамика уменьшения синдрома «тяжелых ног» через 1 месяц от момента первого наблюдения
| Группы пациентов | Первое наблюдение | Через 1 месяц | |
| Пациенты с клинически выраженным синдромом «тяжелых ног» (%) |
Группа I (n=22) | 94% | 45%* |
| Группа II (n=22) | 97,1% | 47%* | |
| Группа III (n=11) | 96,3%* | 24%* |
При анализе результатов исследований большое внимание было уделено наиболее типичным клиническим синдромам. Выявлено, что в I и II группах количество пациентов с отечным синдромом через 1 месяц от начала наблюдения уменьшилось, причем это уменьшение было статистически значимым. Однако при введении в комплекс лечебных мероприятий внутривенных инфузий Актовегина (группа III), наблюдали более выраженное уменьшение количества пациентов с отечным синдромом через 1 месяц (более чем в 2 раза), что достоверно отличалось от показателей в группах I и II.
Похожие данные получены в отношении динамики течения синдрома «тяжелых ног»: в I и II группах наблюдали достоверное уменьшение и купирование синдрома через 1 месяц от начала лечения (45 и 47% соответственно). В III группе лишь 24% пациента отмечали проявления синдрома «тяжелых ног», то есть количество пациентов с таким синдромом уменьшилось почти в 4 раза.
Особое внимание уделялось динамике заживления язвенного дефекта в обследуемых группах как одному из важнейших показателей эффективности терапии (рис. 1). Результаты исследования показали, что при использовании Актовегина наружно в виде геля, крема и мази средние сроки очищения ран от гнойных и некротических масс, появление грануляций были значительно меньше (в среднем на 3 суток) (табл. 5).
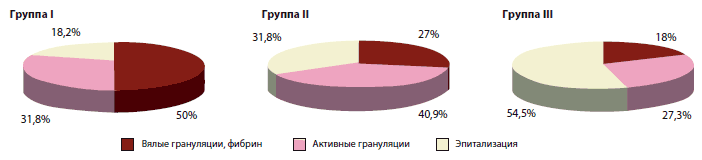
Рис. 1. Динамика заживления язвенного дефекта – распределение в группах пациентов
Таблица 5. Сроки очищения ран от гнойно–некротических масс
| № | Препараты для наружного применения | Количество больных | Средние сроки (сутки) М±m | ||
| Очищение | Грануляции | Краевая эпителизация | |||
| 1 | Левомеколь, диоксиколь | 22 | 6,3±0,8 | 6,9±0,8 | 7,3±0,9 |
| 2 | Актовегин | 33 | 3,5±0,9* | 4,6±1,2* | 4,6±0,9* |
Через 1 месяц от начала терапии у 17 пациентов наблюдали эпителизацию язвенного дефекта (табл. 6). При этом 13 пациентов были из групп, где в лечении применяли Актовегин в виде геля, крема и мази (группы II III). У 19 больных наблюдались вялые грануляции с отложениями фибрина, причем 11 были из группы I.
Таблица 6. Динамика заживления язвенного дефекта через 1 месяц
| Стадии заживления | Группа I (n=22) | Группа II (n=22) | Группа III (n=11) | Всего |
| Вялые грануляции, фибрин | 11 (50%)* | 6 (27,3%) | 2 (18,2%)* | 19 |
| Активные грануляции | 7 (31,8%) | 9 (40,9%) | 3 (27,3%) | 19 |
| Эпителизация | 4 (18,4%)* | 7 (31,8%)* | 6 (54,5%)* | 17 |
При анализе результатов исследования выявили, что при сочетании наружного применения препаратов Актовегина и внутривенных инфузий Актовегина через 1 месяц от начала лечения эпителизация язвенного дефекта наблюдается более чем у половины пациентов (54,5%), что статистически достоверно.
При анализе результатов бактериологического исследования было выявлено, что до начала лечения все больные имели высокий уровень загрязнения ран (Ig KOE ~ 7,04), микробная флора отличалась разнообразием представителей: S. Aureus, S. Epidermidis, E. Coli, Enterobacter sp., P. Aerugiinosa. и др. При контрольных бактериологических посевах из ран на 5–7–е сутки в группах II, III (33 человека) было отмечено статистически достоверное снижение уровня микробной обсемененности (p≤0,05) (табл. 7).
Таблица 7. Динамика микробной обсемененности в группах
| Первичное обследование |
4 сутки | Через 1 месяц | |
| КОЕ | 1×107* | 9×105 | 2×105* |
| Lg КОЕ | 7,04* | 5,09 | 5,03* |
Цитологическое изучение отделяемого из ран до начала лечения выявило преобладание дистрофически–воспалительных типов цитограмм: большое количество свободно лежащей и внутриклеточной микрофлоры (кокковой и палочковой), преобладание нейтрофилов с признаками дистрофии и распада, незавершенный и патологический фагоцитоз микробов. На 3–4–е сутки после начала лечения препаратами Актовегина усиливался фагоцитоз, уменьшалось содержание микрофлоры, распадающихся нейтрофилов. Через 7–14 суток значительно уменьшалась или исчезала микрофлора, появлялись и нарастали активные фагоцитирующие макрофаги и фибропластические клетки (цитограмма воспалительно–репаративного типа). К 21–м суткам признаки репарации (макрофаги, фибробласты и эпителий) в цитограммах еще более усиливались (цитограмма репаративного типа). В группе I динамика этих показателей была замедлена: уменьшение микрофлоры, появление макрофагов и отдельных фибробластов наблюдалась только к 14–21–м суткам.
Таким образом, цитологическое исследование свидетельствует о том, что использование Актовегина ведет к более раннему очищению трофических язв от инфекции и некротического детрита, усилению фагоцитоза, ускорению макрофагальной и фибропластической реакции, т.е. интенсификации раневого процесса.
Наше исследование подтвердило, что у большинства пациентов с ХВН, наряду с нарушениями в системе коагуляционного гемостаза, имеется так называемый «синдром неспецифических гемореологических расстройств», выражающийся в повышении вязкости плазмы и суспензии эритроцитов. До проводимого исследования лабораторно зарегистрированы увеличенный индекс ригидности эритроцитов и повышение их агрегации.
Через 1 месяц от начала лечения в группе I и II существенного изменения показателей реологического состояния крови не произошло, в то время как в группе III, пациентам которой назначали ежедневные внутривенные инфузии Актовегина, наблюдали достоверное уменьшение всех параметров вязкости крови (вязкость крови на низких скоростях сдвига –ВК–, вязкость крови на высоких скоростях сдвига –ВК–, вязкость суспензии эритроцитов, индекс ригидности эритроцитов –Tk), из чего можно заключить, что Актовегин в виде раствора для внутривенного введения является эффективным компонентом комплексной терапии больных с осложненными формами ХВННК.
При анализе данных лазерной допплерофлоуметрии, используемой для оценки микроциркуляции, выявлено достоверное снижение показателя микроциркуляции (ПМ) к 7–м суткам на фоне дополнительного назначения Актовегина внутривенно (группа III), что свидетельствовало о спаде пика воспалительной реакции микрососудов и улучшении венозного оттока.
К 21–м суткам значение ПМ у пациентов группы III приближалось к значениям показателей симметричных участков голени здоровой конечности (3,8–3,9 пер. ед), что демонстрировало восстановление автономных регуляторных механизмов в системе микроциркуляции кожи. Клинически в это время наблюдали процесс эпителизации язвы.
Таким образом, в настоящем исследовании положительное воздействие препарата Актовегин на микроциркуляторные процессы в тканях было подтверждено путем оценки эффективности терапии пациентов с осложненными формами ХВНК.
Выводы
- Назначение Актовегина в виде внутривенных инфузий как компонента системной фармакотерапии эффективно в отношении коррекции микроциркуляторных расстройств.
- Применение Актовегина внутривенно в сочетании с другими препаратами системной фармакотерапии способствует купированию отечно–болевого синдрома у половины пациентов через 1 месяц от начала лечения.
- Применение Актовегина внутривенно в сочетании с другими препаратами системной фармакотерапии способствовало уменьшению количества пациентов с синдромом «тяжелых ног» в 4 раза через 1 месяц от начала лечения.
- Использование препаратов Актовегина для наружного применения позволяет достигнуть более быстрого заживления язвенного дефекта: через 1 месяц от начала лечения у 40–50% пациентов наблюдали стадию эпителизации язвенного дефекта.
- Дополнительное назначение инфузий Актовегина как компонента системной фармакотерапии способствует улучшению гемореологии: снижению показателей вязкости крови и улучшению микроциркуляторных параметров.
- Согласно результатам исследования, препарат Актовегин рекомендуется для лечения пациентов с осложненными формами ХВННК по следующей схеме:
- 20%–й раствор Актовегина по 250 мл ежедневно в течение 10 дней;
- местное лечение трофических язв:
- в стадии экссудации Актовегин гель 20% толстым слоем с последующим наложением компресса с Актовегином – 5%–й мазью (5–7 дней с ежедневной сменой повязки);
- в стадии пролиферации повязка с Актовегином – 5%–м кремом (5–7 дней с ежедневной сменой повязки);
- в стадии грануляции повязка с Актовегином –5%–й мазью (7–10 дней с ежедневной сменой повязки).
Литература
- Абакумов О.Ю., Цветкова Т.А., Щехтер А.Б. Воздействие экзогенного оксида азота на клеточные культуры фибробластов и клеток невриномы. Мат. Научно – практической конференции NO– терапия, Москва, 2001, с.40–43
- Айтаков Э.Н. Аутодермопластика, как один из методов амбулаторного лечения трофических язв нижних конечностей. Мат. 13–ой Международной конференции Российского общества ангиологов и сосудистых хирургов. Ростов–на–Дону, 2002, С. 3
- Анисимов В.Н. Шульц А.А. Комплекс лечебных мероприятий у больных хронической венозной недостаточностью нижних конечностей III степени. Мат. 13–ой Международной конференции Российского общества ангиологов и сосудистых хирургов. Ростов–на–Дону, 2002, С. 8
- Костеноко И. Г. Гемодинамическая характеристика заболеваний сосудов системы нижей полой вены. Автореф. Дис....д–ра мед. наук. – М.,1979.
- Марков Х.М. Вест. РАМН, 1996, №7, С. 73–77
- Савельев В.С. Флебология. Руководство для врачей. М., 2001
- Сатюкова Г.С., Кургузов О.П. Изменения микроциркуляции и возможности их коррекции у людей при варикозной болезни и посттромботическим синдромом. Морфология. М., 2000, №5, С. 29–35
- Яблоков Е.Г., Кириенко А.И., Богачев В.Ю. Хроническая венозная недостаточность. М., 1999, 126 с.
- European Venous Forum. Scientific Program and book of Abstracts. Edizioni Minerva Medica.Turin. 2002
- Handbook of venous disordes. 2th Edition. Guidelines of the American Venous Forum. 2001; C. 557
