Коррекция иммунных нарушений при атопическом дерматите у детей
СтатьиОпубликовано в журнале:
«Педиатрия / приложение consilium medicum», 2011, № 1, с. 16-20
Л.В. Лусс
ФГБУ ГНЦ Институт иммунологии ФМБА России, МГМСУ
Аллергические заболевания (A3) у детей занимают первое место среди всей неинфекционной патологии. В структуре аллергопатологии детского возраста преобладают аллергодерматозы - аллергические заболевания кожи, запускаемые иммунологическими или псевдоаллергическими механизмами. По данным ISAAC, распространенность аллергодерматозов в детской популяции колеблется в широких пределах и составляет: в Австралии от 9,7 до 19,9%, в Латвии от 5,4 до 6,5%, в Польше от 13,2 до 15,5%, в Финляндии от 15 до 19%, в Швеции от 46,9 до 48,8%, в России от 5,9 до40% [1].
Ввиду широкой распространенности, тяжести течения, резкого снижения качества жизни пациентов, огромных финансовых затрат на лечение и реабилитацию больных, атопический дерматит (АтД) составляет не только важную медицинскую, но и медико-социальную проблему. Например, в США лечение АтД у детей обходится в сумму, превышающую 364 млн дол. США [2], а общие расходы на лечение АтД у детей и взрослых в Великобритании составляют примерно 465 млн фунтов стерлингов [3].
В рекомендациях Всемирной организации здравоохранения (ВОЗ), и российских согласительных документах дается определение термина «атопический дерматит» как самостоятельной нозологической формы, имеющей характерные клинико-морфологические отличия от контактного аллергического дерматита, себорейной и микробной экземы, пруриго Бенье, почесух и др. В связи с этим употребление различных синонимов для определения АтД в настоящее время считается недопустимо [4].
У детей первыми проявлениями аллергии наиболее часто являются пищевая аллергия (ПА) и АтД. Развитие A3 в течение жизни у предрасположенных к атопии лиц получило название аллергического, или атопического марша. Первые симптомы АтД, как правило, возникают в младенчестве и часто совпадают по времени с введением прикорма. У детей раннего возраста основными причинами развития аллергии являются пищевые аллергены. В дальнейшем формируются A3 респираторного тракта - бронхиальная астма (БА) и аллергический ринит (АР), развивается аллергия к бытовым и пыльцевым аллергенам. Частота АтД и гастроинтестинальных проявлений аллергии с возрастом уменьшается. У детей школьного возраста и подростков уже преобладают A3 органов дыхания - АР и БА (рисунок).
Развитие A3 в течение жизни у детей (Saarinen UM et al. Lancet 1995).
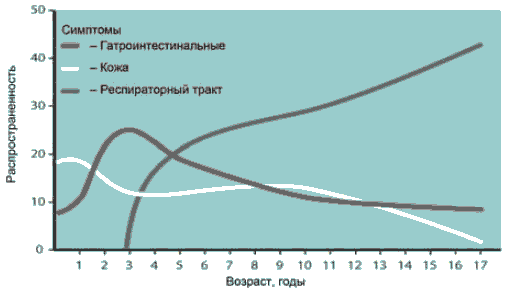
По данным официальной статистики, у 15% детей АтД развивается в возрасте до 7 лет, а у 10-20% из них впоследствии развивается БА. Приблизительно у 50% детей АтД формируется в возрасте до года, еще у 30% -от 1 года до 5 лет.
АтД - хроническое аллергическое заболевание, развивающееся у лиц с наследственной предрасположенностью к атопии, имеющее рецидивирующее течение, с возрастными особенностями воспалительного поражения кожи (в виде зудящих экссудативных эритематосквамозных лихеноидных пруригинозных высыпаний), характеризующееся повышением уровня IgE-AT и гиперчувствительностью как к аллергенам, так и неспецифическим раздражителям [4].
Для АтД характерно раннее начало и быстрое развитие хронических форм, снижение социальной адаптации и качества жизни детей. Обязательным симптомом АтД является кожный зуд трех и более указанных ниже признаков:
- типичная локализация поражения кожи: локтевые сгибы, подколенные ямки, передняя поверхность лодыжек, шея, лицо;
- отягощенный аллергологический семейный анамнез: наличие атопических заболеваний (БА, АтД, поллиноз и др.) у родителей и/или ближайших родственников;
- склонность к сухой коже, особенно в течение последнего года;
- видимые признаки дерматита в области сгибов (или на щеках, лбу, наружных поверхностях конечностей у детей моложе 4 лет);
- манифестация заболевания в раннем детстве (до 2 лет).
В основу классификации АтД легли такие показатели, как возрастные периоды болезни, распространенность кожного процесса, степень тяжести заболевания.
Возрастные периоды болезни: I - младенческий (до 2 лет); II - детский (от 2 до 13 лет); III - подростковый и взрослый (от 14 лет и более).
По распространенности процесса выделяют ограниченный, распространенный и диффузный АтД. Ограниченным АтД считают тогда, когда в патологический процесс вовлечены локтевые и/или подколенные складки, или кисти, или кожа шеи и/или лица и общая площадь поражения кожи не превышает 10%. При распространенном АтД присоединяется частичное поражение кожи груди, спины. Площадь поражения кожи при распространенном АтД составляет от 10 до 50%. При диффузном АтД в патологический процесс вовлекается 50% и более кожного покрова.
По степени тяжести выделяют легкую, средней степени тяжести и тяжелую формы АтД. К легкой степени тяжести АтД относят те формы заболевания, при которых обострения бывают редкими (1-2 раза в год) продолжительностью до 1 мес. Ремиссии 6-8 месяцев и более. Отмечается хороший эффект от проводимой стандартной терапии.
Средняя степень тяжести: обострения отмечаются не менее 3-4 раз в год, возрастает их длительность, процесс приобретает упорное течение с недостаточно хорошим эффектом при проведении стандартной терапии. Длительность ремиссии не превышает 2-3 мес.
Тяжелая форма АтД характеризуется частыми обострениями (не менее 5 раз в год) с короткими ремиссия-ми (до 1,5 мес) или их отсутствием. Стандартная терапия приносит кратковременный незначительный эффект. Характерно диффузное поражение кожи.
В настоящее время для оценки степени тяжести АтД используется шкала SCORAD (scoring atopic dermatitis), которая была предложена в 1994 г. Европейской рабочей группой по АтД. Она объединяет объективные (интенсивность и распространенность кожного поражения) и субъективные (интенсивность дневного кожного зуда и нарушение сна) критерии. Основным преимуществом использования шкалы SCORAD является возможность сравнительного анализа полученных результатов с помощью компьютерной обработки, а также возможность объективной оценки эффективности различных методов терапии [4].
SCORAD предусматривает балльную оценку 6 объективных симптомов: эритема, отек/папулезные элементы, корки/мокнутие, экскориации, лихенификация/шелушение, сухость кожи. Интенсивность каждого признака оценивается по 4 уровневой шкале: 0 - отсутствие, 1 - слабая, 2 - умеренная, 3 - сильная. Расчет индекса SCORAD производится по формуле: SCORAD=A/5+7B/2+C, где:
А - распространенность поражения кожи,
В - сумма уровней интенсивности клинических симптомов АтД,
С - сумма оценок субъективных нарушений по визуальной аналоговой шкале.
Значения индекса могут варьировать в пределах от 0 (нет симптомов заболевания) до 103 (максимально тяжелое течение АтД).
На формирование и течение АтД существенное влияние оказывают преморбидные факторы, в частности генетически детерминированная наследственная предрасположенность к развитию аллергии. Специальными работами установлено, что генетический контроль за синтезом общего иммуноглобулина Е (IgE) является первостепенным фактором в развитии АтД [5].
Патогенез АтД
К основным причинам, способствующим развитию и манифестации АтД, относят различные группы аллергенов и воздействие неспецифических провоцирующих факторов.
Среди причинно-значимых аллергенов при АтД у детей особую роль имеют пищевые аллергены животного и растительного происхождения и различные аэроаллергены.
Среди пищевых аллергенов животного происхождения при АтД особое значение имеют: молоко и молочные продукты (йогурты, сыры), яйца (омлеты), рыба и морепродукты (сельдь, треска, сайда, пикша, раки, крабы, креветки и др.), мясо, птица и продукты из них (паштеты, колбасы). Среди пищевых аллергенов растительного происхождения важное значение имеют: пищевые злаки и зернопродукты, бобовые, орехи и семена, овощи и фрукты (морковь, томаты, баклажаны, лук, чеснок, дыня, манго, персик, клубника, цитрусовые), грибы (вешенка, белые), травы и пряности (базилик, перец черный, анис, кориандр, тмин, укроп, петрушка), мед, дрожжи, чай с добавками и др.
Среди аэроаллергенов, особенно у детей старшего возраста и подростков, наибольшую этиологическую значимость имеют бытовые, эпидермальные, пыльцевые аллергены.
На реализацию этиологического фактора и степень тяжести формирующегося АтД влияют внешние и внутренние условия, которые могут как усиливать тяжесть болезни (факторы риска), так и снижать интенсивность клинических проявлений заболевания (благоприятные условия). Нарушения питания, переутомления, наличие острых и хронических стрессовых ситуаций дома и в детском учреждении (детский сад, школа и т.д.), наличие сопутствующих заболеваний (аллергических, заболеваний ЖКТ, гепатобилиарной системы и др.), плохой уход за ребенком провоцируют обострения и более тяжелое течение АтД. Спектр внешних провоцирующих факторов развития АтД весьма разнообразен: патологии беременности, угрозы выкидыша и нефропатии беременных, заболевания матери во время беременности (особенно различными вирусными инфекциями), нарушения диеты во время беременности, курение и другие злоупотребления [6]. При пассивном курении реализация АтД возрастает в 1,5 раза, так как табачный дым относится к группе поллютантов, способных индуцировать повышенный синтез IgE-антител. К факторам риска развития АтД также относятся: нарушения питания, в частности нерациональное и/или несбалансированное питание матери во время беременности и в период лактации, длительное соблюдение «гипоаллергенной» диеты и другие нарушения. Определенное значение имеют и диетические семейные традиции, в частности: злоупотребление глютенсодержащими (например, мучные продукты и пищевые злаки), консервированными, белковыми продуктами и недостаточное потребление овощей и фруктов.
Важная роль в развитии АтД у детей отводится инфекционным аллергенам, особенно сенсибилизация к золотистому стафилококку [7].
Среди неспецифических факторов провоцирующую роль в обострении АтД играют медикаменты (антибиотики, сульфаниламидные препараты, НПВС, местные анестетики, витамины и др.), химические, физические, биологические факторы и др.
В иммунопатогенезе АтД основную роль играют IgE-опосредованные аллергические реакции, т.е. иммунологические реакции 1-го типа. Они составляют суть иммунных механизмов развития АтД, хотя нельзя исключить участие и других патогенетических механизмов развития аллергии [8]. В основе иммунологических нарушений при АтД лежат дисбаланс Тh1- и Тh2-лимфоцитов, повышенная дегрануляция тучных клеток и повышенная антигенпрезентирующая активность клеток Лангерганса. Эти иммунологические нарушения приводят к повышенной продукции IgE-антител и изменению иммунологической реактивности кожи.
Активация синтеза IgE является ведущим патогенетическим звеном в механизмах развития клинических проявлений АтД. IgE - антитела, обладающие способностью сенсибилизировать ткани организма и опосредовать развитие аллергических реакций немедленного типа, играют полифункциональную роль в развитии аллергического воспаления при АтД. Наиболее существенными из них являются дегрануляция тучных клеток и базофилов, активация макрофагов и моноцитов и стимуляция Тh2-лимфоцитов. В свою очередь Тh2-клетки инициируют IgE-ответ и эозинофилию периферической крови.
Исследования в области иммунопатогенеза АтД показали, что в процесс аллергического воспаления вовлекается целый ряд клеток (тучные клетки, макрофаги, инфильтрирующие эозинофилы, лимфоциты) и цитокинов: ИЛ-4, ИЛ-5, ИЛ-10, ИЛ13, ГМ-КСФ и др. [9]. Схематически механизм развития аллергического воспаления в коже при АтД можно представить следующим образом. При непосредственном воздействии этиологически значимого аллергена на кожу больного АтД происходит активация антиген-представляющих клеток - клеток Лангерганса (КЛ), инфильтрирующих эпидермис, которые несут на своей поверхности IgE-антитела. Последние связываются с КЛ посредством высокоаффинного и низкоаффинного (CD23) рецепторов. Активированные КЛ мигрируют в лимфатические узлы, где, в свою очередь, активируют Тh2-лимфоциты, секретирующие провоспалительные цитокины, играющие основную роль в поддержании аллергического воспаления в коже, в частности, ИЛ-4, ИЛ-5, ИЛ-13. Причем ИЛ-4 и ИЛ-13 выступают в роли фактора, необходимого для переключения синтеза иммуноглобулинов на IgE-ответ, вызывают экспрессию молекул клеточной адгезии (VCAM-1), определяющих миграцию эозинофилов и мононуклеаров непосредственно в очаг воспаления. Известно также, что ИЛ-4 ингибирует продукцию ИФН-γ и подавляет дифференцировку лимфоцитов в сторону Th1 -лимфоцитов.
Кроме того, механическое воздействие на кожу (расчесывание) приводит к повреждению кератиноцитов, инфильтрирующих эпидермис, тучные клетки и IgE-несущие макрофаги, вследствие чего происходит высвобождение ИЛ-1, ФИО, ФАТ, лейкотриенов и других медиаторов, поддерживающих кожный зуд и воспаление.
Не менее важным фактором, инициирующим и поддерживающим аллергическое воспаление в коже, является воздействие инфекционных антигенов, среди которых особое значение имеют экзотоксины золотистого стафилококка, играющие роль суперантигенов.
В последние годы доказано, что в механизме развития и прогнозе АД важную роль играет апоптоз, или запрограммированная гибель эффекторных клеток, который непосредственно участвует в процессах контроля за воспалением в тканях. Повышенная выживаемость клеток воспаления в тканях может быть одним из факторов, способствующих возникновению и поддержанию хронического аллергического воспаления при АтД.
Подходы к терапии
Тактика терапии АтД у детей зависит от многих факторов: этиологии, фазы заболевания (обострение, ремиссия), степени тяжести, распространенности процесса, возраста ребенка, наличия сопутствующей патологии и др. Основными принципами терапии АтД, которые отвечают медицинским стандартам, являются: патогенетический подход, комплексная терапия и этапность в проведении лечения [4]. Лечение АтД включает использование следующих мероприятий:
- элиминация аллергенов (элиминационные охранительные режимы, диетотерапия).
- базисная терапия (антигистаминные препараты -АГП), наружная терапия).
- купирование обострения заболевания.
- коррекция сопутствующих заболеваний (ферменты, пробиотики, антибактериальные препараты, антигельминтная терапия и др.).
- коррекция иммунологических нарушений.
- аллерген-специфическая иммунотерапия (АСИТ).
В лечении АтД особенно важное значение уделяется элиминации причинно-значимых аллергенов и соблюдению охранительных режимов. Элиминацию причинно-значимых аллергенов можно рассматривать как 1-й этап в контроле за иммунными нарушениями и влияющий на изменение цитокинового профиля с Th2 на Th1 у больных АтД. Наряду с элиминационными диетами первостепенное значение имеют и элиминационные охранительные режимы, заключающиеся в проведении санитарно-гигиенических мероприятий в доме. Например, при сенсибилизации к домашней пыли и клещам Dermatophagoides pteronissinus, farinae необходимо производить ежедневную влажную уборку помещений, убрать ковры, заменить перьевые подушки и одеяла на синтепоновые, обрабатывать постельные принадлежности акарицидными средствами и т.д. Диетотерапия больных АтД основывается на исключении из питания продуктов-аллергенов, а также продуктов с высоким содержанием гистамина и гистаминолибераторов.
Фармакотерапия при АтД
При АтД в стадии обострения, сопровождающемся поражением большой поверхности кожи, протекающим с явлениями экзематизации, с лихорадкой, лимфоаденопатией, симптомами общей интоксикации, особенно при присоединении вторичной инфекции, больные подлежат госпитализации. В этих случаях проводится дезинтоксикационная терапия, направленная на купирование острого состояния. После купирования обострения кожного процесса подбирается индивидуальная базисная терапия, включающая назначение АГП; препаратов с мембраностабилизирующими свойствами; топических стероидов, способных подавлять активность аллергического процесса непосредственно в коже и др.
Очень важным этапом лечения больных АтД является коррекция сопутствующей патологии и очагов хронической инфекции, которая проводится в соответствии со стандартами проведения различных видов терапии.
С целью местной терапии применяются топические стероиды, которые являются препаратами базисной терапии, местные АГП, различные местные средства, обладающие смягчающим, увлажняющим, кератолитическим, антибактериальным, противогрибковым и др. свойствами.
Иммунотропная терапия
Дисфункция иммунной системы, лежащая в основе механизма развития АтД, обосновывает назначение методов терапии, направленных на коррекцию иммунологических нарушений. К ним относятся: АСИТ, заместительная терапия, иммуномодулирующая терапия, плазмаферез и др.
Плазмаферез при АтД назначается только по строгим показаниям с целью выведения различных патологических продуктов, образующихся в организме в результате сложных иммунопатологических процессов, лежащих в основе аллергического воспаления тканей: антигенов, антител, иммунных комплексов, медиаторов аллергического воспаления, белков острой фазы и т.д.
АСИТ является патогенетически обоснованным эффективным методом лечения атопических заболеваний, воздействующим на все патогенетически значимые звенья аллергического процесса и обеспечивающим длительный профилактический эффект после завершения лечебных курсов. В настоящее время накоплен большой опыт успешного применения АСИТ при АтД [4,9].
Как правило, лечение дисфункций иммунной системы осуществляется с помощью комплекса методов иммунотерапии, одним из которых является применение иммуномодуляторов [10-12].
Иммуномодулирующая терапия при АтД показана только в тех случаях, когда у больных присутствуют клинические признаки вторичной иммунологической недостаточности (ВИН), такие как часто рецидивирующая пиодермия и наличие очагов хронической инфекции с частыми обострениями, торпидные к традиционной стандартной терапии.
Однако зачастую сведения об эффективности иммуномодуляторов основаны на субъективных впечатлениях врачей-исследователей, так как лишь единичные препараты испытывались по всем правилам доказательной медицины. Строго контролируемые испытания иммуномодуляторов при АтД проводились лишь по отношению к отдельным препаратам. Например, имеется несколько слепых, плацебо-контролируемых исследований, в ходе которых испытывалось действие Полиоксидония.
Иммуномодуляторы при АтД
Целью назначения иммуномодуляторов и проведения иммуномодулирующей терапии при АтД являются: повышение эффективности стандартной терапии, увеличение длительности ремиссии и снижение частоты обострений (и госпитализаций) хронических рецидивирующих инфекционно-воспалительных заболеваний. Восстановление дисфункций иммунитета должно проводиться с учетом: основных свойств и механизмов действия иммуномодуляторов, особенностей этиологии и патогенеза АтД, стадии и степени тяжести АтД, возраста больного, наличия сопутствующих заболеваний.
При выборе иммуномодулятора необходимо учитывать, чтобы последний активировал именно те звенья иммунитета, которые нарушаются при АтД.
В настоящее время можно выделить несколько основных групп лекарственных препаратов, обладающих иммуномодулирующими свойствами [12], и к наиболее перспективным и эффективным иммунотропным средствам относятся иммуномодуляторы из группы химически чистых, среди которых выделяются 2 подгруппы: низкомолекулярные и высокомолекулярные. К низкомолекулярным соединениям относятся галавит, гепон, глутоксим, аллоферон и др.
К высокомолекулярным химически чистым иммуномодуляторам, полученным с помощью направленного химического синтеза, относится препарат Полиоксидоний[13].
Полиоксидоний является N-оксидированным производным полиэтиленпиперазина с молекулярной массой около 100 kD. По своему химическому строению Полиоксидоний близок к веществам природного происхождения, так как N-оксидные группировки, являющиеся основой Полиоксидония, широко встречаются в организме человека. Полиоксидоний является идеальным иммуномодулятором и характеризуется не только высокой клинической эффективностью, но и самым высоким профилем безопасности.
Доклинические экспериментальные исследования физико-химических свойств, фармакологической и иммуномодулирующей активности и безопасности Полиоксидония были проведены в соответствии с нормативными правовыми актами Российской Федерации и методическими указаниями, регламентирующими все этапы доклинических и клинических исследований.
Полиоксидоний не только относится к классическим иммуномодуляторам, но и является основой для создания новых групп высокоэффективных препаратов, используемых для лечения и профилактики различных заболеваний, например, иммуноадювант в вакцинах нового поколения (гриппол, аллерготропины и др.) или носитель физиологически активных веществ (лонгидаза).
В клинических открытых и плацебо-контролируемых исследованиях доказаны выраженная иммуномодулирующая активность Полиоксидония и повышение резистентности организма к различным инфекциям, обусловленная его прямым воздействием на фагоцитирующие клетки, естественные киллеры и стимуляцию антителообразования [14-16]. Лекарственные формы Полиоксидония, рекомендованные при АтД: лиофилизат для приготовления раствора для инъекций и местного применения 3 и 6 мг, суппозитории для вагинального и ректального введения 6 и 12 мг, таблетки 12 мг.
Включение Полиоксидония в комплексную терапию АтД у детей позволяет сократить длительность обострения и ускорить регресс островоспалительных изменений со стороны кожных покровов по сравнению с традиционным лечением в 2 раза и более, в 2 раза быстрее идет процесс восстановления их целостности [17-19]. У детей АтД, получающих комплексную терапию, практически полностью исчезают кожные изменения - папулы, лихенифицированные бляшки, экскориации; в 2 раза быстрее наступает улучшение общего состояния, что связано с уменьшением интоксикации и кожного зуда (у пациентов со среднетяжелым течением он практически исчезает); период ремиссии увеличивается от 2-3 мес (при стандартной терапии) до 7-8 мес.
В случаях гнойных и микотических осложнений АтД включение в комплексное лечение Полиоксидония способствует быстрому и стойкому очищению кожи от инфекции. У большинства детей тяжелое течение АтД трансформируется в среднетяжелое.
У 6596 детей применение ПО в комплексной терапии АтД приводит к уменьшению потребности, доз и длительности введения системных глюкокортикостероидов (ГКС) и антибактериальной терапии.
Повышение клинической эффективности терапии АтД при включении ПО к стандартному лечению кореллирует с восстановлением нарушенных показателей как клеточного, так и гуморального иммунитета. После проведенного курса лечения у больных нормализуется содержание Т-лимфоцитов (CD3+, CD8+), фагоцитарная активность лейкоцитов, содержание IgA. IgM, IgG [20, 21].
Высокая клиническая эффективность и высокий профиль безопасности (официальное разрешение на безрецептурный отпуск конкретных форм), возможность использования во всех возрастных группах, отсутствие взаимодействия с другими фармакологическими средствами, возможность применения в период обострения заболевания и возможность использования у больных с A3 определяют приоритетность применения ПО в клинической практике.
Местные иммуномодулирующие препараты при АтД
Основным направлением наружной иммуномодулирующей терапии наряду с системными иммуномодуляторами является подавление аллергического воспаления кожи при помощи противовоспалительных наружных средств. Выделяют 2 основные группы местных противовоспалительных препаратов: топические ГКС и противовоспалительные препараты, не содержащие ГКС. В педиатрической практике в основном используются негалогенизированные топические ГКС (элоком, адвантан, локоид), обладающие высоким профилем безопасности. Тем не менее несмотря на все положительные эффекты топических ГКС нельзя полностью исключить возможность развития как местных, так и системных побочных явлений, особенно при нарушении правил их использования.
В последние годы при АтД у детей и взрослых в качестве местных противовоспалительных средств, не содержащих ГКС, используются препараты класса аксомициновых макролактамов такролимус и пимекролимус. Пимекролимус - нестероидный клеточно-селективный ингибитор воспалительных цитокинов, обладает избирательным действием в отношении воспалительного процесса в коже и не оказывает влияния на местный и системный иммунитет, что позволяет использовать его более продолжительными курсами. Пимекролимус обладает низкой системной абсорбцией; не вызывает атрофии кожи, может применяться у детей с 3 мес на всех участках тела, включая лицо, шею и кожные складки, без ограничения по площади применения.
Таким образом, АтД представляет собой многофакторное заболевание, в основе которого лежат генетическая предрасположенность к аллергии и сложные иммунные механизмы развития аллергического воспаления в органе-мишени - коже, часто затрагивающего также и слизистую респираторного тракта. Правильное понимание патологических механизмов, лежащих в основе развития АтД, позволяет адекватно оценить, какой объем терапевтической помощи необходим в каждом конкретном случае, и тем самым избежать полипрагмазии, снизить фармацевтическую нагрузку на организм и избежать возможных клинических ошибок.
ЛИТЕРАТУРА
1. Хаитов Р.Ж., Лусс Л.В., Арипова Т.У. и др. Распространенность симптомов бронхиальной астмы, аллергического ринита и аллергодерматозов у детей по критериям ISAAC. Аллергия, астма и клиническая иммунология. Автреф. дис. канд.мед.наук.Ж., 1998; 9:58-69.
2. Lahidus C.S., Schwars D.P., Honig P.J. J Am Acad Dermatol 1993; 28 (5): 699-703.
3. Herd R.M., Tidman M.J., Perscott R.G., Hunter J.A.A. Br J Dermatol 1996;135:20-3.
4. Атонический дерматит: рекомендации для практических врачей. Российский национальный согласительный документ по атопическому дерматиту. Под общ. ред. акад. РМХаитова и члена-корр. РАМН проф. ААКубановой. М., 2002.
5. Феденко Е.С. Атонический дерматит: обоснование по-этапного подхода к терапии. Cons. Med. 2001; 3 (4): 176-83-
6. Смирнова Г.И. Аллергодерматозы у детей. Ж БУК, Лтд, 1998
7. Ярилина Л.Т., Феденко Е.С, Латышева Т.В. Этиология и патогенез атонического дерматита. Жа1егш Жedica. 2000; 1 (25): 3-18
8. Кунгуров Н.В. Иммунологические аспекты атонического дерматита. Вестн. дерматологии и венерологии. 1999; 3: 14-7.
9. Феденко Е.С. Клинико-иммунологическое обоснование дифференцированного подхода к иммунотропной терапии атонического дерматита. Автореф. дис. _ д-ра мед. наук. Ж., 2000.
10. Leung D. Atopic dermatitis: the skin as a window into the pathogenesis of chronic allergic disease.] All Clin Immunol 1995; 96:312-9.
11. Короткий Н.Т. Атопический дерматиту детей: современная тактика илечение. Трудный пациент. 2007; 10.
12. Хаитов Р.Ж., Пинегин Б.В. Жеханизм действия и клиническое применение иммуномодуляторов. Аллергия, астма и клиническая иммунология.Ж, 2003; 8:43-9-
13. Петров Р.В., Хаитов Р.М., Некрасов А.В. и др. Полиоксидоний - иммуномодулятор последнего поколения: итоги трехлетнего клинического применения. Аллергия, астма и клиническая иммунология. 1999;3:3-6.
14. Караулов А.В. Полиоксидоний в клинической практике. ГЭОТАР-Жедиа.Ж, 2008.
15. Шульженко А.Е. Клинические аспекты применения иммуномодулятора Полиоксидония. Жетодическое пособие для врачей.Ж.,2002.
16. Лусс Л.В., Жихеева Г.Н., Тузлукова Е.Б., Царев С.В. Синдром вторичной иммунной недостаточности у больных с аллергическими заболеваниями и методы ее коррекции. Леч. врач. 2000; 4:24-7.
17. Цывкина Г.И. и др. Полиоксидоний в лечении больных с атопическим дерматитом. Применение иммуномодулято-ра ПО в педиатрии (в помощь практическому врачу). Ж., 2005.
18. Цывкина Г.Н., Луценко Г.А. Применение Полиоксидония в комплексной терапии атонического дерматита и дисбиоза кишечника. Жеханизм действия и клиническое применение отечественного иммуномодулятор а Полиоксидония (в помощь практическому врачу). Ж.; 2003;с. 51-3.
19. Цывкина Г.И., Луценко Г.А., Лисицына Е.В., Орловская Г.Б. Полиоксидоний в лечении больных с атопическим дерматитом в возрасте от 6 месяцев до 5 лет. Жеханизм действия и клиническое применение отечественного иммуно-модулятора Полиоксидония (в помощь практическому врачу). Ж., 2003; с. 82-4.
20. Феденко Е.С., Варфоломеева Ж.И., Латышева Т.В. Применение Полиоксидония у больных с атопическим дерматитом.Леч. врач. 2001; 4:52-3.
21. Шутова О.В. Эффективность иммуномодуляторов нового поколения в коррекции ферментных и иммунных изменений при атоническом дерматите у детей. Автореф. дис...канд.мед. наук, 2006.
